Method Article
自己組み立て型血管化ヒト皮膚等価物の生成
要約
このプロトコルの目的は、長期的な培養のためのアクセス可能で簡単な技術を使用して、血管化されたヒトの皮膚同等物の生成および体積分析を記述することです。可能な限り、ステップの根拠は、研究者が研究ニーズに基づいてカスタマイズする能力を可能にするために記述されています。
要約
ヒトの皮膚等価物(HSE)は、ヒト皮膚の表皮および真皮成分をモデル化する組織工学的構造である。これらのモデルは、皮膚の発達、創傷治癒、および接木技術を研究するために使用されてきた。多くのHSEは血管系を欠き続け、構造の容積評価を制限するポストカルチャー組織学的切除を通じてさらに分析される。ここに提示された、血管化されたヒト皮膚同等物(VHSE)を生成するために、アクセス可能な材料を利用する簡単なプロトコルです。さらに説明する、これらの構成体の体積イメージングおよび定量化技術が記載されている。簡単に言えば、VHSEは、真皮および表皮細胞をラットテールコラーゲンI型Iゲルに播種する12のウェル培養インサートで構成される。真皮コンパートメントは、コラーゲンゲル全体に分散した線維芽細胞および内皮細胞で構成されています。表皮コンパートメントは、空気液体界面で分化する角化細胞(皮膚上皮細胞)で構成されています。重要なことに、これらの方法は研究者のニーズに基づいてカスタマイズ可能であり、ヒト皮膚線維芽細胞(hDF)およびヒト肺線維芽細胞(IMR90s)の2つの異なる線維芽細胞タイプを有するVHSE生成を実証する結果がある。VHSEは、共焦点顕微鏡を通じて開発され、4週間および8週間のタイムポイントで計算ソフトウェアを使用して体積的に分析された。容積検査のために、VHSEを固定、染色、画像、およびクリアするための最適化されたプロセスについて説明します。この包括的なモデル、イメージング、および解析の手法は、HSE 経験の有無にかかわらず、個々のラボの特定の研究ニーズに合わせて容易にカスタマイズできます。
概要
人間の皮膚は、免疫/機械的バリアとしての作用、体温の調節、保水性および感覚的役割1、2、3、4など、多くの重要な生物学的機能を果たす。解剖学的には、皮膚は人体で最大の器官であり、表皮、真皮、および下皮の3つの主要な層で構成され、表皮細胞に加えて、間質、血管、腺、および免疫系の構成要素の複雑なシステムを有する。表皮自体は、バリア機能およびネイティブ皮膚の他の構造(すなわち、汗および皮脂腺、爪)3を維持するために連続的に更新される4層の細胞から構成される。皮膚生理学は免疫機能、創傷治癒、癌生物学、その他の分野において重要であり、インビトロ単一培養からインビボ動物モデルまで幅広いモデルを使用する研究者をリードしています。動物モデルは、皮膚生理学の完全な複雑さを研究する能力を提供するが、マウスのような一般的に使用される動物モデルは、ヒト5と比較して有意な生理学的差異を有する。これらの制限は、動物モデルのコストの増加と、ヒト皮膚の生理学をより密接に反映するインビトロモデルの開発に焦点を当てる多くの研究者を導いた1,6.このうち、より単純なモデルタイプの1つは、細胞真皮マトリックス上の表皮角化細胞のみで構成されるヒト表皮同等物(HEE;半厚皮膚モデルとも呼ばれる)であるが、生体内で見られる表皮分化および成層を捕捉する。この上に、皮膚および表皮成分(角化細胞および線維芽細胞)を含むモデルは、しばしばヒト皮膚同等物(HSE)、完全厚さの皮膚モデル、または組織ノティピック皮膚構築物(OSC)と呼ばれる。簡単に言えば、これらのモデルは、ゲルマトリックス内に真皮細胞を封入し、表皮細胞を上に播種することによって生成される。表皮の分化と成層は、特殊なメディアと空気暴露7を介して達成することができる。皮膚等価物は、コラーゲンタイプI(ラットテールまたはウシの皮膚起源のいずれか)1、8で作られた真皮ゲルを用いた自己集合性の技術を用いて生成されることが多いが、同様のモデルはフィブリン9、10のような他のマトリックス成分を組み込んだ。 線維芽細胞由来11、12、カダダビリック表皮化膜13、14、15、16、市販のゲル1、12、13、17、18、19。現在、市販の皮膚同等物があります(前述の1,2)。しかし、これらは主に治療目的のために開発されており、特定の研究の質問に容易にカスタマイズすることはできません。
HSEは創傷治癒、移植、毒物学、および皮膚疾患/発達11、12、13、16、8、20、21、22、23の研究に適用されている。3D培養は2D培養24と比較してヒト組織の機能をより包括的にモデル化するが、生体内集団をより正確に反映する多様な細胞型を含めることで、複雑組織24、25、26における細胞細胞協調の研究が可能になる。ほとんどのHSEは、皮膚線維芽細胞および表皮角化細胞27のみを含むが、生体内皮膚環境には他の多くの細胞タイプが含まれる。最近の研究は、より多くの細胞集団を含む始まった。これらは血管系血管系細胞10、28、29、30、31、32、33、34、皮下組織35、36、神経成分の中の有骨細胞を含む、21, 幹細胞 27,37,38, 免疫細胞10,39,40,41,42, その他の疾患/癌特異的モデル16,40,43,44 ,45,46,47.これらの中で特に重要なのは血管系です。一部のHSEには血管細胞が含まれますが、全体的には真皮10、29、拡張インビトロ安定性28、および適切な血管密度全体にわたる接続性を持つ包括的な毛細管要素が欠けています。さらに、HSEモデルは、通常、HSEの3次元構造の分析を制限するポストカルチャー組織学的断面を通じて評価される。3次元解析により、血管密度48、49の体積評価、表皮厚みおよび分化の局所的変動を可能にする。
HSEは最も一般的なorganotypicモデルの1つですが、適切な細胞外マトリックスと細胞密度の同定、メディアレシピ、適切な空気液体界面手順、培養後分析など、これらの構造を生成する際には多くの技術的課題があります。また、HEEモデルやHSEモデルはプロトコルを公開しているが、組織学的解析ではなく真皮脈管及び体積イメージングを組み込んだ詳細なプロトコルは存在しない。この研究は、主に市販の細胞株から血管化ヒト皮膚同等物(VHSE)の培養のためのアクセス可能なプロトコルを提示する。このプロトコルは容易にカスタマイズ可能に書かれ、異なる細胞タイプおよび研究の必要性に対して簡単に適応することを可能にする。アクセシビリティ、可用性、コストの点で、市販品の使用よりもシンプルな製品や生成技術の使用が優先されました。また、VHSEの三次元構造の評価を可能にする簡単な容積画像化および定量法が記載されている。この手順を堅牢でアクセス可能なプロトコルに翻訳することで、非専門研究者は、これらの重要なモデルを個別化医療、血管化組織工学、移植片開発、および薬物評価に適用することができます。
プロトコル
1. 3D文化の準備
- 確立されたプロトコル50、51、52を使用して、ラットテールコラーゲンストックを8 mg /mLで準備します。あるいは、ラットテールコラーゲンは、適切な濃度でベンダー(材料リストを参照)から購入することができる。
注:コラーゲンは、3〜10 mg / mL、またはより高い50、51、52の範囲で異なる濃度で調製または購入することができます。プロトコルの計算は8 mg/mL濃度を仮定しますが、研究者のニーズに基づいて調整することができます。 - 細胞株を拡張する:内皮細胞および線維芽細胞は、3Dコラーゲン真皮成分生成の開始時に播種する準備ができている必要があります(ステップ2)。ケラチノサイトは、3D培養の7日目に準備ができている必要があります。1 つの完全な VHSE コンストラクトは 7.5 x 105内皮細胞を必要とします。7.5 x 104線維芽細胞;そして1.7 x 105 5のケラチノサイトの生成 (表 1)
注:これらの密度は、12ウェルの透過性組織培養インサートまたは同等の場合に適しています。細胞密度とフォーマットは、研究者のニーズに基づいてスケールアップまたはスケールダウンすることができます。明確にするために、この量の内皮細胞および線維芽細胞は1〜3個の真皮成分を播種し、表皮成分はそれぞれ1.7 x105 ケラチノサイトを必要とする。 - このプロトコルで全ての細胞遠心分離を300xgで5分間行いますが、より脆弱な細胞タイプでは減少する可能性があります。
2. 3Dコラーゲン皮膚成分の生成
注: ステップ 2 は時間を重視する手順で、1 つの設定で完了する必要があります。真皮成分の播種を開始する前に適切なゲル化と均質性を確保するためにコラーゲンストックの品質チェックを完了することをお勧めします、 議論のトラブルシューティングを参照してください。
- 細胞コラーゲン層調製および播種
- 1.7 mLキャップマイクロ遠心分離チューブを2つ用意し、1つは無細胞サポート用、もう1つはセルラー真皮用です。このステップで与えられた量は、(3)12ウェルサイズのVHSEに十分な3mg/mLコラーゲン(標的コラーゲン濃度)の1 mLを調製する。調整が必要な場合は、数式が一覧表示されます。研究者のニーズに基づいて体積と密度の両方をスケーリングすることができます(共通の参照番号は 表2に示されています)。
- 各チューブに、100 μLの培養グレード 10x リン酸緩衝生理食塩 (PBS) (1 本のチューブは 3 VHSE を得る) を加え、8.6 μLの 1 N NaOH を加えます。湿った氷の上にキャップチューブを置き、少なくとも10分間冷やします。
Cs = コラーゲンストック濃度
Vf = 必要なコラーゲンの最終容積
Ct = ターゲットコラーゲン濃度
Vs = 所望量に必要なストックコラーゲンの体積 (Vf)
Vpbs = 標的コラーゲン濃度に必要な10X PBSの体積(Ct)
VNaOH = Ctに必要な 1N NaOH のボリューム
Vメディア= Ctに必要なメディア、コール 中断、または ddH2O のボリューム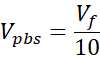
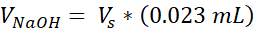
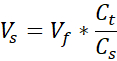
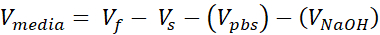
- 1000 μL の正の変位ピペットを使用できるように準備し、取っておきます。後のステップは時間に敏感であるため、ピペットチップとセットボリューム(それぞれ375 μLと125 μL)をロードするのが便利です。さらに、516 μLの通常の1000 μLピペットをセットします。
注:正の変位ピペットは、必要に応じて通常のピペットで置き換えることができますが、コラーゲンの粘度が高く、この手順の時間/温度感度のため、正の変位ピペットは、一貫した播種結果を生成するのに役立ちます。通常のピペットを使用する場合は、動きが遅くなります。 - 培養挿入ウェルプレートを準備する:滅菌鉗子を使用して、3つの12ウェルサイズの培養インサートを無菌12ウェル組織培養プレートに入れ、中央列に入れます。
- 繊維芽細胞および内皮細胞タイプに適した冷たい培地を設定する。
- キャップチューブを冷却した後、1つのチューブ(細胞サポート用)をラック上に置き、内容物を見えます。他のチューブ(セルラー真皮用)を氷の上に置いておく。
- 冷凍から8mg/mLコラーゲンストックを取り除き、湿った氷の上に置きます。
注:これはコラーゲンを凍結するので、冷凍氷や-20°Cベンチトップクーラーを使用しないでください。 - コールドキャップチューブに516 μLの培地を加え、1000 μL 正変位ピペットを使用して375 μLのコールドコラーゲンをすぐに加えます。コラーゲンを溶液に分配します(チューブの側面にはありません)。すぐに空のピペットの先端を取り外し、調製された250 μL正変位ピペットに切り替えて混合します。
- 泡の形成を防ぐために迅速に、しかし穏やかに混ぜ、可能であれば、溶液から先端を除去しないでください。溶液が均質な色になるまで混ぜますが、これは通常約5ピペットサイクルまたは10s(フェノールレッドの培地を使用する場合、色が明るく均一になります)。混合する際は、均一な混合のためにチューブ(底部と上)の異なる位置から描画するようにしてください。
注:これは、516 μLの細胞培養グレードの水または他の細胞培養グレードの液体で行うことができますが、ほとんどの培地のフェノールレッドは混合の良い指標です。2D拡張に使用した繊維芽細胞または内皮培地のいずれかを使用してください。
- 泡の形成を防ぐために迅速に、しかし穏やかに混ぜ、可能であれば、溶液から先端を除去しないでください。溶液が均質な色になるまで混ぜますが、これは通常約5ピペットサイクルまたは10s(フェノールレッドの培地を使用する場合、色が明るく均一になります)。混合する際は、均一な混合のためにチューブ(底部と上)の異なる位置から描画するようにしてください。
- 125 μLの細胞コラーゲンを3つの12ウェル培養インサートの各膜にすぐに分散させます。細胞コラーゲンゲルの均一なカバレッジを確保するために、皿を揺らす;均一な膜被覆を作成しない場合は、ピペットチップを使用して、コラーゲンを穏やかに広げて膜をペイントします。膜に圧力をかけないようにしてください。ゲル化は、ほぼ即座に始まります。このステップを迅速に実行して、カバレッジを均等にします。
注:余分な細胞コラーゲンがあります。しかし、1mL未満のコラーゲン懸濁液を調製すると、溶液の混合が困難になり、ゲル化が不十分になる可能性があります。 - すぐに12ウェルプレートを37°Cの細胞培養インキュベーターに移して、少なくとも20分間ゲル化します(細胞コラーゲンは必要に応じてより長くゲル化することができます。このゲル化時間中に、ステップ2.2に進みます)。氷からコラーゲン懸濁液を取り除き、冷凍に戻します(コラーゲンは4°Cで最も安定しています)。
- 細胞懸濁液及び播種製剤
注: このプロトコルのカルチャのタイムラインでは、これはサブマーション 1 日目 (SD1) に対応します。- 無細胞コラーゲン支持体のゲル化中に、トリプシン化し、内皮および線維芽細胞株をカウントする。
- それぞれの培地の258 μLに7.5 x 10 5個の内皮細胞と7.5 x 104個 の線維芽細胞を懸濁し、細胞懸濁液を組み合わせて516 μLアリコを作り出します。使用するまで、湿った氷の上に細胞懸濁液を維持します。
- 1000 μL の正の変位ピペットを使用できるように準備し、取っておきます。後のステップは時間に敏感であるため、ピペットチップとセットボリューム(それぞれ375 μLと250 μL)をロードするのが便利です。さらに、516 μLの通常の1000 μLピペットをセットします。
- 真皮コンパートメントの細胞を含んだコラーゲンの播種
- ゲル化期間後、インキュベーターから細胞コラーゲンの12ウェルプレートを取り除きます。
注:このコラーゲンが30分後にゲル化しない場合は、播種中に間違いがあったか、コラーゲンストックに問題がある可能性があるため、手順を続行しないでください(説明のトラブルシューティングを参照)。 - 1.7 mLキャップチューブをウェットアイスから取り外します(10x PBSとNaOHを含む)。内容物が見えるようにチューブをラックに配置します。すべてのキャップ(セルサスペンション、コールドキャップチューブ)を緩める/開きます。
- 4°C冷凍からストックコラーゲン(8mg/mL)を取り出し、湿った氷の上に置きます。キャップは開いたままにしておきます。
- 冷たいキャップされたチューブに冷却されたセル懸濁液の516 μLを加えます。1000 μL 正の変位ピペットを使用して、375 μLのコールドコラーゲン溶液をキャップチューブの溶液に直接直接ピペットします。
- ピペットからすべてのコラーゲンをチューブに排出し、正の変位ピペットチップを捨てます。すぐに250 μLの正の変位ピペットに切り替え、コラーゲン溶液を混合する。
- コラーゲン溶液を先に完成した様に混ぜて(素早く、しかし、泡形成を防ぐために、穏やかに)、可能であればゲルから先端を取り除かないでください。溶液が均質になるまで混合する(約5ピペットサイクルまたは10s)。混合する場合は、均一な混合のためのチューブ(底部と上)の異なる位置から描画することを確認してください。
- 混合したら、3つの12ウェル培養インサートのそれぞれで250μLの細胞コラーゲン溶液を細胞内コラーゲン支持体にすぐに移す。無細胞コラーゲン支持体の均一なカバレッジを確保するために、皿を揺らすか、または細胞層を乱すことなく、新たに播種した細胞コラーゲンを穏やかに動かすために正の変位ピペットを使用してください。
- 12ウェルプレートを37°Cの細胞培養インキュベーターに直ちに移動させ、少なくとも30分間ゲル化させます。使用後、コラーゲンを4°Cの冷凍に戻します。
- 30分のゲル時間の後、プレートを軽く傾けてゲル化を評価します。コラーゲンが固化していることを確認します。
- 500 μL と 1000 μL のブレンドメディア (半分の内皮および半分の線維芽細胞維持培地) を挿入器の上部チャンバーと下部チャンバーにそれぞれ加えます(上から、次に底部に、熱静圧がコラーゲンを押し上げないようにします)。コラーゲンゲルに直接ではなく、ウェルの側面にゆっくりとメディアを加え、コラーゲンの破壊を最小限に抑えます。
- コラーゲンゲルが水没していることを確認し、必要に応じてさらに培地を追加します。ウェルプレートを一晩のインキュベーターに入れ、一晩インキュベーターに入れます。この段階では、メディアには 10% FBS が含まれています。各セルラインの通常のメンテナンス メディア( 図1、Aに示す回路図)。
注: VHSE 培養中のメディアは、カスタムセルタイプに適合させることができます。何らかの最適化が必要な場合があります。
- コラーゲンゲルが水没していることを確認し、必要に応じてさらに培地を追加します。ウェルプレートを一晩のインキュベーターに入れ、一晩インキュベーターに入れます。この段階では、メディアには 10% FBS が含まれています。各セルラインの通常のメンテナンス メディア( 図1、Aに示す回路図)。
- ゲル化期間後、インキュベーターから細胞コラーゲンの12ウェルプレートを取り除きます。
- 水中2日目(SD2)メディアの変更
- VHSEウェルの10%FBS培地を5%FBS半繊維芽細胞に変更し、半内皮培地に100 μg/mL L-アスコルビン酸を添加します。ウェルの側面にある培養インサートの上部チャンバーに500 μLを加え(再び、サイドウォールに慎重に加えて、コラーゲンの破壊を最小限に抑える)、1000 μLを下部チャンバーに加えます。
- メディアを 2 日ごとに更新 (SD4 および SD6) 日 7 日 (SD7) までします。
- 手動ピペットを使用して井戸からメディアを取り除きます。吸引器を使用することは可能ですが、構造の損傷または破壊につながる可能性があります。
注:L-アスコルビン酸は、2〜3日ごとに新鮮に作る必要があります(これは、酸化ストレスを誘発し、最終的に細胞損傷を誘発し、酸化ストレスを誘発し、このように過酸化水素を生成するために溶液中で酸化します)。したがって、L-アスコルビン酸が存在するので、培地は、SD2からVHSE培養の終わりまで2〜3日ごとに変更されなければならない。メディアのストックを作り、毎日供給するメディアアリコートにL-アスコルビン酸の新鮮な量を追加するのが最も簡単です。培養グレードの水または培地を溶媒として使用し、100mg/mLで新鮮なL-アスコルビン酸を調製します。L-アスコルビン酸は、適切な速度で線維芽細胞によるコラーゲン合成を刺激し、コラーゲンの安定性を促進します54,55,56;また、内皮透過性を低下させ、血管壁の完全性を維持する56、57、および表皮バリア形成6、58に加えて寄与する。
表皮成分の播種と層化誘導
- 水没7日目(SD7):種子角化細胞
注:SD7上の表皮を確立するためにケラチノサイトをシード。この時点は研究者のニーズに基づいてシフトすることができます。ケラチノサイトを含まない沈み物培養の持続期間は9日を超えてはならないが、より長い水中がしばしば、皮膚収縮の増加をもたらす。収縮がSD7より前に起こる場合は、SD5上で5日及び種子表皮に水没期間を短くすることが推奨される。特定の実験に必要な水没期間を最適化します(説明のトラブルシューティングを参照)。- ケラチノサイト(N/TERT-120、59または他の適切な細胞)を、VHSEにトリプシン化および播種する前に、その合流限界まで培養する。N/TERT-1細胞の場合、2D培養59におけるケラチノサイトの非望ましくない分化を防ぐために、合流率が30%を大幅に超えてはならない。他の適切な細胞株、例えばヒト表皮ケラチノサイトの他の適切な細胞株については、75〜80%の合流限界が一般的に60を使用する。
- トリプシン化後、ヒト皮膚同等物(HSE)分化培地の600μLで510,000個の細胞を5%FBSで補う回数及び懸濁液(表1)。
注:600 μL の 510,000 個のセルは、1 つの構成体(3 VHSE)に 200 μL を播種する場合に 170,000 個のセル/コンストラクトを使用できます。 - 手動ピペットを使用して、各構造の下部と上部のチャンバーに現在メディアを収集し、廃棄します。できるだけ多くのメディアを収集してください。ピペットチップを培養インサート膜の下にそっと置き、挿入物を一時的にノックアウトすることにより、透過膜の下に直接貼り付けることができる培地を収集します。表面張力によりメディアが動かなくなった可能性があります。挿入物は、続行する前に、彼らの井戸に平らに座っていることを確認してください。吸引器を使用することは可能ですが、構造の損傷または破壊につながる可能性があります。
- 各ウェルの下の部屋に5%FBSを補ったHSEメディアの1 mLを加えます。その後、各ウェルの上部チャンバーに200 μLのセルサスペンションを加えます。真皮構築面に直接シードします。ケラチノサイトをインキュベーターで2時間落ち着かせる。
- ケラチノサイトを播種した後の2つの時間は、慎重に各コンストラクトの上部チャンバーに5%FBSを補ったHSE培地の300 μLを追加します。培養挿入物の側にゆっくりとピペットメディア。下層のコラーゲンゲルにしっかりと付着していない可能性のある落ち着いたケラチノサイトを邪魔しないように、メディアを極上チャンバーに非常に慎重にロードします。
- 媒体をロードした後、インキュベーターに構築物を戻します。
- 水中8/9日目(SD8またはSD9)
- 1%FBSと100 μg/mL Lアスコルビン酸を補ったHSE培地を構成します。
- 手動ピペッタで上部と下部の両方のチャンバーからメディアを取り外します。
- 最初に500 μLのメディアを上部チャンバーに加え、次に1 mLを底のチャンバに加えます。(このステップはSD8またはSD9で行うことができます)
- 水中9/10 (SD9またはSD10、これはステップ3.2の翌日でなければなりません)
- 100 μg/mL L-アスコルビン酸を使用した血清フリー HSE 分化培地を作ります。
- 手動ピペッタで上部と下部の両方のチャンバーからメディアを取り外します。
- 上部チャンバーに500 μLを、下のチャンバーに1 mLを積み込みます。
- 空気液体インタフェース 1日目 (ALI1)
注: ALI はステップ 3.3 の翌日に実行されます。- 上部チャンバーのみからメディアの無駄を取り除くことによって、各構成体を空気液体インタフェース(ALI)に持ち上げます。手動ピペットを使用して、触れたり損傷を与えたりすることなく、できるだけ表皮層に近づけることができます。
- プレートを異なる角度で少し傾けて、メディアを収集します。この手順で可能な限り多くのメディアを取り外します。一貫した湿度を維持するためにプレートの周囲の井戸に約2 mLの滅菌水を加えます。井戸は、文化全体を通して水で満たされた保ちます。
- ケラチノサイトがまだ空気液体界面にあることを確認するために、数日後にプレートをチェックしてください。上の部屋にメディアがある場合は、それを削除します。各VHSEウェル(上下のチャンバの初期容積(1500 μL)-除去された媒体は、ALI給餌の開始点を示す) ごとに、どれだけのメディアが取り外されているかを追跡してください。
注: VHSE は、エアリフトに必ずしも同じメディアレベルを必要としません。通常、VHSEが一緒にシードされている場合、それらはエアリフトのためにメディアの同じレベルを必要としますが、必ずしもそうであるとは限りません。必要に応じてボリュームを調整して ALI を維持しますが、メディアレベルが低くなく、VHSE が乾燥しないようにします。空気リフトと水分補給のバランスが取れるまで、毎日少量の媒体を取り除く方が安全です。
- アリ 2 日目 (ALI2)
- この時点から、100 μg/mL L-アスコルビン酸を補った無血清HSE培地のみを使用してください。ALI 2 日目 (ALI2) でメディアを変更します。上部のチャンバーにメディアがある場合は、それを取り出し、以前に記録した削除されたメディアの量に追加します。前の手順の式を使用して、必要なメディアの量を計算します。例: 200 μL のメディアが上部チャンバから取り出された場合、1300 μL を加え、ALI を確立します(1500 μL - 200 μL = 1300 μL)
- 計算した体積を使用して各ウェルの底部チャンバーに積み込み、プレートをセルインキュベーターに戻します。1 日に使用されるボリュームを追跡します。推奨されるコラーゲン量を12ウェル培養インサートで使用すると、通常のALI値の範囲は750 μLから1300 μLの間に収まり、通常、培養熟成に対して体積が減少し、ALIの第2/3週頃に一貫しています。カルチャの詳細に応じて、この数が変更される可能性があり、最適化する必要があります (3.4.2 - 4.1 で説明)。
4. 血管人間の皮膚相当物の定期的な維持
- ALI 3日目(ALI3)から培養エンドポイントまで:100 μg/mL Lアスコルビン酸を含む無血清HSE培地を使用して、2~3日ごとに下部チャンバの培地を更新します。ステップ 3.5.2 で説明されているように、ALI の下部チャンバで必要なメディア レベルの調整と追跡を続行します。
- 表皮表面は空気と接触したままでなければならないので、一貫したALIレベルが確立されるまで、毎日メディアレベルを確認し、調整する必要があります。表皮層は乾燥ではなく水分補給に見えるはずですが、構築物の上にメディアをプールしないでください。ALIの8週間の文化は、最も一貫した形態と表現を提供してきました。ただし、用途によっては、4〜12週間の培養が適切である場合がある。異なる細胞および培養条件の培養期間を最適化する必要がある場合があります。
注:月曜日、水曜日、金曜日にメディアを変更することは良い習慣です。VHSEは週末に健康ですが、メディアは月曜日の早い時間と金曜日遅くに変更する必要があります。ステップ 1 から 4 を完全に完了すると、VHSE の生成が完了します。プロトコルのステップ 5 エンドは、このタイプの 3D コンストラクト用に最適化されたオプションの処理およびイメージング手法です。
5. 3D構造の固定と透過
注: ステップ 5 は、プロトコルの残りの部分で概説されているこの 3D 構造に固有のイメージング技術に最適化されています。VHSE を生成するために、以下のステップは必要ありません。
- 固定/透過
- 培養期間の終点で各ウェルの上下のチャンバーからすべての媒体を慎重に取り除きます。
注:表皮層はおそらく壊れやすく、注意して取り扱い、積極的なピペットで表皮を攪拌しません。 - PBS(pH 6.9)に4%パラホルムアルデヒド(PFA)を加え(構築物に直接ない)上部の壁に加え、次に下の部屋に、各構成体を事前に固定する。チャンバーあたり1 mLを加え、室温で5分間曝します。
注意:PFAは危険であり、目の保護を含む注意と適切な個人保護装置(PPE)で取り扱う必要があります。 - 5分後に4%PFA溶液を取り除き、前のステップで説明したように4%PFA溶液の0.5%トリトンX 100を上下のチャンバに加えます。室温で1時間の露出;VHSEコンストラクトは、今後無菌環境を必要としません。
- 1時間後、両方のチャンバーから透過/固定液を慎重に取り出し、サンプルを1x PBSで3回洗浄します。
- 4 °C冷凍またはすぐに汚れでPBSでサンプルを保存します。サンプルを保存するには、皿をラップで包み、ホイルして蒸発と光の露出を最小限に抑えます
注: ポーズポイント - 固定および透過後、ステップ 5.1.5 で概説したとおりに準備したサンプルは数週間安定しているため、この手順は一時停止できます。あるいは、(ステップ6で説明したように)染色は、ステップ5の直後に完了することができる。
- 培養期間の終点で各ウェルの上下のチャンバーからすべての媒体を慎重に取り除きます。
6. 3D構築物の免疫蛍光染色
- 構築準備
注:VHSEは、培養インサートの多孔質膜から分離するとよく染色されます。膜からの分離は、非閉塞画像化のためにも必要であり、染色のための減少した体積を可能にする。- 免疫蛍光染色用の構成体を調製するには、インサートを逆さまにしてウェルプレートの上に置きます(VHSEが落下した場合はPBSと共に井戸に落ちます) (補足図1A)。
- 細かい先端鉗子および/または精密ナイフを使用して挿入膜の円周の約半分を切断しながら、ウェルの上に片手で挿入物を安定させる。VHSE構造の損傷を防ぐために穏やかな手でプラスチックハウジングにできるだけ近く切ります。
- 細かい先端鉗子を使用して、切断された膜のフラップの端をつかみ、VHSE構造と同様に挿入物から多孔質膜を穏やかに剥がします。VHSE構造構造の損傷を防ぐために、これを非常に慎重かつゆっくりと行ってください。VHSE構造が簡単に分離する場合、それはチャンバーの側面に立ち往生した場合、それは井戸にそれを移動するために細かい先端鉗子または小さなスクープを使用して、下の井戸に落ちる必要があります。表皮層は通常壊れやすいので非常に注意してください(補足図1A)。
注:膜が簡単に外れたり、バラバラに外れたりする場合、慎重に膜とVHSEコンストラクトを引き離すツールを使用します。必要に応じて、PBSに浸すことによって、このプロセス中にVHSEが乾燥しないようにしてください。 - VHSEが井戸に入ったら、挿入膜の残りの部分を捨て、染色中にVHSEを水没位置に保持するために各ウェルに培養挿入ハウジングを保持します。
- 染色
注:VHSEは壊れやすい可能性があるため、染色と関連する取り扱い/操作と、および、スケシュはできるだけ穏やかに行う必要があります。表皮の一部が持ち上がれば、片は別々に染色することができます。表皮の上層は壊れやすく、自然の脱生物4を経るが、分析のためには可能な限り完全性を維持することが重要である。- 選択した一次抗体染色を、1つの構築物ごとのブロッキングバッファーの700 μLで調製します(通常、すべての一次抗体は同じ染色溶液に入れることができますが、これは新しい抗体について確認する必要があります)。700 μL は 12 ウェルサイズで動作しますが、他のカルチャ形式に合わせて調整できます。ブロッキングバッファーレシピを有する一次および二次抗体の推奨濃度は 、表3 に示されている(最適化が必要な場合がある)。
- 手動ピペットを使用して井戸からPBSを取り除き、VHSEから離れてピペットに注意してください(VHSEが浮遊しているので、真空吸引は推奨されません)。
- 各ウェルに一次染色液を加え、培養インサートハウジングをウェルに入れ、VHSEを液中に沈めておく(補足図1B)。ウェルプレートをラップで包みます。撹拌や揺らぎをかけずに4°C冷凍で48時間のフォイルと汚れ(ロッキングはVHSEコンストラクトを損傷する可能性があります)。
- 48時間後、700μLのブロッキングバッファー(ウェルあたり)で二次抗体と化学染色を調製します。
- 培養挿入ハウジングと一次汚れ溶液を取り出し、2次汚れ溶液を添加する前に1x PBS、5分間3倍洗います。培養インサートハウジングを井戸に戻して、VHSEコンストラクトを水没状態に保つ(補足図1B)。攪拌や揺らぎなしで4°Cの冷凍で48時間の露出。
- 48時間の露出後、手動ピペットで汚れ溶液を取り除き、PBSで3倍を静かに洗います。VHSEに液体をまっすぐにピペットしないでください。過剰なPBSで水分補給し、培養インサートハウジングを井戸に戻して、保管中にVHSEを水没させ、水分補給します(蒸発と光暴露を最小限に抑えるためにラップとホイルで包むことで保管)
- クリアリング(オプション&ターミナル)
注: クリアは、イメージングのオプションです。完了した場合、クリアがさらなる染色を防止し、フッ素酸エステルの性能を変え、VHSE構造を損傷する可能性があるため、サンプルを完全に染色/イメージングした後に行う必要があります。複数の組織クリアリング方法は49、61、62存在し、特定のプロジェクトに最適化することができます。後述するメチルサリチル酸除去は、VHSEに対して単純かつ有効である。以下のクリア技術はガラス容器で完了する必要があり、ピペットの先端はガラスまたはポリプロピレン(ポリスチレンはメチルサリチル酸と接触して溶解する)でなければなりません。換気の良いエリアまたはヒュームフードですべてのクリア手順を完了します。- 小さな浅いガラス容器に100%メタノールを加えます(ガラスペトリ料理はうまく機能します)。(試薬の無駄を最小限に抑えるために)構造に適合する最小の可能な容器を使用してください。
- 鉗子/すくずを使用してウェルプレートからコンストラクトを取り出し(補足図1C)、メタノール充填容器に入れます。コンストラクトが水没していない場合は、メタノールを追加します。
- 3 x 10 min浸漬用メタノールでVHSEコンストラクトを脱水する。各浸漬後メタノールを完全に交換し、最後の浴後速やかにメタノールを除去します。この手順の過程で、コンストラクトはより不透明になり、わずかに縮小する可能性があります。
注: これらの持続時間と繰り返しは最適化されていますが、メタノールと以下のメチルサリチル酸手順は、特定の培養形式と汚れに応じてカスタマイズする必要があります。 - メタノールを取り除いた直後に、メチルサリチル酸を加え、5 x 5分浸漬でVHSEを水没させます。各浸漬後に試薬を完全に交換し、VHSEを5番目の浸漬溶液に残して保管します。この手順の過程で、コンストラクトは透明になります。
- 4 °Cで構成または保管をイメージします。 クリア後、蛍光HOREが数日以内にメチルサリチル酸で分解する可能性があるため、できるだけ早くすべてのイメージングを完了します。クリアすると、構築物が脆くなり、拡張ストレージは推奨されませんが、十分な量のメチルサリチル酸があることを確認するために定期的なチェックが必要です。
7. 3次元構造の共焦点イメージング
注:組織培養プラスチックを介したイメージングは、カバースリップガラスを介してイメージングと同じ品質の画像を生成しません、この方法は、共焦点イメージング中の乾燥を防ぐためにカスタムガラス底ウェルの製造を記述します。典型的には、これは、少なくとも3時間のイメージングに対して十分である。
- イメージングの2日前:ポリジメチルシロキサン(PDMS)を準備する
- [9:1]の推奨濃度でPDMS48、63、64を準備し、ベース:架橋器。合計PDMSの30gを準備する:27gの基本成分と3gの架橋剤。任意のクリーンな混合容器を計量バランスに置き、スケールを切ります。ベース(27 g)を加え、クロスリンカー(3g)を加え、合計30gを達成します。常にクロスリンカーの前にベースを追加します。
- 少なくとも4分間、溶液を激しく攪拌します。これは小さな泡を作成します。十分な混合の後、PDMSを100mmペトリ皿、または同様の平底耐熱容器に注ぎます。
- 混合から全ての気泡が消失し、PDMSがクリアされるまで真空チャンバ内のPDMSを脱ガスする。真空をゆっくりと解放し、PDMSを取り外します(ゆっくりと)。一晩(50-60°C)を治すためにオーブンに皿を置きます。PDMSが均等に治癒するために、皿が平らに座っていることを確認してください。
注:硬化後、PDMSは明確にする必要があり、表面は滑らかで粘着性ではありません(粘着性は、不適切な混合を示す可能性があります)。
- イメージングの前日:PDMSの井戸準備
- スチールパンチまたはハンドヘルド精密ナイフを使用して、7.1で用意されたPDMSシートから円形ウェルをパンチまたは切り取ります。ウェルは VHSE コンストラクトと同じサイズにする必要があります。円形ウェルの周りに正方形のパッチをカットして、単一のPDMSウェルを作成します。30 g PDMS の量を準備する少なくとも 4 つのカスタムウェルを生成する必要があります。
注: PDMS ウェルは VHSE コンストラクトのサイズに近いはずです。イメージング中にサンプルの動きを収縮させる必要があります。複数の井戸を一度に製造し、クリーンな容器に無期限に保管することができます。 - PDMSウェルと同様のサイズのガラスカバースリップを使用して、PDMSの底面(ペトリ皿と接触していた滑らかな表面)にシアノアクリル酸接着剤(例えば、スーパー接着剤)を追加し、使い捨てのピペットチップで均等に塗ります。中央に、パンチされた円の中に透明なガラス窓を残したまま、PDMSをガラスの上に押し込みます(接着剤が表示窓の上に塗りつぶされていないことを確認してください)。
注:可能であれば、カバースリップへのPDMSのプラズマ結合は代替65、66、67です。 - 接着剤を数時間、または一晩乾燥させてから使用してください。これらは、通常の消耗から抜け出すまで再利用可能です。
メモ:イメージングに使用される接着PDMS内のサンプルを染色することはお勧めしません。これらの井戸は数時間液体を保持しますが、長い染色中に漏れる可能性があります。
- スチールパンチまたはハンドヘルド精密ナイフを使用して、7.1で用意されたPDMSシートから円形ウェルをパンチまたは切り取ります。ウェルは VHSE コンストラクトと同じサイズにする必要があります。円形ウェルの周りに正方形のパッチをカットして、単一のPDMSウェルを作成します。30 g PDMS の量を準備する少なくとも 4 つのカスタムウェルを生成する必要があります。
- VHSEイメージング
注: 不明確なサンプルをイメージングする場合は、イメージング ソリューションとして PBS を使用します。クリアサンプルでイメージングする場合は、撮像液としてサリチル酸メチル(または選択したクリア溶液)を使用します。- PDMSウェルにイメージングソリューションの数滴を追加し、漏れがある場合は、漏れがある場合は、シアノアクリレートスーパー接着剤のドット/スミアでそれを修復するか、別の井戸を使用してください。
- VHSEを追加する場合は、PDMS 内のイメージング ソリューションを十分に保持します。すくい板または細かい先端鉗子(補足図1C)を使用して、12ウェルプレートからコンストラクトを取り外し、PDMSをガラスカバースリップの上に入れます。目的に向かって関心の方向を持つ構造を配置します。例えば、反転した顕微鏡を使用して表皮を画像化するには、表皮がガラスに向かって下向きになっていることを確認します。
- あるいは、直立顕微鏡の場合、表皮を上に向ける。以下の画像化手順は、反転顕微鏡について説明されるが、直立のために容易に適合することができる。
メモ: VHSE を操作するときは、損傷を避けるため注意してください。VHSEが落下した場合に備えて、ウェルプレートの上に移動します。曲がった平らな先端のすくいは、コンストラクトを移す最も簡単な方法です(補足図1C)。
- あるいは、直立顕微鏡の場合、表皮を上に向ける。以下の画像化手順は、反転顕微鏡について説明されるが、直立のために容易に適合することができる。
- サンプルがウェル内に平らに座っていて、表皮や真皮の部分がサンプルの下に折り畳まれないことを確認してください。折り畳みが発生した場合は、そっと鉗子やすくいによってサンプルを操作します。VHSEを浮かべる余分なイメージング溶液を一時的に追加することは、それがまっすぐに役立つかもしれません。サンプルの折り畳みやしわは、目で見たり、顕微鏡を用いて見ることができます。
- サンプルを水分補給するのに十分な流体を使用して、イメージングソリューションで井戸を満たします。流体が多すぎるとサンプルが浮遊し、イメージング中に動きが生じます。コンストラクトはガラスの窓の上に座っている必要があります。PDMSをうまく傾けることによって動きのためのテスト。動きがある場合は、流体を取り除きます。動きが止まるまで流体ドロップを追加および除去します。
- イメージング中の蒸発を最小限に抑えるために、ウェルの上にガラススライドを置きます(補足図1D)。イメージングセッションが長い場合は、サンプルを頻繁にチェックして、適切な流体レベルを確認します。アクセス可能な場合、イメージング中に加湿されたチャンバーを使用することができます(通常は必要ありません)。
- 顕微鏡のステージにサンプルを置き、ガラスカバースリップウィンドウを通して画像を配置します(補足図1D)。この技術は、連続的な共焦点イメージングの少なくとも3時間を可能にするが、サンプルの水和は、必要に応じて追加されたイメージング溶液で、定期的にチェックする必要があります。
注:サンプルがクリアされている場合、メチルサリチル酸塩は、時間の経過とともに接着剤を劣化させる。PDMS を接着する接着剤は、イメージングの実行間に再適用できます。またはサンプルを定期的に新しい井戸に転送することができます。プラズマボンディングを備えた井戸では、これは問題ではありません。 - イメージング後、試料をできるだけウェルにイメージング液で浮かべる。スコップラまたは細かい先端鉗子を使用して、サンプルをそのストレージウェルに移します。サンプルが落下した場合に備えて、ウェルプレート上で転写を行います。
- 各PDMSウェルとトップガラスカバースリップは、それらが壊れるまで再利用することができます。ウェルの内側と外側の両方で、イメージングの前に底ガラスをきれいにしてください。再使用する前に、必ず漏れがないか確認し、必要に応じて接着剤で修復してください。
- ステップ 6.3.6 で説明されているようにサンプルを保存し、維持するために数ヶ月ごとに PBS を追加します。サンプルがクリアされた場合は、メチルサリチル酸を使用してガラスに保存し、定期的にレベルを確認してください。クリアされたサンプルは急速に (日以内に) 劣化する可能性があり、できるだけ早く画像を作成する必要があります。
結果
ここでは、テロメラーゼ逆転写酵素(TERT)不死化角化ケラチノサイト(N/TERT-120,59)、成人ヒト皮膚線維芽細胞(hDF)、およびヒト微小血管内皮細胞(HMEC-1)を用いて、インビトロ血管化ヒト皮膚同等物(VHSE)を生成するためのプロトコルを提示する( 図1)。さらに、このプロトコルのカスタマイズ可能な性質は、hDFの代わりに一般的に利用可能な肺線維芽細胞(IMR90)を使用する場合のVHSE生成と安定性を実証することによっても強調される。VHSE の生成はステップ 1 から 4 で完了し、ステップ 5 から 7 は、これらの VHSE 用に最適化された任意のエンド ポイント処理およびイメージング技術です。VHSEは特定の研究の質問に従って処理することができ、ステップ5-7は、構造を生成する必要はありません注意することが重要です。容積解析法を実証するために、体積イメージング、解析、および 3D レンダリングを完了しました。これらの容積構造の準備およびイメージ投射の議定書は顕微鏡および巨視的なレベルの両方でVHSE構造を維持し、広範囲の3D分析を可能にする。
表皮および真皮の特性評価は、VHSE構築物におけるヒト皮膚に対して適切な免疫蛍光マーカーを示す(図2、3)。サイトケラチン10(CK10)は、皮膚当量18、30、68の全ての上皮層を通常マークする初期分化角化マーカーである(図2)。インボルクリンおよびフィラグリンは、ケラチノサイトにおける後期分化マーカーであり、皮膚同等物12、30、68、69の上層の上層の上層を示す(図2)。表皮と真皮の両方の核をマーキングするために、極赤色蛍光核色素(材料リストを参照)を使用し、Col IVは真皮の脈管構造を示す(図2、図3、図4)。表皮地下膜(BM)成分は、HSE培養15、16において必ずしも適切に発現されるとは限らない。BMのコルIV染色は、このプロトコルを使用して一貫して観察されない。研究は、BM成分および構造が追加の媒体、細胞、およびイメージング最適化14の恩恵を受けるだろう。
VHSE培養の大部分を通した共焦点イメージングは、しばしば真皮および表皮の計算解析に十分な高解像度画像を生み出すが、記載されたクリアリング方法はより深い組織イメージングを可能にする。クリアリングは共焦点レーザーの貫通深度を改善し、VHSEでの効果的なイメージングは、クリアされたサンプルに対して1mm以上(不明確な場合は〜250 μmと比較して)達成することができます。記載された清算技術(メタノール脱水とメチルサリチル酸)は、VHSE試料組織61全体の屈折率に十分一致する。VHSEをクリアすると、操作なしでコンストラクト全体を通して簡単なイメージングが可能になりました(例えば、真皮と表皮を別々に画像化するように構築物の方向を変更する)(図3)。
容積画像を使用すると、各構造全体で血管構造をマッピングする 3D レンダリングを生成できます (図 4)。簡単に言えば、共焦点画像セットは、コラーゲンIV染色(血管壁のマーキング)および核(遠赤色蛍光核色素によって特徴付ける)を検出するために、VHSEのいくつかのサブボリュームの表皮方向に真皮で撮影した。イメージ スタックは、計算ソフトウェア (マテリアル リストを参照) に読み込まれ、カスタム アルゴリズム (これらのソース 48、70、71、72、73、74、75 に基づく) は、前述の3Dレンダリングと定量に使用されます。このアルゴリズムは、Col IV染色に基づいて血管成分を自動的にセグメント化します。体積セグメンテーションは、高速マーチング75、76、77に基づいてスケルトン化アルゴリズムに渡されます。スケルトン化は、各Col IVマーク容器の決定的な中心を発見し、得られたデータは血管の直径と血管分率を計算するために使用することができる(図4)。レーザー走査顕微鏡が利用できない場合、ワイドフィールド蛍光顕微鏡はアクセス可能なオプションです。血管ネットワークと表皮は、広視野蛍光顕微鏡で画像化することができる(補足図2)。3次元定量は、レーザー走査顕微鏡ではなくVHSEのワイドフィールドイメージングを使用して可能であるが、面外光による画像のより多くのフィルタリングとデコンボリューションが必要な場合がある。
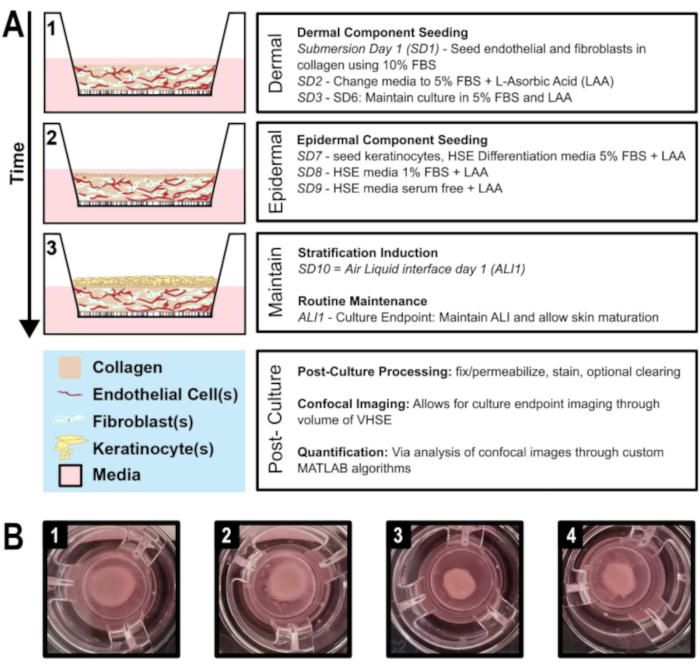
図1:血管化ヒト皮膚等価生成の模式的タイムラインA)1) 真皮成分播種からのVHSEモデルの進行を示し、2)真皮成分にケラチノサイト播種、3)空気液界面および培養維持を介して上皮層層化。培養後処理および体積イメージングは、培養エンドポイントで行うことができる。 B) 培養エンドポイントでのhDF VHSEマクロ構造のカメラ画像は、8週間を挿入する。VHSEでは、さまざまなレベルの収縮が正常です。プロトコルが説明しているように収縮を減らすことができます。(1 & 2)少ない契約サンプル。(3 & 4)より多くの収縮サンプルはまだ適切な皮膚要素を生み出す。 この図の大きなバージョンを表示するには、ここをクリックしてください。
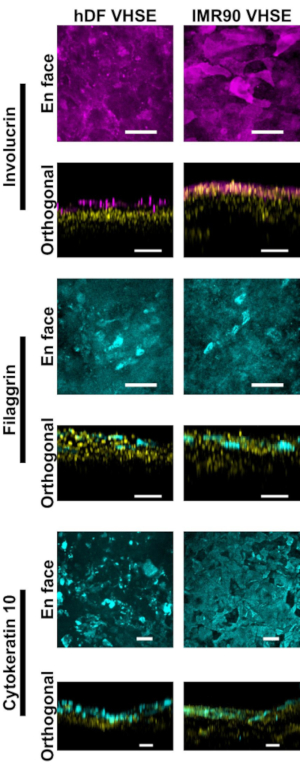
図2:免疫蛍光マーカーによる表皮特性評価 すべての画像は、共焦点顕微鏡を介して8wk培養時点でVHSEを撮影した。対応する染色方法は、プロトコルステップ6に記載されている。適切な上皮マーカーは、hDF VHSE(左カラム)とIMR90 VHSE(右カラム)の両方に存在する。インボルクリンおよびフィラグリンは、ケラチノサイトの後期分化マーカーであり、表皮が両方のVHSEタイプで完全に階層化されていることを実証する。サイトケラチン10は、VHSE中のスラビサル層を同定している初期分化マーカーである。核は黄色で直交図で示される。En面と直交の最大投影画像は、計算ソフトウェアを介してレンダリングされました。画像は、背景の減算と中央値のフィルタリングで個別にスケーリングされ、わかりやすくします。スケールバーは100μmである(一次および二次抗体と社内ブロッキングバッファレシピは 表3に示されている)。 この図の大きなバージョンを表示するには、ここをクリックしてください。
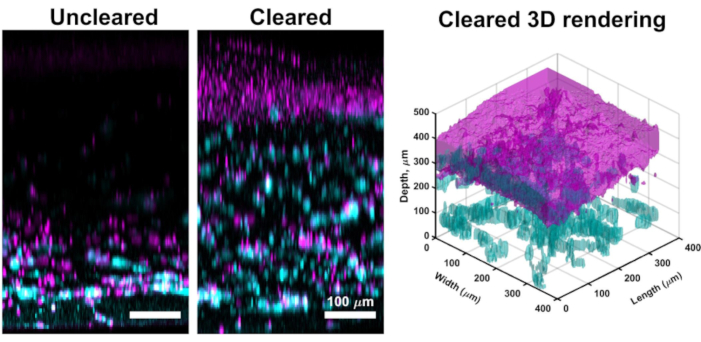
図3:不明確なVHSEとクリアされたVHSEの比較 このVHSEはIMR90sで生成され、画像は共焦点顕微鏡を介して4wk培養時点で撮影された。コラーゲンIVはシアンで示されています;核はマゼンタで示されています;クリアされた3Dレンダリングのマゼンタは、VHSEの表皮層における核の統合を表します。不明なVHSE画像は、より厚いVHSE構築物におけるレーザー減衰の一例であり、クリアリング(メタノールおよびメチルサリチル酸塩)を通じて、構築物の真皮側からのレーザー減衰をほとんど/全く有さないで全体の構造を画像化することができる。レーザーライン、ゲイン、ピンホールなどのイメージング設定を、過飽和を減らすためにVHSEをクリアするために下げました。クリアおよびイメージングは、プロトコルのステップ6及び7に記載されているように完了した。直交最大投影画像と3Dレンダリングは、計算ソフトウェアで完了し、3Dレンダリングはクリアされたコンストラクト画像から生成されました。画像は、背景の減算と中央値のフィルタリングで個別にスケーリングされ、わかりやすくします。スケールバーは100 μmです。 この図の大きなバージョンを表示するには、ここをクリックしてください。
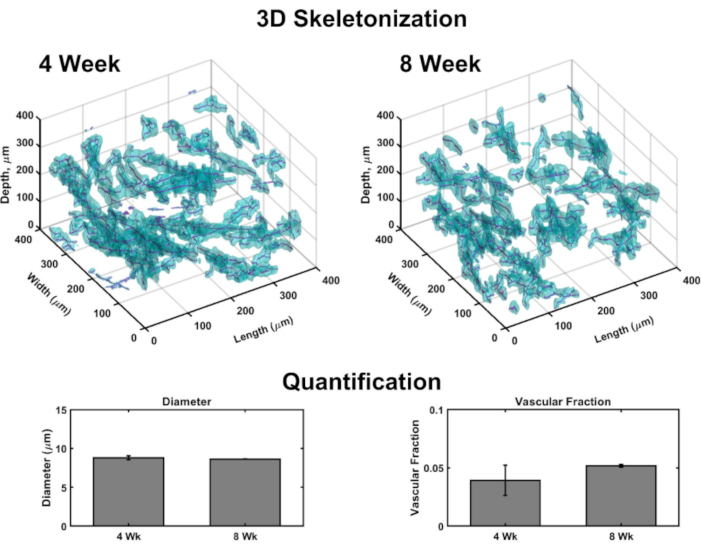
図4:VHSE内の血管構造の3次元解析 共焦点顕微鏡を介して撮影された体積画像は、計算画像解析を通じて培養エンドポイントでの血管パラメータ定量を可能にする。VHSE サブボリュームから, コラーゲン IV 染色の検出 (シアン) 血管構造の内皮壁をマークし、コラーゲン IV 位置に基づいて血管のセグメンテーションを可能にします;;次いで、セグメンテーションデータが骨格化され、各容器の中心が見つかります(マゼンタ)。3Dスケルトン化の例は、4週間および8週間のIMR90 VHSEサンプルについて示され、クリアされていない。IMR90 VHSE実験セットの結果データを使用して、各構成体内の4つのサブボリューム(z方向の各250μm)の血管径および血管画分を計算し、VHSE当たりのデータを平均化し、培養時間ポイントごとにさらに平均化した。これらのデータは、生体内ヒト皮膚78に関連する直径を有する4週間および8週間の培養期間にわたる血管ネットワークのホメオスタシス及び、生体内ヒト皮膚79 と同じ順序の血管分率(コラーゲン構築物中の血管分率はカスタマイズ可能であることが 示されており、さらに値の増加に最適化できることが示されている)。データは、標準誤差平均±平均値として表されます (S.E.M)。n = 各タイムポイントに対して 3。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| メディア | コンポーネント |
| ヒト皮膚線維芽細胞株(hDF) | DMEM HG |
| 5% 牛胎児血清 (FBS) | |
| 1% ペニシリン/ストレプトマイシン (P/S) | |
| IMR90線維芽細胞株 | DMEM/ハムズ F12 50:50 |
| 10% FBS | |
| 1% P/S | |
| HMEC-1内皮細胞株 | MCDB131 ベースメディア |
| 10% FBS | |
| 1% P/S | |
| L-グルタミン [10 mM] | |
| 表皮成長因子 (EGF) [10 ng/mL] | |
| ヒドロコルチゾン [10 μg/mL] | |
| N/TERT-1 ケラチノサイト細胞株 | K-SFM メディアベース |
| 1% P/S | |
| 牛下垂体エキス (BPE) [25 μg/mL]、K-SFMサプリメントキットより | |
| 上皮成長因子 (EGF) [0.2 ng/mL]、K-SFMサプリメントキットから | |
| CaCl2 [0.3 mM] | |
| ヒト皮膚等価(HSE)分化 | 3:1 DMEM:ハムのF12 |
| 1% P/S | |
| 0.5 μM ヒドロコルチゾン | |
| 0.5 μM イソプロテレノール | |
| 0.5 μg/mLインスリン |
表1:メディアレシピヒト皮膚線維芽細胞の2D培養用の培地レシピ、IMR90線維芽細胞、HMEC-1、およびN/TERT-1ケラチノサイトが与えられる。これらのレシピは、VHSEを生成する前に細胞株を拡張するために使用されました。ヒト皮膚等価(HSE)分化媒体は、VHSEを生成するために使用される。基本レシピが与えられ、水没培養と階層化誘導の部分の間に、FBSのテーパリング量は、プロトコルステップ3で説明されているように追加されるべきです。これらのソース11、80に基づくHSEレシピ。
| コラーゲンストック濃度(Cs): | 8 | mg/mL | ||
| 所望のボリューム(Vf): | 1 | ミリリットル | ||
| NaOH 調整の正規化*: | 1 | X | ||
| *各ロットのコラーゲンは、pH 7 -7.4を設定するために必要なNaOHの量を決定するためにテストする必要があります | ||||
| 所望のコラーゲン濃度(mg/mL) | ||||
| 2 | 3 | 4 | 5 | |
| 10X PBS (VPBS) | 0.1 | 0.1 | 0.1 | 0.1 |
| コラーゲンストック(Vs) | 0.25 | 0.375 | 0.5 | 0.625 |
| 1N NaOH (VNaOH) | 0.00575 | 0.008625 | 0.0115 | 0.014375 |
| メディア (Vメディア) | 0.64425 | 0.516375 | 0.3885 | 0.260625 |
表2:コラーゲン計算参照表参考表は、8 mg/mLコラーゲンストック濃度と1mLの所望の最終体積を想定して計算される一般的に望ましいコラーゲン濃度を示します。すべての値は mL です。これらの金額を計算するために使用される方程式は、プロトコルステップ2.2で与えられます。各コラーゲンストックのpHをチェックすることが重要です。必要に応じて、PH 7-7.4(PBS、NaOH、コラーゲンストック、培地が添加された後)を達成するためにNaOH量を添加する必要があります。プロトコルは3 mg/mLコラーゲン濃度を使用してVHSEのために最適化されています。コラーゲン濃度の変化は、異なる細胞株/所望の終了結果48に必要な場合があります。
| 一次抗体 | 源 | 濃度 | 使う |
| フィラグリン (AKH1) マウスモノクローナル IgG | サンタクルス; sc-66192 (200 μg/mL) | [1:250] | 後期分化マーカー15 |
| インボルクリンウサギポリクローナルIgG | プロテインテック; 55328-1-AP(30 μg/150 μL) | [1:250] | 後期端子分化マーカー15 |
| サイトケラチン10(DE-K10)マウスIgG、上清 | サンタクルス; sc-52318 | [1:350] | 上皮上皮マーカー14,36,59 |
| コラーゲンIVウサギポリクローナル | プロテインテック; 55131-1-AP | [1:500] | 血管壁67 |
| ドラク 7 | 細胞シグナル伝達;7406 (0.3 mM) | [1:250] | 核マーカー |
| 二次抗体 | 源 | 濃度 | 使う |
| ヤギアンチラビットIgGダイライト™488コンジュゲート | インビトロジェン;35552 (1 mg/mL) | [1:500] | コラーゲンIV二次 |
| 抗ウサギIgG(H&L)(GOAT)抗体、ダイライト™549コンジュゲート | ロックランド免疫化学;611-142-002 | [1:500] | インボルクリン二次 |
| ヤギアンチマウスIgG(H&L)、ダイライト™ 488 | 熱科学的;35502 (1 mg/mL) | [1:500] | フィラグリンまたはサイトケラチン 10 セカンダリ |
| ブロッキングバッファ (500 mL) | |||
| 試薬 | 量 | ||
| ddH2O | 450 mL | ||
| 10 x PBS | 50 mL | ||
| 牛血清アルブミン (BSA) | 5 g | ||
| トゥイーン 20 | 0.5 mL | ||
| 冷水魚ゼラチン | 1 g | ||
| アジドナトリウム(10%ジH2O中のアジドナトリウム) | 5 mL (0.1 % 最終濃度) | ||
表3:ブロッキング緩衝剤を用いて一次抗体および二次抗体を作る。リストされた抗体および化学染色は、図2、図3、図4に示す染色に使用した。染色は、ここにリストされているブロッキングバッファレシピを用いて、プロトコルステップ6で与えられたように完了した。染色濃度および持続時間のいくつかの最適化は、選択された培養技術および細胞株に応じて必要とされ得る。
補足表 1: 略語リスト 読者の便宜のために含まれる略語リスト。こちらの表をダウンロードしてください。
補足 図1:取扱いのためのVHSEの技術的援助。 VHSEの取り扱いは、特に固定、処理、染色の際に困難です。 A-D は、手順 5 ~ 7 の手順に対応します。 A は、適切な染色を確実にするために培養インサートから多孔質膜を除去する技術的取り扱いを示す。 B は 、染色および保管中に各 VHSE を沈めた状態に保つ方法を示しています。 Cは 、PDMSイメージング井戸にコンストラクトを移動する最も安全で最も簡単な方法を示しています。 D はPDMSイメージングによく座っているVHSEを示す:PDMS井戸は底部のガラススライドに接着され、イメージング用の窓を作成し、ガラススライドは長いイメージング実行を通じて湿度を維持するために上に置かれる。このファイルをダウンロードするには、ここをクリックしてください。
補足 図2:標準広視野蛍光顕微鏡を用いて、VHSEを評価することができる。 ワイドフィールドイメージングは、レーザースキャン顕微鏡が利用できない場合の定期的な評価のために、体積イメージングに使用できます。一例として、円柱とバソラショナルの両方の面からVHSEを撮像することは、顔と直交(Ortho.)の最大投影として示される。(トップ)表皮をマーカーとしてインボルクリンおよび核を用いて画像化した。(下部)皮膚血管系は、マーカーとしてコラーゲンIVを用いて画像化した。画像は、明確にするために背景を減算されます。平面外のライトは、直交ビューで明らかな「ストリーキング」または「フレア」アーティファクトにつながります。ワイドフィールドイメージングは、定量化に使用できますが、より多くの画像処理が必要な場合があります。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、VHSEの生成とその三次元分析のための簡単で再現可能な方法を実証しました。重要なことに、この方法は、いくつかの特殊な技術や機器の部分に依存し、ラボの範囲のためにアクセスできるようにします。さらに、細胞タイプはプロトコルの限られた変更に置き換えることができるので、研究者はこのプロトコルを特定のニーズに適応させることができます。
適切なコラーゲンゲル化は、皮膚培養を確立する上で挑戦的なステップです。特に精製せずに粗精製剤を使用する場合、微量汚染物質がゲル化プロセスに影響を与える可能性があります。一貫性を保つために、VHSE生成に使用するのと同じコラーゲンストックを使用して実験のグループを実行する必要があります。さらに、ゲル化は理想的には7-7.4のpHで起こるべきであり、そして微量の汚染物質はpHをシフトし得る。コラーゲンストックを使用する前に、所望の濃度で細胞ゲルを実践し、pHをゲル化する前に測定する必要があります。真皮成分の播種を開始する前にこのコラーゲン品質チェックを完了すると、完全な実験を設定する前に、適切なゲル化とコラーゲン均質性の問題を特定します。細胞コラーゲンを培養インサートに直接播種する代わりに、pH全体のスケールを評価するpHストリップにコラーゲンを播種し、7-7.4のpHを検証します。ゲル化は、コラーゲンゲル溶液の液滴をカバースリップまたは組織培養プラスチックウェルプレートに塗布することによって評価することができる(培養インサートの閉じ込められた側面をシミュレートするためにウェルプレートが推奨される)。ゲル化時間後、コラーゲンは固形でなければならない、すなわち、プレートが傾いているときには流れてはならない。位相対面顕微鏡では、コラーゲンは均質で透明に見えるはずです。透明なゲル内の不透明なコラーゲンの不定形のブロブが正常であるが、時折、透明なゲル内の不十分な混合、間違ったpH、および/または混合中にコラーゲンを冷やし続けることができなかったために問題が起こりやすいことを示す。
細胞の播種量および培地は調整され得る。上記のプロトコルでは、カプセル化された細胞量は、皮膚構築物の上に播種された1.7 x 10 5ケラチノサイトを有するコラーゲンのmL当たり7.5 x 10 5個の内皮細胞と7.5 x 10 5の内皮細胞で12ウェル挿入物に最適化されている。細胞密度は、様々なコラーゲン濃度48およびHSE生成22、80、81における3D血管ネットワーク発生を調査する予備研究および以前の研究に基づいて、このVHSEプロトコルに対して最適化されている。同様のシステムでは、公表された内皮細胞密度は1.0 x 106細胞/mLコラーゲン48である。線維芽細胞濃度は、コラーゲン22、28、82〜1x105細胞/mLのコラーゲン22、28、1x105細胞/mLのコラーゲンの0.4 x 10の5細胞/mL、58、83、84、85の範囲であることが多い。角化細胞濃度は0.5 x 105 [セル/cm2]から1 x10 5[セル/cm2]8の範囲です。細胞密度は特定の細胞および研究の質問のために最大限に活用することができる。線維芽細胞などの収縮細胞を有する三次元培養は、生存率低下および培養損失86、87を招く収縮を招く可能性がある。予備実験は、真皮コンパートメントの収縮(より多くの真皮細胞、より収縮性の真皮細胞、より長い水没培養、またはより柔らかいマトリックスで起こり得る)および表皮表面被覆を試験するために完了すべきである。さらに、過剰な真皮収縮が起こっている場合やケラチノサイトのカバレッジの異なる速度が必要な場合、沈み込み日数および血清含有量の先細り速度の日数もカスタマイズすることができます。例えば、真皮水没の期間中に収縮が気づいた場合、またはケラチノサイトが表面単層を確立している間に、血清テーパリングプロセスを通してより迅速に移動し、VHSEをALIに上げることは、追加の収縮を防ぐのに役立ちます。同様に、ケラチノサイトの被覆が理想的でない場合、VHSEが血清なしで水没する日数を変更すると、表皮単層カバレッジを増加させ、血清が取り残されるので収縮を緩和するのに役立つ可能性があります。細胞密度の変化や上記の他の提案は、特定の文化と研究目標に合わせて最適化する必要があります。
空気液体界面(ALI)期間中に表皮の適切な階層化を確立するためには、ALIおよび各構成体の適切な水分補給が培養長全体にわたって維持されるように、各ウェルの流体レベルを定期的にチェックし、維持することが重要である。メディア レベルは、一貫した ALI レベルが確立されるまで、毎日チェックおよび追跡する必要があります。表皮層は乾燥ではなく水分補給をしているように見えるはずですが、コンストラクトにはメディアのプールが存在してはいけません。ALI の間、コンストラクトは、通常の不透明な白/黄色の色を作成します。表皮層は不均一に発達する可能性が高い。一般的に、VHSEは、コラーゲンの播種または真皮収縮のために傾いています。また、構築物の中央部で高い表皮部分を小さい構成(24ウェルサイズ)で観察し、VHSEの周囲の隆起形成を12ウェルサイズで観察することも正常である。構成体13 の収縮は、これらの地形形成を変化させ、かつ/または全く観察されない場合がある。
VHSEの染色とイメージングは、VHSEに機械的操作を導入します。各文化の操作を計画し、制限することは非常に重要です。操作が必要な場合は、挿入膜からVHSEを取り除くとき、構造表面に染色または洗浄液を追加する場合、イメージング準備中に貯蔵/イメージングウェル内のVHSEを取り外して交換する際に、穏やかな動きを維持します。具体的には、表皮成分の座端層は壊れやすく、基底表皮層を取り除く危険性がある。表皮の尖体層は壊れやすく、天然組織4でも脱生物を経るが、表皮構造の正確な分析のためには、損傷や損失を最小限に抑えることが重要である。表皮層が構成体から持ち上がった場合、それらは別々に画像化することができます。表皮の基底層は真皮に依然として付着している可能性が最も高く、尖体層の一部が剥離する可能性がある。表皮の可視化のために、核染色は、高密度核が表皮の下層および中層の特徴であるため、これを観察するのに役立ちます。
VHSEポスト・フィケーションの共焦点イメージングはプロトコルで議論されているが、直立ベースの光コヘレン断層撮影(OCT)88、89、90、91、92、93を介して、培養中のVHSEを画像化することも可能である。VHSEは、目立つ効果なしに少なくとも2時間、インキュベーションや加湿なしでイメージングに耐えられるほど安定しています。OCTはラベルフリーで非侵襲的であるため、成熟時に表皮厚さを追跡することが可能です。他の非侵襲的なイメージングモダリティも同様に採用される可能性があります。
VHSEのレーザー減衰により、真皮と表皮の構造を組み合わせた体積画像は困難な場合があります。これは、表皮側(図1)と真皮側(図2)から、真皮血管構造および表皮の良好な分解能を可能にする2つの向きで構成体をイメージングすることによって軽減することができる。さらに、サンプルをクリアすることができ、最小限の減衰で構造全体の容積画像を可能にします。いくつかの消え方が試みられたが、記載のメタノール/メチルサリチル酸法は最良の結果をもたらした。他のクリアメソッドの最適化に興味のある研究者は、これらのレビュー49、61、62に向けられています。クリアする場合、この方法は蛍光体や構造に損傷を与える可能性がありますので、クリアする前にサンプルを完全に画像化することをお勧めします。また、蛍光は数日以内に消えてしまう可能性があるため、クリア後できるだけ早くイメージングを完了する必要があります。
簡潔でアクセス性を高めるには、このプロトコルは、前の文献11,80で見つかった最も単純なメディアブレンドを利用しました。単純なメディア ブレンドを使用することには多くの利点がありますが、この選択の制限も認識されます。他のグループは、表皮および真皮の健康に対する特定の培地成分の影響を研究しており、外部遊離脂肪酸/脂質などの他の培地添加剤94が表皮の角層を増強し、皮膚バリア機能を改善することを発見した。当社の免疫蛍光マーカーは、表皮における適切な分化と成層を示していますが、実施されている研究によっては、追加のメディア最適化が必要になる場合があります。さらに、ここで提示されたVHSEを評価する際に、表皮BMの広範な分析は行われなかった。BMの完全性は、皮膚同等物の重要な指標である。様々なグループは、培養期間及びBMマーキング95に及ぼす影響、ならびに線維芽細胞の存在の分析及びBM発現14に対する成長因子効果の付加に関する研究を行ってきた。BMコンポーネントの分析は、このプロトコルを使用する際に評価し、最適化する必要があることに注意することが重要です。
このプロトコルでは、VHSE生成のための手順を説明し、ALIで8週間後の結果を示す。VHSE培養は、目立った変化や生存率の喪失なしにALIで12週間まで培養されており、より長く生存可能である可能性があります。重要なことに、このプロトコルは、IMR90肺線維芽細胞との皮膚線維芽細胞の置き換えによって示されるように、一般的に利用可能な細胞タイプに容易に適応可能である。研究者のニーズと利用可能なリソースに応じて、培養物の細胞タイプとメディアブレンドを調整できますが、より異なる細胞タイプはメディアの最適化を必要とする場合があります。要約すると、これらの手順は、皮膚生物学と疾患の研究のためのVHSEの文化を明確にすることを意図しています。アクセシビリティを最大限に高めるために、このプロトコルは、研究研究の特定のニーズにさらにカスタマイズできる最小限の効果的なアプローチとして、共通の装置、細胞株、試薬を使用して、このシンプルで堅牢な開発を行いました。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、ジム・ラインヴァルト博士59 とエレン・H・ファン・デン・ボガード20 博士がN/TERT細胞株の寛大な贈り物に感謝している。この作品は、米国心臓協会(19IPLOI34760636)によって支えられていました。
資料
| Name | Company | Catalog Number | Comments |
| 1 N NaOH | Fisher Chemical | S318-100 | (Dilute from Lab stock) |
| 4% Paraformaldehyde | ACROS Organics | #41678-5000, Lot # B0143461 | Made up using solid Paraformaldehyde in PBS, pH adjusted to 6.9 |
| Autoclaved forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| CaCl2 | Fisher bioreagents | Cat # BP510-250, Lot # 190231 | Rnase, Dnase, Protease-Free |
| Cell line, Endothelial: Microvascular Endothelial Cell (HMEC1) | ATCC | CRL-3243 | SV40 Immortalized microvascular endothelial cell. Note that 750,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: dermal Human fibroblast, adult | ATCC | PCS-201-012 | Primary dermal cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: human lung firbroblast (IMR90) | ATCC | CCL-186 | Primary embryonic cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Keratinocyte: N/TERT-1 | Immortalized via hTERT expression. N/TERT-1 was made using a retroviral vector conferring hygromycin resistance. Cell line established by Dickson et al. 2000. Can be replaced with ATCC PCS-200-010 or PCS-200-011. Note that 170,000 cells were used per construct; N/TERT1 cells must be used from plates that are 30% confluent- two 30% confluent 90 mm tissue culture dishes give more than enough cells.The authors thank Dr. Jim Rheinwald and Dr. Ellen H. van den Bogaard for their generous gift of N/TERT cell lines. | ||
| Centrifuge | Thermo Scientific; Sorvall Legend X1R | (standard lab equipment) | |
| Computational Software | MATLAB | MATLAB 2020a | MathWorks, Natick, MA. |
| Confocal Microscope | Leica TCS SPEII confocal | Laser scanning confocal. Can be replaced with other confocals or deconvolution microscopy. | |
| Cover Glass (22 x 22) | Fisher Scientific | 12-545F | 0.13-0.17 mm No.1 Thickness |
| Cyanoacrylate super glue or silicone grease | Glue Masters | #THI0102 | Glue Masters, THICK, Instant Glue, Cyanoacrylate; super glue is preferred |
| DMEM media base | Corning; Mediatech, Inc | REF # 10-013-CM; Lot # 26119007 | DMEM, 1X (Dulbecco's Modification of Eagle's Medium) with 4.5 g/L glucose, L-glutamine & sodium pyruvate |
| DMEM/F-12 50/50 | Corning; Mediatech, Inc | REF # 10-090-CV; Lot # 21119006 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Ethanol | Decon Labs | #V1101 | (standard lab reagent) |
| Fetal Bovine Serum | Fisher Scientific | Cat # FB12999102, Lot # AE29451050 | Research Grade Fetal Bovine Serum, Triple 0.1 um sterile filtered |
| Fine tip forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| Human Epidermal Growth Factor (EGF) | Peprotech | Cat # AF-100-15-1MG, Lot # 0318AFC05 D0218 | Made up in 0.1% BSA in PBS |
| Hydrocortisone | Alpha Easar | Lot # 5002F2A | made up in DMSO |
| Insulin (human) | Peprotech | Lot # 9352621 | |
| Inverted Light/Phase Contrast Microscope | VWR | 76317-470 | (standard lab equipment) |
| Isoproterenol | Alfa Aesar | #AAJ6178806 | DL-Isoproterenol hydrochloride, 98% |
| Keratinocyte-SFM (1x) media base | Gibco; Life Technologies Corporation | REF #: 10724-011; Lot # 2085518 | Keratinocyte-SFM (1X); serum free medium |
| L-Ascorbic Acid | Fisher Chemical | Cat # A61-100, Lot # 181977, CAS # 50-81-7 | Crystalline. L-Ascorbic acid can also be purchased as a salt |
| L-glutamine (solid) | Fisher Bioreagents | CAT # BP379-100, LOT # 172183, CAS # 56-85-9 | L-Glutamine, white crystals or Crystalline powder |
| MCDB 131 media base | Gen Depot | CM034-050, Lot # 03062021 | MCDB 131 Medium Base, No L-Glutamine, sterile filtered |
| Metal punches | Sona Enterprises (SE) | 791LP, 12PC | Hollow Leather Punch Set, High Carbon Steel, Hardness: 48HRC; (various sizes including): 1/8", 5/32", 3/16", 7/32", 1/4", 9/32", 5/16", 3/4", 7/16", 1/2", 5/8:, 3/4". This punch set is helpful, but x-acto knife can work as well. Size of metal punch that works well for 12 well transwell VHSE is 3/8" or 1/2". |
| Methanol | Fisher Chemical | CAS # 67-56-1 | (optional). For clearing dehydration step. |
| Methyl Salicylate | Fisher Chemical | O3695-500; Lot # 164535; CAS # 119-36-8 | (optional). For clearing. |
| Microtubes, 1.7 mL | Genesee Scientific Corporation; Olympus Plastics | Cat # 24-282; Lot # 19467 | 1.7 ml Microtubes, Clear; Boilproof, Polypropulene, Certified Rnase, Dnase, DNA, PCR inhibitor and endotoxin-Free |
| PBS, 10x Culture grade or autoclaved | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. |
| PBS, 1x Culture grade, (-) Calcium, (-) magnesium | Genesee Scientific Corporation | Ref # 25-508; Lot # 07171015 | |
| PBS, 1x non-Culture grade | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. Dilute to 1x with water. |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | Ref # 15140-122, Lot # 2199839 | Pen Strep (10,000 Units/mL Penicillin; 10,000 ug/mL Streptomycin) |
| Petri Dish, glass, small | Corning | PYREX 316060 | (optional). To be used as a clearing container |
| Petri Dishes, 100 mm | Fisher Scientific | FB0875713 | Use for making up PDMS. |
| Polydimethylsiloxane (PDMS) | Dow Corning | GMID 02065622, Batch # H04719H035 | Sylgard 184 Silicone Elastomer Base, Dow Corning, Midland, MI) |
| Dow Corning | GMID 02065622, Batch # H047JC4003 | DOWSIL 184, Silicone Elastomer Curing Agent | |
| note: PDMS is usually sold as a kit that includes both the base and curing agent components. | |||
| Positive Displacement Pipettes (1000 & 250 uL) | Gilson | 1000 uL: HM05136, M1000. 250 uL: T12269L | M1000 pipette capacity (100-1000 uL); M250 pipette capacity to 250 uL |
| Positive Displacement Tips/Pistons (1000 & 250 uL) | Gilson | 1000 uL: CAT # F148180, BATCH # B01292902S; 250 uL: CAT # F148114, BATCH # B05549718S | Sterilized capillaries and pistons |
| Round tipped scoopula | (optional; standard lab equipment) For manipulation of VHSEs prior to imaging | ||
| Supplements for Keratinocyte-SFM media | Gibco; Life Technologies Corporation | Ref # 37000-015, Lot # 2154180 | Contains EGF Human Recombinant (Cat # 10450-013), Bovine Pituitary Extract (Cat # 13028-014) |
| Tissue Culture Plate Inserts, 12 well size, 3 µm pore size | Corning; Costar | REF # 3462 - Clear; Lot # 14919057 | Transwell; 12 mm Diameter Inserts, 3.0 um pore size, tissue culture treated, polyester membrane, polystyrene plates, |
| Tissue Culture Plates, 12 well size | Greiner Bio-one; CellStar | Cat # 665 180; Lot # E18103QT | 12 well cell culture plate; sterile, with lid; products are sterile, free of detectable Dnase, Rnase, human DNA and pyrogens. Contents non-cytotoxic |
| Tissue Culture Plates, 60.8cm^2 growth area | Genesee Scientific Corporation | Cat # 25-202; Lot No: 191218-177B | Tissue culture dishes; treated, growth area 60.8 cm^2; sterile, Dnase, Rnase, Pyrogen Free; virgin polystyrene |
| Triton x 100 | Ricca Chemical Company | Cat # 8698.5-16, Lot # 4708R34 | Wetting agent |
| Trypsin 0.25% | Corning; Mediatech, Inc | Ref # 25-053-CI | 0.25% Trypsin, 2.21 mM EDTA, 1x [-] sodium bicarbonate |
| Type 1 Collagen isolated from Rat tail | Pel-Freez Biologicals | 56054-1 | Sprauge-Dawley rat tails can be purchased frozen from Pel-Freez or other suppliers. Collagen can be isolated from the tail tendons. Isolation Protocol references [Cross et al.,2010; Rajan et al.,2007; Bornstein, 1958] .Alternatively, high concentration rat-tail collagen can be purchased from suppliers including Corning (Catalog Number: 354249) |
| Vaccum chamber, benchtop | Bel-Art | F42010-0000 | (standard lab equipment) |
| Handheld Precision knife | X-Acto | X3311 | (X-Acto knife optional if purchased steel punches) |
参考文献
- Stojic, M., et al. Skin tissue engineering 3. Biomaterials for Skin Repair and Regeneration. , 59 (2019).
- Shevchenko, R. V., James, S. L., James, S. E. A review of tissue-engineered skin bioconstructs available for skin reconstruction. Journal of The Royal Society Interface. 7 (43), 229-258 (2010).
- Kolarsick, P. A. J., Kolarsick, M. A., Goodwin, C. Anatomy and Physiology of the Skin. Journal of the Dermatology Nurses' Association. 3 (4), (2011).
- McGrath, J. A., Eady, R. A. J., Pope, F. M. Anatomy and organization of human skin. Rook's textbook of dermatology. 10, 9781444317633 (2004).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. Journal of Dermatological Science. 90 (1), 3-12 (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue Engineered Human Skin Equivalents. Pharmaceutics. 4 (1), (2012).
- Oh, J. W., Hsi, T. -. C., Guerrero-Juarez, C. F., Ramos, R., Plikus, M. V. Organotypic skin culture. The Journal of investigative dermatology. 133 (11), 1-4 (2013).
- El-Ghalbzouri, A., Gibbs, S., Lamme, E., Van Blitterswijk, C. A., Ponec, M. Effect of fibroblasts on epidermal regeneration. British Journal of Dermatology. 147 (2), 230-243 (2002).
- Sun, T., Haycock, J., MacNeil, S. In situ image analysis of interactions between normal human keratinocytes and fibroblasts cultured in three-dimensional fibrin gels. Biomaterials. 27 (18), 3459-3465 (2006).
- Kreimendahl, F., et al. Macrophages significantly enhance wound healing in a vascularized skin model. Journal of Biomedical Materials Research Part A. 107, 1340-1350 (2019).
- El Ghalbzouri, A., Commandeur, S., Rietveld, M. H., Mulder, A. A., Willemze, R. Replacement of animal-derived collagen matrix by human fibroblast-derived dermal matrix for human skin equivalent products. Biomaterials. 30 (1), 71-78 (2009).
- Roger, M., et al. Bioengineering the microanatomy of human skin. Journal of Anatomy. 234, 438-455 (2019).
- Carlson, M. W., Alt-Holland, A., Egles, C., Garlick, J. A. Three-Dimensional Tissue Models of Normal and Diseased Skin. Current Protocols in Cell Biology. 41 (1), 1-17 (2008).
- El Ghalbzouri, A., Jonkman, M. F., Dijkman, R., Ponec, M. Basement Membrane Reconstruction in Human Skin Equivalents Is Regulated by Fibroblasts and/or Exogenously Activated Keratinocytes. Journal of Investigative Dermatology. 124 (1), 79-86 (2005).
- Pruniéras, M., Régnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. The Journal of Investigative Dermatology. 81, 28-33 (1983).
- Ali, N., Hosseini, M., Vainio, S., Taieb, A., Cario-André, M., Rezvani, H. R. Skin equivalents: skin from reconstructions as models to study skin development and diseases. British Journal of Dermatology. 173 (2), 391-403 (2015).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Innovative tissue models for drug discovery and development. 69-70, 81-102 (2014).
- Mieremet, A., Rietveld, M., Absalah, S., van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by chitosan modulated dermal matrices. PLOS ONE. 12 (3), 0174478 (2017).
- Vidal, S. E. L., Tamamoto, K. A., Nguyen, H., Abbott, R. D., Cairns, D. M., Kaplan, D. L. 3D biomaterial matrix to support long term, full thickness, immuno-competent human skin equivalents with nervous system components. Organoids and Ex Vivo Tissue On-Chip Technologies. 198, 194-203 (2019).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Lebonvallet, N., et al. Effects of the re-innervation of organotypic skin explants on the epidermis. Experimental Dermatology. 21 (2), 156-158 (2011).
- Van Drongelen, V., et al. Barrier Properties of an N/TERT-Based Human Skin Equivalent. Tissue Engineering Part A. 20 (21-22), 3041-3049 (2014).
- . Establishment and initial characterization of a simple 3D organotypic wound healing model Available from: https://opus.hs-furtwangen.de/frontdoor/index/index/docld/4852 (2018)
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5), 240-249 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Amelian, A., Wasilewska, K., Megias, D., Winnicka, K. Application of standard cell cultures and 3D in vitro tissue models as an effective tool in drug design and development. Pharmacological Reports. 69 (5), 861-870 (2017).
- Lu, W., et al. Mixture of Fibroblasts and Adipose Tissue-Derived Stem Cells Can Improve Epidermal Morphogenesis of Tissue-Engineered Skin. Cells Tissues Organs. 195 (3), 197-206 (2012).
- Marino, D., Luginbühl, J., Scola, S., Meuli, M., Reichmann, E. Bioengineering Dermo-Epidermal Skin Grafts with Blood and Lymphatic Capillaries. Science Translational Medicine. 6 (221), 221 (2014).
- Martins-Green, M., Li, Q. -. J., Yao, M. A new generation organ culture arising from cross-talk between multiple primary human cell types. The FASEB Journal. 19 (2), 222-224 (2004).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. -. W. 3D Cell Printing of Perfusable Vascularized Human Skin Equivalent Composed of Epidermis, Dermis, and Hypodermis for Better Structural Recapitulation of Native Skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Baltazar, T., et al. 3D bioprinting of a vascularized and perfusable skin graft using human keratinocytes. Tissue Engineering Part A. 26 (5-6), 227-238 (2019).
- Klar, A. S., et al. Tissue-engineered dermo-epidermal skin grafts prevascularized with adipose-derived cells. Biomaterials. 35 (19), 5065-5078 (2014).
- Grebenyuk, S., Ranga, A. Engineering Organoid Vascularization. Frontiers in Bioengineering and Biotechnology. 7, (2019).
- Black, A. F., Berthod, F., L'heureux, N., Germain, L., Auger, F. A. In vitro reconstruction of a human capillary-like network in a tissue-engineered skin equivalent. The FASEB Journal. 12 (13), 1331-1340 (1998).
- Huber, B., Link, A., Linke, K., Gehrke, S. A., Winnefeld, M., Kluger, P. J. Integration of Mature Adipocytes to Build-Up a Functional Three-Layered Full-Skin Equivalent. Tissue Engineering Part C: Methods. 22 (8), 756-764 (2016).
- Monfort, A., Soriano-Navarro, M., García-Verdugo, J. M., Izeta, A. Production of human tissue-engineered skin trilayer on a plasma-based hypodermis. Journal of Tissue Engineering and Regenerative Medicine. 7 (6), 479-490 (2013).
- Shamis, Y., et al. Fibroblasts derived from human embryonic stem cells direct development and repair of 3D human skin equivalents. Stem Cell Research & Therapy. 2 (1), 10 (2011).
- Kim, Y., et al. Establishment of a complex skin structure via layered co-culture of keratinocytes and fibroblasts derived from induced pluripotent stem cells. Stem Cell Research & Therapy. 9 (1), 217 (2018).
- Chau, D. Y. S., Johnson, C., MacNeil, S., Haycock, J. W., Ghaemmaghami, A. M. The development of a 3D immunocompetent model of human skin. Biofabrication. 5 (3), 035011 (2013).
- Vanden Bogaard, E. H., et al. Crosstalk between Keratinocytes and T Cells in a 3D Microenvironment: A Model to Study Inflammatory Skin Diseases. Journal of Investigative Dermatology. 134 (3), 719-727 (2014).
- Linde, N., Gutschalk, C. M., Hoffmann, C., Yilmaz, D., Mueller, M. M. Integrating Macrophages into Organotypic Co-Cultures: A 3D In Vitro Model to Study Tumor-Associated Macrophages. PLOS ONE. 7 (7), 40058 (2012).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical Advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Weinmüllner, R., et al. Organotypic human skin culture models constructed with senescent fibroblasts show hallmarks of skin aging. npj Aging and Mechanisms of Disease. 6 (1), 4 (2020).
- Barker, C. L., et al. The Development and Characterization of an In Vitro Model of Psoriasis. Journal of Investigative Dermatology. 123 (5), 892-901 (2004).
- Larcher, F., Espada, J., Díaz-Ley, B., Jaén, P., Juarranz, A., Quintanilla, M. New Experimental Models of Skin Homeostasis and Diseases. Actas Dermo-Sifiliográficas (English Edition). 106 (1), 17-28 (2015).
- Varkey, M., Ding, J., Tredget, E. E. Fibrotic Remodeling of Tissue-Engineered Skin with Deep Dermal Fibroblasts Is Reduced by Keratinocytes. Tissue Engineering Part A. 20 (3-4), 716-727 (2013).
- Moulin, V. J. Reconstitution of skin fibrosis development using a tissue engineering approach. Methods in Molecular Biology. 961, 287-303 (2013).
- Morgan, J. T., Shirazi, J., Comber, E. M., Eschenburg, C., Gleghorn, J. P. Fabrication of centimeter-scale and geometrically arbitrary vascular networks using in vitro self-assembly. Biomaterials. 189, 37-47 (2019).
- Silvestri, L., Costantini, I., Sacconi, L., Pavone, F. S. Clearing of fixed tissue: a review from a microscopist's perspective. Journal of Biomedical Optics. 21 (8), 1-8 (2016).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1, 2753 (2007).
- Bornstein, M. B. Reconstituted rat-tail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Laboratory Investigation. 7 (2), 134-137 (1958).
- Clément, M. -. V., Ramalingam, J., Long, L. H., Halliwell, B. The In Vitro Cytotoxicity of Ascorbate Depends on the Culture Medium Used to Perform the Assay and Involves Hydrogen Peroxide. Antioxidants & Redox Signaling. 3 (1), 157-163 (2001).
- Tajima, S., Pinnell, S. R. Ascorbic acid preferentially enhances type I and III collagen gene transcription in human skin fibroblasts. Journal of Dermatological Science. 11 (3), 250-253 (1996).
- Murad, S., Tajima, S., Johnson, G. R., Sivarajah, A., Pinnell, S. R. Collagen Synthesis in Cultured Human Skin Fibroblasts: Effect of Ascorbic Acid and Its Analogs. Journal of Investigative Dermatology. 81 (2), 158-162 (1983).
- Villacorta, L., Azzi, A., Zingg, J. -. M. Regulatory role of vitamins E and C on extracellular matrix components of the vascular system. Vitamin E: An Overview of Major Research Directions. 28 (5), 507-537 (2007).
- Ashino, H., et al. Novel Function of Ascorbic Acid as an Angiostatic Factor. Angiogenesis. 6 (4), 259-269 (2003).
- Ponec, M., et al. The Formation of Competent Barrier Lipids in Reconstructed Human Epidermis Requires the Presence of Vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
- Johansen, C. Generation and Culturing of Primary Human Keratinocytes from Adult Skin. Journal of visualized experiments: JoVE. (130), e56863 (2017).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Ariel, P. A beginner's guide to tissue clearing. The International Journal of Biochemistry & Cell Biology. 84, 35-39 (2017).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Ng, J. M. K., Gitlin, I., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. ELECTROPHORESIS. 23 (20), 3461-3473 (2002).
- Eddings, M. A., Johnson, M. A., Gale, B. K. Determining the optimal PDMS-PDMS bonding technique for microfluidic devices. Journal of Micromechanics and Microengineering. 18 (6), 067001 (2008).
- Markov, D. A., Lillie, E. M., Garbett, S. P., McCawley, L. J. Variation in diffusion of gases through PDMS due to plasma surface treatment and storage conditions. Biomedical microdevices. 16 (1), 91-96 (2014).
- Katzenberg, F. Plasma-bonding of poly(dimethylsiloxane) to glass. e-Polymers. 5 (1), (2005).
- El Ghalbzouri, A., Lamme, E., Ponec, M. Crucial role of fibroblasts in regulating epidermal morphogenesis. Cell and Tissue Research. 310 (2), 189-199 (2002).
- Kanitakis, J. Anatomy, histology and immunohistochemistry of normal human skin. European journal of dermatology: EJD. 12 (4), 390-399 (2002).
- Hessian based Frangi Vesselness filter. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/24409-hessian-based-frangi-vesselness-filter (2010)
- Jerman, T., Pernuš, F., Likar, B. Špiclin Enhancement of Vascular Structures in 3D and 2D Angiographic Images. IEEE Transactions on Medical Imaging. 35 (9), 2107-2118 (2016).
- Kovesi, P. Phase Preserving Denoising of Images. signal. 4, 6 (1999).
- Vincent, L. Morphological grayscale reconstruction in image analysis: applications and efficient algorithms. IEEE Transactions on Image Processing. 2 (2), 176-201 (1993).
- Xie, L., et al. Quantitative susceptibility mapping of kidney inflammation and fibrosis in type 1 angiotensin receptor-deficient mice. NMR in Biomedicine. 26 (12), 1853-1863 (2013).
- Van Uitert, R., Bitter, I. Subvoxel precise skeletons of volumetric data based on fast marching methods. Medical Physics. 34 (2), 627-638 (2007).
- Sethian, J. A. A fast marching level set method for monotonically advancing fronts. Proceedings of the National Academy of Sciences of the United States of America. 93 (4), 1591-1595 (1996).
- Sethian, J. A. Fast Marching Methods. SIAM Review. 41 (2), 199-235 (1999).
- Braverman, I. M. The Cutaneous Microcirculation. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 3-9 (2000).
- Men, S. J., Chen, C. -. L., Wei, W., Lai, T. -. Y., Song, S. Z., Wang, R. K. Repeatability of vessel density measurement in human skin by OCT-based microangiography. Skin research and technology: official journal of International Society for Bioengineering and the Skin (ISBS) [and] International Society for Digital Imaging of Skin (ISDIS) [and] International Society for Skin Imaging (ISSI). 23 (4), 607-612 (2017).
- Commandeur, S., Ho, S. H., de Gruijl, F. R., Willemze, R., Tensen, C. P., El Ghalbzouri, A. Functional characterization of cancer-associated fibroblasts of human cutaneous squamous cell carcinoma. Experimental Dermatology. 20 (9), 737-742 (2011).
- Thakoersing, V. S., Danso, M. O., Mulder, A., Gooris, G., Ghalbzouri, A. E., Bouwstra, J. A. Nature versus nurture: does human skin maintain its stratum corneum lipid properties in vitro. Experimental Dermatology. 21 (11), 865-870 (2012).
- Thakoersing, V. S., Gooris, G. S., Mulder, A., Rietveld, M., El Ghalbzouri, A., Bouwstra, J. A. Unraveling barrier properties of three different in-house human skin equivalents. Tissue Engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Bouwstra, J. A., Groenink, H. W. W., Kempenaar, J. A., Romeijn, S. G., Ponec, M. Water distribution and natural moisturizer factor content in human skin equivalents are regulated by environmental relative humidity. The Journal of Investigative Dermatology. 128 (2), 378-388 (2008).
- Thakoersing, V. S., van Smeden, J., Mulder, A. A., Vreeken, R. J., El Ghalbzouri, A., Bouwstra, J. A. Increased Presence of Monounsaturated Fatty Acids in the Stratum Corneum of Human Skin Equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Smola, H., Thiekötter, G., Fusenig, N. Mutual induction of growth factor gene expression by epidermal-dermal cell interaction. The Journal of Cell Biology. 122 (2), 417 (1993).
- Fluck, J., Querfeld, C., Cremer, A., Niland, S., Krieg, T., Sollberg, S. Normal Human Primary Fibroblasts Undergo Apoptosis in Three-Dimensional Contractile Collagen Gels. Journal of Investigative Dermatology. 110 (2), 153-157 (1998).
- Nakagawa, S., Pawelek, P., Grinnell, F. Long-Term Culture of Fibroblasts in Contracted Collagen Gels: Effects on Cell Growth and Biosynthetic Activity. Journal of Investigative Dermatology. 93 (6), 792-798 (1989).
- Smith, L. E., Bonesi, M., Smallwood, R., Matcher, S. J., MacNeil, S. Using swept-source optical coherence tomography to monitor the formation of neo-epidermis in tissue-engineered skin. Journal of Tissue Engineering and Regenerative Medicine. 4 (8), 652-658 (2010).
- Pierce, M. C., Strasswimmer, J., Park, H., Cense, B., De Boer, J. F. Birefringence measurements in human skin using polarization-sensitive optical coherence tomography. Biomed Opt. 2 (2), 287-291 (2004).
- Pierce, M. C., Strasswimmer, J., Hyle Park, B., Cense, B., de Boer, J. F. Advances in Optical Coherence Tomography Imaging for Dermatology. Journal of Investigative Dermatology. 123 (3), 458-463 (2004).
- Yeh, A. T., Kao, B., Jung, W. G., Chen, Z., Nelson, J. S., Tromberg, B. J. Imaging wound healing using optical coherence tomography and multiphoton microscopy in an in vitro skin-equivalent tissue model. Journal of Biomedical Optics. 9 (2), 9 (2004).
- Derr, K., et al. Fully Three-Dimensional Bioprinted Skin Equivalent Contructs with Validated Morphology and Barrier Funtion. Tissue Engineering Part C: Methods. 25 (6), 334-343 (2019).
- Park, B. H., de Boer, J. F. Polarization Sensitive Optical Coherence Tomography. Optical Coherence Tomography: Technology and Applications. , 1055-1101 (2015).
- Batheja, P., Song, Y., Wertz, P., Michniak-Kohn, B. Effects of Growth Conditions on the Barrier Properties of a Human Skin Equivalent. Pharmaceutical Research. 26 (7), 1689-1700 (2009).
- Dos Santos, M., Metral, E., Boher, A., Rousselle, P., Thepot, A., Damour, O. In vitro 3-D model based on extending time of culture for studying chronological epidermis aging. Matrix Biology. 47, 85-97 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved