Method Article
Kendi Kendine Monte Edilmiş Vaskülerleştirilmiş İnsan Derisi Eşdeğerlerinin Üretimi
Bu Makalede
Özet
Bu protokolün amacı, uzun vadeli kültür için erişilebilir ve basit teknikler kullanarak damarlı insan derisi eşdeğerlerinin neslini ve hacimsel analizini tanımlamaktır. Mümkün olduğu ölçüde, adımların gerekçesi, araştırmacılara araştırma ihtiyaçlarına göre özelleştirme olanağı sağlamak için açıklanmıştır.
Özet
İnsan derisi eşdeğerleri (HSE'ler), insan derisinin epidermal ve dermal bileşenlerini modelleyen doku mühendisliği yapılardır. Bu modeller cilt gelişimi, yara iyileşmesi ve aşılama tekniklerini incelemek için kullanılmıştır. Birçok HSE vaskülürden yoksun olmaya devam eder ve ayrıca yapının hacimsel değerlendirmesini sınırlayan kültür sonrası histolojik bölümleme yoluyla analiz edilir. Burada sunulan, damarlı insan derisi eşdeğerleri (VHSE) oluşturmak için erişilebilir malzemeler kullanan basit bir protokoldür; ayrıca bu yapıların hacimsel görüntüleme ve nicelleştirme teknikleri tanımlanmıştır. Kısaca, VHSE'ler dermal ve epidermal hücrelerin sıçan kuyruk kollajen tipi I jel içine tohum edildiği 12 kuyu kültürü kesici uçta inşa edilir. Dermal bölme, kollajen jel boyunca dağılmış fibroblast ve endotel hücrelerinden oluşur. Epidermal bölme, hava-sıvı arayüzünde farklılık gösteren keratinositlerden (cilt epitel hücreleri) oluşur. Daha da önemlisi, bu yöntemler araştırmacının ihtiyaçlarına göre özelleştirilebilir ve sonuçlar VHSE neslini iki farklı fibroblast hücre tipiyle gösterir: insan dermal fibroblastları (hDF) ve insan akciğer fibroblastları (IMR90'lar). VHSE'ler geliştirildi, konfokal mikroskopi ile görüntülendi ve 4 ve 8 haftalık zaman noktalarında hesaplama yazılımı kullanılarak hacimsel olarak analiz edildi. Hacimsel muayene için VHSE'leri düzeltmek, lekelemek, görüntülemek ve temizlemek için optimize edilmiş bir süreç açıklanmıştır. Bu kapsamlı model, görüntüleme ve analiz teknikleri, önceden HSE deneyimi olan veya olmayan bireysel laboratuvarların özel araştırma ihtiyaçlarına göre kolayca özelleştirilebilir.
Giriş
İnsan derisi, bağışıklık/ mekanik bariyer görevi, vücut sıcaklığını düzenleme, su tutma ve duyusalrollerekatılma dahil olmak üzere birçok temel biyolojik işlevi yerine getirir 1,2,3,4. Anatomik olarak, cilt insan vücudundaki en büyük organdır ve üç ana katmandan (epidermis, dermis ve hipodermis) oluşur ve epidermal hücrelere ek olarak stromal, vasküler, glandüler ve bağışıklık / sinir sistemi bileşenlerinden oluşan karmaşık bir sisteme sahiptir. Epidermisin kendisi, bariyer fonksiyonunu ve doğal cildin diğer yapılarını (yani ter ve yağ bezleri, tırnaklar) korumak için sürekli yenilenen dört hücre katmanından oluşur3. Cilt fizyolojisi bağışıklık fonksiyonu, yara iyileşmesi, kanser biyolojisi ve diğer alanlarda önemlidir ve araştırmacıların in vitro monokültürlerden in vivo hayvan modellerine kadar çok çeşitli modeller kullanmasına yol açmaktadır. Hayvan modelleri cilt fizyolojisinin tüm karmaşıklığını inceleme yeteneği sunar, ancak fareler gibi yaygın olarak kullanılan hayvan modelleri insanlara kıyasla önemli fizyolojik farklılıklara sahiptir5. Bu sınırlamalar ve hayvan modellerinin artan maliyeti, birçok araştırmacının insan derisinin fizyolojisini daha yakından yansıtan in vitro modeller geliştirmeye odaklanmasına neden oldu1,6. Bunlardan daha basit model türlerinden biri, hücresel dermal matris üzerinde sadece epidermal keratinositlerden oluşan, ancak in vivo olarak görülen epidermal farklılaşma ve tabakalaşmayı yakalayan insan epidermal eşdeğeridir (HEE; yarı kalınlıkta cilt modelleri olarak da adlandırılır). Bunun üzerine inşa edilen dermal ve epidermal bileşenler (keratinositler ve fibroblastlar) içeren modeller genellikle insan derisi eşdeğerleri (HSE), tam kalınlıkta cilt modelleri veya organotipik cilt yapıları (OSC) olarak adlandırılır. Kısaca, bu modeller jel matrisler içindeki dermal hücrelerin kapsüllenerek ve üstte epidermal hücrelerin tohumlanarak oluşturulur. Epidermal farklılaşma ve tabakalaşma daha sonra özel ortam ve hava maruziyeti ile elde edilebilir7. Cilt eşdeğerleri en sık kollajen tip I (fare kuyruğu veya sığır derisi kökenli)1,8,ancak benzer modeller fibrin 9,10, fibroblast gibi diğer matris bileşenlerini içeren dermal jeller kullanılarak kendi kendine montaj teknikleri ile üretilmiştir. türetilmiş11,12, kadavra epidermizlenmiş membranlar13,14,15,16, ticari olarak mevcut jeller ve diğerleri 1,12,13,17,18,19. Şu anda, ticari olarak mevcut cilt eşdeğerleri vardır (daha önce incelenmiş olduğu gibi1,2). Bununla birlikte, bunlar öncelikle terapötik amaçlar için geliştirilmiştir ve belirli araştırma sorularına kolayca özelleştirilemez.
HSE'ler yara iyileşmesi, greftleme, toksikoloji ve cilt hastalığı/gelişimi 11,12,13,16,8 ,20,21,22,23çalışmalarında uygulanmıştır. 3D kültürü, 2D kültürlere kıyasla insan dokusunun işlevlerini daha kapsamlı bir şekilde modellese de24, in vivo popülasyonu daha doğru yansıtan çeşitli hücre türlerinin dahil edilmesi, karmaşık dokularda hücre-hücre koordinasyonu çalışmalarına olanak sağlar24,25,26. Çoğu HSE sadece dermal fibroblastlar ve epidermal keratinositleriçerir 27In vivo cilt ortamı diğer birçok hücre tipini içermelerine rağmen. Son çalışmalar daha fazla hücre popülasyonu dahil başladı; Bunlar arasında10,28 , 29,30,31 ,32,33,34,alt deri dokusundaki adipositler35,36,sinir bileşenleri19,2'dekiendotel hücreleribulunur.1 , kök hücreler27,37,38, bağışıklık hücreleri10,39,40,41,42ve diğer hastalık/kansere özgü modeller16, 40,43,44,45,46,47. Bunlar arasında özellikle önemli olan vaskülattır; Bazı HSE'ler vasküler hücreler içerirken, genel olarak hala tüm dermis10, 29,genişletilmiş in vitro stabilite28 ve uygun damar yoğunluğu boyunca bağlantıya sahip kapsamlı kılcal elementlerden yoksunlar. Ayrıca, İsG modelleri tipik olarak HSE'lerin üç boyutlu yapısının analizini sınırlayan kültür sonrası histolojik bölümleme yoluyla değerlendirilir. Üç boyutlu analiz, vasküler yoğunluğun hacimsel olarak değerlendirilmesinisağlar 48,49 ve epidermal kalınlık ve farklılaşmanın bölgesel varyasyonunu sağlar.
HSE'ler en yaygın organotipik modellerden biri olmasına rağmen, uygun hücre dışı matris ve hücre yoğunluklarının tanımlanması, medya tarifleri, uygun hava sıvısı arayüz prosedürleri ve kültür sonrası analiz dahil olmak üzere bu yapıların oluşturulmasında birçok teknik zorluk vardır. Ayrıca, HEE ve HSE modelleri protokoller yayınlamış olsa da, histolojik analizden ziyade dermal vaskülat ve hacimsel görüntülemeyi içeren ayrıntılı bir protokol yoktur. Bu çalışma, esas olarak ticari hücre hatlarından damarlı insan derisi eşdeğerleri (VHSE) kültürü için erişilebilir bir protokol sunun. Bu protokol, farklı hücre türlerine ve araştırma ihtiyaçlarına doğrudan adaptasyon sağlayan kolayca özelleştirilebilir olacak şekilde yazılmıştır. Erişilebilirlik, kullanılabilirlik ve maliyet açısından, basit ürünlerin kullanımı ve üretim teknikleri, piyasada bulunan ürünlerin kullanımına göre önceliklendirilmiştir. Ayrıca, VHSE'nin üç boyutlu yapısının değerlendirilmesine izin veren basit hacimsel görüntüleme ve nicelleştirme yöntemleri açıklanmıştır. Bu prosedürün sağlam ve erişilebilir bir protokole çevrilmesi, uzman olmayan araştırmacıların bu önemli modelleri kişiselleştirilmiş tıp, damarlı doku mühendisliği, greft geliştirme ve ilaç değerlendirmesinde uygulamalarını sağlar.
Protokol
1. 3D kültüre hazırlık
- Belirlenen protokolleri kullanarak 8 mg / mL'de sıçan kuyruk kollajen stoğu hazırlayın50,51,52. Alternatif olarak, sıçan kuyruğu kolajeni satıcılardan (malzeme listesine bakın) uygun konsantrasyonlarda satın alınabilir.
NOT: Kollajen 3-10 mg/mL veya daha yüksek50, 51,52aralığında farklı konsantrasyonlarda hazırlanabilir veya satın alınabilir. Protokoldeki hesaplamalar 8 mg/mL konsantrasyon varsayar, ancak araştırmacının ihtiyaçlarına göre ayarlanabilir. - Hücre hatlarını genişletin: Endotel ve fibroblast hücrelerinin 3D kollajen dermal bileşen üretimi başlangıcında tohumlamaya hazır olması gerekir (adım 2). Keratinositlerin 3D kültürün 7. Bir komple VHSE yapısı 7,5 x 105 endotel hücresi gerektirir; 7,5 x 104 fibroblast; ve 1.7 x 105 keratinosit üretimi için (Tablo 1).
NOT: Bu yoğunluklar 12 kuyu boyutunda geçirgen doku kültürü kesici uçları veya eşdeğeri için uygundur. Hücre yoğunluğu ve formatı araştırmacının ihtiyaçlarına göre yukarı veya aşağı ölçeklendirilebilir. Açıklığa kavuşturmak için, bu miktarda endotel ve fibroblast hücresi 1-3 dermal bileşen tohumlarken, her epidermal bileşen 1.7 x 105 keratinosit gerektirir. - Bu protokoldeki tüm hücre santrifüjlemesini 5 dakika boyunca 300 x g'da gerçekleştirin, ancak bu daha kırılgan hücre tipleri için azaltılabilir.
2. 3D kollajen dermal bileşenin üretimi
NOT: Adım 2 zamana duyarlı bir yordamdır ve tek bir ayarda tamamlanmalıdır. Dermal bileşen tohumlama başlamadan önce uygun jelleşme ve homojenliği sağlamak için kollajen stoğunun kalite kontrolünü tamamlamanız önerilir, tartışmada sorun gidermeye bakın.
- Hücresel kollajen tabakası hazırlama ve tohumlama
- Biri hücresel destek, diğeri hücresel dermis için olmak üzere iki adet 1,7 mL kapaklı mikrosantrifüj tüpü hazırlayın. Bu adımda verilen miktarlar 1 mL 3 mg/mL kollajen (hedef kollajen konsantrasyonu) hazırlayacaktır, (3) 12 kuyu boyutunda VHSE'ler için yeterlidir. Ayarlama gerekiyorsa denklemler listelenir. Hem hacim hem de yoğunluk araştırmacının ihtiyaçlarına göre ölçeklendirilebilir (ortak referans numaraları Tablo 2'deverilmiştir).
- Her tüpe 100 μL kültür sınıfı 10x Fosfat tamponlu salin (PBS) ekleyin (bir tüp 3 VHSE verecektir) ve 8,6 μL 1 N NaOH ekleyin. En az 10 dakika soğuması için kapüşonlu tüpleri ıslak buzun üzerine yerleştirin.
Cs = Kollajen Stok Konsantrasyonu
Vf = Gerekli Kollajenin Son Hacmi
Ct = Hedef Kollajen Konsantrasyonu
Vs = İstenilen miktar için gerekli stok kollajen hacmi (Vf)
Vpbs = Hedef kollajen konsantrasyonu için gereken 10X PBS hacmi (Ct)
VNaOH = Ct için gereken 1N NaOH hacmi
Vortam = Ct için gereken ortam hacmi, çağrı askıya alma veya ddH2O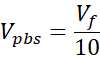
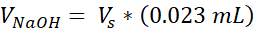
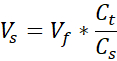
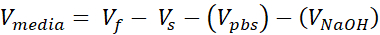
- Kullanım için 1000 ve 250 μL pozitif deplasman pipetleri hazırlayın ve bir kenara koyun. Daha sonraki adımlar zamana duyarlı olduğundan, pipet uçlarını yüklemek ve hacimleri ayarlamak uygundur (sırasıyla 375 μL ve 125 μL). Ayrıca, 516 μL için normal bir 1000 μL pipet ayarlayın.
NOT: Pozitif deplasman pipetleri gerekirse normal pipetlerle değiştirilebilir, ancak kollajenin yüksek viskozitesi ve bu prosedürün zaman / sıcaklık hassasiyeti nedeniyle, tutarlı tohumlama sonuçları üretmeye yardımcı olmak için pozitif deplasman pipetleri önerilir. Normal pipet kullanıyorsanız, yavaş hareketler kullanın. - Kültür kesici uç kuyu plakaları hazırlayın: Üç adet 12 kuyu büyüklüğündeki kültür kesici uçlarını steril 12 kuyulu doku kültürü plakasına yerleştirmek için steril tokmaklar kullanın, orta sütunlara yerleştirin.
- Fibroblast ve endotel hücre tiplerine uygun soğuk ortamlar belirleyin.
- Kapaklı tüplerin soğutulduktan sonra, içeriği görünür olan bir rafa bir tüp (hücre desteği için) yerleştirin. Diğer tüpü (hücresel dermis için) buz üzerinde bırakın.
- 8 mg/mL kollajen stoğunu soğutmadan çıkarın ve ıslak buza yerleştirin.
NOT: Kollajeni donduracağından dondurucu buz veya -20 °C tezgah üstü soğutucu kullanmayın. - Soğuk kapaklı tüpe 516 μL ortam ekleyin ve hemen 1000 μL pozitif deplasman pipetini kullanarak 375 μL soğuk kollajen ekleyin. Kolajeni çözeltiye dağıtın (tüpün yanına değil). Boş pipet ucunu hemen çıkarın ve karıştırmak için hazırlanan 250 μL pozitif deplasmanlı pipete geçin.
- Kabarcık oluşumunu önlemek için hızlı ama hafifçe karıştırın, mümkünse ucu çözeltiden çıkarmayın. Çözelti homojen renk olana kadar karıştırın, bu da tipik olarak yaklaşık 5 pipet döngüsü veya 10 s sürer (fenol kırmızısı olan ortam kullanıyorsanız, renk daha açık ve düzgün hale gelir). Karıştırırken, düzgün karıştırma için tüpün farklı konumlarından (alt ve üst) çektiğinizden emin olun.
NOT: Bu, 516 μL hücre kültürü sınıfı su veya diğer hücre kültürü sınıfı sıvı ile yapılabilir, ancak çoğu ortamın fenol kırmızısı karıştırmanın iyi bir göstergesidir. 2B genişletmeler için kullanılan fibroblast veya endotel ortamlarını kullanın.
- Kabarcık oluşumunu önlemek için hızlı ama hafifçe karıştırın, mümkünse ucu çözeltiden çıkarmayın. Çözelti homojen renk olana kadar karıştırın, bu da tipik olarak yaklaşık 5 pipet döngüsü veya 10 s sürer (fenol kırmızısı olan ortam kullanıyorsanız, renk daha açık ve düzgün hale gelir). Karıştırırken, düzgün karıştırma için tüpün farklı konumlarından (alt ve üst) çektiğinizden emin olun.
- 125 μL hücresel kollajeni hemen üç 12 kuyulu kültür kesici ucunun her birinin zarına dağıtın. Hücresel kollajen jelinin düzgün bir şekilde kapsamasını sağlamak için yemeği sallayın; bu tek tip membran kapsamı oluşturmuyorsa, kollajeni hafifçe etrafa yayarak zarı boyamak için pipet ucunu kullanın; zara basınç uygulamaktan kaçının. Jelleşme hemen başlar; eşit kapsama sağlamak için bu adımı hızlı bir şekilde gerçekleştirin.
NOT: Fazla hücreli kollajen olacaktır. Hacim azaltılabilir, ancak 1 mL'den daha az kollajen süspansiyon hazırlamak çözeltiyi karıştırmada zorluklara ve yetersiz jelleşmeye neden olabilir. - 12 kuyu plakasını hemen 37 °C hücre kültürü inkübatörüne taşıyarak en az 20 dakika jelleşmesini sağlar (hücresel kollajen gerekirse daha uzun süre jellenebilir; bu jelleşme süresi boyunca 2.2 adımına geçin). Kollajen süspansiyonu buzdan çıkarın ve tekrar soğutmaya yerleştirin (kollajen en çok 4 °C'de stabildir).
- Hücre süspansiyonu ve tohumlama hazırlığı
NOT: Bu protokolün kültür zaman çizelgesi için bu, 1.- Hücresel kollajen desteğinin jelasyonu sırasında endotel ve fibroblast hücre çizgilerini trypsinize edin ve sayın.
- 7,5 x 105 endotel hücrelerini ve 7,5 x 104 fibroblastları ilgili ortamlarının 258 μL'sinde askıya alın ve hücre süspansiyonlarını birleştirerek 516 μL aliquot oluşturun. Hücre süspansiyonlarını kullanıma kadar ıslak buzda muhafaza edin.
- Kullanım için 1000 ve 250 μL pozitif deplasman pipetleri hazırlayın ve bir kenara koyun. Daha sonraki adımlar zamana duyarlı olduğundan, pipet uçlarını yüklemek ve hacimleri ayarlamak uygundur (sırasıyla 375 μL ve 250 μL). Ayrıca, 516 μL için normal bir 1000 μL pipet ayarlayın.
- Dermal bölmenin hücre yüklü kollajen tohumlama
- Jelleşme döneminden sonra, 12 kuyu plakası hücreli kolajeni inkübatörden çıkarın.
NOT: Bu kolajen 30 dk sonra jelleşmezse, tohumlama sırasında bir hata olabileceğinden veya kollajen stoğunda bir sorun olabileceğinden prosedüre devam etmeyin (bkz. - 1,7 mL kapaklı tüpü ıslak buzdan çıkarın (10x PBS ve NaOH içerir). Tüpü, içeriğin görünür olması için bir rafa yerleştirin. Tüm kapakları gevşetin /açın (hücre süspansiyonu, soğuk kapaklı tüp).
- Stok kolajenini (8 mg/mL) 4 °C soğutmadan çıkarın ve ıslak buza yerleştirin. Kapağı açık bırak.
- 516 μL soğutulmuş hücre süspansiyonu soğuk kapaklı tüpe ekleyin. 1000 μL pozitif deplasmanlı pipet, 375 μL soğuk kollajen çözeltisini doğrudan kapaklı tüpün çözeltisine hemen borulamak için kullanın.
- Tüm kollajenleri pipetten tüpe atın ve pozitif deplasman pipet ucunu atın. Hemen 250 μL pozitif deplasman pipetine geçin ve kollajen çözeltisini karıştırın.
- Kollajen çözeltisini daha önce tamamlandığı gibi karıştırın (kabarcık oluşumunu önlemek için hızlı ama hafifçe), mümkünse ucu jelden çıkarmayın. Çözelti homojen olana kadar karıştırın (yaklaşık 5 pipet döngüsü veya 10 s). Karıştırırken, düzgün karıştırma için tüpün farklı konumlarından (alt ve üst) çektiğinizden emin olun.
- Karıştırıldığında, 250 μL hücresel kollajen çözeltisini üç 12 kuyulu kültür kesici ucunun her birinde hücresel kollajen desteklerine hemen aktarın. Hücresel kollajen desteğinin düzgün bir şekilde kapsamasını sağlamak için, yemeği sallayın ve/veya taze tohumlanmış hücresel kollajeni hücresel tabakayı bozmadan hafifçe hareket ettirmek için pozitif deplasman pipetini kullanın.
- En az 30 dakika jel olması için 12 kuyu plakasını hemen 37 °C hücre kültürü inkübatörüne taşıyın. Kollajeni kullanımdan sonra tekrar 4 °C soğutmaya yerleştirin.
- 30 dakikalık jel süresinden sonra, jelasyonu değerlendirmek için plakayı hafifçe eğin. Kollajenin katı olduğundan emin olun.
- Kesici ucun üst odasına ve alt odasına sırasıyla 500 μL ve 1000 μL karışım ortamı (yarım endotel ve yarı fibroblast bakım ortamı) ekleyin (hidrostatik basıncın kollajeni yukarı itmesini önlemek için önce üst, sonra alt). Kolajenin bozulmasını en aza indirmek için medyayı doğrudan kolajen jeline değil, kuyunun kenarına yavaşça ekleyin.
- Kollajen jelinin suya batırıldığından emin olun, gerekirse daha fazla ortam ekleyin. Kuyu plakasını gece kuluçka için hücre inkübatörüne yerleştirin. Bu aşamada, medya% 10 FBS içerir; her hücre satırı için normal bakım ortamı (Şekil 1, A'daverilen zaman çizelgesi ve şematik).
NOT: VHSE kültürü boyunca ortamlar özel hücre türleri için uyarlanabilir; bazı optimizasyon gerekebilir.
- Kollajen jelinin suya batırıldığından emin olun, gerekirse daha fazla ortam ekleyin. Kuyu plakasını gece kuluçka için hücre inkübatörüne yerleştirin. Bu aşamada, medya% 10 FBS içerir; her hücre satırı için normal bakım ortamı (Şekil 1, A'daverilen zaman çizelgesi ve şematik).
- Jelleşme döneminden sonra, 12 kuyu plakası hücreli kolajeni inkübatörden çıkarın.
- DalgıçLık Günü 2 (SD2) ortam değişikliği
- VHSE kuyularındaki %10 FBS medyasını %5 FBS yarı fibroblast, 100 μg/mL L-Askorbik Asit ile desteklenmiş yarı endotel ortam olarak değiştirin. Kuyunun yan tarafındaki kültür kesici ucunun üst odasına 500 μL ekleyin (yine kollajenin bozulmasını en aza indirmek için yan duvara dikkatlice ekleyin) ve alt odaya 1000 μL ekleyin.
- Submersion Day 7'ye (SD7) kadar her 2 günde bir (SD4 ve SD6) medyayı yenileyin.
- Kuyulardan medya çıkarmak için manuel pipet kullanın. Aspiratör kullanmak mümkündür, ancak yapının hasar görmesine veya tahrip olmasına neden olabilir.
NOT: L-askorbik asit her 2-3 günde bir taze olarak yapılmalıdır (hidrojen peroksit üretmek için çözeltide oksitler, böylece oksidatif strese ve sonunda hücresel hasara neden olur53). Bu nedenle, L-askorbik asit mevcut olduğundan, medya SD2'den VHSE kültürünün sonuna kadar her 2-3 günde bir değiştirilmelidir. Her beslenme gününde bir medya aliquotuna bir medya stoğu yapmak ve taze hazırlanmış miktarda L-askorbik asit eklemek en kolayıdır. Solvent olarak kültür sınıfı su veya ortam kullanın ve 100 mg/mL'de taze L-askorbik asit hazırlayın. L-askorbik asit, fibroblastlar tarafından uygun bir oranda kollajen sentezini uyarır ve kollajen stabilitesini teşvik eder54,55,56; ayrıca endotel geçirgenliğini azaltır ve damar duvarı bütünlüğünükorur 56,57 ve ayrıca epidermal bariyer oluşumuna katkıda bulunur6,58.
3. Epidermal bileşenin tohumlanması ve tabakalaşma indüksiyonu
- Dalgıçlık Günü 7 (SD7): tohum keratinositleri
NOT: SD7'de epidermisi kurmak için tohum keratinositleri. Bu zaman noktası araştırmacının ihtiyaçlarına göre kaydırılabilir. Keratinositler olmadan submersion kültürünün süresi 9 günü geçmemelidir, çünkü daha uzun bir submersion genellikle artan dermal kasılmaya yol açar. SD7'den önce kasılma meydana gelirse, dalgıçlık süresinin 5 güne kısaltılması ve SD5'te tohum epidermisinin yapılması önerilir. Belirli denemeler için gerektiğinde dalgıçlık süresini en iyi duruma getirme (bkz. tartışmadaki sorun giderme).- Kültür keratinositleri (N/TERT-120,59 veya diğer uygun hücreler) VHSE'lere trypsinizasyon ve tohumlamadan önce konflüens limitlerine. N/TERT-1 hücreleri için, 2B kültürde keratinositlerin istenmeyen farklılaşmasını önlemek için konfluens önemli ölçüde% 30'u geçmemelidir59. Birincil insan epidermal keratinositler gibi diğer uygun hücre hatları için, genellikle% 75-80'lik bir izdiah sınırıkullanılır 60.
- Trypnizasyondan sonra, %5 FBS(Tablo1) ile desteklenmiş 600 μL İnsan Derisi Eşdeğeri (HSE) Farklılaşma medyasında 510.000 hücreyi sayın ve askıya alın.
NOT: 600 μL'de 510.000 hücre, yapı başına 200 μL (3 VHSE) tohumlama yaparken 170.000 hücre/yapıya izin verir. - Manuel pipet kullanarak, her yapı için alt ve üst bölmede bulunan medyayı toplayın ve atın. Mümkün olduğunca çok medya topladığından emin olun. Pipet ucunu kültürün altına hafifçe yerleştirerek ve kesici ucu geçici olarak yerinden çıkararak geçirgen zarın hemen altına sıkışmış olabilecek ortamları toplayın. Yüzey gerilimi nedeniyle medya sıkışmış olabilir. Devam etmeden önce kesici uçların kuyularında düz oturduğundan emin olun. Aspiratör kullanmak mümkündür, ancak yapının hasar görmesine veya tahrip olmasına neden olabilir.
- Her kuyunun alt odasına% 5 FBS ile desteklenmiş 1 mL İsG ortamı ekleyin. Daha sonra her kuyunun üst odasına 200 μL hücre süspansiyonu ekleyin. Doğrudan dermal yapı yüzeyine tohumlayın. Keratinositlerin inkübatörde 2 saate yerleşmesine izin verin.
- Keratinositlerin tohumlanmasının ardından iki saat, her yapının üst odasına% 5 FBS ile desteklenmiş 300 μL HSE medyasını dikkatlice ekleyin; yavaşça pipet ortamı kültür ekleme tarafına. Henüz alttaki kolajen jeline sıkıca yapışmamış olabilecek yerleşik keratinositleri rahatsız etmemek için medyayı üst odaya çok dikkatli bir şekilde yükleyin.
- Ortamı yükledikten sonra, yapıyı inkübatöre geri yerleştirin.
- DalgıçLık Günü 8/9 (SD8 veya SD9)
- %1 FBS ve 100 μg/mL L-askorbik asit ile desteklenmiş HSE ortamlarını oluşturan.
- Manuel pipetle hem üst hem de alt bölmelerden ortamı çıkarın.
- Önce üst odaya 500 μL, ardından alt odaya 1 mL ortam ekleyin. (Bu adım SD8 veya SD9'da yapılabilir)
- DalgıçLık Günü 9/10 (SD9 veya SD10, bu adım 3.2'den sonraki gün olmalıdır)
- Serumsuz HSE farklılaşma medyayı 100 μg/mL L-askorbik asit ile yapın.
- Manuel pipetle hem üst hem de alt bölmelerden ortamı çıkarın.
- Üst hazneye 500 μL ve alt hazneye 1 mL yükleyin.
- Hava-Sıvı Arayüz Günü 1 (ALI1)
NOT: ALI, 3.3 adımından sonraki gün gerçekleştirilir.- Medya atıklarını yalnızca üst bölmeden kaldırarak her yapıyı hava sıvısı arayüzüne (ALI) kaldırın. Epidermal tabakaya dokunmadan veya zarar vermeden mümkün olduğunca yaklaşmak için manuel bir pipet kullanın.
- Ortamı toplamak için plakayı farklı açılarda hafifçe eğin. Bu adımda mümkün olduğunca fazla medya kaldırın. Tutarlı nemi korumak için plakadaki çevredeki kuyulara yaklaşık 2 mL steril su ekleyin; kültür boyunca su dolu kuyuları tutun.
- Keratinositlerin hala hava sıvısı arayüzünde olduğundan emin olmak için plakayı birkaç saat sonra kontrol edin. Üst bölmede ortam varsa çıkarın. Her VHSE için ne kadar ortamın çıkarıldığını iyi takip edin (Üst ve alt odaların başlangıç hacmi (1500 μL) - ortam kaldırıldı = ALI beslemesi için iyi bir başlangıç noktası).
NOT: VHSE'ler hava asansörü için mutlaka aynı ortam seviyesini gerektirmez; genellikle VHSE'ler birlikte tohumlanırsa, hava kaldırma için yaklaşık aynı medya seviyesine ihtiyaç duyarlar, ancak bu her zaman böyle değildir. ALI'yi korumak için birimleri gerektiği gibi ayarlayın, ancak ortam düzeylerinin VHSE'lerin kuruyacağı kadar düşük olmadığından emin olun. Hava kaldırma ve hidrasyon arasındaki denge yerine gelene kadar her gün dikkatli olmak ve küçük medya miktarlarını çıkarmak daha güvenlidir.
- ALİ Gün 2 (ALİ2)
- Bu noktadan sonra, sadece 100 μg / mL L-askorbik asit ile desteklenmiş serumsuz HSE ortamı kullanın. ALI Gün 2'de (ALI2) medyayı değiştirin. Üst bölmede ortam varsa, kaldırın ve daha önce kaydedilen kaldırılan ortam miktarına ekleyin. Önceki adımdaki denklemi kullanarak gereken ortam hacmini hesaplayın. Örneğin: Üst bölmeden 200 μL ortam çıkarıldıysa, ALI'yi kurmak için 1300 μL ekleyin (1500 μL - 200 μL = 1300 μL olarak)
- Her kuyunun alt haznesine yüklemek için hesaplanan hacmi kullanın, ardından plakayı hücre inkübatörüne geri yerleştirin. Günde kullanılan birimi takip edin. Önerilen kollajen miktarlarını 12 kuyulu kültür kesici uçlarında kullanırken, normal ALI değerleri aralığı 750 μL ile 1300 μL arasında düşer. Kültür özelliklerine bağlı olarak, bu sayı değişebilir ve en iyi duruma getirilmelidir (3.4.2 - 4.1'de açıklandığı gibi).
4. Vasküler insan derisi eşdeğerinin rutin bakımı
- ALI Day 3'ten (ALI3) kültür uç noktasına: 100 μg/mL L-askorbik asit ile serumsuz HSE ortamı kullanarak alt odanın medyasını her 2-3 günde bir yenileyin. Adım 3.5.2'de açıklandığı gibi ALI için alt bölmede gereken medya düzeyini ayarlamaya ve izlemeye devam edin.
- Epidermal yüzeyin hava ile temas halinde kalması gerektiğinden, tutarlı ALI seviyeleri kurulana kadar ortam seviyesini günlük olarak kontrol edin ve ayarlayın. Epidermal tabaka kuru değil, nemli görünmelidir, ancak yapının üstünde birikmiş ortam olmamalıdır. 8 haftalık ALI'ye sahip kültürler en tutarlı morfolojiyi ve ifadeyi sağlamıştır; ancak uygulamaya bağlı olarak 4 ila 12 haftalık kültürler uygun olabilir. Farklı hücre ve kültür koşulları için kültür süresinin optimize edilmesi gerekebilir.
NOT: Pazartesi, Çarşamba, Cuma medya değiştirmek iyi bir uygulamadır. VHSE'ler hafta sonu sağlıklıdır, ancak medya Pazartesi günü erken ve Cuma günü geç saatlerde değiştirilmelidir. 1-4 arası adımları tamamen tamamladıktan sonra, bir VHSE üretimi tamamlanır. Protokolün 5.sonu adımları, bu tür 3D yapı için en iyi duruma getirilmiş isteğe bağlı işleme ve görüntüleme teknikleridir.
5. 3D yapıların sabitlenmesi ve permeabilizasyonu
NOT: Adım 5, protokolün geri kalanında özetlenen bu 3D yapıya özgü görüntüleme teknikleri için en iyi duruma getirilmiştir. VHSE oluşturmak için aşağıdaki adımlar gerekli değildir.
- Fiksasyon/permeabilizasyon
- Kültür döneminin bitiş noktasındaki her kuyunun üst ve alt odalarından tüm ortamları dikkatlice çıkarın.
NOT: Epidermal tabaka muhtemelen kırılgandır, dikkatli bir şekilde işleyin ve epidermisi agresif pipetleme ile çalkalamayın. - Pbs 'de (pH 6.9) %4 paraformaldehit (PFA) üst bölme duvarına (doğrudan yapıda değil) ve daha sonra alt odaya her yapıyı önceden sabitlemek için ekleyin. Oda başına 1 mL ekleyin ve oda sıcaklığında 5 dakika maruzleyin.
DİkKAT: PFA tehlikelidir ve göz koruması da dahil olmak üzere dikkatli ve uygun kişisel koruma ekipmanı (KKD) ile ele alınmalıdır. - 5 dakika sonra %4 PFA çözeltisini çıkarın ve önceki adımda açıklandığı gibi %0,5 Triton X 100%4 PFA çözeltisini üst ve alt bölmelere ekleyin. Oda sıcaklığında 1 saat maruz bırakmak; VHSE yapısı bundan sonra steril bir ortam gerektirmez.
- 1 saat sonra, permeabilizasyon / fiksasyon çözeltisini her iki odadan dikkatlice çıkarın ve numuneyi 1x PBS ile 3 kez yıkayın.
- Numuneleri PBS'de 4 °C soğutma veya hemen leke halinde saklayın. Numuneleri saklamak için, kabı plastik bir sargıya sarın ve ardından buharlaşmayı ve ışığa maruz kalmayı en aza indirmek için folyo
NOT: Duraklatma noktası - Fiksasyon ve permeabilizasyondan sonra, 5.1.5 adımında belirtildiği gibi hazırlanan numuneler birkaç hafta boyunca stabil olduğundan bu prosedür duraklatılabilir. Alternatif olarak, boyama (adım 6'da açıklandığı gibi) 5.
- Kültür döneminin bitiş noktasındaki her kuyunun üst ve alt odalarından tüm ortamları dikkatlice çıkarın.
6. 3D yapıların immünofluoresan boyanma
- Yapı Hazırlığı
NOT: VHSE'ler, kültür kesici ucun gözenekli zarından ayrıldığında iyi lekelenir; membrandan ayırma, engelsiz görüntüleme için de gereklidir ve lekelenme için daha az hacim sağlar.- İmmünofluoresan boyama için yapıyı hazırlamak için, bir kesici ucu ters çevirin ve kuyu plakasının üzerine yerleştirin (VHSE düşerse PBS ile kuyuya düşecektir) (Ek Şekil 1A).
- Kesici ucun zarının çevresinin yaklaşık yarısını kesmek için ince uçlu önps ve/veya hassas bir bıçak kullanırken kesici ucu bir elinizle kuyunun üzerine sabitleyin. VHSE yapısına zarar vermemesi için plastik gövdeye mümkün olduğunca yakın bir el ile kesin.
- İnce uçlu asaları kullanarak, kesilmiş membran kapağının kenarını tutun ve gözenekli zarı kesici ucun yanı sıra VHSE yapısından hafifçe soyun. VHSE yapı yapısının zarar görmesini önlemek için bunu çok dikkatli ve yavaş bir şekilde yapın. VHSE yapısı kolayca ayrılırsa, odanın kenarına sıkışırsa, kuyuya taşımak için ince uçlu uzun uçları veya küçük bir kepçeyi kullanın. Epidermal tabakaya genellikle kırılgan olduğu için çok dikkatli olun(Ek Şekil 1A).
NOT: Bazen membran kolayca çıkmaz veya parçalar halinde çıkmaz, bu durumda membran ve VHSE yapıyı dikkatlice ayırmak için araçları kullanın. Gerekirse PBS'ye daldırarak VHSE'lerin bu işlem sırasında kurumamasını sağlayın. - VHSE kuyuya girdikten sonra, kesici uç zarının kalan parçalarını atın ve boyama sırasında VHSE'leri batık bir konumda tutmak için kültürün her kuyuda muhafazasını tutun.
- Boy -ama
NOT: VHSE'ler kırılgan olabildiğinden lekelenme ve ilişkili elleçleme/manipülasyon ve yıkamalar mümkün olduğunca nazikçe yapılmalıdır. Epidermisin kısımları kalkarsa, parçalar ayrı ayrı boyanabilir; epidermisin üst katmanları kırılgandır ve doğal desquamasyon4, ancak analiz için bütünlüğü mümkün olduğunca korumak önemlidir.- Seçilen birincil antikor lekelerini yapı başına 700 μL blokaj tamponunda iyi hazırlayın (tipik olarak, tüm birincil antikorlar aynı boyama çözeltisinde olabilir, ancak bu yeni antikorlar için onaylanmalıdır). 700 μL, 12 kuyu boyutu için çalışır, ancak diğer kültür formatları için ayarlanabilir. Bloke tampon tarifi ile önerilen primer ve ikincil antikor konsantrasyonları Tablo 3'te verilmiştir (optimizasyon gerekebilir).
- Manuel pipet kullanarak kuyudan herhangi bir PBS çıkarın, VHSE'lerden uzağa pipetleme dikkatli olun (VHSE'ler yüzerken vakum aspirasyonu önerilmez).
- Her kuyuya birincil leke çözeltisini ekleyin ve VHSE'yi sıvıya batırmak için kültür ekleme muhafazasını kuyuya yerleştirin(Ek Şekil 1B). Kuyu tabağını plastik sargı ile sarın. Ajitasyon veya sallanma olmadan 4 °C soğutmada 48 saat boyunca folyo ve leke (sallanma VHSE yapısına zarar verebilir).
- 48 saat sonra, 700 μL blokaj tamponunda (kuyu başına) ikincil antikorlar ve kimyasal lekeler hazırlayın.
- Kültür kesici uç muhafazasını ve birincil leke çözeltisini çıkarın ve ikincil leke çözeltisini eklemeden önce 1x PBS ile 3x 5 dakika yıkayın. VHSE yapıyı su altında tutmak için kültür ekleme muhafazasını kuyuya geriyerleştirin (Ek Şekil 1B). Ajitasyon veya sallanma olmadan 4 °C soğutmada 48 saat maruz kalın.
- 48 saat pozlamadan sonra, leke çözeltisini manuel bir pipetle çıkarın ve PBS ile 3x'i hafifçe yıkayın; kırılgan olabilecekleri için sıvıyı doğrudan VHSE'lerin üzerine boruya dökmeyin. Aşırı PBS ile yeniden sulandırın ve VHSE'yi depolama sırasında su altında ve nemli tutmak için kültür kesici uç muhafazasını kuyuya geri yerleştirin (buharlaşmayı ve ışığa maruz kalmayı en aza indirmek için plastik sargı ve folyoya sararak saklayın)
- Temizleme (isteğe bağlı ve terminal)
NOT: Temizleme görüntüleme için isteğe bağlıdır. Tamamlandığında, temizleme daha fazla lekelenmeyi önlediğinden, florofor performansını değiştirebileceğinden ve VHSE yapısına zarar verebileceğinden, numune tamamen boyandıktan / görüntülemeden sonra yapılmalıdır. Çoklu doku temizleme yöntemleri49,61,62 mevcuttur ve belirli projeler için optimize edilebilir. Aşağıda açıklanan metil salisilat temizleme, VHSE için hem basit hem de etkilidir. Aşağıdaki temizleme tekniği cam kaplarda tamamlanmalı ve pipet uçları cam veya polipropilen olmalıdır (polistiren metil salisilat ile temas halinde çözünür). Tüm temizleme prosedürünü iyi havalandırılmış bir alanda veya duman kaputunda tamamlayın.- Küçük bir sığ cam kaba% 100 metanol ekleyin (cam Petri tabakları iyi çalışır). Yapıya uyacak mümkün olan en küçük kabı kullanın (reaktif atıklarını en aza indirmek için).
- Yapıyı asalar / kepçe (Ek Şekil 1C) kullanarak kuyu plakasından çıkarın ve metanol dolu kaba yerleştirin. Yapı su altında değilse daha fazla metanol ekleyin.
- VHSE yapıyı 3 x 10 dakika daldırma için metanolde susuz bırakın; her daldırmadan sonra metanol'u tamamen değiştirin ve son banyodan sonra metanol'u derhal çıkarın. Bu prosedür boyunca, yapı daha opak hale gelebilir ve hafifçe küçülebilir.
NOT: Bu süreler ve tekrarlar optimize edilmiştir, ancak methanol ve aşağıdaki metil salisilat prosedürlerinin belirli kültür formatına ve lekelere bağlı olarak özelleştirilmiş olması gerekebilir. - Metanol çıkarıldıktan hemen sonra, metil salisilat ekleyin ve VHSE'yi 5 x 5 dakikalık daldırmalarda batırın. Her daldırmadan sonra reaktifi tamamen değiştirin ve VHSE'yi depolama için 5. Bu yordam boyunca, yapı saydam hale gelir.
- Yapıyı veya depoyu 4 °C'de görüntüleyin. Temizlendikten sonra, floroforlar birkaç gün içinde metil salisilatta bozulabileceğinden, tüm görüntülemeyi mümkün olan en kısa sürede tamamlayın. Temizleme, yapıların kırılgan hale gelmesine neden olur ve genişletilmiş depolama, önerilmese de, yeterli miktarda metil salisilat olduğundan emin olmak için düzenli bir kontrole ihtiyaç duyar.
7. 3D yapıların Konfokal Görüntülemesi
NOT: Doku kültürü plastik üzerinden görüntüleme, kapak camı aracılığıyla görüntüleme ile aynı kalitede görüntü vermeyecektir, bu yöntem konfokal görüntüleme sırasında kurumasını önlemek için özel bir cam tabanlı kuyunun imalatını açıklar. Tipik olarak, bu en az 3 saat görüntüleme için yeterlidir.
- Görüntülemeden iki gün önce: polidimetilsiloksina (PDMS) hazırlayın
- PDMS48,63,64'ü önerilen [9:1] konsantrasyonda hazırlayın, taban: çapraz bağlantı. Toplam 30 g PDMS hazırlayın: 27 g temel bileşen ve 3 g çapraz bağlantı. Herhangi bir temiz karıştırma kabını tartım terazisine yerleştirin ve tartıyı daralayın. Tabanı (27 g) ekleyin ve ardından toplam 30 g elde etmek için çapraz bağlantıyı (3 g) ekleyin. Çapraz bağlantıdan önce her zaman taban ekleyin.
- Çözeltiyi en az 4 dakika kuvvetlice karıştırın; bu küçük kabarcıklar oluşturacaktır. Yeterli karıştırmadan sonra, PDMS'yi 100 mm Petri kabına veya benzer düz taban ısısına dayanıklı bir kaba dökün.
- Karıştırmadan kaynaklanan tüm kabarcıklar kaybolana ve PDMS temizleninceye kadar PDMS'yi vakum odasında gazdan arındırın. Vakumun yavaşça serbest bırakılmasının ve PDMS'nin (yavaşça) çıkarılması. Gece boyunca (50-60 °C) kürleme için yemeği bir fırına yerleştirin; PDMS'nin eşit şekilde iyileştirmesi için yemeğin düz oturduğundan emin olun.
NOT: Kürlemeden sonra PDMS net olmalı ve yüzey pürüzsüz olmalı ve yapışkan olmamalıdır (yapışkanlık yetersiz karıştırmaya işaret edebilir).
- Görüntülemeden bir gün önce: PDMS iyi hazırlık
- Çelik bir zımba veya el tipi hassas bıçak kullanarak, 7.1'de hazırlanan PDMS sayfasından dairesel bir kuyuyu yumruklayın veya kesin. Kuyu, VHSE yapısıyla aynı boyutta olmalıdır. Tek bir PDMS kuyusu oluşturmak için dairesel kuyunun etrafına kare bir yama kesin. Hazırlanan 30 g PDMS miktarı en az dört özel kuyu vermelidir.
NOT: PDMS kuyusu VHSE yapının boyutuna yakın olmalıdır. Görüntüleme sırasında örnek hareketi daraltmalıdır. Birden fazla kuyu aynı anda üretilebilir ve süresiz olarak temiz bir kapta saklanabilir. - PDMS kuyusuna benzer boyutta bir cam kapak ucu kullanarak, PDMS'nin alt yüzeyine (Petri kabıyla temas eden pürüzsüz yüzey) siyanoakrilat tutkal (örneğin, süper tutkal) ekleyin ve tek kullanımlık bir pipet ucuyla eşit şekilde sürün. Ortalayın ve pdms'yi cam üzerine iyice bastırın ve delikli dairenin içinde açık bir cam pencere bırakırken (tutkalın görüntüleme penceresinin üzerine bulaşmamasını sağlayın).
NOT: Varsa, PDMS'nin kapak kapağına plazma bağlanması alternatif bir65,66,67 'dir. - Kullanmadan önce tutkalın birkaç saat veya gece boyunca kurumasına izin verin. Bunlar normal aşınma ve yıpranmadan kopana kadar yeniden kullanılabilir.
NOT: Görüntüleme için iyi kullanılan yapıştırılmış PDMS'deki örneklerin boyanması önerilmez. Bu kuyular sıvıyı birkaç saat tutar, ancak daha uzun boyama sırasında sızıntı yapabilir.
- Çelik bir zımba veya el tipi hassas bıçak kullanarak, 7.1'de hazırlanan PDMS sayfasından dairesel bir kuyuyu yumruklayın veya kesin. Kuyu, VHSE yapısıyla aynı boyutta olmalıdır. Tek bir PDMS kuyusu oluşturmak için dairesel kuyunun etrafına kare bir yama kesin. Hazırlanan 30 g PDMS miktarı en az dört özel kuyu vermelidir.
- VHSE görüntüleme
NOT: Belirsiz örnekleri görüntüleme ise, görüntüleme çözümü olarak PBS kullanın. Temizlenmiş örneklerle görüntüleme ise, görüntüleme çözümü olarak metil salisilat (veya seçilen temizleme çözeltisi) kullanın.- PDMS kuyusuna birkaç damla görüntüleme çözeltisi ekleyin ve sızıntı olup olmadığını kontrol edin (sızıntı varsa, siyanoakrilat süper tutkalın nokta / lekesi ile onarın veya başka bir kuyu kullanın).
- VHSE'yi eklerken görüntüleme çözümünü PDMS'de iyi tutun. Kepçe veya ince uçlu uzun uçlu tipler (Ek Şekil 1C)kullanarak, yapıyı 12 kuyu plakasından çıkarın ve PDMS'ye cam kapak ucuna iyi yerleştirin. Amacına yönelik ilgi yönelimi ile yapıyı yerleştirin. Örneğin, epidermisi ters bir mikroskop kullanarak görüntülemek için, epidermisin cama doğru aşağı doğru aşağı dönük olduğundan emin olun.
- Alternatif olarak, dik bir mikroskop için epidermisin yüzü yukarı bakacaktır. Aşağıdaki görüntüleme prosedürleri ters mikroskop için tanımlanmıştır, ancak dik bir şekilde kolayca uyarlanabilir.
NOT: Hasar görmemesi için VHSE'yi manipüle ederken dikkatli olun. VHSE'nin düşmesi durumunda kuyu plakası üzerinden aktarın. Bükülmüş, düz uçlu kepçe yapıyı aktarmanın en kolay yoludur (Ek Şekil 1C).
- Alternatif olarak, dik bir mikroskop için epidermisin yüzü yukarı bakacaktır. Aşağıdaki görüntüleme prosedürleri ters mikroskop için tanımlanmıştır, ancak dik bir şekilde kolayca uyarlanabilir.
- Numunenin kuyuda düz oturduğundan ve numunenin altına epidermisin veya dermisin hiçbir bölümünün katlandığından emin olun. Katlama meydana gelirse, örneği bir kepçe veya kepçe ile hafifçe manipüle edin; VHSE'yi yüzdürmek için geçici olarak ek görüntüleme çözümü eklemek, düzeltmesine yardımcı olabilir. Numunenin katlanması veya kırışması gözle veya mikroskop kullanılarak görülebilir.
- Numuneyi nemli tutmak için yeterli sıvı kullanarak kuyuyu görüntüleme çözeltisi ile doldurun; çok fazla sıvı numuneyi yüzdürür ve görüntüleme sırasında hareket halinde olur. Yapı cam görüntüleme penceresinde oturmalıdır; PDMS'yi iyi yatırarak hareket testi. Hareket varsa, biraz sıvı çıkarın; hareket durana kadar sıvı damlasını akıllıca ekleyin ve çıkarın.
- Görüntüleme sırasında buharlaşmayı en aza indirmek için kuyunun üzerine cam bir slayt yerleştirin(Ek Şekil 1D). Daha uzun görüntüleme seansları için, uygun sıvı seviyelerini sağlamak için numuneyi sık sık kontrol edin. Erişilebilirse, görüntüleme sırasında nemlendirilmiş bir oda kullanılabilir (genellikle gerekli olmasa da).
- Numuneyi mikroskop aşamasına ve görüntüye cam kapak kılıfı penceresinden yerleştirin(Ek Şekil 1D). Bu teknik en az 3 saat sürekli konfokal görüntülemeye izin verir, ancak numunenin hidrasyonunun düzenli olarak kontrol edilmesi ve gerektiğinde görüntüleme çözeltisinin eklenmesi gerekir.
NOT: Numune temizlenirse, metil salisilat zamanla tutkalı bozacaktır. PDMS'yi yapıştırma tutkal görüntüleme çalışmaları arasında yeniden uygulanabilir; veya numune periyodik olarak yeni kuyulara aktarılabilir. Plazma bağlanması olan kuyularda, bu bir sorun olmayacaktır. - Görüntülemeden sonra, numuneyi kuyuda mümkün olduğunca görüntüleme sıvısı ile yüzdürin. Numuneyi depolama kuyusuna aktarmak için bir kepçe veya ince uçlu toka kullanın. Numunenin düşmesi durumunda aktarımı iyi bir plaka üzerinde gerçekleştirin.
- Her PDMS iyi ve üst cam kapak kapağı kırılılana kadar yeniden kullanılabilir. Görüntülemeden önce alt camı hem kuyunun içinde hem de dışında temizleyin. Yeniden kullanmadan önce, her zaman sızıntıları kontrol edin ve gerektiğinde tutkalla onarın.
- Örnekleri adım 6.3.6'da açıklandığı gibi depolayın ve korumak için birkaç ayda bir PBS ekleyin; numuneler temizlenirse, metil salisilat kullanarak camda saklayın ve seviyeleri düzenli olarak kontrol edin. Temizlenen numuneler hızla bozulabilir (birkaç gün içinde) ve mümkün olan en kısa sürede görüntülenmelidir.
Sonuçlar
Burada telomeraz ters transkriptaz (TERT) ölümsüzleştirilmiş keratinositler (N/TERT-120,59),yetişkin insan dermal fibroblastlar (hDF) ve insan mikrovasküler endotel hücreleri (HMEC-1) kullanılarak in vitro vaskülerize insan derisi eşdeğerlerinin (VHSE) üretimi için bir protokol sunulmaktadır (Şekil 1). Ayrıca, bu protokolün özelleştirilebilir doğası, hDF yerine yaygın olarak bulunan akciğer fibroblastları (IMR90) kullanırken VHSE oluşturma ve kararlılığını göstererek vurgulanır. VHSE'nin üretimi 1-4 adımlarında tamamlanırken, 5-7. VHSE'lerin belirli araştırma sorularına göre işlenebildiğine ve yapıyı oluşturmak için 5-7 arası adımların gerekli olmadığına dikkat etmek önemlidir. Hacimsel görüntüleme, analiz ve 3D işlemeler hacimsel analiz yöntemini göstermek için tamamlandı. Bu hacimsel yapı hazırlama ve görüntüleme protokolleri VHSE yapısını hem mikroskobik hem de makroskopik seviyelerde koruyarak kapsamlı 3D analize olanak sağlar.
Epidermisin ve dermisin karakterizasyonu VHSE yapılarında insan cildi için uygun immünofluoresan belirteçleri gösterir (Şekil 2, 3). Sitokeratin 10 (CK10), genellikle cilt eşdeğerlerindeki tüm suprabasal tabakaları 18,30,68 (Şekil 2)olarak işaretleyen erken farklılaşma keratinosit belirtecidir. involucrin ve filaggrin keratinositlerde geç farklılaşma belirteçleridir ve cilt eşdeğerlerinde en üstteki suprabasal tabakaları işaretler12,30,68,69 ( Şekil2). Hem epidermis hem de dermiste çekirdekleri işaretlemek için uzak kırmızı bir floresan nükleer boya (bkz. malzeme listesi) kullanıldı, Col IV dermisin vaskülatını işaretledi (Şekil 2, Şekil 3, Şekil 4). Epidermal bodrum membran (BM) bileşenleri her zaman HSE kültürlerinde düzgün bir şekilde ifade değildir15,16; ve BM'nin Col IV lekelenmesi bu protokol kullanılarak sürekli olarak gözlenmez. Araştırma odaklı BM bileşenleri ve yapısı ek medya, hücre ve görüntüleme optimizasyonundan yararlanacaktır14.
VHSE kültürlerinin büyük bir kısmı boyunca konfokal görüntüleme genellikle dermis ve epidermisin hesaplama analizi için yeterli olan yüksek çözünürlüklü görüntüler sunsa da, açıklanan temizleme yöntemi daha derin doku görüntülemesine izin verir. Temizleme, konfokal lazer penetrasyon derinliğini artırır ve VHSE'lerde etkili görüntüleme, temizlenmiş numuneler için 1 mm'nin üzerine çıkabilir (net olmayanlar için ~250 μm ile karşılaştırıldığında). Açıklanan temizleme tekniği (methanol dehidrasyon ve metil salisilat) VHSE örnek dokusu61boyunca refraktif indeksle yeterince eşleşir. VHSE'nin temizlenmesi, tüm yapı boyunca manipülasyon olmadan basit görüntülemeye izin verilir (örneğin, dermis ve epidermisi ayrı ayrı görüntülemek için yapıyı yeniden yönlendirme), (Şekil 3).
Hacimsel görüntüler, her yapı boyunca vaskülat haritalamak için 3D işlemenin oluşturulmasına izin verir (Şekil 4). Kısaca, konfokal görüntü setleri, Kollajen IV lekesi (işaretli damar duvarları) ve çekirdekleri (uzak kırmızı floresan nükleer boya ile işaretlenmiş) tespit etmek için birkaç alt hacimli VHSE'lerin epidermal yönelimine dermal olarak alındı. Görüntü yığınları hesaplama yazılımına yüklenir (bkz. malzeme listesi)ve daha önce açıklandığı gibi 3D işleme ve niceleme için özel bir algoritma (bu kaynaklara dayanarak 48,70,71 , 72,73, 74,75)kullanılır. Bu algoritma, Col IV lekesini temel aarak vasküler bileşeni otomatik olarak segmentlere ayırır. Hacimsel segmentasyon, hızlı yürüyüş 75,76 , 77'ye dayanan bir iskeletleştirme algoritmasına geçirilir. İskeletleşme her Col IV işaretli geminin kesin merkezini bulur ve elde eden veriler damar çapının yanı sıra vasküler fraksiyonu hesaplamak için kullanılabilir (Şekil 4). Lazer taramalı mikroskopi mevcut değilse geniş alan floresan mikroskopisi erişilebilir bir seçenektir; vasküler ağ ve epidermis geniş alan floresan mikroskopisi ile görüntülenebilir (Ek Şekil 2). Üç boyutlu niceleme, lazer tarama mikroskopisi yerine VHSE'lerin geniş alan görüntülemesi kullanılarak mümkündür, ancak düzlem dışı ışık nedeniyle görüntülerin daha fazla filtrelenmesini ve dekonvolüsiyonu gerektirebilir.
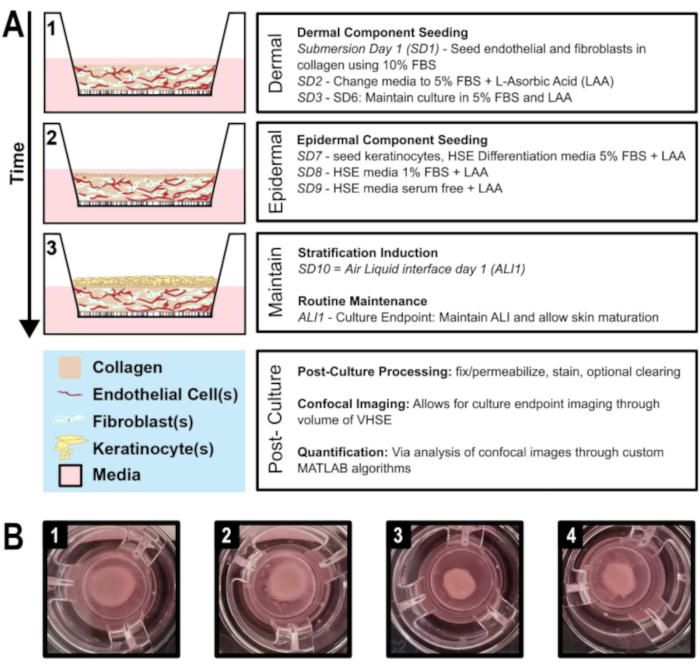
Şekil 1: Damarlı insan derisi eşdeğeri neslin şematik zaman çizelgesi. A) VHSE modelinin ilerlemesini gösterir 1) dermal bileşen tohumlama, 2) keratinosit tohumlama dermal bileşen üzerine, 3) hava sıvı arayüzü ve kültür bakımı yoluyla epitel tabakalama. Kültür uç noktasında kültür sonrası işleme ve hacimsel görüntüleme yapılabilir. B) Kültürdeki hDF VHSE makroyapısının kamera görüntüleri, kültür uç noktalarına ekler, 8 hafta. VHSE'ler için çeşitli daralma seviyeleri normaldir; daralma, protokolün tanımladığı gibi azaltılabilir. (1 & 2) Daha az sözleşmeli numune. (3 & 4) Daha fazla sözleşmeli numune hala uygun cilt elemanları verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
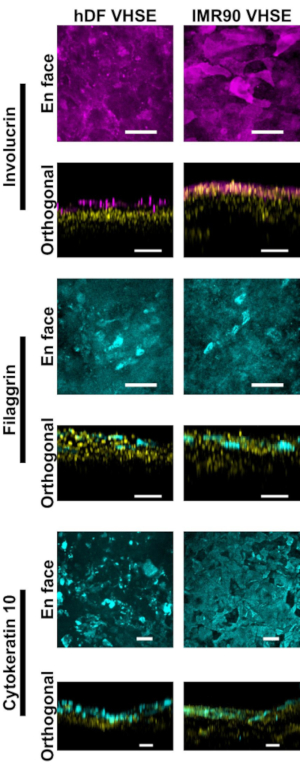
Şekil 2: İmmünofluoresan belirteçler ile epidermal karakterizasyon. Tüm görüntüler konfokal mikroskopi ile 8wk kültür zaman noktasında VHSE'lerin çekilmiştir. İlgili boyama yöntemleri protokol adım 6'da açıklanmıştır. Hem hDF VHSE'lerde (sol sütun) hem de IMR90 VHSE'lerde (sağ sütun) uygun epitel belirteçleri bulunur. Involucrin ve Filaggrin, keratinositlerin geç farklılaşma belirteçleridir ve epidermisin her iki VHSE tipinde de tamamen tabakalı olduğunu göstermektedir. Sitokeratin 10, VHSE'lerdeki suprabasal katmanları tanımlayan erken bir farklılaşma belirtecidir. Çekirdekler ortogonal görünümlerde sarı renkte gösterilir. En face ve ortogonal max projeksiyon görüntüleri hesaplama yazılımı ile işlenmiştir; Görüntüler, netlik için arka plan çıkarma ve ortanca filtreleme ile ayrı ayrı ölçeklendirilir. Ölçek çubukları 100 μm'dir(Tablo 3'tekurum içi bloke tampon tarifi ile birincil ve ikincil antikorlar verilmiştir). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
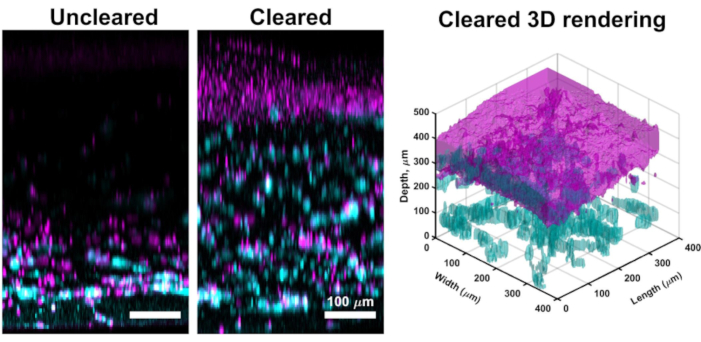
Şekil 3: Net olmayan VHSE ile karşılaştırıldığında. Bu VHSE, IMR90'larla oluşturulmuş ve konfokal mikroskopi ile 4wk kültür zaman noktasında görüntüler alınmıştır. Kollajen IV siyanda gösterilir; Çekirdekler macenta ile gösterilir; temizlenen 3D işlemedeki macenta, VHSE'nin epidermal katmanında çekirdeklerin birleştirilmesini temsil eder. Net olmayan VHSE görüntüsü, daha kalın VHSE yapılarında lazer zayıflamasının bir örneğidir, temizleme yoluyla (metanol ve metil salisilat) tüm yapı, yapının dermal tarafından çok az / hiç lazer zayıflaması ile görüntülenebilir. Aşırı doymamışlığı azaltmak için temizlenmiş VHSE için lazer hattı, kazanç ve iğne deliği gibi görüntüleme ayarları düşürüldü. Temizleme ve görüntüleme, protokoldeki 6 ve 7. Ortogonal maksimum projeksiyon görüntüleri ve 3D işleme hesaplamalı yazılımla tamamlandı, temizlenmiş yapı görüntülerinden 3D render oluşturuldu. Görüntüler, netlik için arka plan çıkarma ve ortanca filtreleme ile ayrı ayrı ölçeklendirilir. Ölçek çubukları 100 μm'dir. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
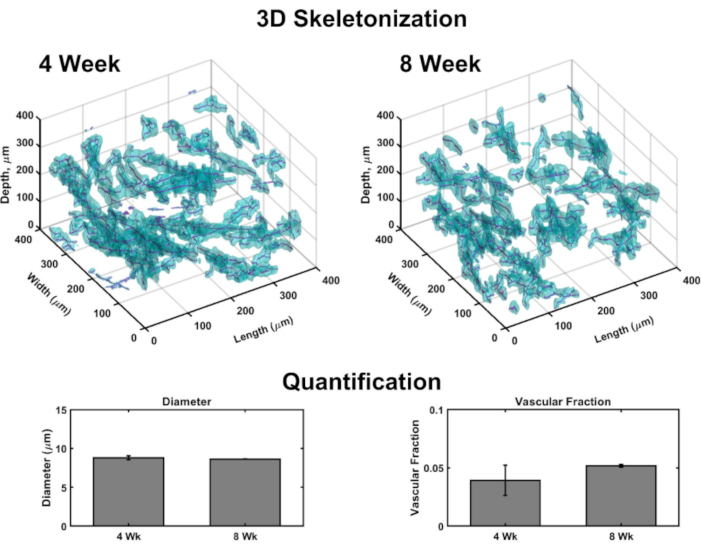
Şekil 4: VHSE'ler içinde vaskülatın üç boyutlu analizi. Konfokal mikroskopi ile çekilen hacimsel görüntüler, hesaplamalı görüntü analizi ile kültür uç noktalarında vasküler parametre nicelemesini sağlar. VHSE alt hacimlerinden, Kollajen IV lekesinin (camgöbeği) tespiti, vaskülatın endotel duvarlarını işaretler ve kollajen IV konumuna göre vasküler segmentasyona izin verir; segmentasyon verileri daha sonra iskeletleştirilir ve her geminin merkezi bulunur (macenta). 3D iskeletleştirme örnekleri, temizlenmemiş 4 hafta ve 8 hafta IMR90 VHSE örnekleri için gösterilmiştir. Bir IMR90 VHSE deney setinin elde edilen verileri, her yapıdaki dört alt hacim (her biri z yönünde 250 μm) için damar çaplarını ve vasküler fraksiyonları hesaplamak için kullanıldı, veriler VHSE başına ortalama alındı ve kültür zaman noktası başına daha fazla ortalama alındı. Bu veriler, in vivo insan derisi78ile ilgili çaplara sahip 4 ve 8 haftalık kültür sürelerine yayılan vasküler ağ homeostazını ve in vivo insan derisi79 ile aynı sırayla vasküler fraksiyonu göstermektedir (kollajen yapılarındaki vasküler fraksiyonun özelleştirilebilir48 olduğu gösterilmiştir ve artan değerler için daha da optimize edilebilir). Veriler standart hata ± (S.E.M) olarak temsil edilir; n = Her zaman noktası için 3. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| medya | Bileşen |
| İnsan Dermal Fibroblast hücre hattı (hDF) | DMEM HG |
| %5 Fetal Sığır Serumu (FBS) | |
| %1 Penisilin/Streptomisiin (P/S) | |
| IMR90 Fibroblast hücre hattı | DMEM/HAM'ıN F12'LERI 50:50 |
| %10 FBS | |
| %1 P/S | |
| HMEC-1 Endotel hücre hattı | MCDB131 Temel orta |
| %10 FBS | |
| %1 P/S | |
| L-Glutamin [10 mM] | |
| Epidermal Büyüme Faktörü (EGF) [10 ng/mL] | |
| Hidrokortizon [10 μg/mL] | |
| N/TERT-1 Keratinosit hücre hattı | K-SFM medya tabanı |
| %1 P/S | |
| Sığır Hipofiz Özü (BPE) [25 μg/mL], K-SFM takviye kitinden | |
| Epidermal Büyüme Faktörü (EGF) [0.2 ng/mL], K-SFM takviye kitinden | |
| CaCl2 [0,3 mM] | |
| İnsan Derisi Eşdeğeri (HSE) Farklılaşması | 3:1 DMEM: Ham'ın F12'leri |
| %1 P/S | |
| 0,5 μM Hidrokortizon | |
| 0,5 μM İzoproterenol | |
| 0,5 μg/mL İnsülin |
Tablo 1: Medya tarifleri. İnsan dermal fibroblastları, IMR90 fibroblastları, HMEC-1 ve N/TERT-1 keratinositlerinin 2D kültürü için medya tarifleri verilmiştir. Bu tarifler VHSE oluşturmadan önce hücre hatlarını genişletmek için kullanılmıştır. VHSE oluşturmak için insan derisi eşdeğeri (HSE) farklılaşma ortamı kullanılır; bir temel tarif verilir, dalgıçlık kültürü ve tabaka indüksiyonunun bölümleri sırasında, protokol adım 3'te açıklandığı gibi konik miktarda FBS eklenmelidir. Bu kaynaklara dayanan İsG tarifi11,80.
| Kollajen stok konsantrasyonu (Cs) : | 8 | mg/mL | ||
| İstenen Ses Seviyesi (Vf): | 1 | Ml | ||
| NaOH Ayarlaması Normalleştirme*: | 1 | X | ||
| *pH 7 - 7.4'i ayarlamak için gereken NaOH miktarını belirlemek için her kollajen miktarının test edilmesi gerekir | ||||
| İstenen Kollajen Konsantrasyonu (mg/mL) | ||||
| 2 | 3 | 4 | 5 | |
| 10X PBS (Vpbs) | 0.1 | 0.1 | 0.1 | 0.1 |
| Kollajen stok (Vs) | 0.25 | 0.375 | 0.5 | 0.625 |
| 1N NaOH (VNaOH) | 0.00575 | 0.008625 | 0.0115 | 0.014375 |
| Medya (Vmedya) | 0.64425 | 0.516375 | 0.3885 | 0.260625 |
Tablo 2: Kollajen hesaplama referans tablosu. Referans tablosu, 8 mg / mL kollajen stok konsantrasyonu ve 1 mL istenen son hacim varsayılarak hesaplanan yaygın olarak istenen kollajen konsantrasyonlarını verir; tüm değerler mL'dedir. Bu tutarları hesaplamak için kullanılan denklemler protokol adım 2.2'de verilmiştir. Her kollajen stoğu için pH'ı kontrol etmek önemlidir; gerekirse, pH 7 - 7.4 elde etmek için NaOH miktarları eklenmelidir (PBS, NaOH, kollajen stoğu, medya eklendikten sonra). Protokol, 3 mg/mL kollajen konsantrasyonu kullanılarak VHSE'ler için optimize edilmiştir; kollajen konsantrasyonundaki değişiklikler farklı hücre hatları/istenen son sonuçlar için gerekli olabilir48.
| Birincil Antikor | kaynak | konsantrasyon | kullanmak |
| Filaggrin (AKH1) fare monoklonal IgG | Santa Cruz; sc-66192 (200 μg/mL) | [1:250] | Geç farklılaşma işareti15 |
| involucrin tavşan poliklonal IgG | Proteintech; 55328-1-AP (30 μg/150 μL) | [1:250] | Geç terminal farklılaşma işareti15 |
| Sitokeratin 10 (DE-K10) fare IgG, süpernatant | Santa Cruz; sc-52318 | [1:350] | Suprabasal epidermal marker14,36,59 |
| Kollajen IV tavşan poliklonal | Proteintech; 55131-1-AP | [1:500] | Endotel vasküler duvar67 |
| DRAQ 7 | Hücre Sinyali; 7406 (0,3 mM) | [1:250] | Nükleer işaretleyici |
| İkincil Antikor | kaynak | konsantrasyon | kullanmak |
| Keçi Anti-Tavşan IgG DyLight™ 488 Konjuge | Invitrogen; 35552 (1 mg/mL) | [1:500] | Kollajen IV ikincil |
| Anti-Tavşan IgG (H&L) (GOAT) Antikoru, DyLight™ 549 Konjuge | Rockland İmmünokimyasallar; 611-142-002 | [1:500] | involucrin ikincil |
| Keçi Anti-Fare IgG (H&L), DyLight™ 488 | Termo Bilimsel; 35502 (1 mg/mL) | [1:500] | Filaggrin veya Cytokeratin 10 ikincil |
| ENGELLEME ARABELLEĞI (500 mL) | |||
| reaktif | miktar | ||
| ddH2O | 450 mL | ||
| 10 x PBS | 50 mL | ||
| Sığır Serum Albümin (BSA) | 5 g | ||
| Ara 20 | 0,5 mL | ||
| Soğuk su Balık Jelatin | 1 g | ||
| Sodyum Azide (10% Sodyum Azide in diH2O) | 5 mL (%0,1 son konsantrasyon) | ||
Tablo 3: Bloke tampon tarifi ile birincil ve ikincil antikorlar. Listelenen antikorlar ve kimyasal lekeler Şekil 2 , Şekil 3, Şekil 4'tegösterilen lekeleme için kullanılmıştır. Boyama, protokol adım 6'da verildiği gibi, burada listelenen engelleme arabelleği tarifi kullanılarak tamamlandı. Seçilen kültür tekniklerine ve hücre hatlarına bağlı olarak lekelenme konsantrasyonlarının ve süresinin bazı optimizasyonları gerekebilir.
Ek Tablo 1: Kısaltmalar Listesi. Okuyucunun rahatlığı için kısaltmalar listesi dahildir. Bu tabloyu indirmek için lütfen tıklayınız.
Ek Şekil 1: Taşıma için VHSE teknik yardımı. VHSE'lerin işlenmesi özellikle sabitleme, işleme ve boyama sırasında zordur. A-D, 5-7. A, uygun boyamayı sağlamak için gözenekli zarın bir kültür kesici uçtan çıkarılmasının teknik olarak ele alındığını gösterir. B, boyama ve depolama sırasında her VHSE'nin nasıl su altında tutılacağını gösterir. C, yapıları PDMS görüntüleme kuyularına taşımanın en güvenli ve kolay yolunu gösterir. D, PDMS görüntüleme kuyusunda oturan bir VHSE gösterir: PDMS kuyusu alttaki bir cam slayda yapıştırılır, görüntüleme için bir pencere oluşturulur, uzun görüntüleme çalıştırmaları yoluyla nemi korumak için üzerine bir cam slayt yerleştirilir. Bu dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 2: VHSE'leri değerlendirmek için standart geniş alan floresan mikroskopisi kullanılabilir. Lazer tarama mikroskopisi mevcut olmadığında rutin değerlendirme için hacimsel görüntüleme için geniş alan görüntüleme kullanılabilir. Örnek olarak, VHSE'lerin hem apikal hem de bazolateral yönlerden görüntülenmesi en yüz ve ortogonal (Orto.) maksimum projeksiyonlar olarak gösterilir. (Üst) Epidermis, involucrin ve çekirdekler belirteç olarak kullanılarak görüntülendi. (Alt) Dermal vaskülat, belirteç olarak kollajen IV kullanılarak görüntülendi. Görüntüler netlik için arka plan çıkarılır. Düzlem dışı ışık, ortogonal görünümlerde belirgin olan "çizgili" veya "işaret fişeği" yapıtlarına yol açar. Geniş alan görüntüleme nicelleştirme için kullanılabilir, ancak daha fazla görüntü işleme gerektirebilir. Bu dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Bu protokol, VHSE'lerin üretimi ve üç boyutlu analizleri için basit ve tekrarlanabilir bir yöntem göstermiştir. Daha da önemlisi, bu yöntem birkaç özel teknik veya ekipman parçasına dayanır ve bu da onu çeşitli laboratuvarlar için erişilebilir hale getirir. Ayrıca, hücre tipleri protokoldeki sınırlı değişikliklerle değiştirilebilir ve araştırmacıların bu protokolü özel ihtiyaçlarına uyarlamalarına izin verebilir.
Uygun kollajen jelasyonu cilt kültürünün oluşturulmasında zorlu bir adımdır. Özellikle saflaştırma olmadan ham preparatlar kullanırken, eser kirleticiler jelleşme sürecini etkileyebilir. Tutarlılığı sağlamaya yardımcı olmak için, deney grupları VHSE üretimi için kullanılacak aynı kollajen stoğu ile yapılmalıdır. Ayrıca, jelleşme ideal olarak 7-7.4 pH'da gerçekleşmelidir ve eser kirleticiler pH'ı değiştirebilir. Herhangi bir kollajen stoğu kullanmadan önce, istenen konsantrasyonda bir uygulama asellüler jel yapılmalı ve jelleşmeden önce pH ölçülmelidir. Dermal bileşen tohumlama başlamadan önce bu kollajen kalite kontrolünü tamamlamak, tam bir deney kurmadan önce uygun jelleşme ve kollajen homojenliği ile ilgili sorunları belirleyecektir. Hücresel kollajeni doğrudan bir kültür kesici ucuna tohumlemek yerine, tüm pH ölçeğini değerlendiren ve 7-7.4 pH'ını doğrulayan bir pH şeridine biraz kolajen tohumlayın. Jelleşme, kollajen jel çözeltisinin bir damlacığı bir kapak ucuna veya doku kültürü plastik kuyu plakasına uygulanarak değerlendirilebilir (bir kültür kesici ucun sınırlı taraflarını simüle etmek için bir kuyu plakası önerilir). Jelleşme süresinden sonra kollajen katı olmalı, yani plaka eğildiğinde akmamalıdır. Faz kontrastı mikroskopisi altında kollajen homojen ve net görünmelidir. Kollajen tohumlamadan kaynaklanan kabarcıklar normaldir, ancak berrak jel içindeki büyük amorf opak kollajen lekeleri, yetersiz karıştırma, yanlış pH ve / veya karıştırma sırasında kollajenin soğutulmaması nedeniyle bir sorun olduğunu gösterir.
Hücre tohumlama miktarları ve ortam ayarlanabilir. Yukarıdaki protokolde, kapsüllenmiş hücre miktarları, dermal yapının üzerine tohumlanmış 1,7 x 10 5 keratinosit ile kollajen mL başına 7,5 x10 4 fibroblast ve 7,5 x10 5 endotel hücresinde 12 kuyulu bir kesici uç için optimize edilmiştir. Hücre yoğunlukları, çeşitli kollajen konsantrasyonlarında 3D vasküler ağ neslini araştıran ön çalışmalara ve önceki araştırmaya dayanarak bu VHSE protokolü için optimize edilmiştir48 ve HSE nesil22,80,81. Benzer sistemlerde, yayınlanan endotel hücre yoğunlukları 1.0 x 106 hücre / mL kollajen48'dir; fibroblast konsantrasyonları genellikle kollajen22, 28,82 ila1 x 105hücre / mL kollajen 8 ,58 ,83,84,850.4 x 105hücre / mL arasında değişir; ve keratinosit konsantrasyonları 0,5 x 105 [hücreler/cm2]80 ila 1 x 105 [hücreler/cm2]8arasında değişmektedir. Hücre yoğunlukları belirli hücreler ve araştırma sorusu için optimize edilebilir. Fibroblastlar gibi kontrtil hücreli üç boyutlu kültürler, canlılık azalmasına ve kültür kaybına yol açabilir86,87. Dermal bölmenin daralmasını (daha fazla dermal hücre, daha fazla kontrantil dermal hücre, daha uzun dalgıçlık kültürleri veya daha yumuşak matrislerle ortaya çıkabilir) test etmek ve epidermal yüzey kapsamını test etmek için ön deneyler tamamlanmalıdır. Ayrıca, aşırı dermal kasılma meydana gelirse veya farklı bir keratinosit kapsama oranı gerekiyorsa, dalgıçlıktaki gün sayısı ve serum içeriğinin koniklik oranı da özelleştirilebilir. Örneğin, dermal submersion döneminde veya keratinositler bir yüzey monolayer kurarken kasılma fark edilirse, serum konikleme işleminde daha hızlı hareket etmek ve VHSE'leri ALI'ye yükseltmek ek kasılmaların önlenmesine yardımcı olabilir. Benzer şekilde, keratinosit kapsamı ideal değilse, VHSE'nin serum olmadan batırıldığı gün sayısını değiştirmek epidermal monolayer kapsamını artırmaya ve serum dışarıda bırakıldığından kasılma azaltabilir. Hücre yoğunluklarındaki değişiklikler veya yukarıdaki diğer öneriler, belirli kültürler ve araştırma hedefleri için optimize edilmelidir.
Hava sıvı arayüzü (ALI) döneminde epidermisin uygun bir tabakalaşmasını sağlamak için, her bir kuyuda sıvı seviyelerini düzenli olarak kontrol etmek ve korumak önemlidir, böylece ALI ve her yapının uygun hidrasyon kültür uzunluğu boyunca tutulur. Tutarlı ALI düzeyleri belirlenene kadar medya düzeyleri günlük olarak denetlenmeli ve izlenmelidir. Epidermal tabaka kuru değil, nemli görünmelidir, ancak yapıda ortam havuzları olmamalıdır. ALI sırasında, yapı normal olan opak beyaz/sarı bir renk geliştirecektir. Epidermal tabaka muhtemelen düzensiz bir şekilde gelişecektir. Yaygın olarak, VHSE'ler kollajen tohumlama veya dermal kasılma nedeniyle eğilir. Yapının ortasında daha küçük yapılarda (24 kuyu boyutunda) daha yüksek bir epidermal kısım ve VHSE çevresi çevresinde 12 kuyu boyutunda bir sırt oluşumu gözlemlemek de normaldir. Yapıların daralması13 bu topoğrafik oluşumları değiştirebilir ve/veya hiç gözlemlenmeyebilir.
VHSE'lerin boyanması ve görüntülenmesi VHSE'lere mekanik manipülasyonu tanıtır. Her kültürün manipülasyonunun planlandırılması ve sınırlandırılması çok önemlidir. Manipülasyon gerektiğinde, VHSE'leri kesici uç zarlarından çıkarırken, yapı yüzeyine boyama veya yıkama çözümleri eklerken ve görüntüleme hazırlığı sırasında depolama/görüntüleme kuyularındaki VHSE'leri çıkarırken ve değiştirirken nazik hareketleri koruyun. Özellikle, epidermal bileşenin apikal katmanları kırılgan olabilir ve bazal epidermal tabakaları kesme riski altındadır. Epidermisin apikal katmanları kırılgandır ve doğal dokuda bile desquamasyondan geçer4, ancak epidermal yapının doğru analizi için hasarı veya kaybı en aza indirmek önemlidir. Epidermal katmanlar yapıyı kaldırırsa, ayrı ayrı görüntülenebilirler. Epidermisin bazal katmanları büyük olasılıkla hala dermis'e bağlıyken, apikal katmanların bölümleri ayrılabilir. Epidermisin görselleştirilmesi için, yoğun çekirdek epidermisin alt ve orta katmanlarının bir özelliği olduğundan, nükleer bir leke bunu gözlemlemede yardımcı olur.
VHSE post-fiksasyonunun konfokal görüntülemesi protokolde tartışılmıştır, ancak VHSE'leri kültür boyunca dik tabanlı optik tutarlılık tomografisi (OCT)88 , 89,90,91,92,93ile görüntülemek de mümkündür. VHSE, gözle görülür etkileri olmadan en az iki saat boyunca inkübasyon veya nemlendirme olmadan görüntülemeye dayanacak kadar kararlıdır. OCT etiketsiz ve noninvaziv olduğundan, olgunlaşma sırasında epidermal kalınlığı izlemek mümkündür. Diğer noninvaziv görüntüleme yöntemleri de kullanılabilir.
VHSE'nin daha derinlerinde lazer zayıflaması nedeniyle kombine dermal ve epidermal yapıların hacimsel görüntülemesi zor olabilir. Bu, yapının epidermal taraftan (Şekil 1) ve dermal taraftan ( Şekil2) olmak üzere iki yönde görüntülenmesi ile azaltılabilir ve dermal vasküler yapıların ve epidermisin iyi çözülmesini sağlar. Ek olarak, numune temizlenebilir ve tüm yapının hacimsel görüntülerinin minimum zayıflama ile olmasını sağlar. Çeşitli temizleme yöntemleri denendi, ancak açıklanan methanol / metil salisilat yöntemi en iyi sonuçları verdi. Diğer takas yöntemlerini optimize etmek isteyen araştırmacılar bu incelemelere yönlendirilir49,61,62. Temizleme ise, yöntem floroforlara ve/veya yapıya zarar verebileceği için, temizlemeden önce numunenin tam olarak görüntülenebilmesi önerilir. Ayrıca, floresan birkaç gün içinde solabileceğinden, görüntüleme temizlendikten sonra mümkün olan en kısa sürede tamamlanmalıdır.
Basitlik ve erişilebilirlik için, bu protokol önceki literatürde bulunan en basit ortam karışımlarını kullandı11,80. Basit medya karışımlarını kullanmanın birçok avantajı olsa da, bu seçimin sınırlamaları da kabul edilmektedir. Diğer gruplar, belirli medya bileşenlerinin epidermal ve dermal sağlık üzerindeki etkilerini incelediler ve dış serbest yağ asitleri / lipitler gibi diğer medya katkı maddeleri94'ünepidermisin stratum korneumunu artırdığını ve cilt bariyeri işlevini iyileştirdiğini buldular. İmmünofluoresan belirteçlerimiz epidermisin içinde uygun farklılaşma ve tabakalaşma gösterse de, yapılan çalışmalara bağlı olarak ek medya optimizasyonu gerekebilir. Ayrıca, burada sunulan VHSE'ler değerlendirilirken epidermal BM'nin kapsamlı bir analizi yapılmamıştır. BM'nin bütünlüğü cilt eşdeğerlerinin önemli bir göstergesidir; çeşitli gruplar, kültür süresi ve BM işaretleri95 üzerindeki etkisinin yanı sıra fibroblast varlığının analizi ve BM ekspresyörü üzerinde büyüme faktörü etkileri hakkında araştırmalar yapmıştır14. Bu protokol kullanırken BM bileşeninin analizinin değerlendirilmesi ve optimize edilmesi gerektiğini belirtmek önemlidir.
Bu protokolde, ALI'de 8 hafta sonra sonuçları gösteren VHSE oluşturma prosedürü açıklanmaktadır. VHSE kültürleri ALI'de gözle görülür bir değişiklik veya canlılık kaybı olmadan 12 haftaya kadar kültürlenmiştir ve daha uzun süre yaşayabilir olmaları mümkündür. Daha da önemlisi, bu protokol dermal fibroblastların IMR90 akciğer fibroblastları ile değiştirilmesinde gösterildiği gibi, yaygın olarak bulunan hücre tiplerine kolayca uyarlanabilir. Araştırmacının ihtiyacına ve kullanılabilir kaynaklara bağlı olarak, daha farklı hücre türleri medya optimizasyonu gerektirebileceğinden, kültür üzerindeki hücre türleri ve ortam karışımları ayarlanabilir. Özetle, bu prosedürler cilt biyolojisi ve hastalıklarının incelenmesi için VHSE'lerin kültürü hakkında netlik sağlamak içindir. Erişilebilirliği en üst düzeye çıkarmak için protokol, araştırma çalışmalarının özel ihtiyaçlarına göre daha da özelleştirilebilen minimal etkili bir yaklaşım olarak ortak ekipman, hücre hatları ve reaktifler kullanılarak bu basit ve sağlam şekilde geliştirilmiştir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, Dr. Jim Rheinwald59 ve Dr. Ellen H. van den Bogaard20'ye N/TERT hücre hatları cömert hediyeleri için teşekkür ediyor. Bu çalışma Amerikan Kalp Derneği (19IPLOI34760636) tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 N NaOH | Fisher Chemical | S318-100 | (Dilute from Lab stock) |
| 4% Paraformaldehyde | ACROS Organics | #41678-5000, Lot # B0143461 | Made up using solid Paraformaldehyde in PBS, pH adjusted to 6.9 |
| Autoclaved forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| CaCl2 | Fisher bioreagents | Cat # BP510-250, Lot # 190231 | Rnase, Dnase, Protease-Free |
| Cell line, Endothelial: Microvascular Endothelial Cell (HMEC1) | ATCC | CRL-3243 | SV40 Immortalized microvascular endothelial cell. Note that 750,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: dermal Human fibroblast, adult | ATCC | PCS-201-012 | Primary dermal cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: human lung firbroblast (IMR90) | ATCC | CCL-186 | Primary embryonic cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Keratinocyte: N/TERT-1 | Immortalized via hTERT expression. N/TERT-1 was made using a retroviral vector conferring hygromycin resistance. Cell line established by Dickson et al. 2000. Can be replaced with ATCC PCS-200-010 or PCS-200-011. Note that 170,000 cells were used per construct; N/TERT1 cells must be used from plates that are 30% confluent- two 30% confluent 90 mm tissue culture dishes give more than enough cells.The authors thank Dr. Jim Rheinwald and Dr. Ellen H. van den Bogaard for their generous gift of N/TERT cell lines. | ||
| Centrifuge | Thermo Scientific; Sorvall Legend X1R | (standard lab equipment) | |
| Computational Software | MATLAB | MATLAB 2020a | MathWorks, Natick, MA. |
| Confocal Microscope | Leica TCS SPEII confocal | Laser scanning confocal. Can be replaced with other confocals or deconvolution microscopy. | |
| Cover Glass (22 x 22) | Fisher Scientific | 12-545F | 0.13-0.17 mm No.1 Thickness |
| Cyanoacrylate super glue or silicone grease | Glue Masters | #THI0102 | Glue Masters, THICK, Instant Glue, Cyanoacrylate; super glue is preferred |
| DMEM media base | Corning; Mediatech, Inc | REF # 10-013-CM; Lot # 26119007 | DMEM, 1X (Dulbecco's Modification of Eagle's Medium) with 4.5 g/L glucose, L-glutamine & sodium pyruvate |
| DMEM/F-12 50/50 | Corning; Mediatech, Inc | REF # 10-090-CV; Lot # 21119006 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Ethanol | Decon Labs | #V1101 | (standard lab reagent) |
| Fetal Bovine Serum | Fisher Scientific | Cat # FB12999102, Lot # AE29451050 | Research Grade Fetal Bovine Serum, Triple 0.1 um sterile filtered |
| Fine tip forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| Human Epidermal Growth Factor (EGF) | Peprotech | Cat # AF-100-15-1MG, Lot # 0318AFC05 D0218 | Made up in 0.1% BSA in PBS |
| Hydrocortisone | Alpha Easar | Lot # 5002F2A | made up in DMSO |
| Insulin (human) | Peprotech | Lot # 9352621 | |
| Inverted Light/Phase Contrast Microscope | VWR | 76317-470 | (standard lab equipment) |
| Isoproterenol | Alfa Aesar | #AAJ6178806 | DL-Isoproterenol hydrochloride, 98% |
| Keratinocyte-SFM (1x) media base | Gibco; Life Technologies Corporation | REF #: 10724-011; Lot # 2085518 | Keratinocyte-SFM (1X); serum free medium |
| L-Ascorbic Acid | Fisher Chemical | Cat # A61-100, Lot # 181977, CAS # 50-81-7 | Crystalline. L-Ascorbic acid can also be purchased as a salt |
| L-glutamine (solid) | Fisher Bioreagents | CAT # BP379-100, LOT # 172183, CAS # 56-85-9 | L-Glutamine, white crystals or Crystalline powder |
| MCDB 131 media base | Gen Depot | CM034-050, Lot # 03062021 | MCDB 131 Medium Base, No L-Glutamine, sterile filtered |
| Metal punches | Sona Enterprises (SE) | 791LP, 12PC | Hollow Leather Punch Set, High Carbon Steel, Hardness: 48HRC; (various sizes including): 1/8", 5/32", 3/16", 7/32", 1/4", 9/32", 5/16", 3/4", 7/16", 1/2", 5/8:, 3/4". This punch set is helpful, but x-acto knife can work as well. Size of metal punch that works well for 12 well transwell VHSE is 3/8" or 1/2". |
| Methanol | Fisher Chemical | CAS # 67-56-1 | (optional). For clearing dehydration step. |
| Methyl Salicylate | Fisher Chemical | O3695-500; Lot # 164535; CAS # 119-36-8 | (optional). For clearing. |
| Microtubes, 1.7 mL | Genesee Scientific Corporation; Olympus Plastics | Cat # 24-282; Lot # 19467 | 1.7 ml Microtubes, Clear; Boilproof, Polypropulene, Certified Rnase, Dnase, DNA, PCR inhibitor and endotoxin-Free |
| PBS, 10x Culture grade or autoclaved | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. |
| PBS, 1x Culture grade, (-) Calcium, (-) magnesium | Genesee Scientific Corporation | Ref # 25-508; Lot # 07171015 | |
| PBS, 1x non-Culture grade | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. Dilute to 1x with water. |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | Ref # 15140-122, Lot # 2199839 | Pen Strep (10,000 Units/mL Penicillin; 10,000 ug/mL Streptomycin) |
| Petri Dish, glass, small | Corning | PYREX 316060 | (optional). To be used as a clearing container |
| Petri Dishes, 100 mm | Fisher Scientific | FB0875713 | Use for making up PDMS. |
| Polydimethylsiloxane (PDMS) | Dow Corning | GMID 02065622, Batch # H04719H035 | Sylgard 184 Silicone Elastomer Base, Dow Corning, Midland, MI) |
| Dow Corning | GMID 02065622, Batch # H047JC4003 | DOWSIL 184, Silicone Elastomer Curing Agent | |
| note: PDMS is usually sold as a kit that includes both the base and curing agent components. | |||
| Positive Displacement Pipettes (1000 & 250 uL) | Gilson | 1000 uL: HM05136, M1000. 250 uL: T12269L | M1000 pipette capacity (100-1000 uL); M250 pipette capacity to 250 uL |
| Positive Displacement Tips/Pistons (1000 & 250 uL) | Gilson | 1000 uL: CAT # F148180, BATCH # B01292902S; 250 uL: CAT # F148114, BATCH # B05549718S | Sterilized capillaries and pistons |
| Round tipped scoopula | (optional; standard lab equipment) For manipulation of VHSEs prior to imaging | ||
| Supplements for Keratinocyte-SFM media | Gibco; Life Technologies Corporation | Ref # 37000-015, Lot # 2154180 | Contains EGF Human Recombinant (Cat # 10450-013), Bovine Pituitary Extract (Cat # 13028-014) |
| Tissue Culture Plate Inserts, 12 well size, 3 µm pore size | Corning; Costar | REF # 3462 - Clear; Lot # 14919057 | Transwell; 12 mm Diameter Inserts, 3.0 um pore size, tissue culture treated, polyester membrane, polystyrene plates, |
| Tissue Culture Plates, 12 well size | Greiner Bio-one; CellStar | Cat # 665 180; Lot # E18103QT | 12 well cell culture plate; sterile, with lid; products are sterile, free of detectable Dnase, Rnase, human DNA and pyrogens. Contents non-cytotoxic |
| Tissue Culture Plates, 60.8cm^2 growth area | Genesee Scientific Corporation | Cat # 25-202; Lot No: 191218-177B | Tissue culture dishes; treated, growth area 60.8 cm^2; sterile, Dnase, Rnase, Pyrogen Free; virgin polystyrene |
| Triton x 100 | Ricca Chemical Company | Cat # 8698.5-16, Lot # 4708R34 | Wetting agent |
| Trypsin 0.25% | Corning; Mediatech, Inc | Ref # 25-053-CI | 0.25% Trypsin, 2.21 mM EDTA, 1x [-] sodium bicarbonate |
| Type 1 Collagen isolated from Rat tail | Pel-Freez Biologicals | 56054-1 | Sprauge-Dawley rat tails can be purchased frozen from Pel-Freez or other suppliers. Collagen can be isolated from the tail tendons. Isolation Protocol references [Cross et al.,2010; Rajan et al.,2007; Bornstein, 1958] .Alternatively, high concentration rat-tail collagen can be purchased from suppliers including Corning (Catalog Number: 354249) |
| Vaccum chamber, benchtop | Bel-Art | F42010-0000 | (standard lab equipment) |
| Handheld Precision knife | X-Acto | X3311 | (X-Acto knife optional if purchased steel punches) |
Referanslar
- Stojic, M., et al. Skin tissue engineering 3. Biomaterials for Skin Repair and Regeneration. , 59(2019).
- Shevchenko, R. V., James, S. L., James, S. E. A review of tissue-engineered skin bioconstructs available for skin reconstruction. Journal of The Royal Society Interface. 7 (43), 229-258 (2010).
- Kolarsick, P. A. J., Kolarsick, M. A., Goodwin, C. Anatomy and Physiology of the Skin. Journal of the Dermatology Nurses' Association. 3 (4), (2011).
- McGrath, J. A., Eady, R. A. J., Pope, F. M. Anatomy and organization of human skin. Rook's textbook of dermatology. 10, 9781444317633(2004).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. Journal of Dermatological Science. 90 (1), 3-12 (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue Engineered Human Skin Equivalents. Pharmaceutics. 4 (1), (2012).
- Oh, J. W., Hsi, T. -C., Guerrero-Juarez, C. F., Ramos, R., Plikus, M. V. Organotypic skin culture. The Journal of investigative dermatology. 133 (11), 1-4 (2013).
- El-Ghalbzouri, A., Gibbs, S., Lamme, E., Van Blitterswijk, C. A., Ponec, M. Effect of fibroblasts on epidermal regeneration. British Journal of Dermatology. 147 (2), 230-243 (2002).
- Sun, T., Haycock, J., MacNeil, S. In situ image analysis of interactions between normal human keratinocytes and fibroblasts cultured in three-dimensional fibrin gels. Biomaterials. 27 (18), 3459-3465 (2006).
- Kreimendahl, F., et al. Macrophages significantly enhance wound healing in a vascularized skin model. Journal of Biomedical Materials Research Part A. 107, 1340-1350 (2019).
- El Ghalbzouri, A., Commandeur, S., Rietveld, M. H., Mulder, A. A., Willemze, R. Replacement of animal-derived collagen matrix by human fibroblast-derived dermal matrix for human skin equivalent products. Biomaterials. 30 (1), 71-78 (2009).
- Roger, M., et al. Bioengineering the microanatomy of human skin. Journal of Anatomy. 234, 438-455 (2019).
- Carlson, M. W., Alt-Holland, A., Egles, C., Garlick, J. A. Three-Dimensional Tissue Models of Normal and Diseased Skin. Current Protocols in Cell Biology. 41 (1), 1-17 (2008).
- El Ghalbzouri, A., Jonkman, M. F., Dijkman, R., Ponec, M. Basement Membrane Reconstruction in Human Skin Equivalents Is Regulated by Fibroblasts and/or Exogenously Activated Keratinocytes. Journal of Investigative Dermatology. 124 (1), 79-86 (2005).
- Pruniéras, M., Régnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. The Journal of Investigative Dermatology. 81, 1 Suppl 28-33 (1983).
- Ali, N., Hosseini, M., Vainio, S., Taieb, A., Cario-André, M., Rezvani, H. R. Skin equivalents: skin from reconstructions as models to study skin development and diseases. British Journal of Dermatology. 173 (2), 391-403 (2015).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Innovative tissue models for drug discovery and development. 69-70, 81-102 (2014).
- Mieremet, A., Rietveld, M., Absalah, S., van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by chitosan modulated dermal matrices. PLOS ONE. 12 (3), 0174478(2017).
- Vidal, S. E. L., Tamamoto, K. A., Nguyen, H., Abbott, R. D., Cairns, D. M., Kaplan, D. L. 3D biomaterial matrix to support long term, full thickness, immuno-competent human skin equivalents with nervous system components. Organoids and Ex Vivo Tissue On-Chip Technologies. 198, 194-203 (2019).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838(2017).
- Lebonvallet, N., et al. Effects of the re-innervation of organotypic skin explants on the epidermis. Experimental Dermatology. 21 (2), 156-158 (2011).
- Van Drongelen, V., et al. Barrier Properties of an N/TERT-Based Human Skin Equivalent. Tissue Engineering Part A. 20 (21-22), 3041-3049 (2014).
- Hensler, S., Kühlbach, C., Parente, J. D., Krüger-Ziolek, S., Möller, K., Müller, M. Establishment and initial characterization of a simple 3D organotypic wound healing model. , Available from: https://opus.hs-furtwangen.de/frontdoor/index/index/docld/4852 (2018).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5), 240-249 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Amelian, A., Wasilewska, K., Megias, D., Winnicka, K. Application of standard cell cultures and 3D in vitro tissue models as an effective tool in drug design and development. Pharmacological Reports. 69 (5), 861-870 (2017).
- Lu, W., et al. Mixture of Fibroblasts and Adipose Tissue-Derived Stem Cells Can Improve Epidermal Morphogenesis of Tissue-Engineered Skin. Cells Tissues Organs. 195 (3), 197-206 (2012).
- Marino, D., Luginbühl, J., Scola, S., Meuli, M., Reichmann, E. Bioengineering Dermo-Epidermal Skin Grafts with Blood and Lymphatic Capillaries. Science Translational Medicine. 6 (221), 221(2014).
- Martins-Green, M., Li, Q. -J., Yao, M. A new generation organ culture arising from cross-talk between multiple primary human cell types. The FASEB Journal. 19 (2), 222-224 (2004).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. -W. 3D Cell Printing of Perfusable Vascularized Human Skin Equivalent Composed of Epidermis, Dermis, and Hypodermis for Better Structural Recapitulation of Native Skin. Advanced Healthcare Materials. 8 (7), 1801019(2019).
- Baltazar, T., et al. 3D bioprinting of a vascularized and perfusable skin graft using human keratinocytes. Tissue Engineering Part A. 26 (5-6), 227-238 (2019).
- Klar, A. S., et al. Tissue-engineered dermo-epidermal skin grafts prevascularized with adipose-derived cells. Biomaterials. 35 (19), 5065-5078 (2014).
- Grebenyuk, S., Ranga, A. Engineering Organoid Vascularization. Frontiers in Bioengineering and Biotechnology. 7, (2019).
- Black, A. F., Berthod, F., L'heureux, N., Germain, L., Auger, F. A. In vitro reconstruction of a human capillary-like network in a tissue-engineered skin equivalent. The FASEB Journal. 12 (13), 1331-1340 (1998).
- Huber, B., Link, A., Linke, K., Gehrke, S. A., Winnefeld, M., Kluger, P. J. Integration of Mature Adipocytes to Build-Up a Functional Three-Layered Full-Skin Equivalent. Tissue Engineering Part C: Methods. 22 (8), 756-764 (2016).
- Monfort, A., Soriano-Navarro, M., García-Verdugo, J. M., Izeta, A. Production of human tissue-engineered skin trilayer on a plasma-based hypodermis. Journal of Tissue Engineering and Regenerative Medicine. 7 (6), 479-490 (2013).
- Shamis, Y., et al. Fibroblasts derived from human embryonic stem cells direct development and repair of 3D human skin equivalents. Stem Cell Research & Therapy. 2 (1), 10(2011).
- Kim, Y., et al. Establishment of a complex skin structure via layered co-culture of keratinocytes and fibroblasts derived from induced pluripotent stem cells. Stem Cell Research & Therapy. 9 (1), 217(2018).
- Chau, D. Y. S., Johnson, C., MacNeil, S., Haycock, J. W., Ghaemmaghami, A. M. The development of a 3D immunocompetent model of human skin. Biofabrication. 5 (3), 035011(2013).
- Vanden Bogaard, E. H., et al. Crosstalk between Keratinocytes and T Cells in a 3D Microenvironment: A Model to Study Inflammatory Skin Diseases. Journal of Investigative Dermatology. 134 (3), 719-727 (2014).
- Linde, N., Gutschalk, C. M., Hoffmann, C., Yilmaz, D., Mueller, M. M. Integrating Macrophages into Organotypic Co-Cultures: A 3D In Vitro Model to Study Tumor-Associated Macrophages. PLOS ONE. 7 (7), 40058(2012).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical Advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Weinmüllner, R., et al. Organotypic human skin culture models constructed with senescent fibroblasts show hallmarks of skin aging. npj Aging and Mechanisms of Disease. 6 (1), 4(2020).
- Barker, C. L., et al. The Development and Characterization of an In Vitro Model of Psoriasis. Journal of Investigative Dermatology. 123 (5), 892-901 (2004).
- Larcher, F., Espada, J., Díaz-Ley, B., Jaén, P., Juarranz, A., Quintanilla, M. New Experimental Models of Skin Homeostasis and Diseases. Actas Dermo-Sifiliográficas (English Edition). 106 (1), 17-28 (2015).
- Varkey, M., Ding, J., Tredget, E. E. Fibrotic Remodeling of Tissue-Engineered Skin with Deep Dermal Fibroblasts Is Reduced by Keratinocytes. Tissue Engineering Part A. 20 (3-4), 716-727 (2013).
- Moulin, V. J. Reconstitution of skin fibrosis development using a tissue engineering approach. Methods in Molecular Biology. 961, Clifton, N.J. 287-303 (2013).
- Morgan, J. T., Shirazi, J., Comber, E. M., Eschenburg, C., Gleghorn, J. P. Fabrication of centimeter-scale and geometrically arbitrary vascular networks using in vitro self-assembly. Biomaterials. 189, 37-47 (2019).
- Silvestri, L., Costantini, I., Sacconi, L., Pavone, F. S. Clearing of fixed tissue: a review from a microscopist's perspective. Journal of Biomedical Optics. 21 (8), 1-8 (2016).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Rajan, N., Habermehl, J., Coté, M. -F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1, 2753(2007).
- Bornstein, M. B. Reconstituted rat-tail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Laboratory Investigation. 7 (2), 134-137 (1958).
- Clément, M. -V., Ramalingam, J., Long, L. H., Halliwell, B. The In Vitro Cytotoxicity of Ascorbate Depends on the Culture Medium Used to Perform the Assay and Involves Hydrogen Peroxide. Antioxidants & Redox Signaling. 3 (1), 157-163 (2001).
- Tajima, S., Pinnell, S. R. Ascorbic acid preferentially enhances type I and III collagen gene transcription in human skin fibroblasts. Journal of Dermatological Science. 11 (3), 250-253 (1996).
- Murad, S., Tajima, S., Johnson, G. R., Sivarajah, A., Pinnell, S. R. Collagen Synthesis in Cultured Human Skin Fibroblasts: Effect of Ascorbic Acid and Its Analogs. Journal of Investigative Dermatology. 81 (2), 158-162 (1983).
- Villacorta, L., Azzi, A., Zingg, J. -M. Regulatory role of vitamins E and C on extracellular matrix components of the vascular system. Vitamin E: An Overview of Major Research Directions. 28 (5), 507-537 (2007).
- Ashino, H., et al. Novel Function of Ascorbic Acid as an Angiostatic Factor. Angiogenesis. 6 (4), 259-269 (2003).
- Ponec, M., et al. The Formation of Competent Barrier Lipids in Reconstructed Human Epidermis Requires the Presence of Vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
- Johansen, C. Generation and Culturing of Primary Human Keratinocytes from Adult Skin. Journal of visualized experiments: JoVE. (130), e56863(2017).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Ariel, P. A beginner's guide to tissue clearing. The International Journal of Biochemistry & Cell Biology. 84, 35-39 (2017).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502(2010).
- Ng, J. M. K., Gitlin, I., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. ELECTROPHORESIS. 23 (20), 3461-3473 (2002).
- Eddings, M. A., Johnson, M. A., Gale, B. K. Determining the optimal PDMS-PDMS bonding technique for microfluidic devices. Journal of Micromechanics and Microengineering. 18 (6), 067001(2008).
- Markov, D. A., Lillie, E. M., Garbett, S. P., McCawley, L. J. Variation in diffusion of gases through PDMS due to plasma surface treatment and storage conditions. Biomedical microdevices. 16 (1), 91-96 (2014).
- Katzenberg, F. Plasma-bonding of poly(dimethylsiloxane) to glass. e-Polymers. 5 (1), (2005).
- El Ghalbzouri, A., Lamme, E., Ponec, M. Crucial role of fibroblasts in regulating epidermal morphogenesis. Cell and Tissue Research. 310 (2), 189-199 (2002).
- Kanitakis, J. Anatomy, histology and immunohistochemistry of normal human skin. European journal of dermatology: EJD. 12 (4), 390-399 (2002).
- Kroon, D. -J. Hessian based Frangi Vesselness filter. MATLAB Central File Exchange. , Available from: https://www.mathworks.com/matlabcentral/fileexchange/24409-hessian-based-frangi-vesselness-filter (2010).
- Jerman, T., Pernuš, F., Likar, B. Špiclin Enhancement of Vascular Structures in 3D and 2D Angiographic Images. IEEE Transactions on Medical Imaging. 35 (9), 2107-2118 (2016).
- Kovesi, P. Phase Preserving Denoising of Images. signal. 4, 6(1999).
- Vincent, L. Morphological grayscale reconstruction in image analysis: applications and efficient algorithms. IEEE Transactions on Image Processing. 2 (2), 176-201 (1993).
- Xie, L., et al. Quantitative susceptibility mapping of kidney inflammation and fibrosis in type 1 angiotensin receptor-deficient mice. NMR in Biomedicine. 26 (12), 1853-1863 (2013).
- Van Uitert, R., Bitter, I. Subvoxel precise skeletons of volumetric data based on fast marching methods. Medical Physics. 34 (2), 627-638 (2007).
- Sethian, J. A. A fast marching level set method for monotonically advancing fronts. Proceedings of the National Academy of Sciences of the United States of America. 93 (4), 1591-1595 (1996).
- Sethian, J. A. Fast Marching Methods. SIAM Review. 41 (2), 199-235 (1999).
- Braverman, I. M. The Cutaneous Microcirculation. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 3-9 (2000).
- Men, S. J., Chen, C. -L., Wei, W., Lai, T. -Y., Song, S. Z., Wang, R. K. Repeatability of vessel density measurement in human skin by OCT-based microangiography. Skin research and technology: official journal of International Society for Bioengineering and the Skin (ISBS) [and] International Society for Digital Imaging of Skin (ISDIS) [and] International Society for Skin Imaging (ISSI). 23 (4), 607-612 (2017).
- Commandeur, S., Ho, S. H., de Gruijl, F. R., Willemze, R., Tensen, C. P., El Ghalbzouri, A. Functional characterization of cancer-associated fibroblasts of human cutaneous squamous cell carcinoma. Experimental Dermatology. 20 (9), 737-742 (2011).
- Thakoersing, V. S., Danso, M. O., Mulder, A., Gooris, G., Ghalbzouri, A. E., Bouwstra, J. A. Nature versus nurture: does human skin maintain its stratum corneum lipid properties in vitro. Experimental Dermatology. 21 (11), 865-870 (2012).
- Thakoersing, V. S., Gooris, G. S., Mulder, A., Rietveld, M., El Ghalbzouri, A., Bouwstra, J. A. Unraveling barrier properties of three different in-house human skin equivalents. Tissue Engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Bouwstra, J. A., Groenink, H. W. W., Kempenaar, J. A., Romeijn, S. G., Ponec, M. Water distribution and natural moisturizer factor content in human skin equivalents are regulated by environmental relative humidity. The Journal of Investigative Dermatology. 128 (2), 378-388 (2008).
- Thakoersing, V. S., van Smeden, J., Mulder, A. A., Vreeken, R. J., El Ghalbzouri, A., Bouwstra, J. A. Increased Presence of Monounsaturated Fatty Acids in the Stratum Corneum of Human Skin Equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Smola, H., Thiekötter, G., Fusenig, N. Mutual induction of growth factor gene expression by epidermal-dermal cell interaction. The Journal of Cell Biology. 122 (2), 417(1993).
- Fluck, J., Querfeld, C., Cremer, A., Niland, S., Krieg, T., Sollberg, S. Normal Human Primary Fibroblasts Undergo Apoptosis in Three-Dimensional Contractile Collagen Gels. Journal of Investigative Dermatology. 110 (2), 153-157 (1998).
- Nakagawa, S., Pawelek, P., Grinnell, F. Long-Term Culture of Fibroblasts in Contracted Collagen Gels: Effects on Cell Growth and Biosynthetic Activity. Journal of Investigative Dermatology. 93 (6), 792-798 (1989).
- Smith, L. E., Bonesi, M., Smallwood, R., Matcher, S. J., MacNeil, S. Using swept-source optical coherence tomography to monitor the formation of neo-epidermis in tissue-engineered skin. Journal of Tissue Engineering and Regenerative Medicine. 4 (8), 652-658 (2010).
- Pierce, M. C., Strasswimmer, J., Park, H., Cense, B., De Boer, J. F. Birefringence measurements in human skin using polarization-sensitive optical coherence tomography. Biomed Opt. 2 (2), 287-291 (2004).
- Pierce, M. C., Strasswimmer, J., Hyle Park, B., Cense, B., de Boer, J. F. Advances in Optical Coherence Tomography Imaging for Dermatology. Journal of Investigative Dermatology. 123 (3), 458-463 (2004).
- Yeh, A. T., Kao, B., Jung, W. G., Chen, Z., Nelson, J. S., Tromberg, B. J. Imaging wound healing using optical coherence tomography and multiphoton microscopy in an in vitro skin-equivalent tissue model. Journal of Biomedical Optics. 9 (2), 9(2004).
- Derr, K., et al. Fully Three-Dimensional Bioprinted Skin Equivalent Contructs with Validated Morphology and Barrier Funtion. Tissue Engineering Part C: Methods. 25 (6), 334-343 (2019).
- Park, B. H., de Boer, J. F. Polarization Sensitive Optical Coherence Tomography. Optical Coherence Tomography: Technology and Applications. , 1055-1101 (2015).
- Batheja, P., Song, Y., Wertz, P., Michniak-Kohn, B. Effects of Growth Conditions on the Barrier Properties of a Human Skin Equivalent. Pharmaceutical Research. 26 (7), 1689-1700 (2009).
- Dos Santos, M., Metral, E., Boher, A., Rousselle, P., Thepot, A., Damour, O. In vitro 3-D model based on extending time of culture for studying chronological epidermis aging. Matrix Biology. 47, 85-97 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır