Method Article
Génération d’équivalents de peau humaine vascularisée auto-assemblés
Dans cet article
Résumé
Le but de ce protocole est de décrire la génération et l’analyse volumétrique des équivalents humains vascularisés de peau utilisant des techniques accessibles et simples pour la culture à long terme. Dans la mesure du possible, la justification des étapes est décrite pour permettre aux chercheurs de personnaliser en fonction de leurs besoins en matière de recherche.
Résumé
Les équivalents de peau humaine (HSE) sont des constructions tissulaires qui modélisent les composants épidermiques et cutanés de la peau humaine. Ces modèles ont été utilisés pour étudier le développement de la peau, la cicatrisation des plaies et les techniques de greffe. De nombreux HSE continuent de manquer de vascularisation et sont en outre analysés par sectionnement histologique post-culture qui limite l’évaluation volumétrique de la structure. Présenté ici est un protocole simple utilisant des matériaux accessibles pour générer des équivalents vascularisés de peau humaine (VHSE) ; plus loin décrits sont des techniques volumétriques d’imagerie et de quantification de ces constructions. En bref, les VHSEs sont construits dans 12 inserts de culture de puits dans lesquels des cellules cutanées et épidermiques sont ensemencées dans le gel de collagène de type I de queue de rat. Le compartiment cutané est constitué de fibroblastes et de cellules endothéliales dispersées dans tout le gel de collagène. Le compartiment épidermique est constitué de kératinocytes (cellules épithéliales de la peau) qui se différencient à l’interface air-liquide. Il est important de faire en sorte que ces méthodes soient personnalisables en fonction des besoins du chercheur, les résultats démontrant la génération de VHSE avec deux types de cellules fibroblastiques différents : les fibroblastes cutanés humains (hDF) et les fibroblastes pulmonaires humains (IMR90s). Des VHSEs ont été développés, es imaged par la microscopie confocal, et volumétriquement analysés utilisant le logiciel de calcul à des points de temps de 4 et de 8 semaines. Un processus optimisé pour fixer, colorer, imager, et effacer VHSEs pour l’examen volumétrique est décrit. Ce modèle complet, cette imagerie et ces techniques d’analyse sont facilement personnalisables en fonction des besoins de recherche spécifiques de laboratoires individuels avec ou sans expérience préalable en ESS.
Introduction
La peau humaine remplit de nombreuses fonctions biologiques essentielles, notamment agir comme une barrière immunitaire / mécanique, réguler la température corporelle, participer à la rétention d’eau et aux rôles sensoriels1,2,3,4. Anatomiquement, la peau est le plus grand organe du corps humain et est composée de trois couches principales (épiderme, derme et hypoderme) et possède un système complexe de composants stromaux, vasculaires, glandulaires et du système immunitaire / nerveux en plus des cellules épidermiques. L’épiderme lui-même est composé de quatre couches de cellules qui sont continuellement renouvelées pour maintenir la fonction barrière et d’autres structures de la peau native (c.-à-d. sueur et glandes sébacées, ongles)3. La physiologie de la peau est importante dans la fonction immunitaire, la cicatrisation des plaies, la biologie du cancer et d’autres domaines, ce qui conduit les chercheurs à utiliser un large éventail de modèles, des monocultures in vitro aux modèles animaux in vivo. Les modèles animaux offrent la possibilité d’étudier toute la complexité de la physiologie de la peau, cependant, les modèles animaux couramment utilisés tels que les souris ont des différences physiologiques significatives par rapport aux humains5. Ces limites, et l’augmentation du coût des modèles animaux, ont conduit de nombreux chercheurs à se concentrer sur le développement de modèles in vitro qui reflètent plus fidèlement la physiologie de la peau humaine1,6. Parmi ceux-ci, l’un des types de modèles les plus simples est l’équivalent épidermique humain (HEE; également appelé modèles de peau de demi-épaisseur) qui sont composés uniquement de kératinocytes épidermiques sur une matrice cutanée acellulaire, mais capturent la différenciation et la stratification épidermiques observées in vivo. Sur cette base, les modèles contenant des composants cutanés et épidermiques (kératinocytes et fibroblastes) sont souvent appelés équivalents de peau humaine (HSE), modèles de peau pleine épaisseur ou constructions de peau organotypiques (OSC). En bref, ces modèles sont générés en encapsulant des cellules dermiques dans des matrices de gel et en semant des cellules épidermiques sur le dessus. La différenciation et la stratification épidermiques peuvent alors être obtenues par l’intermédiaire de milieux spécialisés et d’une exposition à l’air7. Des équivalents cutanés ont le plus souvent été générés par des techniques d’auto-assemblage utilisant des gels cutanés en collagène de type I (soit de queue de rat, soit d’origine bovine)1,8,mais des modèles similaires ont incorporé d’autres composants matriciels tels que la fibrine9,10,les fibroblastes dérivés11,12,les membranes dé-épidermisées cadavériques13, 14,15,16,les gels disponibles dans le commerce et autres1,12,13,17,18,19. Actuellement, il existe des équivalents de peau disponibles dans le commerce (comme précédemment examiné1,2). Cependant, ceux-ci sont principalement développés à des fins thérapeutiques et ne peuvent pas être facilement adaptés à des questions de recherche spécifiques.
Les HSE ont été appliquées dans des études de cicatrisation des plaies, de greffage, de toxicologie et de maladies/développements de la peau11,12, 13,16,8,20,21,22,23. Bien que la culture 3D modélise de manière plus complète les fonctions des tissus humains par rapport aux cultures 2D24,l’inclusion de divers types de cellules qui reflètent plus précisément la population in vivo permet des études de coordination cellule-cellule dans des tissus complexes24,25,26. La plupart des HSE ne comprennent que des fibroblastes cutanés et des kératinocytes épidermiques27, bien que l’environnement cutané in vivo comprenne de nombreux autres types de cellules. Des études récentes ont commencé à inclure plus de populations cellulaires; ceux-ci comprennent les cellules endothéliales dans la vascularisation10,28,29,30,31,32,33,34,les adipocytes dans le tissu sous-cutané35,36,les composants nerveux19,21,les cellules souches27,37,38,les cellules immunitaires10,39,40,41,42,et d’autres modèles spécifiques à la maladie / cancer16,40,43,44,45,46,47. La vascularisation est particulièrement importante parmi ceux-ci; alors que certains HSEs incluent des cellules vasculaires, dans l’ensemble, ils manquent encore d’éléments capillaires complets avec une connectivité à travers l’ensemble du derme10,29, stabilité in vitro étendue28,et densité appropriée des vaisseaux. De plus, les modèles HSE sont généralement évalués par sectionnement histologique post-culture qui limite l’analyse de la structure tridimensionnelle des HSE. L’analyse tridimensionnelle tient compte de l’évaluation volumétrique de la densité vasculaire48,49 aussi bien que de la variation régionale de l’épaisseur épidermique et de la différenciation.
Bien que les HSE soient l’un des modèles organotypiques les plus courants, la génération de ces constructions comporte de nombreux défis techniques, notamment l’identification de la matrice extracellulaire appropriée et des densités cellulaires, les recettes des milieux, les procédures d’interface air-liquide appropriées et l’analyse post-culture. De plus, bien que les modèles HEE et HSE aient publié des protocoles, il n’existe pas de protocole détaillé intégrant la vascularisation cutanée et l’imagerie volumétrique plutôt qu’une analyse histologique. Ce travail présente un protocole accessible pour la culture d’équivalents cutanés humains vascularisés (VHSE) à partir de lignées cellulaires principalement commerciales. Ce protocole est écrit pour être facilement personnalisable, permettant une adaptation simple aux différents types de cellules et besoins de recherche. Dans l’intérêt de l’accessibilité, de la disponibilité et du coût, l’utilisation de produits et de techniques de génération simples a été prioritaire par rapport à l’utilisation de produits disponibles dans le commerce. De plus, on décrit des méthodes volumétriques simples d’imagerie et de quantification qui permettent d’évaluer la structure tridimensionnelle du VHSE. Traduire cette procédure en un protocole robuste et accessible permet aux chercheurs non spécialisés d’appliquer ces modèles importants à la médecine personnalisée, à l’ingénierie tissulaire vascularisée, au développement de greffes et à l’évaluation de médicaments.
Protocole
1. Préparation à la culture 3D
- Préparer le stock de collagène de queue de rat à 8 mg/mL, en utilisant les protocoles établis50,51,52. Alternativement, le collagène de queue de rat peut être acheté auprès de fournisseurs (voir la liste des matériaux) à des concentrations appropriées.
REMARQUE: Le collagène peut être préparé ou acheté à différentes concentrations dans la gamme de 3-10 mg / mL, ou plus50,51,52. Les calculs dans le protocole supposent une concentration de 8 mg/mL, mais peuvent être ajustés en fonction des besoins du chercheur. - Élargir les lignées cellulaires : Les cellules endothéliales et fibroblastiques doivent être prêtes pour l’ensemencement au début de la génération de composants cutanés de collagène 3D (étape 2). Les kératinocytes doivent être prêts le jour 7 de la culture 3D. Une construction VHSE complète nécessite 7,5 x 105 cellules endothéliales; 7,5 x 104 fibroblastes; et 1,7 x 105 kératinocytes pour la génération (tableau 1).
NOTA : Ces densités conviennent aux inserts de culture tissulaire perméables de taille de 12 puits ou à l’équivalent. La densité et le format cellulaires peuvent être augmentés ou réduits en fonction des besoins du chercheur. Pour clarifier, cette quantité de cellules endothéliales et fibroblastiques ensemencera 1-3 composants cutanés, tandis que chaque composant épidermique nécessite 1,7 x 105 kératinocytes. - Effectuer toute la centrifugation cellulaire dans ce protocole pendant 5 min à 300 x g, mais cela peut être diminué pour les types de cellules plus fragiles.
2. Génération de composant cutané de collagène 3D
Remarque : Étape 2 est une procédure sensible au temps et doit être effectuée dans un seul paramètre. Il est conseillé d’effectuer un contrôle de qualité du stock de collagène pour assurer une gélification et une homogénéité appropriées avant de commencer l’ensemencement des composants cutanés, voir dépannage dans la discussion.
- Préparation et ensemencement de couches de collagène acellulaires
- Préparer deux tubes microcentrifugeurs coiffés de 1,7 mL, l’un pour le support acellulaire et l’autre pour le derme cellulaire. Les quantités données à cette étape prépareront 1 mL de collagène de 3 mg/mL (concentration cible de collagène), suffisante pour (3) VHSEs de taille 12 puits. Les équations sont répertoriées si un ajustement est nécessaire. Le volume et la densité peuvent être mis à l’échelle en fonction des besoins du chercheur (les numéros de référence communs sont donnés dans le tableau 2).
- À chaque tube, ajouter 100 μL de solution saline tamponnée au phosphate (PBS) de grade de culture 10x (un tube donnera 3 VHSE) et ajouter 8,6 μL de 1 N NaOH. Placez les tubes coiffés sur de la glace humide pour refroidir pendant au moins 10 min.
Cs = Concentration en stock de collagène
Vf = Volume final de collagène nécessaire
Ct = Concentration cible de collagène
Vs = Volume de collagène de stock nécessaire pour la quantité désirée (Vf)
Vpbs = Volume de PBS 10X nécessaire pour la concentration cible de collagène (Ct)
VNaOH = Volume de 1N NaOH nécessaire pour Ct
Vmedia = Volume de support, suspension d’appel ou ddH2O nécessaire pour Ct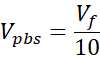
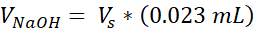
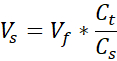
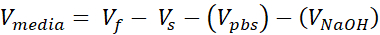
- Préparer des pipettes à déplacement positif de 1000 et 250 μL pour l’utilisation et mettre de côté. Comme les étapes ultérieures sont sensibles au temps, il est pratique de charger des pointes de pipette et de régler des volumes (375 μL et 125 μL, respectivement). En outre, configurez une pipette normale de 1000 μL pour 516 μL.
REMARQUE: Les pipettes à déplacement positif peuvent être remplacées par des pipettes normales si nécessaire, mais en raison de la viscosité élevée du collagène et de la sensibilité temps / température de cette procédure, les pipettes à déplacement positif sont recommandées pour aider à produire des résultats d’ensemencement cohérents. Si vous utilisez des pipettes normales, utilisez des mouvements lents. - Préparer les plaques de puits d’insertion de culture: Utilisez des pinces stériles pour placer trois inserts de culture de 12 puits dans une plaque de culture de tissu stérile de 12 puits, placez-les dans les colonnes centrales.
- Définir un milieux froids approprié pour les types de cellules fibroblastes et endothéliales.
- Après refroidissement des tubes bouchés, placez un tube (pour le support acellulaire) sur un rack dont le contenu est visible. Laissez l’autre tube (pour le derme cellulaire) sur la glace.
- Retirer 8 mg/mL de collagène de la réfrigération et le placer sur de la glace humide.
REMARQUE: N’utilisez pas de glace de congélation ou de refroidisseurs de paillasse à -20 °C, car cela congelera le collagène. - Au tube à calage froid, ajouter 516 μL de milieux et ajouter immédiatement 375 μL de collagène froid à l’aide de la pipette à déplacement positif de 1000 μL. Distribuer le collagène dans la solution (pas sur le côté du tube). Retirez immédiatement la pointe vide de la pipette et passez à la pipette à déplacement positif de 250 μL préparée pour mélanger.
- Mélanger rapidement mais doucement pour éviter la formation de bulles, ne pas retirer la pointe de la solution, si possible. Mélanger jusqu’à ce que la solution soit de couleur homogène, ce qui prend généralement environ 5 cycles de pipette ou 10 s (si vous utilisez un support avec du rouge phénol, la couleur deviendra plus claire et uniforme). Lors du mélange, assurez-vous de dessiner à partir de différentes positions du tube (en bas et en haut) pour un mélange uniforme.
REMARQUE: Cela peut être effectué avec 516 μL d’eau de qualité de culture cellulaire ou un autre liquide de qualité de culture cellulaire, cependant, le rouge de phénol de la plupart des milieux est un bon indicateur du mélange. Utilisez des fibroblastes ou des milieux endothéliaux qui ont été utilisés pour les expansions 2D.
- Mélanger rapidement mais doucement pour éviter la formation de bulles, ne pas retirer la pointe de la solution, si possible. Mélanger jusqu’à ce que la solution soit de couleur homogène, ce qui prend généralement environ 5 cycles de pipette ou 10 s (si vous utilisez un support avec du rouge phénol, la couleur deviendra plus claire et uniforme). Lors du mélange, assurez-vous de dessiner à partir de différentes positions du tube (en bas et en haut) pour un mélange uniforme.
- Disperser immédiatement 125 μL de collagène acellulaire sur la membrane de chacun des trois inserts de culture à 12 puits. Pour assurer une couverture uniforme du gel de collagène acellulaire, basculez le plat; si cela ne crée pas une couverture membranaire uniforme, utilisez la pointe de la pipette pour peindre essentiellement la membrane en étalant doucement le collagène; éviter d’appliquer une pression sur la membrane. La gélification commence presque immédiatement; effectuez cette étape rapidement pour assurer une couverture uniforme.
REMARQUE: Il y aura un excès de collagène acellulaire. Le volume peut être réduit, cependant, la préparation de moins de 1 mL de suspension de collagène peut entraîner des difficultés à mélanger la solution et une gélification insuffisante. - Déplacez immédiatement la plaque de 12 puits vers un incubateur de culture cellulaire à 37 °C pour la laisser geler pendant au moins 20 min (le collagène acellulaire peut geler plus longtemps si nécessaire; pendant ce temps de gélification, passez à l’étape 2.2). Retirez la suspension de collagène de la glace et replacez-la dans la réfrigération (le collagène est le plus stable à 4 °C).
- Suspension cellulaire et préparation d’ensemencement
REMARQUE : Pour la chronologie de culture de ce protocole, cela correspond au jour de submersion 1 (SD1)- Pendant la gélification du support de collagène acellulaire, trypsiniser et compter les variétés de cellule endothéliales et fibroblastiques.
- Suspendre 7,5 x 105 cellules endothéliales et 7,5 x 104 fibroblastes dans 258 μL de leurs milieux respectifs et combiner des suspensions cellulaires pour créer une partie aliquote de 516 μL. Maintenir les suspensions cellulaires sur de la glace humide jusqu’à l’utilisation.
- Préparer des pipettes à déplacement positif de 1000 et 250 μL pour l’utilisation et mettre de côté. Comme les étapes ultérieures sont sensibles au temps, il est pratique de charger les pointes de pipette et de régler les volumes (375 μL et 250 μL, respectivement). En outre, configurez une pipette normale de 1000 μL pour 516 μL.
- Ensemencement de collagène chargé de cellules du compartiment cutané
- Après la période de gélification, retirez la plaque de 12 puits de collagène acellulaire de l’incubateur.
REMARQUE: Si ce collagène n’est pas gélifié après 30 min, ne continuez pas la procédure car il y avait probablement une erreur lors de l’ensemencement ou le stock de collagène peut avoir un problème (voir dépannage dans la discussion). - Retirez le tube coiffé de 1,7 mL de la glace humide (contient 10x PBS et NaOH). Placez le tube dans un rack afin que le contenu soit visible. Desserrer/ouvrir tous les bouchons (suspension cellulaire, tube à bouchon froid).
- Retirer le collagène d’origine (8 mg/mL) de la réfrigération à 4 °C et le placer sur de la glace humide. Laissez le bouchon ouvert.
- Ajouter les 516 μL de suspension cellulaire refroidie au tube à calage à froid. Utilisez la pipette à déplacement positif de 1000 μL pour pipeter immédiatement 375 μL de solution de collagène froid directement dans la solution du tube coiffé.
- Expulser tout le collagène de la pipette dans le tube et jeter la pointe de la pipette à déplacement positif. Passez immédiatement à la pipette à déplacement positif de 250 μL et mélangez la solution de collagène.
- Mélanger la solution de collagène comme terminé précédemment (rapidement mais doucement pour éviter la formation de bulles), ne pas enlever la pointe du gel si possible. Mélanger jusqu’à ce que la solution soit homogène (environ 5 cycles de pipette ou 10 s). Lors du mélange, assurez-vous de dessiner à partir de différentes positions du tube (en bas et en haut) pour un mélange uniforme.
- Une fois mélangé, transférer immédiatement 250 μL de solution de collagène cellulaire sur les supports de collagène acellulaires dans chacun des trois inserts de culture à 12 puits. Pour assurer une couverture uniforme du support de collagène acellulaire, basculez le plat et /ou utilisez la pipette à déplacement positif pour déplacer doucement le collagène cellulaire fraîchement ensemencé sans perturber la couche acellulaire.
- Déplacez immédiatement la plaque de 12 puits à l’incubateur de culture cellulaire à 37 °C pour la laisser geler pendant au moins 30 min. Replacer le collagène dans une réfrigération à 4 °C après utilisation.
- Après le temps de gel de 30 minutes, inclinez doucement la plaque pour évaluer la gélification. Assurez-vous que le collagène est solidifié.
- Ajouter 500 μL et 1000 μL de mélange (demi-endothélial et moitié fibroblaste d’entretien) à la chambre supérieure et à la chambre inférieure de l’insert, respectivement (en haut d’abord, puis en bas pour empêcher la pression hydrostatique de pousser le collagène vers le haut). Ajouter le support lentement sur le côté du puits, pas directement sur le gel de collagène, pour minimiser la perturbation du collagène.
- Assurez-vous que le gel de collagène est immergé, ajoutez plus de milieux si nécessaire. Placez la plaque de puits dans l’incubateur de cellules pour une incubation de nuit. À ce stade, les médias contiennent 10% fbs; le support d’entretien normal pour chaque lignée cellulaire (chronologie et schéma donnés à la figure 1,A).
REMARQUE: Les supports tout au long de la culture VHSE peuvent être adaptés aux types de cellules personnalisés; une certaine optimisation peut être nécessaire.
- Assurez-vous que le gel de collagène est immergé, ajoutez plus de milieux si nécessaire. Placez la plaque de puits dans l’incubateur de cellules pour une incubation de nuit. À ce stade, les médias contiennent 10% fbs; le support d’entretien normal pour chaque lignée cellulaire (chronologie et schéma donnés à la figure 1,A).
- Après la période de gélification, retirez la plaque de 12 puits de collagène acellulaire de l’incubateur.
- Changement de média du jour 2 de la submersion (SD2)
- Changer 10% de milieu FBS dans les puits VHSE à 5% FBS moitié fibroblaste, moitié milieu endothélial complété avec 100 μg/mL d’acide L-ascorbique. Ajouter 500 μL à la chambre supérieure de l’insert de culture sur le côté du puits (encore une fois, ajouter soigneusement à la paroi latérale pour minimiser la perturbation du collagène) et ajouter 1000 μL à la chambre inférieure.
- Renouveler le support tous les 2 jours (SD4 et SD6) jusqu’au jour de submersion 7 (SD7).
- Utilisez une pipette manuelle pour retirer les supports des puits. L’utilisation d’un aspirateur est possible mais peut entraîner des dommages ou la destruction de la construction.
NOTE: L’acide L-ascorbique doit être composé frais tous les 2-3 jours (il s’oxyde en solution pour produire ainsi du peroxyde d’hydrogène, induisant ainsi un stress oxydatif et éventuellement des dommages cellulaires53). Ainsi, les milieux doivent être changés tous les 2-3 jours de SD2 jusqu’à la fin de la culture VHSE puisque l’acide L-ascorbique est présent. Il est plus facile de faire un stock de milieu et d’ajouter une quantité fraîchement préparée d’acide L-ascorbique à une partie aliquote du milieu chaque jour d’alimentation. Utilisez de l’eau ou des milieux de culture comme solvant et préparez de l’acide L-ascorbique frais à 100 mg/mL. L’acide L-ascorbique stimule la synthèse du collagène par les fibroblastes à un rythme approprié et favorise la stabilité du collagène 54,55,56 ; il diminue également la perméabilité endothéliale et maintient l’intégrité de la paroi des vaisseaux56,57 et contribue en outre à la formation de barrières épidermiques6,58.
3. Ensemencement de la composante épidermique et induction de la stratification
- Jour de submersion 7 (SD7): kératinocytes de graines
REMARQUE: Ensemencez les kératinocytes pour établir l’épiderme sur SD7. Ce point de temps peut être décalé en fonction des besoins du chercheur. La durée de la culture de submersion sans kératinocytes ne doit pas dépasser 9 jours, car une submersion plus longue conduit souvent à une contraction cutanée accrue. Si la contraction se produit avant SD7, il est recommandé de raccourcir la période de submersion à 5 jours et de semer l’épiderme sur SD5. Optimisez la période de submersion selon les besoins pour des expériences spécifiques (voir dépannage dans la discussion).- Culturer les kératinocytes (N/TERT-120,59 ou d’autres cellules appropriées) jusqu’à leur limite de confluence avant la trypsinisation et l’ensemencement sur les ECHS. Pour les cellules N/TERT-1, la confluence ne doit pas dépasser de manière significative 30% pour éviter une différenciation non souhaitée des kératinocytes en culture 2D59. Pour d’autres lignées cellulaires appropriées, telles que les kératinocytes épidermiques humains primaires, une limite de confluence de 75-80% est généralement utilisée60.
- Après la trypsinisation, comptez et suspendez 510 000 cellules dans 600 μL de milieux de différenciation équivalents à la peau humaine (HSE) complétés par un FBS à 5 %(tableau 1).
REMARQUE : 510 000 cellules dans 600 μL permettent 170 000 cellules/construction lors de l’ensemencement de 200 μL par construction (3 ESSV). - À l’aide d’une pipette manuelle, collectez et jetez les supports actuellement dans la chambre inférieure et supérieure pour chaque puits de construction. Assurez-vous de recueillir autant de médias que possible. Recueillir les milieux qui peuvent être coincés directement sous la membrane perméable en plaçant doucement la pointe de la pipette sous la membrane de l’insert de culture et en faisant tomber temporairement l’insert. Les médias ont peut-être été bloqués en raison de la tension superficielle. Assurez-vous que les inserts sont assis à plat dans leurs puits avant de continuer. L’utilisation d’un aspirateur est possible mais peut entraîner des dommages ou la destruction de la construction.
- Ajouter 1 mL de support HSE complété par 5% FBS à la chambre inférieure de chaque puits. Ajoutez ensuite 200 μL de suspension cellulaire à la chambre supérieure de chaque puits. Amorcez directement sur la surface de construction cutanée. Laissez les kératinocytes se déposer pendant 2 h dans l’incubateur.
- Deux h après l’ensemencement des kératinocytes, ajouter soigneusement 300 μL de milieux HSE complétés par 5% de FBS à la chambre supérieure de chaque puits de construction; pipeter lentement les médias sur le côté de l’insert de culture. Chargez les médias dans la chambre supérieure très soigneusement afin de ne pas déranger les kératinocytes installés qui n’ont peut-être pas encore adhéré étroitement au gel de collagène sous-jacent.
- Après avoir chargé le support, replacez la construction dans l’incubateur.
- Jour de submersion 8/9 (SD8 ou SD9)
- Compléter les milieux HSE complétés par 1 % de FBS et 100 μg/mL d’acide L-ascorbique.
- Retirez le support des chambres supérieure et inférieure à l’munis d’un pipettor manuel.
- Ajouter d’abord un support de 500 μL dans la chambre supérieure, puis 1 mL dans la chambre inférieure. (Cette étape peut être effectuée sur SD8 ou SD9)
- Jour de submersion 9/10 (SD9 ou SD10, cela devrait être le lendemain de l’étape 3.2)
- Constituer un milieu de différenciation HSE sans sérum avec 100 μg/mL d’acide L-ascorbique.
- Retirez le support des chambres supérieure et inférieure à l’munis d’un pipettor manuel.
- Charger 500 μL dans la chambre haute et 1 mL dans la chambre basse.
- Interface air-liquide Jour 1 (ALI1)
REMARQUE: ALI est effectué le lendemain de l’étape 3.3.- Soulevez chaque construction à l’interface air-liquide (ALI) en retirant les déchets de médias de la chambre haute seulement. Utilisez une pipette manuelle pour vous rapprocher le plus possible de la couche épidermique sans la toucher ni l’endommager.
- Inclinez légèrement la plaque à différents angles pour collecter le support. Supprimez autant de médias que possible dans cette étape. Ajouter environ 2 mL d’eau stérile aux puits environnants dans la plaque pour maintenir une humidité constante; garder les puits remplis d’eau tout au long de la culture.
- Vérifiez la plaque quelques h plus tard pour vous assurer que les kératinocytes sont toujours à l’interface air-liquide. S’il y a des médias à la Chambre haute, retirez-le. Gardez une trace de la quantité de milieu retirée pour chaque puits VHSE (le volume initial des chambres supérieure et inférieure (1500 μL) - média retiré = un bon point de départ pour l’alimentation ALI).
NOTA : Les VHSE ne nécessitent pas nécessairement le même niveau de support pour le transport d’air; habituellement, si les VHSE sont ensemencés ensemble, ils ont besoin d’environ le même niveau de support pour le transport aérien, mais ce n’est pas toujours le cas. Ajustez les volumes selon vos besoins pour maintenir ALI, mais assurez-vous que les niveaux de support ne sont pas si bas que les VHSE se dessèchent. Il est plus sûr d’être prudent et d’enlever quotidiennement les petites quantités de milieux jusqu’à ce qu’un équilibre entre le transport de l’air et l’hydratation soit atteint.
- ALI Jour 2 (ALI2)
- À partir de ce moment, n’utilisez que des milieux HSE sans sérum complétés par de l’acide L-ascorbique de 100 μg/mL. Changer de média le jour 2 d’ALI (ALI2). S’il y a un support dans la chambre supérieure, retirez-le et ajoutez-le à la quantité de média retiré enregistré précédemment. Calculez le volume de support nécessaire à l’aide de l’équation de l’étape précédente. Par exemple : Si 200 μL de milieu ont été retirés de la chambre haute, ajoutez 1300 μL pour établir la LAI (comme 1500 μL - 200 μL = 1300 μL)
- Utilisez le volume calculé pour charger dans la chambre inférieure de chaque puits, puis replacez la plaque dans l’incubateur de cellules. Gardez une trace du volume utilisé par jour. Lors de l’utilisation des quantités de collagène recommandées dans des inserts de culture à 12 puits, la plage habituelle de valeurs ALI se situe entre 750 μL et 1300 μL. En règle générale, le volume diminue au cours de la maturation de la culture et devient cohérent vers les semaines 2/3 de l’ALI. Selon les spécificités de la culture, ce nombre peut changer et doit être optimisé (comme décrit dans 3.4.2 - 4.1).
4. Entretien de routine de l’équivalent de la peau humaine vasculaire
- Du jour 3 de l’ALI (ALI3) jusqu’au critère d’effet de la culture : Renouveler le milieu de la chambre inférieure tous les 2-3 jours en utilisant un milieu HSE sans sérum avec 100 μg/mL d’acide L-ascorbique. Continuer d’ajuster et de suivre le niveau de support nécessaire dans la chambre inférieure pour ALI, comme décrit à l’étape 3.5.2.
- Comme la surface épidermique doit rester en contact avec l’air, vérifiez et ajustez quotidiennement le niveau du support jusqu’à ce que des niveaux constants d’AAA soient établis. La couche épidermique doit avoir l’air hydratée, pas sèche, mais il ne doit pas y avoir de médias regroupés au-dessus de la construction. Les cultures avec 8 semaines d’ALI ont fourni la morphologie et l’expression les plus cohérentes ; cependant, selon l’application, des cultures de 4 à 12 semaines peuvent être appropriées. La durée de la culture pour différentes conditions cellulaires et de culture peut devoir être optimisée.
REMARQUE: Changer de média lundi, mercredi, vendredi est une bonne pratique. Les VHSE sont en bonne santé au cours du week-end, mais les médias devraient être changés tôt le lundi et tard le vendredi. Après avoir entièrement terminé les étapes 1 à 4, la génération d’un VHSE est terminée. Les étapes 5-fin du protocole sont des techniques de traitement et d’imagerie facultatives qui ont été optimisées pour ce type de construction 3D.
5. Fixation et perméabilisation des constructions 3D
Remarque : Étape 5 a été optimisée pour les techniques d’imagerie spécifiques à cette construction 3D qui sont décrites dans le reste du protocole. Les étapes suivantes ne sont pas nécessaires pour générer un VHSE.
- Fixation/perméabilisation
- Retirez soigneusement tous les milieux des chambres supérieures et inférieures de chaque puits au point final de la période de culture.
REMARQUE: La couche épidermique est peut-être fragile, manipuler avec soin et ne pas agiter l’épiderme avec un pipetage agressif. - Ajouter 4 % de paraformaldéhyde (PFA) dans le PBS (pH 6,9) à la paroi supérieure de la chambre (pas directement sur la construction), puis à la chambre inférieure, pour pré-fixer chaque construction. Ajouter 1 mL par chambre et exposer pendant 5 min à température ambiante.
ATTENTION: La PFA est dangereuse et doit être manipulée avec soin et avec un équipement de protection individuelle (EPI) approprié, y compris une protection oculaire. - Retirer la solution de PFA à 4 % après 5 min et ajouter la solution de Triton X 100 à 0,5 % dans une solution de PFA à 4 % aux chambres supérieure et inférieure comme décrit à l’étape précédente. Exposer pendant 1 heure à température ambiante; La construction VHSE ne nécessite plus d’environnement stérile.
- Après 1 heure, retirez soigneusement la solution de perméabilisation/fixation des deux chambres et lavez l’échantillon 3 fois avec 1x PBS.
- Entreposer les échantillons dans du PBS dans une réfrigération à 4 °C ou les colorer immédiatement. Pour stocker les échantillons, enveloppez le plat dans une pellicule de plastique, puis foil pour minimiser l’évaporation et l’exposition à la lumière
NOTA : Point de pause - Après fixation et perméabilisation, cette procédure peut être suspendue puisque les échantillons sont stables pendant plusieurs semaines s’ils sont préparés comme indiqué à l’étape 5.1.5. Alternativement, la coloration (telle que décrite à l’étape 6) peut être effectuée immédiatement après l’étape 5.
- Retirez soigneusement tous les milieux des chambres supérieures et inférieures de chaque puits au point final de la période de culture.
6. Coloration immunofluorescente des constructions 3D
- Préparation de la construction
REMARQUE: Les VHSEs se colorent bien lorsqu’ils sont séparés de la membrane poreuse de l’insert de culture; la séparation de la membrane est également nécessaire pour l’imagerie non obstruée et permet des volumes réduits pour la coloration.- Pour préparer la construction à la coloration immunofluorescente, tournez un insert à l’envers et placez-le sur son puits sur la plaque du puits (si le VHSE tombe, il tombera dans le puits avec du PBS)(Figure supplémentaire 1A).
- Stabiliser l’insert d’une main sur le puits tout en utilisant des pinces à pointe fine et / ou un couteau de précision pour couper environ la moitié de la circonférence de la membrane d’insertion. Coupez le plus près possible du boîtier en plastique avec une main douce pour éviter d’endommager la construction VHSE.
- À l’aide de la pince à pointe fine, saisissez le bord du rabat de membrane coupé et décollez doucement la membrane poreuse de l’insert ainsi que la construction VHSE. Faites-le très soigneusement et lentement pour éviter d’endommager la structure de construction VHSE. Si la construction VHSE se sépare facilement, elle devrait tomber dans le puits en dessous, si elle est coincée sur le côté de la chambre, utilisez la pince à pointe fine ou une petite scoopula pour la déplacer vers le puits. Soyez très attentif à la couche épidermique car elle est généralement fragile(figure supplémentaire 1A).
REMARQUE: Parfois, la membrane ne se détache pas facilement ou se détache en morceaux, si cela se produit, utilisez les outils pour séparer soigneusement la membrane et la construction VHSE. Assurez-vous que les VHSE ne se dessèchent pas pendant ce processus en trempant dans le PBS, si nécessaire. - Une fois que le VHSE est dans le puits, jetez tous les morceaux restants de la membrane d’insertion et gardez le boîtier de l’insert de culture dans chaque puits pour maintenir les VHSE en position immergée pendant la coloration.
- Coloration
NOTA : La coloration et la manipulation/manipulation et lavages associés doivent être effectués aussi doucement que possible, car les ESSV peuvent être fragiles. Si des parties de l’épiderme décollent, les morceaux peuvent être colorés séparément; les couches supérieures de l’épiderme sont fragiles et passent par la desquamation naturelle4, mais pour l’analyse, il est important de maintenir l’intégrité autant que possible.- Préparer les taches d’anticorps primaires choisies dans 700 μL de tampon de blocage par puits de construction (généralement, tous les anticorps primaires peuvent être dans la même solution de coloration, mais cela devrait être confirmé pour les nouveaux anticorps). 700 μL fonctionne pour une taille de 12 puits, mais peut être ajusté pour d’autres formats de culture. Les concentrations recommandées d’anticorps primaires et secondaires avec recette de tampon de blocage sont indiquées dans le tableau 3 (une optimisation peut être nécessaire).
- Retirez tout PBS du puits à l’aide d’une pipette manuelle, veillez à l’éloigner des VHSE (comme les VHSE flottent, l’aspiration sous vide n’est pas recommandée).
- Ajouter la solution de coloration primaire à chaque puits et placer le boîtier de l’insert de culture dans le puits pour maintenir le VHSE immergé dans le fluide(figure supplémentaire 1B). Enveloppez la plaque de puits avec une pellicule de plastique. Feuille et coloration pendant 48 h dans une réfrigération à 4 °C sans agitation ni bascule (le balancement peut endommager la construction VHSE).
- Après 48 h, préparer des anticorps secondaires et des taches chimiques dans 700 μL de tampon de blocage (par puits).
- Retirez le boîtier de l’insert de culture et la solution de coloration primaire et lavez avec 1x PBS, 3x pendant 5 min avant d’ajouter la solution de coloration secondaire. Replacez le boîtier d’insertion de culture dans le puits pour garder la construction VHSE immergée(figure supplémentaire 1B). Exposer pendant 48 h dans une réfrigération à 4 °C sans agitation ni balancement.
- Après une exposition de 48 h, retirer la solution de coloration avec un pipettor manuel et laver doucement 3x avec du PBS; ne pas pipetter le liquide directement sur les VHSE car ils peuvent être fragiles. Réhydrater avec l’excès de PBS et replacer le boîtier d’insert de culture dans le puits pour garder le VHSE immergé et hydraté pendant l’entreposage (conserver en l’enveloppant dans une pellicule de plastique et une feuille pour minimiser l’évaporation et l’exposition à la lumière)
- Effacement (facultatif &terminal)
Remarque : la compensation est facultative pour l’imagerie. Si elle est terminée, elle doit être effectuée après la coloration ou l’imagerie complète de l’échantillon, car l’élimination empêche toute coloration supplémentaire, peut altérer les performances des fluorophores et peut endommager la structure VHSE. Plusieurs méthodes de nettoyage des tissus existent49,61,62 et peuvent être optimisées pour des projets spécifiques. L’élimination du salicylate de méthyle, décrite ci-dessous, est à la fois simple et efficace pour le VHSE. La technique de nettoyage suivante doit être effectuée dans des récipients en verre et les pointes de pipette doivent être en verre ou en polypropylène (le polystyrène se dissoudra au contact du salicylate de méthyle). Effectuez toutes les procédures de déblaiement dans un endroit bien ventilé ou dans une hotte.- Ajoutez 100% méthanol à un petit récipient en verre peu profond (les boîtes de Petri en verre fonctionnent bien). Utilisez le plus petit contenant possible qui s’adaptera à la construction (pour minimiser les déchets de réactifs).
- Retirer la construction de la plaque du puits à l’aide d’une pince ou d’une scoopula(figure supplémentaire 1C)et la placer dans le contenant rempli de méthanol. Ajouter plus de méthanol si la construction n’est pas submergée.
- Déshydrater la construction VHSE dans du méthanol pendant 3 x 10 min d’immersions; remplacer complètement le méthanol après chaque immersion et retirer rapidement le méthanol après le dernier bain. Au cours de cette procédure, la construction peut devenir plus opaque et rétrécir légèrement.
REMARQUE: Ces durées et répétitions ont été optimisées, mais le méthanol et les procédures suivantes de salicylate de méthyle peuvent devoir être personnalisées, en fonction du format de culture spécifique et des taches. - Immédiatement après avoir retiré le méthanol, ajouter le salicylate de méthyle et submerger le VHSE en immersions de 5 x 5 minutes. Remplacer complètement le réactif après chaque immersion et laisser le VHSE dans la 5ème solution d’immersion pour le stockage. Au cours de cette procédure, la construction devient transparente.
- Imagez la construction ou le magasin à 4 °C. Après le nettoyage, complétez toute l’imagerie dès que possible, car les fluorophores peuvent se dégrader dans le salicylate de méthyle en quelques jours. L’effacement rend les constructions fragiles et le stockage prolongé, bien que non recommandé, nécessite une vérification régulière pour s’assurer qu’il y a une quantité suffisante de salicylate de méthyle.
7. Imagerie confocale des constructions 3D
REMARQUE: L’imagerie par culture tissulaire plastique ne donnera pas la même qualité d’image que l’imagerie à travers du verre de couverture, cette méthode décrit la fabrication d’un puits de fond de verre personnalisé pour empêcher le séchage pendant l’imagerie confocale. Typiquement, ceci est suffisant pour au moins 3 h d’imagerie.
- Deux jours avant l’imagerie : préparer le polydiméthylsiloxane (PDMS)
- Préparer PDMS48,63,64 à une concentration suggérée de [9:1], base : réticulation. Préparer 30 g de PDMS au total: 27 g de composant de base et 3 g de réticulation. Placez tout récipient de mélange propre sur une balance de pesée et tarez la balance. Ajouter la base (27 g), puis ajouter le réticule (3 g) pour obtenir un total de 30 g. Ajoutez toujours une base avant le réticulation.
- Remuer vigoureusement la solution pendant au moins 4 min; cela va créer de petites bulles. Après un mélange suffisant, versez le PDMS dans une boîte de Petri de 100 mm ou dans un récipient similaire résistant à la chaleur à fond plat.
- Démentez le PDMS dans une chambre à vide jusqu’à ce que toutes les bulles du mélange disparaissent et que le PDMS soit clair. Relâchez le vide lentement et retirez le PDMS (lentement). Placer le plat dans un four pour le faire durcir pendant la nuit (50-60 °C); assurez-vous que le plat est à plat pour que PDMS guérisse uniformément.
REMARQUE: Après le durcissement, PDMS doit être clair et la surface doit être lisse et non collante (l’adhérence peut indiquer un mélange inadéquat).
- Un jour avant l’imagerie : préparation du puits PDMS
- À l’aide d’un poinçon en acier ou d’un couteau de précision portatif, poinçonner ou découper un puits circulaire à partir de la feuille PDMS préparée en 7.1. Le puits doit être à peu près de la même taille que la construction VHSE. Coupez une tache carrée autour du puits circulaire pour créer un seul puits PDMS. La quantité de PDMS de 30 g préparée devrait donner au moins quatre puits personnalisés.
Remarque : le puits PDMS doit être proche de la taille de la construction VHSE. Il doit restreindre le mouvement de l’échantillon pendant l’imagerie. Plusieurs puits peuvent être fabriqués à la fois et stockés indéfiniment dans un récipient propre. - À l’aide d’une lame de couverture en verre d’une taille similaire à celle du puits PDMS, ajoutez de la colle cyanoacrylate (p. ex. super colle) à la surface inférieure du PDMS (la surface lisse qui était en contact avec la boîte de Petri) et étalez uniformément avec une pointe de pipette jetable. Centrez et appuyez bien sur le PDMS sur le verre tout en laissant une fenêtre en verre transparent dans le cercle perforé (assurez-vous que la colle n’est pas maculée sur la fenêtre de visualisation).
REMARQUE: Si disponible, la liaison plasma du PDMS à la lamelle de couverture est une alternative65,66,67. - Laissez sécher la colle pendant plusieurs heures, ou pendant la nuit, avant de l’utiliser. Ceux-ci sont réutilisables jusqu’à ce qu’ils rompent de l’usure normale.
REMARQUE: Il n’est pas recommandé de colorer les échantillons dans le PDMS collé bien utilisé pour l’imagerie. Ces puits retiennent le fluide pendant plusieurs heures, mais peuvent fuir pendant une coloration plus longue.
- À l’aide d’un poinçon en acier ou d’un couteau de précision portatif, poinçonner ou découper un puits circulaire à partir de la feuille PDMS préparée en 7.1. Le puits doit être à peu près de la même taille que la construction VHSE. Coupez une tache carrée autour du puits circulaire pour créer un seul puits PDMS. La quantité de PDMS de 30 g préparée devrait donner au moins quatre puits personnalisés.
- Imagerie VHSE
REMARQUE : Si l’imagerie des échantillons n’a pas été pris en clair, utilisez pbs comme solution d’imagerie. Si l’imagerie avec des échantillons effacés, utilisez le salicylate de méthyle (ou la solution de nettoyage choisie) comme solution d’imagerie.- Ajoutez quelques gouttes de solution d’imagerie dans le puits PDMS et vérifiez les fuites (s’il y a une fuite, réparez-la avec un point / frottis de super colle cyanoacrylate ou utilisez un autre puits).
- Conservez bien la solution d’imagerie dans le PDMS lors de l’ajout du VHSE. À l’aide d’une scoopula ou d’une pince à pointe fine(figure supplémentaire 1C),retirez la construction de la plaque de 12 puits et placez-la dans le puits PDMS sur la lamelle de couverture en verre. Placez la construction avec l’orientation d’intérêt tournée vers l’objectif. Par exemple, pour imager l’épiderme à l’aide d’un microscope inversé, assurez-vous que l’épiderme est tourné vers le bas, vers le verre.
- Alternativement, pour un microscope droit, faites face à l’épiderme vers le haut. Les procédures d’imagerie ci-dessous sont décrites pour un microscope inversé, mais pourraient être facilement adaptées pour un montant.
REMARQUE: Soyez prudent lorsque vous manipulez le VHSE pour éviter tout dommage. Transférer sur la plaque de puits au cas où le VHSE tomberait. Une scoopula à pointe plate et tonte est le moyen le plus simple de transférer la construction(figure supplémentaire 1C).
- Alternativement, pour un microscope droit, faites face à l’épiderme vers le haut. Les procédures d’imagerie ci-dessous sont décrites pour un microscope inversé, mais pourraient être facilement adaptées pour un montant.
- Assurez-vous que l’échantillon est assis à plat dans le puits et qu’aucune partie de l’épiderme ou du derme n’est pliée sous l’échantillon. En cas de pliage, manipuler doucement l’échantillon avec une pince ou une scoopula; l’ajout temporaire d’une solution d’imagerie supplémentaire pour faire flotter le VHSE peut l’aider à se redresser. Le pliage ou le plissement de l’échantillon peut être vu à l’œil nu ou à l’aide du microscope.
- Remplissez le puits avec une solution d’imagerie, en utilisant juste assez de liquide pour garder l’échantillon hydraté; trop de liquide fera flotter l’échantillon, ce qui entraînera un mouvement pendant l’imagerie. La construction doit être assise sur la fenêtre d’observation en verre; tester le mouvement en inclinant bien le PDMS. S’il y a du mouvement, retirez un peu de liquide; ajouter et enlever le liquide goutte sage jusqu’à ce que le mouvement s’arrête.
- Placez une lame de verre sur le puits pour minimiser l’évaporation pendant l’imagerie(figure supplémentaire 1D). Pour les séances d’imagerie plus longues, vérifiez fréquemment l’échantillon pour vous assurer des niveaux de liquide appropriés. Si elle est accessible, une chambre humidifiée pendant l’imagerie peut être utilisée (bien que ce ne soit généralement pas nécessaire).
- Placez l’échantillon sur l’étage du microscope et l’image à travers la fenêtre de lamelle en verre(figure supplémentaire 1D). Cette technique permet au moins 3 h d’imagerie confocale continue, mais l’hydratation de l’échantillon doit être vérifiée régulièrement, avec une solution d’imagerie ajoutée en cas de besoin.
REMARQUE: Si l’échantillon est nettoyé, le salicylate de méthyle dégradera la colle au fil du temps. La liaison de colle du PDMS peut être réappulée entre les exécutions d’imagerie; ou l’échantillon peut être transféré périodiquement dans de nouveaux puits. Dans les puits avec liaison plasma, ce ne sera pas un problème. - Après l’imagerie, faire flotter l’échantillon avec du liquide d’imagerie autant que possible dans le puits. Utilisez une scoopula ou une pince à pointe fine pour transférer l’échantillon dans son puits de stockage. Effectuez le transfert sur une plaque de puits au cas où l’échantillon tomberait.
- Chaque puits PDMS et chaque lamelle de verre supérieure peuvent être réutilisés jusqu’à ce qu’ils se cassent. Nettoyez le verre du fond avant l’imagerie, à l’intérieur et à l’extérieur du puits. Avant de la réutilisation, vérifiez toujours les fuites et réparez avec de la colle, au besoin.
- Stocker les échantillons comme décrit à l’étape 6.3.6 et ajouter du PBS tous les quelques mois pour les maintenir; si les échantillons sont nettoyés, conserver dans le verre à l’aide de salicylate de méthyle et vérifier les niveaux régulièrement. Les échantillons éliminés peuvent se dégrader rapidement (en quelques jours) et doivent être essiés dès que possible.
Résultats
Ici est présenté un protocole pour la génération d’équivalents cutanés humains vascularisés in vitro (VHSE) utilisant des kératinocytes immortalisés par transcriptase inverse de la télomérase (TERT) (N/TERT-120,59),des fibroblastes cutanés humains adultes (hDF) et des cellules endothéliales microvasculaires humaines (HMEC-1)(figure 1). En outre, la nature personnalisable de ce protocole est mise en évidence en démontrant également la génération et la stabilité de VHSE lors de l’utilisation de fibroblastes pulmonaires couramment disponibles (IMR90) au lieu de hDF. La génération du VHSE est terminée aux étapes 1 à 4, tandis que les étapes 5 à 7 sont des techniques de traitement et d’imagerie de point de fin facultatives qui ont été optimisées pour ces VHSE. Il est important de noter que les VHSE peuvent être traités selon des questions de recherche spécifiques et que les étapes 5 à 7 ne sont pas nécessaires pour générer la construction. L’imagerie volumétrique, l’analyse et les rendus 3D ont été réalisés pour démontrer une méthode d’analyse volumétrique. Ces protocoles de préparation de construction volumétrique et d’imagerie préservent la structure VHSE aux niveaux microscopique et macroscopique, permettant une analyse 3D complète.
La caractérisation de l’épiderme et du derme montre des marqueurs immunofluorescents appropriés pour la peau humaine dans les constructions VHSE (Figure 2,3). La cytokératine 10 (CK10) est un marqueur kératinocytes de différenciation précoce qui marque généralement toutes les couches suprabasales dans les équivalents cutanés18,30,68 (Figure 2). L’involucrine et la filaggrine sont des marqueurs de différenciation tardive dans les kératinocytes et marquent les couches suprabasales les plus élevées dans les équivalents cutanés12,30,68,69 (figure 2). Un colorant nucléaire fluorescent à rouge lointain (voir la liste des matériaux) a été utilisé pour marquer les noyaux dans l’épiderme et le derme, le col IV marquant la vascularisation du derme(figure 2, figure 3, figure 4). Les composants épidermiques de la membrane basale (BM) ne sont pas toujours correctement exprimés dans les cultures HSE15,16; et la souillure du col IV du BM n’est pas uniformément observée utilisant ce protocole. Les composants et la structure de la bm axés sur la recherche bénéficieraient d’une optimisation supplémentaire des milieux, des cellules et de l’imagerie14.
Bien que l’imagerie confocale à travers la majeure partie des cultures VHSE donne souvent des images à haute résolution qui sont suffisantes pour l’analyse computationnelle du derme et de l’épiderme, la méthode de dégagement décrite permet une imagerie tissulaire plus profonde. L’effacement améliore la profondeur de pénétration du laser confocale, et une imagerie efficace dans les VHSE peut être obtenue à plus de 1 mm pour les échantillons nettoyés (par rapport à ~ 250 μm pour les échantillons non nettoyés). La technique de compensation décrite (déshydratation au méthanol et salicylate de méthyle) correspond suffisamment à l’indice de réfraction dans l’ensemble du tissu échantillon de VHSE61. L’effacement du VHSE a permis une imagerie simple à travers l’ensemble de la construction sans manipulation (par exemple, réorienter la construction pour imager le derme et l’épiderme séparément)(figure 3).
Les images volumétriques permettent de générer un rendu 3D pour cartographier la vascularisation dans chaque construction (Figure 4). Brièvement, des ensembles d’images confocales ont été pris dans l’orientation cutanée à épidermique de plusieurs sous-volumes de VHSEs pour détecter la tache de collagène IV (marquage des parois de navire) et les noyaux (marqués par un colorant nucléaire fluorescent extrême-rouge). Les piles d’images sont chargées dans un logiciel de calcul (voir la liste des matériaux) et un algorithme personnalisé (basé sur ces sources 48,70,71,72,73,74,75)est utilisé pour le rendu et la quantification 3D comme décrit précédemment48. Cet algorithme segmente automatiquement la composante vasculaire en fonction de la tache Col IV. La segmentation volumétrique est transmise à un algorithme de squelettisation basé sur la marche rapide75,76,77. La squelettisation trouve le centre définitif de chaque vaisseau marqué col IV et les données résultantes peuvent être utilisées pour calculer le diamètre du vaisseau ainsi que la fraction vasculaire (Figure 4). La microscopie fluorescente à large champ est une option accessible si la microscopie à balayage laser n’est pas disponible; le réseau vasculaire et l’épiderme peuvent être microscopés à large champ par microscopie fluorescente(figure supplémentaire 2). La quantification tridimensionnelle est possible en utilisant l’imagerie à large champ des VHSEs plutôt que la microscopie à balayage laser, bien qu’elle puisse nécessiter plus de filtrage et de déconvolution des images en raison de la lumière hors plan.
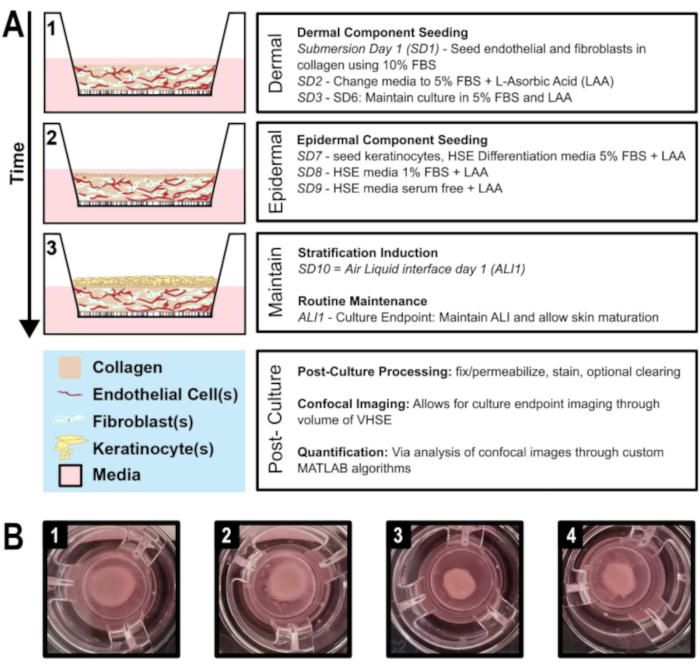
Figure 1: Chronologie schématique de la génération d’équivalent de la peau humaine vascularisée. A) Montre la progression du modèle VHSE à partir de 1) l’ensemencement des composants cutanés, 2) l’ensemencement des kératinocytes sur le composant cutané, 3) la stratification épithéliale via l’interface air-liquide et le maintien de la culture. Le traitement post-culture et l’imagerie volumétrique peuvent être effectués au point final de la culture. B) Images de caméra de la macrostructure VHSE hDF dans les inserts de culture à leur extrémité de culture, 8 semaines. Divers niveaux de contraction sont normaux pour les VHSEs; la contraction peut être réduite comme le protocole décrit. (1 & 2) Moins d’échantillons contractés. (3 & 4) Plus d’échantillons contractés donnent encore des éléments de peau appropriés. Veuillez cliquer ici pour voir une version plus grande de cette figure.
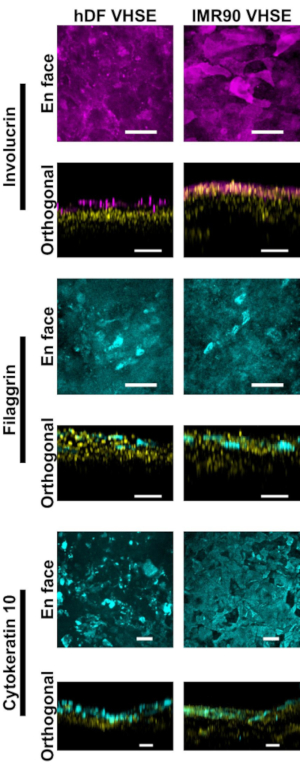
Figure 2: Caractérisation épidermique par marqueurs immunofluorescents. Toutes les images ont été prises de VHSEs au point de temps de culture 8wk par l’intermédiaire de la microscopie confocal. Les méthodes de coloration correspondantes sont décrites à l’étape 6 du protocole. Des marqueurs épithéliaux appropriés sont présents dans les VHSEs hDF (colonne de gauche) et les VHSEs IMR90 (colonne de droite). L’involucrine et le filaggrin sont des marqueurs de différenciation en retard des keratinocytes et démontrent que l’épiderme est entièrement stratifié dans les deux types de VHSE. Cytokeratin 10 est un marqueur tôt de différenciation qui identifie des couches suprabasal dans les VHSEs. Les noyaux sont représentés dans les vues orthogonales en jaune. Les images de projection en face et orthogonale max ont été rendues via un logiciel de calcul; Les images sont mises à l’échelle individuellement avec soustraction d’arrière-plan et filtrage médian pour plus de clarté. Les barres d’échelle sont de 100 μm (les anticorps primaires et secondaires avec la recette interne de tampon de blocage sont donnés dans le tableau 3). Veuillez cliquer ici pour voir une version plus grande de cette figure.
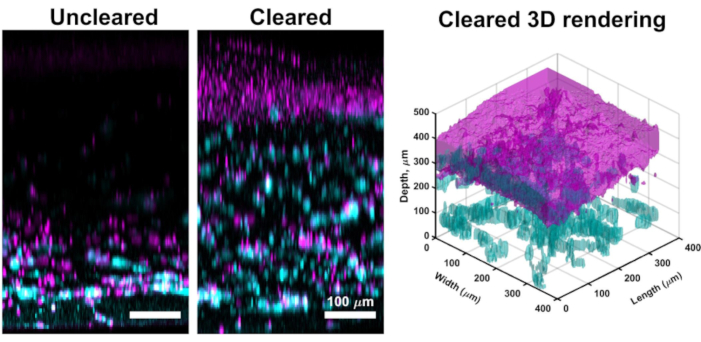
Figure 3: Comparaison entre le VHSE non compensé et le VHSE non autorisé. Ce VHSE a été généré avec IMR90s et des images ont été prises au point de temps de culture 4wk par l’intermédiaire de la microscopie confocale. Le collagène IV est représenté en cyan; Les noyaux sont représentés en magenta; magenta dans le rendu 3D effacé représente la consolidation des noyaux dans la couche épidermique du VHSE. L’image VHSE non clarifiée est un exemple d’atténuation laser dans des constructions VHSE plus épaisses, grâce à la compensation (méthanol et salicylate de méthyle) l’ensemble de la construction peut être ifcomie avec peu ou pas d’atténuation laser du côté cutané de la construction. Des configurations d’imagerie comprenant la ligne de laser, le gain, et le trou d’épingle ont été abaissées pour VHSE dégagé pour réduire la sursaturation. L’effacement et l’imagerie ont été effectués comme décrit aux étapes 6 et 7 du protocole. Les images de projection maximale orthogonale et le rendu 3D ont été complétés avec un logiciel de calcul, le rendu 3D a été généré à partir d’images de construction effacées. Les images sont mises à l’échelle individuellement avec soustraction d’arrière-plan et filtrage médian pour plus de clarté. Les barres d’échelle sont de 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
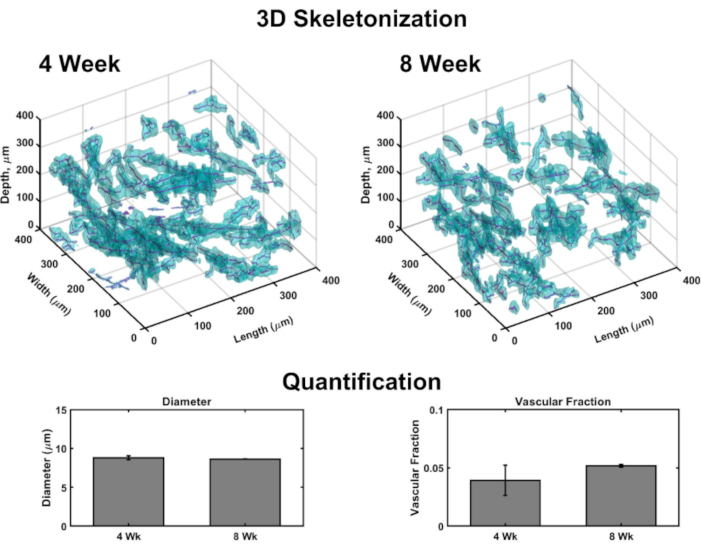
Figure 4: Analyse tridimensionnelle de la vascularisation au sein des ESSV. Les images volumétriques prises par microscopie confocale permettent la quantification des paramètres vasculaires aux paramètres de culture grâce à l’analyse d’image computationnelle. À partir des sous-volumes VHSE, la détection de la coloration du collagène IV (cyan) marque les parois endothéliales de la vascularisation et permet la segmentation vasculaire basée sur l’emplacement du collagène IV; les données de segmentation sont ensuite squelettées, et le centre de chaque vaisseau est trouvé (magenta). Des exemples de squelettisation 3D sont montrés pour des échantillons IMR90 VHSE de 4 semaines et 8 semaines, non effacés. Les données résultantes d’un ensemble d’expériences IMR90 VHSE ont été utilisées pour calculer les diamètres des vaisseaux et les fractions vasculaires pour quatre sous-volumes (chacun de 250 μm dans la direction z) dans chaque construction, les données ont été moyennées par VHSE et en moyenne par point de temps de culture. Ces données montrent l’homéostasie de réseau vasculaire couvrant des durées de culture de 4 et 8 semaines avec des diamètres pertinents pour la peau humaine in vivo78,et la fraction vasculaire dans le même ordre que la peau humaine in vivo79 (la fraction vasculaire dans des constructions de collagène s’est avérée personnalisable48 et pourrait être encore optimisée pour des valeurs accrues). Les données sont présentées comme des moyennes ± moyenne d’erreur type (S.E.M); n = 3 pour chaque point de temps. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| média | Composants |
| Lignée cellulaire de fibroblastes cutanés humains (hDF) | DMEM HG |
| 5 % de sérum fœtal bovin (SBF) | |
| 1 % pénicilline/streptomycine (P/S) | |
| Lignée cellulaire de fibroblastes IMR90 | F12 DE DMEM/HAM 50:50 |
| 10% FBS | |
| 1 % P/S | |
| Lignée cellulaire endothéliale HMEC-1 | MCDB131 Support de base |
| 10% FBS | |
| 1 % P/S | |
| L-Glutamine [10 mM] | |
| Facteur de croissance épidermique (FEM) [10 ng/mL] | |
| Hydrocortisone [10 μg/mL] | |
| Lignée cellulaire n/TERT-1 des kératinocytes | Base de médias K-SFM |
| 1 % P/S | |
| Extrait hypophysaire bovin (BPE) [25 μg/mL], du kit de supplément K-SFM | |
| Facteur de croissance épidermique (EGF) [0,2 ng/mL], du kit de supplément K-SFM | |
| CaCl2 [0,3 mM] | |
| Différenciation de l’équivalent de la peau humaine (HSE) | 3:1 DMEM: Ham’s F12 |
| 1 % P/S | |
| 0,5 μM d’hydrocortisone | |
| 0,5 μM d’isoprolénol | |
| 0,5 μg/mL d’insuline |
Tableau 1 : Recettes médiatiques. Des recettes médiatiques pour la culture 2D des fibroblastes cutanés humains, des fibroblastes IMR90, des kératinocytes HMEC-1 et N/TERT-1 sont administrées. Ces recettes ont été utilisées pour élargir les lignées cellulaires avant de générer des SSE. Les milieux de différenciation équivalents à la peau humaine (HSE) sont utilisés pour générer des VHSE; une recette de base est donnée, pendant les parties de la culture de submersion et de l’induction de la stratification, des quantités effilées de FBS doivent être ajoutées comme décrit à l’étape 3 du protocole. Recette HSE basée sur ces sources11,80.
| Concentration en stock de collagène( Cs) : | 8 | mg/mL | ||
| Volume souhaité(Vf): | 1 | Ml | ||
| Normalisation de l’ajustement NaOH* : | 1 | X | ||
| *Chaque lot de collagène doit être testé pour déterminer la quantité de NaOH nécessaire pour régler le pH 7 - 7,4 | ||||
| Concentration de collagène souhaitée (mg/mL) | ||||
| 2 | 3 | 4 | 5 | |
| PBS 10X (Vpbs) | 0.1 | 0.1 | 0.1 | 0.1 |
| Stock de collagène (Vs) | 0.25 | 0.375 | 0.5 | 0.625 |
| 1N NaOH (VNaOH) | 0.00575 | 0.008625 | 0.0115 | 0.014375 |
| Médias (Vmedia) | 0.64425 | 0.516375 | 0.3885 | 0.260625 |
Tableau 2: Tableau de référence du calcul du collagène. Le tableau de référence donne les concentrations de collagène couramment souhaitées calculées en supposant une concentration de 8 mg/mL de collagène et un volume final souhaité de 1 mL; toutes les valeurs sont en mL. Les équations utilisées pour calculer ces montants sont données à l’étape 2.2 du protocole. Il est important de vérifier le pH de chaque stock de collagène; si nécessaire, des quantités de NaOH doivent être ajoutées pour atteindre un pH de 7 à 7,4 (après l’ajout de PBS, de NaOH, de stock de collagène, de milieux). Le protocole a été optimisé pour les VHSEs utilisant une concentration de collagène de 3 mg/mL ; des changements dans la concentration de collagène peuvent être nécessaires pour différentes lignées cellulaires/résultats finaux souhaités48.
| Anticorps primaires | source | concentration | utiliser |
| Filaggrin (AKH1) souris IgG monoclonale | Santa Cruz; sc-66192 (200 μg/mL) | [1:250] | Marqueur de différenciation tardive15 |
| IgG polyclonale de lapin involucrine | Proteintech; 55328-1-AP (30 μg/150 μL) | [1:250] | Marqueur de différenciation terminale tardive15 |
| Cytokératine 10 (DE-K10) souris IgG, surnageant | Santa Cruz; sc-52318 | [1:350] | Marqueur épidermique suprabasal14,36,59 |
| Collagène IV lapin polyclonal | Proteintech; 55131-1-AP | [1:500] | Paroi vasculaire endothéliale67 |
| DRAQ 7 | Signalisation cellulaire; 7406 (0,3 mM) | [1:250] | Marqueur nucléaire |
| Anticorps secondaire | source | concentration | utiliser |
| Chèvre Anti-Lapin IgG DyLight™ 488 Conjugué | Invitrogen; 35552 (1 mg/mL) | [1:500] | Collagène IV secondaire |
| Anticorps IgG anti-lapin (H&L) (GOAT), DyLight™ 549 conjugué | Rockland Immunochemicals; 611-142-002 | [1:500] | Involucrine secondaire |
| IgG anti-souris de chèvre (H&L), DyLight™ 488 | Thermo Scientific; 35502 (1 mg/mL) | [1:500] | Filaggrin ou Cytokératine 10 secondaire |
| TAMPON DE BLOCAGE (500 mL) | |||
| Réactif | quantité | ||
| ddH2O | 450 mL | ||
| 10 x PBS | 50 mL | ||
| Albumine sérique bovine (BSA) | 5 g | ||
| Préadolescent 20 | 0,5 mL | ||
| Gélatine de poisson d’eau froide | 1 g | ||
| Azide de sodium (10% d’azide de sodium dans le diH2O) | 5 mL (concentration finale de 0,1 %) | ||
Tableau 3 : Anticorps primaires et secondaires avec recette tampon bloquante. Les anticorps et les taches chimiques énumérés ont été utilisés pour la coloration illustrée à la figure 2, à la figure 3, à la figure 4. La coloration a été effectuée comme indiqué à l’étape 6 du protocole à l’aide de la recette de tampon de blocage répertoriée ici. Certaines optimisations des concentrations de coloration et de la durée peuvent être nécessaires en fonction des techniques de culture choisies et des lignées cellulaires.
Tableau supplémentaire 1 : Liste des abréviations. Liste d’abréviations incluses pour la commodité du lecteur. Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire 1: Aide technique VHSE pour la manutention. La manipulation des VHSEs est difficile particulièrement pendant la fixation, le traitement, et la souillure. A-D correspond aux instructions des étapes 5 à 7. A montre la manipulation technique de l’enlèvement de la membrane poreuse d’un insert de culture pour assurer une coloration appropriée. B montre comment garder chaque VHSE immergé pendant la coloration et le stockage. C montre le moyen le plus sûr et le plus simple de déplacer des constructions vers des puits d’imagerie PDMS. D montre un VHSE assis dans un puits d’imagerie PDMS: le puits PDMS est collé à une lame de verre sur le fond, créant une fenêtre pour l’imagerie, une lame de verre est placée sur le dessus pour maintenir l’humidité pendant de longues courses d’imagerie. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2: La microscopie à fluorescence à champ large standard peut être utilisée pour évaluer les ESV. L’imagerie à large champ peut être utilisée pour l’imagerie volumétrique pour l’évaluation de routine lorsque la microscopie à balayage laser n’est pas disponible. À titre d’exemple, l’imagerie des VHSEs des aspects apicaux et basolatéraux est représentée par des projections maximales en face et orthogonales (Ortho.). (Haut) L’épiderme a été céfré utilisant l’involucrine et les noyaux comme marqueurs. (En bas) La vascularisation cutanée a été iculée utilisant le collagène IV comme marqueur. Les images sont soustraites à l’arrière-plan pour plus de clarté. La lumière hors plan conduit aux artefacts de « stries » ou de « fusée éclairante » évidents dans les vues orthogonales. L’imagerie à large champ peut être utilisée pour la quantification, mais peut nécessiter plus de traitement d’image. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ce protocole a démontré une méthode simple et reproductible pour la génération de VHSEs et leur analyse tridimensionnelle. Il est important de faire en sorte que cette méthode repose sur quelques techniques ou pièces d’équipement spécialisées, ce qui la rend accessible à une gamme de laboratoires. De plus, les types de cellules peuvent être remplacés par des changements limités dans le protocole, ce qui permet aux chercheurs d’adapter ce protocole à leurs besoins spécifiques.
La gélification appropriée du collagène est une étape difficile dans l’établissement de la culture de la peau. Surtout lors de l’utilisation de préparations brutes sans purification, des contaminants traces pourraient influencer le processus de gélification. Pour aider à assurer la cohérence, des groupes d’expériences doivent être effectués avec le même stock de collagène qui sera utilisé pour la génération de VHSE. De plus, la gélification devrait idéalement se produire à un pH de 7-7,4, et les contaminants traces peuvent modifier le pH. Avant d’utiliser un stock de collagène, un gel acellulaire de pratique doit être fabriqué à la concentration souhaitée et le pH doit être mesuré avant la gélification. L’achèvement de ce contrôle de qualité du collagène avant de commencer l’ensemencement des composants cutanés permettra d’identifier les problèmes de gélification et d’homogénéité du collagène avant de mettre en place une expérience complète. Au lieu d’ensemencer du collagène acellulaire directement sur un insert de culture, ensemencez du collagène sur une bande de pH qui évalue toute l’échelle de pH et vérifie un pH de 7-7,4. La gélification peut être évaluée en appliquant une gouttelette de la solution de gel de collagène sur une plaque de couverture ou une plaque de puits en plastique de culture tissulaire (une plaque de puits est recommandée pour simuler les côtés confinés d’un insert de culture). Après le temps de gélification, le collagène doit être solide, c’est-à-dire qu’il ne doit pas s’écouler lorsque la plaque est inclinée. Sous microscopie à contraste de phase, le collagène doit être homogène et clair. Les bulles occasionnelles de l’ensemencement de collagène sont normales mais de grandes gouttes amorphes de collagène opaque dans le gel clair indiquent un problème-probable dû au mélange insuffisant, au pH erroné, et/ou au manque de garder le collagène refroidi pendant le mélange.
Les quantités d’ensemencement cellulaire et les milieux peuvent être ajustés. Dans le protocole ci-dessus, les quantités de cellules encapsulées ont été optimisées pour un insert de 12 puits à 7,5 x10 4 fibroblastes et 7,5 x10 5 cellules endothéliales par mL de collagène avec 1,7 x 105 kératinocytes ensemencés sur le dessus de la construction cutanée. Les densités cellulaires ont été optimisées pour ce protocole VHSE sur la base des études préliminaires et des recherches précédentes portant sur la génération de réseaux vasculaires 3D dans diverses concentrations de collagène48 et la génération HSE22,80,81. Dans des systèmes similaires, les densités cellulaires endothéliales publiées sont de 1,0 x 106 cellules/mL de collagène48; les concentrations en fibroblastes vont souvent de 0,4 x10 5 cellules/mL de collagène22,28,82 à 1 x 105 cellules/mL de collagène8,58,83,84,85; et les concentrations de kératinocytes vont de 0,5 x 105 [cellules/cm2]80 à 1 x 105 [cellules/cm2]8. Les densités cellulaires peuvent être optimisées pour des cellules spécifiques et des questions de recherche. Les cultures tridimensionnelles avec des cellules contractiles, telles que les fibroblastes, peuvent se contracter conduisant à une réduction de la viabilité et à une perte de culture86,87. Des expériences préliminaires doivent être réalisées pour tester la contraction du compartiment cutané (qui peut se produire avec plus de cellules cutanées, plus de cellules cutanées contractiles, des cultures de submersion plus longues ou des matrices plus douces) et pour tester la couverture de surface épidermique. En outre, le nombre de jours dans la submersion et le taux de réduction progressive de la teneur en sérum peuvent également être personnalisés si une contraction cutanée excessive se produit ou si un taux différent de couverture des kératinocytes est requis. Par exemple, si une contraction est remarquée pendant la période de submersion cutanée ou pendant que les kératinocytes établissent une monocouche de surface, se déplacer plus rapidement dans le processus de rétrécissement du sérum et augmenter les VHSEs à ALI peut aider à prévenir une contraction supplémentaire. De même, si l’assurance de keratinocyte n’est pas idéale, changer le nombre de jours que le VHSE est submergé sans sérum peut aider à augmenter la couverture épidermique de monocouche et atténuer la contraction puisque le sérum est laissé de court. Les changements dans les densités cellulaires ou d’autres suggestions ci-dessus doivent être optimisés pour les cultures et les objectifs de recherche spécifiques.
Pour établir une stratification appropriée de l’épiderme pendant la période d’interface air-liquide (AAA), il est essentiel de vérifier et de maintenir régulièrement les niveaux de liquide dans chaque puits afin que l’ALI et l’hydratation appropriée de chaque construction soient conservées tout au long de la culture. Les niveaux de média doivent être vérifiés et suivis quotidiennement jusqu’à ce que des niveaux d’AAA cohérents soient établis. La couche épidermique doit avoir l’air hydratée, pas sèche, mais il ne doit pas y avoir de piscines de milieux sur la construction. Pendant ALI, la construction développera une couleur opaque blanc / jaune qui est normale. La couche épidermique se développera probablement de manière inégale. Généralement, les VHSEs sont inclinés en raison de l’ensemencement du collagène ou de la contraction cutanée. Il est également normal d’observer une partie épidermique plus élevée au milieu de la construction dans des constructions plus petites (taille de 24 puits) et une formation de crête autour du périmètre du VHSE dans la taille de 12 puits. La contraction des constructions13 peut modifier ces formations topographiques, et/ou ne peut pas être observée du tout.
La coloration et l’imagerie des VHSEs introduisent la manipulation mécanique aux VHSEs. Il est très important de planifier et de limiter la manipulation de chaque culture. Lorsque la manipulation est nécessaire, maintenir des mouvements doux lors de l’élimination des ECHSE des membranes d’insertion, lors de l’ajout de solutions de coloration ou de lavage à la surface de construction, et lors du retrait et du remplacement des VHSE dans leurs puits de stockage / d’imagerie pendant la préparation de l’imagerie. Plus précisément, les couches apicales du composant épidermique peuvent être fragiles et risquent de s’écasser des couches épidermiques basales. Les couches apicales de l’épiderme sont fragiles et passent par la desquamation même dans les tissus natifs4, mais pour une analyse précise de la structure épidermique, il est important de minimiser les dommages ou la perte. Si les couches épidermiques soulèvent la construction, elles peuvent être es imageées séparément. Les couches basales de l’épiderme sont très probablement encore attachées au derme tandis que des parties des couches apicales peuvent se détacher. Pour la visualisation de l’épiderme, une tache nucléaire est utile en observant ceci puisque les noyaux denses sont une caractéristique des couches inférieures et moyennes de l’épiderme.
L’imagerie confocale du VHSE post-fixation a été discutée dans le protocole, mais il est également possible d’imager les VHSEs dans toute la culture via la tomographie par cohérence optique à base verticale (OCT)88,89,90,91,92,93. Les VHSE sont suffisamment stables pour résister à l’imagerie sans incubation ni humidification pendant au moins deux heures sans effets notables. Comme l’OCT est sans étiquette et non invasif, il est possible de suivre l’épaisseur épidermique pendant la maturation. D’autres modalités non envahissantes de formation image peuvent probablement être employées aussi bien.
L’imagerie volumétrique des structures cutanées et épidermiques combinées peut être due provocante à l’atténuation laser plus profonde dans le VHSE. Cela peut être atténué par l’imagerie de la construction en deux orientations, du côté épidermique (Figure 1) et du côté cutané (Figure 2), permettant une bonne résolution des structures vasculaires cutanées et de l’épiderme. De plus, l’échantillon peut être effacé, ce qui permet des images volumétriques de l’ensemble de la structure avec une atténuation minimale. Plusieurs méthodes de compensation ont été essayées, cependant, la méthode de méthanol/salicylate de méthyle décrite a donné les meilleurs résultats. Les chercheurs intéressés par l’optimisation d’autres méthodes de compensation sont dirigés vers ces revues49,61,62. En cas de nettoyage, il est suggéré d’imager complètement l’échantillon avant le nettoyage, car la méthode peut endommager les fluorophores et / ou la structure. De plus, l’imagerie doit être terminée dès que possible après la clairière, car la fluorescence peut s’estomper en quelques jours.
Pour des raisons de simplicité et d’accessibilité, ce protocole a utilisé les mélanges de médias les plus simples trouvés dans la littérature précédente11,80. Bien qu’il existe de nombreux avantages à utiliser des mélanges de médias simples, les limites de ce choix sont également reconnues. D’autres groupes ont étudié les effets de composants de milieux spécifiques sur la santé épidermique et cutanée et ont constaté que d’autres additifs de milieux94,tels que les acides gras libres externes/lipides, améliorent la couche cornée de l’épiderme et améliorent la fonction barrière cutanée. Bien que nos marqueurs immunofluorescents montrent la différenciation et la stratification appropriées dans l’épiderme, selon les études menées, l’optimisation supplémentaire de médias peut être nécessaire. De plus, une analyse étendue de la nomenclature épidermique n’a pas été conduite en évaluant les VHSEs présentés ici. L’intégrité du BM est une indication importante des équivalents cutanés; divers groupes ont effectué des recherches sur la durée de culture et son effet sur les marquages BM95 ainsi que l’analyse de la présence de fibroblastes et des effets de facteur de croissance ajoutés sur l’expression BM14. Il est important de noter que l’analyse de la composante BM doit être évaluée et optimisée lors de l’utilisation de ce protocole.
Dans ce protocole est décrit une procédure pour la génération de VHSE, démontrant des résultats après 8 semaines à ALI. Les cultures VHSE ont été cultivées jusqu’à 12 semaines à ALI sans changement notable ou perte de viabilité, et il est possible qu’elles soient viables plus longtemps. D’une manière primordiale, ce protocole est facilement adaptable aux types de cellules couramment disponibles, comme démontré par le remplacement des fibroblastes cutanés par des fibroblastes de poumon IMR90. Selon les besoins du chercheur et les ressources disponibles, les types de cellules et les mélanges de milieux sur la culture peuvent être ajustés, bien que des types de cellules plus différents puissent nécessiter une optimisation des milieux. En résumé, ces procédures sont destinées à fournir des éclaircissements sur la culture des VHSEs pour l’étude de la biologie et de la maladie de la peau. Pour maximiser l’accessibilité, le protocole a été développé en utilisant cet équipement, des lignées cellulaires et des réactifs communs comme une approche minimale efficace qui peut être davantage adaptée aux besoins spécifiques des études de recherche.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient le Dr Jim Rheinwald59 et le Dr Ellen H. van den Bogaard20 pour leur généreux don de lignées cellulaires N/TERT. Ce travail a été soutenu par l’American Heart Association (19IPLOI34760636).
matériels
| Name | Company | Catalog Number | Comments |
| 1 N NaOH | Fisher Chemical | S318-100 | (Dilute from Lab stock) |
| 4% Paraformaldehyde | ACROS Organics | #41678-5000, Lot # B0143461 | Made up using solid Paraformaldehyde in PBS, pH adjusted to 6.9 |
| Autoclaved forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| CaCl2 | Fisher bioreagents | Cat # BP510-250, Lot # 190231 | Rnase, Dnase, Protease-Free |
| Cell line, Endothelial: Microvascular Endothelial Cell (HMEC1) | ATCC | CRL-3243 | SV40 Immortalized microvascular endothelial cell. Note that 750,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: dermal Human fibroblast, adult | ATCC | PCS-201-012 | Primary dermal cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Fibroblasts: human lung firbroblast (IMR90) | ATCC | CCL-186 | Primary embryonic cells. Note that 75,000 cells/mL of collagen were used. |
| Cell line, Keratinocyte: N/TERT-1 | Immortalized via hTERT expression. N/TERT-1 was made using a retroviral vector conferring hygromycin resistance. Cell line established by Dickson et al. 2000. Can be replaced with ATCC PCS-200-010 or PCS-200-011. Note that 170,000 cells were used per construct; N/TERT1 cells must be used from plates that are 30% confluent- two 30% confluent 90 mm tissue culture dishes give more than enough cells.The authors thank Dr. Jim Rheinwald and Dr. Ellen H. van den Bogaard for their generous gift of N/TERT cell lines. | ||
| Centrifuge | Thermo Scientific; Sorvall Legend X1R | (standard lab equipment) | |
| Computational Software | MATLAB | MATLAB 2020a | MathWorks, Natick, MA. |
| Confocal Microscope | Leica TCS SPEII confocal | Laser scanning confocal. Can be replaced with other confocals or deconvolution microscopy. | |
| Cover Glass (22 x 22) | Fisher Scientific | 12-545F | 0.13-0.17 mm No.1 Thickness |
| Cyanoacrylate super glue or silicone grease | Glue Masters | #THI0102 | Glue Masters, THICK, Instant Glue, Cyanoacrylate; super glue is preferred |
| DMEM media base | Corning; Mediatech, Inc | REF # 10-013-CM; Lot # 26119007 | DMEM, 1X (Dulbecco's Modification of Eagle's Medium) with 4.5 g/L glucose, L-glutamine & sodium pyruvate |
| DMEM/F-12 50/50 | Corning; Mediatech, Inc | REF # 10-090-CV; Lot # 21119006 | DMEM/F-12 50/50, 1X (Dulbecco's Mod. Of Eagle's Medium/Ham's F12 50/50 Mix) with L-glutamine |
| Ethanol | Decon Labs | #V1101 | (standard lab reagent) |
| Fetal Bovine Serum | Fisher Scientific | Cat # FB12999102, Lot # AE29451050 | Research Grade Fetal Bovine Serum, Triple 0.1 um sterile filtered |
| Fine tip forceps | Fine Science Tools | #11295-00 | Dumont #5 forceps |
| Human Epidermal Growth Factor (EGF) | Peprotech | Cat # AF-100-15-1MG, Lot # 0318AFC05 D0218 | Made up in 0.1% BSA in PBS |
| Hydrocortisone | Alpha Easar | Lot # 5002F2A | made up in DMSO |
| Insulin (human) | Peprotech | Lot # 9352621 | |
| Inverted Light/Phase Contrast Microscope | VWR | 76317-470 | (standard lab equipment) |
| Isoproterenol | Alfa Aesar | #AAJ6178806 | DL-Isoproterenol hydrochloride, 98% |
| Keratinocyte-SFM (1x) media base | Gibco; Life Technologies Corporation | REF #: 10724-011; Lot # 2085518 | Keratinocyte-SFM (1X); serum free medium |
| L-Ascorbic Acid | Fisher Chemical | Cat # A61-100, Lot # 181977, CAS # 50-81-7 | Crystalline. L-Ascorbic acid can also be purchased as a salt |
| L-glutamine (solid) | Fisher Bioreagents | CAT # BP379-100, LOT # 172183, CAS # 56-85-9 | L-Glutamine, white crystals or Crystalline powder |
| MCDB 131 media base | Gen Depot | CM034-050, Lot # 03062021 | MCDB 131 Medium Base, No L-Glutamine, sterile filtered |
| Metal punches | Sona Enterprises (SE) | 791LP, 12PC | Hollow Leather Punch Set, High Carbon Steel, Hardness: 48HRC; (various sizes including): 1/8", 5/32", 3/16", 7/32", 1/4", 9/32", 5/16", 3/4", 7/16", 1/2", 5/8:, 3/4". This punch set is helpful, but x-acto knife can work as well. Size of metal punch that works well for 12 well transwell VHSE is 3/8" or 1/2". |
| Methanol | Fisher Chemical | CAS # 67-56-1 | (optional). For clearing dehydration step. |
| Methyl Salicylate | Fisher Chemical | O3695-500; Lot # 164535; CAS # 119-36-8 | (optional). For clearing. |
| Microtubes, 1.7 mL | Genesee Scientific Corporation; Olympus Plastics | Cat # 24-282; Lot # 19467 | 1.7 ml Microtubes, Clear; Boilproof, Polypropulene, Certified Rnase, Dnase, DNA, PCR inhibitor and endotoxin-Free |
| PBS, 10x Culture grade or autoclaved | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. |
| PBS, 1x Culture grade, (-) Calcium, (-) magnesium | Genesee Scientific Corporation | Ref # 25-508; Lot # 07171015 | |
| PBS, 1x non-Culture grade | APEX Bioresearch Products | Cat # 20-134, Lot # 202237 | PBS Buffer, 10x Dry Pack; add contents of pack into container and add water to 1 liter to produce 10x concentrated. Dilute to 1x with water. |
| Penicillin/Streptomycin | Gibco; Life Technologies Corporation | Ref # 15140-122, Lot # 2199839 | Pen Strep (10,000 Units/mL Penicillin; 10,000 ug/mL Streptomycin) |
| Petri Dish, glass, small | Corning | PYREX 316060 | (optional). To be used as a clearing container |
| Petri Dishes, 100 mm | Fisher Scientific | FB0875713 | Use for making up PDMS. |
| Polydimethylsiloxane (PDMS) | Dow Corning | GMID 02065622, Batch # H04719H035 | Sylgard 184 Silicone Elastomer Base, Dow Corning, Midland, MI) |
| Dow Corning | GMID 02065622, Batch # H047JC4003 | DOWSIL 184, Silicone Elastomer Curing Agent | |
| note: PDMS is usually sold as a kit that includes both the base and curing agent components. | |||
| Positive Displacement Pipettes (1000 & 250 uL) | Gilson | 1000 uL: HM05136, M1000. 250 uL: T12269L | M1000 pipette capacity (100-1000 uL); M250 pipette capacity to 250 uL |
| Positive Displacement Tips/Pistons (1000 & 250 uL) | Gilson | 1000 uL: CAT # F148180, BATCH # B01292902S; 250 uL: CAT # F148114, BATCH # B05549718S | Sterilized capillaries and pistons |
| Round tipped scoopula | (optional; standard lab equipment) For manipulation of VHSEs prior to imaging | ||
| Supplements for Keratinocyte-SFM media | Gibco; Life Technologies Corporation | Ref # 37000-015, Lot # 2154180 | Contains EGF Human Recombinant (Cat # 10450-013), Bovine Pituitary Extract (Cat # 13028-014) |
| Tissue Culture Plate Inserts, 12 well size, 3 µm pore size | Corning; Costar | REF # 3462 - Clear; Lot # 14919057 | Transwell; 12 mm Diameter Inserts, 3.0 um pore size, tissue culture treated, polyester membrane, polystyrene plates, |
| Tissue Culture Plates, 12 well size | Greiner Bio-one; CellStar | Cat # 665 180; Lot # E18103QT | 12 well cell culture plate; sterile, with lid; products are sterile, free of detectable Dnase, Rnase, human DNA and pyrogens. Contents non-cytotoxic |
| Tissue Culture Plates, 60.8cm^2 growth area | Genesee Scientific Corporation | Cat # 25-202; Lot No: 191218-177B | Tissue culture dishes; treated, growth area 60.8 cm^2; sterile, Dnase, Rnase, Pyrogen Free; virgin polystyrene |
| Triton x 100 | Ricca Chemical Company | Cat # 8698.5-16, Lot # 4708R34 | Wetting agent |
| Trypsin 0.25% | Corning; Mediatech, Inc | Ref # 25-053-CI | 0.25% Trypsin, 2.21 mM EDTA, 1x [-] sodium bicarbonate |
| Type 1 Collagen isolated from Rat tail | Pel-Freez Biologicals | 56054-1 | Sprauge-Dawley rat tails can be purchased frozen from Pel-Freez or other suppliers. Collagen can be isolated from the tail tendons. Isolation Protocol references [Cross et al.,2010; Rajan et al.,2007; Bornstein, 1958] .Alternatively, high concentration rat-tail collagen can be purchased from suppliers including Corning (Catalog Number: 354249) |
| Vaccum chamber, benchtop | Bel-Art | F42010-0000 | (standard lab equipment) |
| Handheld Precision knife | X-Acto | X3311 | (X-Acto knife optional if purchased steel punches) |
Références
- Stojic, M., et al. Skin tissue engineering 3. Biomaterials for Skin Repair and Regeneration. , 59 (2019).
- Shevchenko, R. V., James, S. L., James, S. E. A review of tissue-engineered skin bioconstructs available for skin reconstruction. Journal of The Royal Society Interface. 7 (43), 229-258 (2010).
- Kolarsick, P. A. J., Kolarsick, M. A., Goodwin, C. Anatomy and Physiology of the Skin. Journal of the Dermatology Nurses' Association. 3 (4), (2011).
- McGrath, J. A., Eady, R. A. J., Pope, F. M. Anatomy and organization of human skin. Rook's textbook of dermatology. 10, 9781444317633 (2004).
- Zomer, H. D., Trentin, A. G. Skin wound healing in humans and mice: Challenges in translational research. Journal of Dermatological Science. 90 (1), 3-12 (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue Engineered Human Skin Equivalents. Pharmaceutics. 4 (1), (2012).
- Oh, J. W., Hsi, T. -. C., Guerrero-Juarez, C. F., Ramos, R., Plikus, M. V. Organotypic skin culture. The Journal of investigative dermatology. 133 (11), 1-4 (2013).
- El-Ghalbzouri, A., Gibbs, S., Lamme, E., Van Blitterswijk, C. A., Ponec, M. Effect of fibroblasts on epidermal regeneration. British Journal of Dermatology. 147 (2), 230-243 (2002).
- Sun, T., Haycock, J., MacNeil, S. In situ image analysis of interactions between normal human keratinocytes and fibroblasts cultured in three-dimensional fibrin gels. Biomaterials. 27 (18), 3459-3465 (2006).
- Kreimendahl, F., et al. Macrophages significantly enhance wound healing in a vascularized skin model. Journal of Biomedical Materials Research Part A. 107, 1340-1350 (2019).
- El Ghalbzouri, A., Commandeur, S., Rietveld, M. H., Mulder, A. A., Willemze, R. Replacement of animal-derived collagen matrix by human fibroblast-derived dermal matrix for human skin equivalent products. Biomaterials. 30 (1), 71-78 (2009).
- Roger, M., et al. Bioengineering the microanatomy of human skin. Journal of Anatomy. 234, 438-455 (2019).
- Carlson, M. W., Alt-Holland, A., Egles, C., Garlick, J. A. Three-Dimensional Tissue Models of Normal and Diseased Skin. Current Protocols in Cell Biology. 41 (1), 1-17 (2008).
- El Ghalbzouri, A., Jonkman, M. F., Dijkman, R., Ponec, M. Basement Membrane Reconstruction in Human Skin Equivalents Is Regulated by Fibroblasts and/or Exogenously Activated Keratinocytes. Journal of Investigative Dermatology. 124 (1), 79-86 (2005).
- Pruniéras, M., Régnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. The Journal of Investigative Dermatology. 81, 28-33 (1983).
- Ali, N., Hosseini, M., Vainio, S., Taieb, A., Cario-André, M., Rezvani, H. R. Skin equivalents: skin from reconstructions as models to study skin development and diseases. British Journal of Dermatology. 173 (2), 391-403 (2015).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Innovative tissue models for drug discovery and development. 69-70, 81-102 (2014).
- Mieremet, A., Rietveld, M., Absalah, S., van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by chitosan modulated dermal matrices. PLOS ONE. 12 (3), 0174478 (2017).
- Vidal, S. E. L., Tamamoto, K. A., Nguyen, H., Abbott, R. D., Cairns, D. M., Kaplan, D. L. 3D biomaterial matrix to support long term, full thickness, immuno-competent human skin equivalents with nervous system components. Organoids and Ex Vivo Tissue On-Chip Technologies. 198, 194-203 (2019).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838 (2017).
- Lebonvallet, N., et al. Effects of the re-innervation of organotypic skin explants on the epidermis. Experimental Dermatology. 21 (2), 156-158 (2011).
- Van Drongelen, V., et al. Barrier Properties of an N/TERT-Based Human Skin Equivalent. Tissue Engineering Part A. 20 (21-22), 3041-3049 (2014).
- . Establishment and initial characterization of a simple 3D organotypic wound healing model Available from: https://opus.hs-furtwangen.de/frontdoor/index/index/docld/4852 (2018)
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5), 240-249 (2013).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nature Reviews Molecular Cell Biology. 15 (10), 647-664 (2014).
- Amelian, A., Wasilewska, K., Megias, D., Winnicka, K. Application of standard cell cultures and 3D in vitro tissue models as an effective tool in drug design and development. Pharmacological Reports. 69 (5), 861-870 (2017).
- Lu, W., et al. Mixture of Fibroblasts and Adipose Tissue-Derived Stem Cells Can Improve Epidermal Morphogenesis of Tissue-Engineered Skin. Cells Tissues Organs. 195 (3), 197-206 (2012).
- Marino, D., Luginbühl, J., Scola, S., Meuli, M., Reichmann, E. Bioengineering Dermo-Epidermal Skin Grafts with Blood and Lymphatic Capillaries. Science Translational Medicine. 6 (221), 221 (2014).
- Martins-Green, M., Li, Q. -. J., Yao, M. A new generation organ culture arising from cross-talk between multiple primary human cell types. The FASEB Journal. 19 (2), 222-224 (2004).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. -. W. 3D Cell Printing of Perfusable Vascularized Human Skin Equivalent Composed of Epidermis, Dermis, and Hypodermis for Better Structural Recapitulation of Native Skin. Advanced Healthcare Materials. 8 (7), 1801019 (2019).
- Baltazar, T., et al. 3D bioprinting of a vascularized and perfusable skin graft using human keratinocytes. Tissue Engineering Part A. 26 (5-6), 227-238 (2019).
- Klar, A. S., et al. Tissue-engineered dermo-epidermal skin grafts prevascularized with adipose-derived cells. Biomaterials. 35 (19), 5065-5078 (2014).
- Grebenyuk, S., Ranga, A. Engineering Organoid Vascularization. Frontiers in Bioengineering and Biotechnology. 7, (2019).
- Black, A. F., Berthod, F., L'heureux, N., Germain, L., Auger, F. A. In vitro reconstruction of a human capillary-like network in a tissue-engineered skin equivalent. The FASEB Journal. 12 (13), 1331-1340 (1998).
- Huber, B., Link, A., Linke, K., Gehrke, S. A., Winnefeld, M., Kluger, P. J. Integration of Mature Adipocytes to Build-Up a Functional Three-Layered Full-Skin Equivalent. Tissue Engineering Part C: Methods. 22 (8), 756-764 (2016).
- Monfort, A., Soriano-Navarro, M., García-Verdugo, J. M., Izeta, A. Production of human tissue-engineered skin trilayer on a plasma-based hypodermis. Journal of Tissue Engineering and Regenerative Medicine. 7 (6), 479-490 (2013).
- Shamis, Y., et al. Fibroblasts derived from human embryonic stem cells direct development and repair of 3D human skin equivalents. Stem Cell Research & Therapy. 2 (1), 10 (2011).
- Kim, Y., et al. Establishment of a complex skin structure via layered co-culture of keratinocytes and fibroblasts derived from induced pluripotent stem cells. Stem Cell Research & Therapy. 9 (1), 217 (2018).
- Chau, D. Y. S., Johnson, C., MacNeil, S., Haycock, J. W., Ghaemmaghami, A. M. The development of a 3D immunocompetent model of human skin. Biofabrication. 5 (3), 035011 (2013).
- Vanden Bogaard, E. H., et al. Crosstalk between Keratinocytes and T Cells in a 3D Microenvironment: A Model to Study Inflammatory Skin Diseases. Journal of Investigative Dermatology. 134 (3), 719-727 (2014).
- Linde, N., Gutschalk, C. M., Hoffmann, C., Yilmaz, D., Mueller, M. M. Integrating Macrophages into Organotypic Co-Cultures: A 3D In Vitro Model to Study Tumor-Associated Macrophages. PLOS ONE. 7 (7), 40058 (2012).
- Ouwehand, K., Spiekstra, S. W., Waaijman, T., Scheper, R. J., de Gruijl, T. D., Gibbs, S. Technical Advance: Langerhans cells derived from a human cell line in a full-thickness skin equivalent undergo allergen-induced maturation and migration. Journal of Leukocyte Biology. 90 (5), 1027-1033 (2011).
- Weinmüllner, R., et al. Organotypic human skin culture models constructed with senescent fibroblasts show hallmarks of skin aging. npj Aging and Mechanisms of Disease. 6 (1), 4 (2020).
- Barker, C. L., et al. The Development and Characterization of an In Vitro Model of Psoriasis. Journal of Investigative Dermatology. 123 (5), 892-901 (2004).
- Larcher, F., Espada, J., Díaz-Ley, B., Jaén, P., Juarranz, A., Quintanilla, M. New Experimental Models of Skin Homeostasis and Diseases. Actas Dermo-Sifiliográficas (English Edition). 106 (1), 17-28 (2015).
- Varkey, M., Ding, J., Tredget, E. E. Fibrotic Remodeling of Tissue-Engineered Skin with Deep Dermal Fibroblasts Is Reduced by Keratinocytes. Tissue Engineering Part A. 20 (3-4), 716-727 (2013).
- Moulin, V. J. Reconstitution of skin fibrosis development using a tissue engineering approach. Methods in Molecular Biology. 961, 287-303 (2013).
- Morgan, J. T., Shirazi, J., Comber, E. M., Eschenburg, C., Gleghorn, J. P. Fabrication of centimeter-scale and geometrically arbitrary vascular networks using in vitro self-assembly. Biomaterials. 189, 37-47 (2019).
- Silvestri, L., Costantini, I., Sacconi, L., Pavone, F. S. Clearing of fixed tissue: a review from a microscopist's perspective. Journal of Biomedical Optics. 21 (8), 1-8 (2016).
- Cross, V. L., et al. Dense type I collagen matrices that support cellular remodeling and microfabrication for studies of tumor angiogenesis and vasculogenesis in vitro. Biomaterials. 31 (33), 8596-8607 (2010).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1, 2753 (2007).
- Bornstein, M. B. Reconstituted rat-tail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Laboratory Investigation. 7 (2), 134-137 (1958).
- Clément, M. -. V., Ramalingam, J., Long, L. H., Halliwell, B. The In Vitro Cytotoxicity of Ascorbate Depends on the Culture Medium Used to Perform the Assay and Involves Hydrogen Peroxide. Antioxidants & Redox Signaling. 3 (1), 157-163 (2001).
- Tajima, S., Pinnell, S. R. Ascorbic acid preferentially enhances type I and III collagen gene transcription in human skin fibroblasts. Journal of Dermatological Science. 11 (3), 250-253 (1996).
- Murad, S., Tajima, S., Johnson, G. R., Sivarajah, A., Pinnell, S. R. Collagen Synthesis in Cultured Human Skin Fibroblasts: Effect of Ascorbic Acid and Its Analogs. Journal of Investigative Dermatology. 81 (2), 158-162 (1983).
- Villacorta, L., Azzi, A., Zingg, J. -. M. Regulatory role of vitamins E and C on extracellular matrix components of the vascular system. Vitamin E: An Overview of Major Research Directions. 28 (5), 507-537 (2007).
- Ashino, H., et al. Novel Function of Ascorbic Acid as an Angiostatic Factor. Angiogenesis. 6 (4), 259-269 (2003).
- Ponec, M., et al. The Formation of Competent Barrier Lipids in Reconstructed Human Epidermis Requires the Presence of Vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Dickson, M. A., et al. Human keratinocytes that express hTERT and also bypass a p16(INK4a)-enforced mechanism that limits life span become immortal yet retain normal growth and differentiation characteristics. Molecular and Cellular Biology. 20 (4), 1436-1447 (2000).
- Johansen, C. Generation and Culturing of Primary Human Keratinocytes from Adult Skin. Journal of visualized experiments: JoVE. (130), e56863 (2017).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Ariel, P. A beginner's guide to tissue clearing. The International Journal of Biochemistry & Cell Biology. 84, 35-39 (2017).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Ng, J. M. K., Gitlin, I., Stroock, A. D., Whitesides, G. M. Components for integrated poly(dimethylsiloxane) microfluidic systems. ELECTROPHORESIS. 23 (20), 3461-3473 (2002).
- Eddings, M. A., Johnson, M. A., Gale, B. K. Determining the optimal PDMS-PDMS bonding technique for microfluidic devices. Journal of Micromechanics and Microengineering. 18 (6), 067001 (2008).
- Markov, D. A., Lillie, E. M., Garbett, S. P., McCawley, L. J. Variation in diffusion of gases through PDMS due to plasma surface treatment and storage conditions. Biomedical microdevices. 16 (1), 91-96 (2014).
- Katzenberg, F. Plasma-bonding of poly(dimethylsiloxane) to glass. e-Polymers. 5 (1), (2005).
- El Ghalbzouri, A., Lamme, E., Ponec, M. Crucial role of fibroblasts in regulating epidermal morphogenesis. Cell and Tissue Research. 310 (2), 189-199 (2002).
- Kanitakis, J. Anatomy, histology and immunohistochemistry of normal human skin. European journal of dermatology: EJD. 12 (4), 390-399 (2002).
- Hessian based Frangi Vesselness filter. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/24409-hessian-based-frangi-vesselness-filter (2010)
- Jerman, T., Pernuš, F., Likar, B. Špiclin Enhancement of Vascular Structures in 3D and 2D Angiographic Images. IEEE Transactions on Medical Imaging. 35 (9), 2107-2118 (2016).
- Kovesi, P. Phase Preserving Denoising of Images. signal. 4, 6 (1999).
- Vincent, L. Morphological grayscale reconstruction in image analysis: applications and efficient algorithms. IEEE Transactions on Image Processing. 2 (2), 176-201 (1993).
- Xie, L., et al. Quantitative susceptibility mapping of kidney inflammation and fibrosis in type 1 angiotensin receptor-deficient mice. NMR in Biomedicine. 26 (12), 1853-1863 (2013).
- Van Uitert, R., Bitter, I. Subvoxel precise skeletons of volumetric data based on fast marching methods. Medical Physics. 34 (2), 627-638 (2007).
- Sethian, J. A. A fast marching level set method for monotonically advancing fronts. Proceedings of the National Academy of Sciences of the United States of America. 93 (4), 1591-1595 (1996).
- Sethian, J. A. Fast Marching Methods. SIAM Review. 41 (2), 199-235 (1999).
- Braverman, I. M. The Cutaneous Microcirculation. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 3-9 (2000).
- Men, S. J., Chen, C. -. L., Wei, W., Lai, T. -. Y., Song, S. Z., Wang, R. K. Repeatability of vessel density measurement in human skin by OCT-based microangiography. Skin research and technology: official journal of International Society for Bioengineering and the Skin (ISBS) [and] International Society for Digital Imaging of Skin (ISDIS) [and] International Society for Skin Imaging (ISSI). 23 (4), 607-612 (2017).
- Commandeur, S., Ho, S. H., de Gruijl, F. R., Willemze, R., Tensen, C. P., El Ghalbzouri, A. Functional characterization of cancer-associated fibroblasts of human cutaneous squamous cell carcinoma. Experimental Dermatology. 20 (9), 737-742 (2011).
- Thakoersing, V. S., Danso, M. O., Mulder, A., Gooris, G., Ghalbzouri, A. E., Bouwstra, J. A. Nature versus nurture: does human skin maintain its stratum corneum lipid properties in vitro. Experimental Dermatology. 21 (11), 865-870 (2012).
- Thakoersing, V. S., Gooris, G. S., Mulder, A., Rietveld, M., El Ghalbzouri, A., Bouwstra, J. A. Unraveling barrier properties of three different in-house human skin equivalents. Tissue Engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Bouwstra, J. A., Groenink, H. W. W., Kempenaar, J. A., Romeijn, S. G., Ponec, M. Water distribution and natural moisturizer factor content in human skin equivalents are regulated by environmental relative humidity. The Journal of Investigative Dermatology. 128 (2), 378-388 (2008).
- Thakoersing, V. S., van Smeden, J., Mulder, A. A., Vreeken, R. J., El Ghalbzouri, A., Bouwstra, J. A. Increased Presence of Monounsaturated Fatty Acids in the Stratum Corneum of Human Skin Equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Smola, H., Thiekötter, G., Fusenig, N. Mutual induction of growth factor gene expression by epidermal-dermal cell interaction. The Journal of Cell Biology. 122 (2), 417 (1993).
- Fluck, J., Querfeld, C., Cremer, A., Niland, S., Krieg, T., Sollberg, S. Normal Human Primary Fibroblasts Undergo Apoptosis in Three-Dimensional Contractile Collagen Gels. Journal of Investigative Dermatology. 110 (2), 153-157 (1998).
- Nakagawa, S., Pawelek, P., Grinnell, F. Long-Term Culture of Fibroblasts in Contracted Collagen Gels: Effects on Cell Growth and Biosynthetic Activity. Journal of Investigative Dermatology. 93 (6), 792-798 (1989).
- Smith, L. E., Bonesi, M., Smallwood, R., Matcher, S. J., MacNeil, S. Using swept-source optical coherence tomography to monitor the formation of neo-epidermis in tissue-engineered skin. Journal of Tissue Engineering and Regenerative Medicine. 4 (8), 652-658 (2010).
- Pierce, M. C., Strasswimmer, J., Park, H., Cense, B., De Boer, J. F. Birefringence measurements in human skin using polarization-sensitive optical coherence tomography. Biomed Opt. 2 (2), 287-291 (2004).
- Pierce, M. C., Strasswimmer, J., Hyle Park, B., Cense, B., de Boer, J. F. Advances in Optical Coherence Tomography Imaging for Dermatology. Journal of Investigative Dermatology. 123 (3), 458-463 (2004).
- Yeh, A. T., Kao, B., Jung, W. G., Chen, Z., Nelson, J. S., Tromberg, B. J. Imaging wound healing using optical coherence tomography and multiphoton microscopy in an in vitro skin-equivalent tissue model. Journal of Biomedical Optics. 9 (2), 9 (2004).
- Derr, K., et al. Fully Three-Dimensional Bioprinted Skin Equivalent Contructs with Validated Morphology and Barrier Funtion. Tissue Engineering Part C: Methods. 25 (6), 334-343 (2019).
- Park, B. H., de Boer, J. F. Polarization Sensitive Optical Coherence Tomography. Optical Coherence Tomography: Technology and Applications. , 1055-1101 (2015).
- Batheja, P., Song, Y., Wertz, P., Michniak-Kohn, B. Effects of Growth Conditions on the Barrier Properties of a Human Skin Equivalent. Pharmaceutical Research. 26 (7), 1689-1700 (2009).
- Dos Santos, M., Metral, E., Boher, A., Rousselle, P., Thepot, A., Damour, O. In vitro 3-D model based on extending time of culture for studying chronological epidermis aging. Matrix Biology. 47, 85-97 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon