Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Formulación y caracterización de nanopartículas lipídicas para la administración de genes utilizando una plataforma de mezcla microfluídica
* Estos autores han contribuido por igual
En este artículo
Resumen
Las nanopartículas lipídicas se desarrollan utilizando un enfoque de plataforma de mezcla microfluídica para la encapsulación de ARNm y ADN.
Resumen
Los portadores de fármacos basados en lípidos se han utilizado para sistemas de administración disponibles clínica y comercialmente debido a su pequeño tamaño, biocompatibilidad y alta eficiencia de encapsulación. El uso de nanopartículas lipídicas (LNP) para encapsular ácidos nucleicos es ventajoso para proteger el ARN o el ADN de la degradación, al tiempo que promueve la absorción celular. Los LNP a menudo contienen múltiples componentes lipídicos, incluidos un lípido ionizable, lípido auxiliar, colesterol y lípido conjugado de polietilenglicol (PEG). Los LNP pueden encapsular fácilmente los ácidos nucleicos debido a la presencia de lípidos ionizables, que a pH bajo es catiónico y permite la complejación con ARN o ADN cargado negativamente. Aquí los LNPs se forman encapsulando arn mensajero (ARNm) o ADN plásmido (pDNA) utilizando la mezcla rápida de los componentes lipídicos en una fase orgánica y el componente de ácido nucleico en una fase acuosa. Esta mezcla se realiza utilizando una plataforma de mezcla microfluídica precisa, lo que permite el autoensamblaje de nanopartículas mientras se mantiene el flujo laminar. El tamaño hidrodinámico y la polidispersidad se miden mediante dispersión dinámica de la luz (DLS). La carga superficial efectiva en el LNP se determina midiendo el potencial zeta. La eficiencia de encapsulación se caracteriza utilizando un tinte fluorescente para cuantificar el ácido nucleico atrapado. Los resultados representativos demuestran la reproducibilidad de este método y la influencia que los diferentes parámetros de formulación y proceso tienen en los LNPs desarrollados.
Introducción
Los portadores de fármacos se utilizan para proteger y administrar una terapéutica con propiedades favorables típicas que incluyen baja citotoxicidad, aumento de la biodisponibilidad y mejora dela estabilidad 1,2,3. Las nanopartículas poliméricas, micelas y partículas basadas en lípidos se han explorado previamente para la encapsulación y entrega de ácidos nucleicos4,5,6,7. Los lípidos se han utilizado en diferentes tipos de sistemas de nanoportadores, incluidos los liposomas y las nanopartículas lipídicas, ya que son biocompatibles con altaestabilidad 8. Los LNP pueden encapsular fácilmente los ácidos nucleicos para la entregade genes 9,10. Protegen el ácido nucleico de la degradación por proteasas séricas durante la circulación sistémica11 y pueden mejorar la entrega a sitios específicos, ya que la topografía superficial y las propiedades físicas de los LNPs influyen en su biodistribución12. Los LNPs también mejoran la penetración tisular y la captación celular9. Estudios previos han demostrado el éxito de la encapsulación de siRNA dentro de un LNP13,incluido el primer LNP disponible comercialmente que contiene siRNA terapéutico para el tratamiento de la polineuropatía del tratamiento de la amiloidosis hereditaria mediada por transtiretina14 que fue aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) y la Agencia Europea de Medicamentos en 2018. Más recientemente, los LNP se están estudiando para la entrega de cantidades de ácidos nucleicos más grandes, a saber, ARNm y ADN9. A partir de 2018, había ~ 22 sistemas de administración de ácidos nucleicos basados en lípidos sometidos a ensayos clínicos14. Además, los ARNm que contienen LNPs son actualmente candidatos líderes y se han empleado para una vacuna COVID-1915,16. El éxito potencial de estas terapias génicas no virales requiere la formación de partículas pequeñas (~ 100 nm), estables y uniformes con alta encapsulación del ácido nucleico.
El uso de un lípido ionizable como componente principal en la formulación de LNP ha mostrado ventajas para la complejidad, encapsulación y eficiencia de entrega14. Los lípidos ionizables suelen tener una constante de disociación ácida (pKa) < 7; por ejemplo, dilinoleylmethyl-4-dimethylaminobutyrate (D-Lin-MC3-DMA), el lípido ionizable utilizado en la formulación de LNP aprobada por la FDA, tiene un pKa de 6.4417. A pH bajo, los grupos amina en el lípido ionizable se protonan y cargan positivamente, lo que permite el ensamblaje con grupos fosfato cargados negativamente en ARNm y ADN. La proporción de grupos amina, "N", a fosfato, "P", se utiliza para optimizar el ensamblaje. La relación N/P depende de los lípidos y ácidos nucleicos utilizados, que varían en función de la formulación18. Después de la formación, el pH se puede ajustar a un pH neutro o fisiológico para permitir la administración terapéutica. A estos valores de pH, el lípido ionizable también se desprotona, lo que imparte carga superficial neutra al LNP.
El lípido ionizable también ayuda en el escape endosomal19,20. Los LNP sufren endocitosis durante la absorción celular y deben liberarse del endosoma para entregar la carga de ARNm en el citoplasma celular o la carga de ADN al núcleo21. Dentro del endosoma es típicamente un ambiente más ácido que el medio extracelular, lo que hace que el lípido ionizable cargado positivamente22,23. El lípido ionizable cargado positivamente puede interactuar con cargas negativas en la membrana lipídica endosomal, lo que puede causar desestabilización del endosoma permitiendo la liberación del LNP y el ácido nucleico. Actualmente se están estudiando diferentes lípidos ionizables para mejorar la eficacia tanto de la distribución de LNP, como del escape endosomal14.
Otros componentes típicos de un LNP incluyen lípidos auxiliares, como un lípido fosfatidilcolina (PC) o fosfoetanolamina (PE). 1,2-Dioleoyl-sn -glycero-3-phosphoethanolamine (DOPE), 1,2-distearoyl-sn-glycero-3-phosphocholine (DSPC), y 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) son lípidos auxiliares de uso común24,25. Se ha demostrado que el DOPE forma una fase hexagonal II invertida (HII) y mejora la transfección por fusión de membrana26,mientras que se ha pensado que el DSPC estabiliza los LNPs con su geometría cilíndrica27. El colesterol también se incorpora en la formulación para aumentar la rigidez de la membrana, ayudando posteriormente en la estabilidad de la LNP. Finalmente, el polietilenglicol conjugado con lípidos (PEG) se incluye en la formulación para proporcionar la barrera estérica necesaria para ayudar en el autoensamblaje de partículas27. PEG también mejora la estabilidad de almacenamiento de los LNP al evitar la agregación. Además, PEG se utiliza a menudo como un componente sigiloso y puede aumentar el tiempo de circulación de los LNP. Sin embargo, este atributo también puede plantear desafíos para el reclutamiento de LNPs a hepatocitos a través de un mecanismo de orientación endógeno impulsado por la apolipoproteína E (ApoE)28. Por lo tanto, los estudios han investigado la longitud de la cadena de acilo para la difusión de PEG desde el LNP, encontrando que las longitudes cortas (C8-14) se disocian del LNP y son más susceptibles al reclutamiento de ApoE en comparación con las longitudes de acilo más largas28. Además, se ha demostrado que el grado de saturación de la cola lipídica con la que se conjuga el PEG influye en la distribución tisular de los LNPs29. Recientemente, se demostró que Tween 20, que es un surfactante de uso común en formulaciones de productos farmacéuticos biológicos y tiene una larga cola lipídica insaturada, tiene una alta transfección en los ganglios linfáticos drenantes en comparación con PEG-DSPE, que transfectó en gran medida el músculo en el sitio de inyección29. Este parámetro se puede optimizar para lograr la biodistribución LNP deseada.
Los métodos convencionales de formación de LNPs incluyen el método de hidratación de película delgada y el método de inyección de etanol27. Si bien estas son técnicas fácilmente disponibles, también requieren mucha mano de obra, pueden resultar en una baja eficiencia de encapsulación y son difíciles de escalar27. Los avances en las técnicas de mezcla han dado como resultado métodos más susceptibles de escalar, mientras que el desarrollo de partículas más uniformes27. Estos métodos incluyen la mezcla de unión en T, la mezcla escalonada de espiga y el enfoque hidrodinámico microfluídico27. Cada método tiene una estructura única, pero todos permiten la mezcla rápida de una fase acuosa que contiene el ácido nucleico con una fase orgánica que contiene los componentes lipídicos, lo que resulta en una alta encapsulación del ácido nucleico27. En este protocolo, se utiliza una mezcla rápida y controlada a través de un cartucho microfluídico, que emplea el diseño de mezcla escalonada de espiga. Este protocolo describe la preparación, ensamblaje y caracterización de ácidos nucleicos que contienen LNPs.
Protocolo
En la Figura 1se proporciona un esquema del proceso general.
1. Preparación de tampones
NOTA: El filtrado estéril de los tampones se recomienda aquí para eliminar cualquier partícula que pueda afectar la calidad del ácido nucleico y el LNP.
- Solución salina tamponada con fosfato (PBS)
- Prepare 1x PBS usando 8 mM Na2HPO4, 2 mM KH2PO4, 137 mM NaCl y 2.7 mM KCl en agua libre de nucleasa y ajuste el pH a 7.4.
- Esterilizar por filtración al vacío utilizando un filtro de tamaño de poro de 0,22 μm.
- Tampón de citrato
- Prepare el tampón de citrato usando citrato de sodio de 5 mM, ácido cítrico de 5 mM y cloruro de sodio de 150 mM en agua libre de nucleasa y ajuste a pH 4.5.
- Esterilizar por filtración al vacío utilizando un filtro de tamaño de poro de 0,22 μm.
NOTA: El tampón de citrato solo necesita ser preparado si el ARNm es el ácido nucleico que se encapsulará en el LNP. Si el ADN se encapsula, omita 1.2 y proceda a 1.3.
- Tampón de ácido málico
- Prepare el tampón de ácido málico utilizando ácido málico de 20 mM y cloruro de sodio de 30 mM en agua libre de nucleasa y ajuste a pH 3.0.
- Esterilizar por filtración al vacío utilizando un filtro de tamaño de poro de 0,22 μm.
NOTA: El tampón de ácido málico solo necesita ser preparado si el ADN es el ácido nucleico que se encapsulará en el LNP. Omita 1.3 si se va a encapsular el ARNm. El tampón de citrato se utiliza para la encapsulación de ARNm, ya que el pH más bajo de 3.0 con tampón de ácido málico puede conducir a una mayor probabilidad de degradación de ARNm. El protocolo se puede pausar aquí.
2. Preparación de la mezcla de lípidos
- Si los lípidos de stock están en forma de polvo, solubilizar en etanol puro a prueba de 200.
- Calcule la mezcla requerida de componentes lipídicos en función de la relación molar deseada. Una relación molar de 50:10:39:1 (lípido ionizable:lípido auxiliar:colesterol:PEG) se utilizará aquí como ejemplo para una concentración total de lípidos de 10 mM. La Tabla 1 muestra las concentraciones y volúmenes necesarios para cada uno de estos componentes.
NOTA: Al calcular el volumen necesario para alcanzar la concentración de mezcla de lípidos en etanol (EtOH) para el mezclador microfluídico, se tiene en cuenta el volumen total para garantizar que la adición de EtOH no influya en las concentraciones de lípidos. Por ejemplo, un volumen lipídico ionizable de 68,5 μL se calcula multiplicando la concentración de 5 mM en etanol por un volumen total de mezcla lipídica de 533 μL y luego dividiendo por la concentración de lípidos de 38,9 mM. - Agregue la cantidad adecuada de cada solución de caldo de lípidos a un vial de vidrio para permitir que los componentes se mezclen con vórtice intermitente. Añadir 200 etanol a prueba para una mezcla total de 533 μL. Para el ejemplo de la Tabla 1,esto es 254 μL de etanol.
NOTA: Para que una sola tirada produzca 1 ml de LNPs, se necesitan 342,5 μL de solución lipídica. Esto se debe a una mezcla 3:1 de ácido nucleico acuoso a solución lipídica orgánica con algo de volumen descartado antes y después de la recolección de muestras. Se hace una mezcla de 533 μL para compensar como excedente.
3. Preparación de la solución de ácido nucleico
NOTA: La preparación y manipulación de soluciones de ácidos nucleicos debe realizarse en un entorno estéril y libre de RNasa siempre que sea posible. Trabaje en un gabinete de bioseguridad siempre que sea posible con el ácido nucleico.
- Calcular la relación N/P. La relación N/P es el número total de grupos de amina lipídica ionizable (N) y el número total de grupos fosfato de ácido nucleico (P) cargados negativamente. La relación N/P es a menudo un parámetro que se puede optimizar durante la formación de LNP. Siga los pasos a continuación.
- Calcule el número de N unidades utilizando la siguiente fórmula:
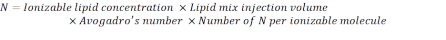
NOTA: La concentración de lípidos ionizables (Tabla 1) es de 5 mM, lo que equivale a 5 x 10-6 mol/mL. El volumen de inyección de lípidos requerido es de 0,3425 ml. Por ejemplo, si el número de N unidades por molécula es 1, usando la ecuación anterior, hay 1.03 x 1018 N unidades en la mezcla de lípidos. - Calcule las unidades P para la relación N/P deseada. Aquí se usa un N/P = 36 por ejemplo.
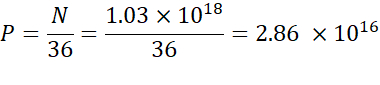
- Calcule el número de N unidades utilizando la siguiente fórmula:
- Calcular la concentración de ácido nucleico necesaria para obtener 2,86 x 10unidades de 16 P utilizando la siguiente ecuación.
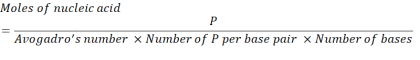
Donde, el número de unidades P por par de bases para arNm es 1 y ADN es 2. Para un ARNm con 1.200 bases, la cantidad de ARNm requerida para un N/P = 36 es de 3,96 x 10-11 moles. - Calcule la concentración en masa de ARNm requerida para N/P = 36 utilizando la siguiente ecuación.
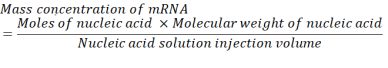
El peso molecular medio de una unidad de monofosfato de ribonucleótido es de 322 g/mol30. Con ARNm de 1.200 bases, el peso molecular del ARNm es de 386.400 g/mol. El volumen de inyección requerido de solución de ácido nucleico es de 1.028 ml. Por lo tanto, la concentración de ARNm necesaria es de 1.488x10-5 g / ml, que es de 14.88 μg / ml. - Ensan para 1,5 ml de 14,88 μg/ml de ARNm en tampón de citrato.
NOTA: Cuando el ADN será el ácido nucleico encapsulado, use un tampón de ácido málico para componer la solución de ácido nucleico.
4. Cebado de los canales microfluídicos
NOTA: Este protocolo está adaptado de las directrices del fabricante del instrumento.
- Introduzca los parámetros de cebado en el software del instrumento haciendo clic en los campos apropiados (Tabla 2).
NOTA: Se recomienda una relación de flujo de 3:1 y un caudal de 4-12 mL/min27,31 . Esto ha demostrado ser óptimo en los estudios presentados aquí, así como por el fabricante. Esto se puede variar si es de interés para la aplicación. - Abra la tapa del instrumento y coloque un cartucho microfluídico en el bloque giratorio.
- Extraiga al menos 0,5 ml de etanol en una jeringa de 1 ml, asegurándose de que no haya burbujas ni espacios de aire en la punta de la jeringa. Cargue esta jeringa en la entrada derecha del cartucho.
- Llene una jeringa de 3 ml con 1,5 ml de tampón acuoso (citrato para arn y ácido málico para ADN), asegurándose de que no haya burbujas de aire ni huecos. Cargue esta jeringa en la entrada izquierda del cartucho.
- Inserte dos tubos cónicos de 15 ml en los soportes de clip para que sirvan como contenedores de residuos.
- Haga clic en Ejecutar en el software del instrumento para comenzar la mezcla, asegurándose de que los parámetros se ingresen correctamente.
- Cuando el instrumento deje de cebar, indicado por el cierre de la luz azul inferior, abra la tapa y deseche adecuadamente los tubos cónicos y las jeringas.
5. Formación de LNP
NOTA: Este protocolo está adaptado de las directrices del fabricante del instrumento.
- Actualice el software con los parámetros de formulación haciendo clic en los campos apropiados (Tabla 2).
- Llene una jeringa de 1 ml con la mezcla de lípidos (preparada en el paso 2). Retire los espacios de aire o burbujas en la punta de la jeringa e inserte la jeringa en el lado derecho del cartucho.
- Extraiga la solución de ácido nucleico (preparada en el paso 3) en una jeringa de 3 ml, asegurándose de que no haya burbujas ni espacios de aire en la punta de la jeringa. Inserte la jeringa en la entrada izquierda del cartucho.
NOTA: Se proporcionan volúmenes para hacer una solución de 1 ml de LNPs. Este instrumento puede incorporar tamaños de jeringa de hasta 10 ml, y los volúmenes se pueden escalar en consecuencia sin influencia en el resultado. El volumen máximo de LNPs que se pueden preparar en una preparación es de 12 mL. - Etiquete un tubo cónico sin RNasa de 15 ml con el nombre de la muestra e insértelo en el clip del tubo izquierdo. Coloque un cónico de residuos de 15 ml en el clip de tubo derecho.
- Cierre la tapa del instrumento y haga clic en Ejecutar, después de confirmar la entrada correcta de parámetros.
- Una vez que el instrumento haya terminado de funcionar, deseche correctamente el contenedor de desechos y el cartucho. Retener el tubo cónico con la muestra LNP.
- Diluya el LNP 5x con PBS para minimizar el etanol a <5% (v/v).
NOTA: Es importante diluir los LNPs en PBS tan pronto como sea posible después de la mezcla microfluídica para evitar la degradación. Realice siempre la dilución en un gabinete de bioseguridad y continúe trabajando en el gabinete de bioseguridad durante los intercambios de tampón.
6. Intercambio de búfer
NOTA: Se proporciona un protocolo para el uso de filtros de ultracentrífuga. Si bien este método da como resultado un intercambio de tampones más eficiente en el tiempo, la diálisis puede ser sustituida aquí.
- Prelavado de un filtro ultracentrífugo (tamaño de poro de 100 kDa) con 2 ml de PBS centrifugando a 1000 x g durante 5 min. Vacíe el PBS del compartimento inferior.
NOTA: PBS se elige para aumentar el pH a 7.4 ± 0.2, lo cual es fisiológicamente relevante y dará como resultado que el lípido ionizable tenga una carga neutra. - Agregue LNPs diluidos al compartimento superior del filtro de ultracentrífuga prelavado y centrífuga a 1000 x g durante 12 min.
- Deseche el flujo a través del compartimento inferior. Realice dos lavados más agregando 5 ml de PBS al filtro de ultracentrífuga cada vez. Centrifugar a los mismos parámetros. No hay un volumen máximo que deba mantenerse.
NOTA: Si se preparó un volumen de LNP a escala, aumente el volumen de PBS para cada lavado en consecuencia. Por ejemplo, si se prepararon 2 ml de LNP en una sola ejecución, se sugieren 10 ml de PBS por lavado. - Pipetear la solución LNP contra las paredes del filtro ultracentrífugo varias veces para minimizar la pérdida de LNP. Retire la solución de LNP del filtro de ultracentrífuga y guárdelo en un vial sin nucleasas. Agregue PBS si es necesario para lograr un volumen final de la solución LNP de 1 ml.
- Filtre a través de un filtro de jeringa pre húmedo de 0,2 μm, si es necesario.
NOTA: El protocolo se puede pausar aquí.
7. Medir la eficiencia de encapsulación
- Prepare una curva estándar haciendo diluciones en serie de 2 veces de solución de ácido nucleico de trabajo en PBS, comenzando con una concentración más alta de 500 ng / ml y haciendo al menos cinco diluciones. Utilice PBS como espacio en blanco.
- Preparar las diluciones de muestra de LNP. Diluya muestras de LNP con PBS, para lograr una concentración teórica aproximada que se encuentre alrededor del punto medio de la curva estándar (por ejemplo, ~ 250 ng / ml de ácido nucleico estimado a partir de la concentración inicial).
- Preparar una solución del reactivo de cuantificación de ARN (para mediciones de ARNm) con TritonX-100 para interrumpir los LNPs y medir la cantidad total de ácido nucleico dentro y fuera del LNP. Esta solución contiene 0,5% (v/v) de reactivo de ARN, 0,4% (v/v) de TritonX-100 y 99,1% (v/v) de PBS.
- Preparar una solución del reactivo sin TritonX-100 para medir la cantidad de ácido nucleico no encapsulado en los LNPs. Esta solución contiene 0,5% (v/v) de reactivo de ARN y 99,5% (v/v) de PBS.
NOTA: Si los LNP encapsulan ADN de doble cadena (dsDNA), como el ADN plásmido, use el reactivo dsDNA en 7.3 y 7.4 en su lugar, siguiendo el mismo procedimiento. - En una placa con capacidad de fluorescencia negra de 96 pozos, cargue al menos cuatro réplicas de cada una de las soluciones estándar de LNP y ácido nucleico preparadas en 7.1 y 7.2.
- A la mitad de las réplicas de estándares y muestras, agregue un volumen igual del reactivo que contiene TritonX-100. Esto cuantificará la cantidad total de ácido nucleico.
- A los pozos restantes de estándares y muestras, agregue un volumen igual del reactivo sin TritonX-100. Esto cuantificará la cantidad de ácido nucleico no encapsulado dentro del LNP.
- Agite la placa durante 5 minutos a temperatura ambiente para garantizar una mezcla completa de estándares y muestras con el reactivo agregado, tomando precauciones para evitar la exposición a la luz.
- Mida la fluorescencia utilizando un lector de microplacas, con una longitud de onda de excitación de 480 nm y una longitud de onda de emisión de 520 nm.
- Calcular la concentración de ácido nucleico fuera del LNP utilizando la curva estándar realizada con la adición del reactivo sin TritonX-100. Multiplicar por el factor de dilución utilizado en 7.2.
- Calcular la concentración de ácido nucleico tanto dentro como fuera del LNP utilizando la curva estándar realizada con la adición del reactivo que contiene TritonX-100. Multiplicar por el factor de dilución utilizado en 7.2.
- Calcular la concentración de ácido nucleico en el interior restando la concentración de ácido nucleico en el exterior (calculada a partir del paso 7.10) de la concentración total de ácido nucleico tanto en el interior como en el exterior (calculada a partir del paso 7.11)
- Cuantificar la eficiencia de encapsulación a partir de la relación entre la concentración de ácido nucleico dentro del LNP (calculada a partir del paso 7.12) y la concentración total de ácido nucleico (calculada a partir del paso 7.11).
NOTA: El protocolo se puede pausar aquí.
8. Ajustes de concentración
- Si es necesario, ajuste la concentración de ácido nucleico dentro de la solución de LNP utilizando los resultados de la eficiencia de encapsulación.
- Si se desea una solución menos concentrada, diluya la solución con PBS para lograr la concentración deseada.
- Si se desea una solución más concentrada, realice centrifugaciones adicionales utilizando un filtro de ultracentrífuga.
NOTA: El protocolo se puede pausar aquí.
9. Medir el tamaño hidrodinámico y la polidispersidad de LNP
- Diluir una alícuota de la solución LNP 40x con PBS para obtener un volumen final de 1 mL.
NOTA: Esta dilución se puede cambiar si es necesario. Este valor de dilución se sugiere ya que utiliza un pequeño volumen de la solución de stock LNP al tiempo que proporciona resultados de calidad. - Usando una cubeta semi-micro, mida el diámetro hidrodinámico y el índice de polidispersidad. Agregue la solución de LNP en la cubeta e insértelo en el instrumento. Configure un procedimiento operativo en el software del instrumento para incluir el tipo de medición, los detalles de la muestra (material, dispersante, temperatura y tipo de celda) y las instrucciones de medición (número de tiradas). Haga clic en Iniciar cuando esté listo para comenzar la adquisición de la medición.
10. Medir el potencial zeta de LNP
- Diluir una alícuota de la solución LNP 40x con agua libre de nucleasa para obtener un volumen final de 1 mL.
NOTA: El agua libre de nucleasa se utiliza como disolvente para las mediciones de potencial zeta para minimizar la influencia de los tampones de sal alta en la conductividad. - Usando una célula zeta capilar plegada, mida el potencial zeta.
- Agregue la solución LNP en la cubeta hasta la línea de llenado. Insértelo en el instrumento asegurándose de que los electrodos están haciendo contacto con el instrumento.
- Configure un procedimiento operativo en el software del instrumento para incluir el tipo de medición, los detalles de la muestra (material, dispersante, temperatura y tipo de celda) y las instrucciones de medición (número de tiradas). Haga clic en Iniciar cuando esté listo para comenzar la adquisición de la medición.
Resultados
Se desarrollaron múltiples lotes de LNPs con la misma formulación lipídica y una relación N/P de 6 en días separados para demostrar la reproducibilidad de la técnica. Los lotes 1 y 2 dieron lugar a distribuciones de tamaño superpuestas con polidispersidad similar (Figura 2A) No se observaron diferencias significativas en el tamaño o la eficiencia de encapsulación entre los dos lotes diferentes (Figura 2B). La eficiencia ...
Discusión
La reproducibilidad, la velocidad y el cribado de bajo volumen son ventajas significativas del uso de la mezcla microfluídica para formar LNPs en comparación con otros métodos existentes (por ejemplo, hidratación de la película lipídica e inyección de etanol). Hemos demostrado la reproducibilidad de este método sin impacto en la eficiencia de encapsulación o el tamaño de partícula observado con diferentes lotes de LNP. Este es un criterio esencial para que cualquier terapia, incluidos los LNP, esté clínicame...
Divulgaciones
Todos los autores son empleados de Sanofi. Los autores declaran que no tienen conflicto de intereses ni intereses financieros en competencia.
Agradecimientos
Gracias a Atul Saluja, Yatin Gokarn, Maria-Teresa Peracchia, Walter Schwenger y Philip Zakas por su orientación y contribuciones al desarrollo de LNP.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (C-14 PEG) | Avanti Polar Lipids | 880151P | |
| 10 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1121-3810 | |
| 1000 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1111-2831 | |
| 20 µl Beveled Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-1810 | |
| 200 µl Graudated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-8810 | |
| 3β-Hydroxy-5-cholestene, 5-Cholesten-3β-ol (Cholesterol) | Sigma-Aldrich | C8667 | |
| BD Slip Tip Sterile Syringes (1 ml syringe) | Thermo Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes (3 ml syringe) | Thermo Fisher Scientific | 14-823-436 | |
| BD Vacutainer General Use Syringe Needles (BD Blunt Fill Needle 18G) | Thermo Fisher Scientific | 23-021-020 | |
| Benchtop Centrifuge | Beckman coulter | ||
| Black 96 well plates | Thermo Fisher Scientific | 14-245-177 | |
| BrandTech BRAND BIO-CERT RNase-, DNase-, DNA-free microcentrifuge tubes (1.5mL) | Thermo Fisher Scientific | 14-380-813 | |
| Citric Acid | Fisher Scientific | 02-002-611 | |
| Corning 500ml Vacuum Filter/Storage Bottle System, 0.22 um pore | Corning | 430769 | |
| Disposable folded capillary cells | Malvern | DTS1070 | |
| Ethyl Alcohol, Pure 200 proof | Sigma-Aldrich | 459844 | |
| Fisher Brand Semi-Micro Cuvette | Thermo Fisher Scientific | 14955127 | |
| Invitrogen Conical Tubes (15 mL) (DNase-RNase-free) | Thermo Fisher Scientific | AM12500 | |
| MilliporeSigma Amicon Ultra Centrifugal Filter Units | Thermo Fisher Scientific | UFC901024 | |
| NanoAssemblr Benchtop | Precision Nanyosystems | ||
| Nuclease-free water | Thermo Fisher Scientific | AM9930 | |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9624 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Thermo Fisher Scientific | P7589 | |
| Quant-iT RiboGreen RNA Assay Kit | Thermo Fisher Scientific | R11490 | |
| Sodium Chloride | Fisher Scientific | 02-004-036 | |
| Sodium Citrate, Dihydrate, granular | Fisher Scientific | 02-004-056 | |
| SpectraMax i3x | Molecular Devices | ||
| Zetasizer Nano | Malvern |
Referencias
- Mitchell, M. J., Billingsley, M. M., Haley, R. M., Wechsler, M. E., Peppas, N. A., Langer, R., et al. Engineering precision nanoparticles for drug delivery. Nature Reviews Drug Discovery. , 1-24 (2020).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nanoscience and technology: A collection of reviews from nature journals. (239), 250 (2010).
- Patra, J. K., Das, G., Fraceto, L. F., et al. Nano based drug delivery systems: recent developments and future prospects. J Nanobiotechnol. 16 (71), (2018).
- Rai, R., Alwani, S., Badea, I. Polymeric nanoparticles in gene therapy: New avenues of design and optimization for delivery applications. Polymers. 11 (4), 745 (2019).
- Bailey, C. M., Nagarajan, R., Camesano, T. A. Designing polymer micelles of controlled size, stability, and functionality for siRNA delivery. ACS Symposium Series. 1271, 35-70 (2017).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Bailey-Hytholt, C. M., Nagarajan, R., Camesano, T. A. Förster resonance energy transfer probing of assembly and disassembly of short interfering RNA/Poly(ethylene glycol)-Poly-L-Lysine polyion complex micelles. Molecular Assemblies: Characterization and Applications. , 47-60 (2020).
- Puri, A., Loomis, K., Smith, B. Lipid-based nanoparticles as pharmaceutical drug carriers: from concepts to clinic. Crit Rev Ther Drug Carrier Syst. 26 (6), 523-580 (2009).
- Cullis, P. R., Hope, M. J. Lipid nanoparticle systems for enabling gene therapies. Molecular Therapy. 25 (7), 1467-1475 (2017).
- Munsell, E. V., Ross, N. L., Sullivan, M. O. Journey to the center of the cell: Current Nanocarrier design strategies targeting biopharmaceuticals to the cytoplasm an nucleus. Current Pharmaceutical Design. 22 (9), 1227-1244 (2016).
- Zhao, Y., Huang, L. Lipid nanoparticles for gene delivery. Advances in Genetics. 88, 13-36 (2014).
- Chen, S., et al. Influence of particle size on the in vivo potency of lipid nanoparticle formulations of siRNA. Journal of Controlled Release. 235, 236-244 (2016).
- Wan, C., Allen, T. M., Cullis, P. R. Lipid nanoparticle delivery systems for siRNA-based therapeutics. Drug Delivery and Translational Research. 4 (1), 74-83 (2014).
- Kulkarni, J. A., Cullis, P. R., Van Der Meel, R. Lipid nanoparticles enabling gene therapies: From concepts to clinical utility. Nucleic Acid Therapeutics. 28 (3), 146-157 (2018).
- Shin, M. D., et al. COVID-19 vaccine development and a potential nanomaterial path forward. Nature Nanotechnology. 15 (8), 646-655 (2020).
- Thanh Le, T., et al. The COVID-19 vaccine development landscape. Nature Reviews. Drug Discovery. 19 (5), 305-306 (2020).
- Tam, Y. Y. C., Chen, S., Cullis, P. R. Advances in lipid nanoparticles for siRNA delivery. Pharmaceutics. 5 (3), 498-507 (2013).
- Cayabyab, C., Brown, A., Tharmarajah, G., Thomas, A. mRNA lipid nanoparticles. Precision Nanosystems Application Note. , (2019).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nature Biotechnology. 31 (7), 638-646 (2013).
- Suzuki, Y., Ishihara, H. Structure, activity and uptake mechanism of siRNA-lipid nanoparticles with an asymmetric ionizable lipid. International Journal of Pharmaceutics. 510 (1), 350-358 (2016).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Schmid, J. A. The acidic environment in endocytic compartments. Biochemical Journal. 303 (2), 679-680 (1994).
- Maugeri, M., et al. Linkage between endosomal escape of LNP-mRNA and loading into EVs for transport to other cells. Nature Communications. 10 (1), (2019).
- Kulkarni, J. A., Witzigmann, D., Leung, J., Tam, Y., Cullis, P. R. On the role of helper lipids in lipid nanoparticle formulations of siRNA. Nanoscale. (45), (2019).
- Hafez, I. M., Maurer, N., Cullis, P. R. On the mechanism whereby cationic lipids promote intracellular delivery of polynucleic acids. Gene Therapy. 8 (15), 1188-1196 (2001).
- Hafez, I. M., Culis, P. R. Roles of lipid polymorphism in intracellular delivery. Advanced Drug Delivery Reviews. 47 (2-3), 139-148 (2001).
- Evers, M. J. W., et al. State-of-the-art design and rapid-mixing production techniques of lipid nanoparticles for nucleic acid delivery. Small Methods. 2 (9), 1700375 (2018).
- Mui, B. L., et al. Influence of polyethylene glycol lipid desorption rates on pharmacokinetics and pharmacodynamics of siRNA lipid nanoparticles. Molecular Therapy - Nucleic Acids. 2 (139), (2013).
- Zukancic, D., et al. The importance of poly(Ethylene glycol) and lipid structure in targeted gene delivery to lymph nodes by lipid nanoparticles. Pharmaceutics. 12 (11), 1-16 (2020).
- NEBioCalculator. New England BioLabs Inc Available from: https://nebiocalculator.neb.com/#!/formulas (2020)
- Kastner, E., et al. High-throughput manufacturing of size-tuned liposomes by a new microfluidics method using enhanced statistical tools for characterization. International Journal of Pharmaceutics. 477 (1-2), 361-368 (2014).
- Zhigaltsev, I. V., et al. Bottom-up design and synthesis of limit size lipid nanoparticle systems with aqueous and triglyceride cores using millisecond microfluidic mixing. Langmuir. 28 (7), 3633-3640 (2012).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37 (2012).
- Hassett, K. J., et al. Optimization of lipid nanoparticles for intramuscular administration of mRNA vaccines. Molecular Therapy - Nucleic Acids. 15, 1-11 (2019).
- Tanaka, H., et al. The delivery of mRNA to colon inflammatory lesions by lipid-nano-particles containing environmentally-sensitive lipid-like materials with oleic acid scaffolds. Heliyon. 4 (12), 00959 (2018).
- Singh, J., et al. Nucleic acid lipid nanoparticles. Precision Nanosystems Application Note. , (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados