需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用微流体混合平台为基因传递制订和定性脂质纳米粒子
摘要
脂质纳米粒子是使用微流体混合平台方法开发的,用于mRNA和DNA封装。
摘要
基于脂质的药物载体由于体积小、生物相容性和封装效率高,已用于临床和商业上可用的交付系统。使用脂质纳米粒子(LNPs)封装核酸有利于保护RNA或DNA免受降解,同时促进细胞吸收。LNPs 通常含有多种脂质成分,包括电离子脂、辅助脂质、胆固醇和聚乙烯乙二醇 (PEG) 结合脂质。LNPs 可以很容易地封装核酸,由于电离子脂质的存在,在低 pH 值是阴离子的,并允许与负电压 RNA 或 DNA 的复合。在这里,LNPs是通过封装信使RNA(mRNA)或质粒DNA(pDNA)形成的,使用有机相中的脂质成分和在声相中核酸成分的快速混合。这种混合使用精确的微流体混合平台进行,允许纳米粒子自组装,同时保持层流。水动力学大小和多散射是使用动态光散射 (DLS) 测量的。LNP 上的有效表面电荷通过测量 zeta 电位来确定。封装效率的特点是使用荧光染料来量化包裹的核酸。具有代表性的结果表明,该方法具有可重复性,并且不同的配方和工艺参数对已开发的 LNP 具有影响。
引言
药物携带者用于保护和提供具有典型有利特性的治疗,包括低细胞毒性,增加生物可用性,并改善稳定性1,2,3。聚合物纳米粒子、鼠类和脂质粒子以前曾被探索过核酸封装和输送4、5、6、7。脂质已用于不同类型的纳米载体系统,包括脂质体和脂质纳米粒子,因为它们与高稳定性8生物相容。LNPs可以很容易地封装核酸的基因传递9,10。它们保护核酸在系统循环过程中不受血清蛋白酶的降解,并可以改善对特定部位的输送,因为LNPs的表面地形和物理特性会影响其生物分布12。LNPs还改善组织渗透和细胞吸收9。先前的研究表明,在LNP13中,西RNA封装取得了成功,包括首个含有西RNA治疗遗传性转乙酰激素介质淀粉样体病的LNP治疗药物,该疗法于2018年获得美国食品和药物管理局(FDA)和欧洲药品管理局的批准。最近,正在研究LNPs的交付更大的核酸,即mRNA和DNA9。截至2018年,有+22个基于脂质的核酸输送系统正在进行临床试验14。此外,含有LNPs的mRNA目前是主要候选者,并已受雇于COVID-19疫苗15,16。这些非病毒基因疗法的潜在成功需要形成小(+100 nm),稳定和均匀的粒子与高核酸封装。
在LNP配方中使用电离子脂作为主要成分,在复合、封装和递送效率14方面显示出优势。离子脂质通常具有酸分离常数 (pKa) < 7:例如,二烯酰-4-二甲基丁基丁酸酯(D-Lin-MC3-DMA),在FDA批准的LNP配方中使用的电离子脂质,pKa为6.4417。在低pH值下,电离子脂质上的胺组变得质子化和正电荷,允许在mRNA和DNA上与负电荷磷酸盐组组装。胺、"N"、组与磷酸盐、"P"的比例,用于优化组件。N/P比率取决于使用的脂质和核酸,根据配方18而异。形成后,pH值可调整为中性或生理pH值,以便进行治疗管理。在这些 pH 值下,电离脂质也脱质,从而向 LNP 提供中性表面电荷。
电离子脂也有助于内分泌逃生19,20。LNPs在细胞吸收过程中接受内分泌,必须从内皮体中释放出来,以便将mRNA货物送入细胞质或DNA货物到细胞核21。内皮体内部通常比细胞外介质更酸性,使电离子脂质正电荷22,23。带正电荷的电离子脂质可与内分泌脂膜上的负电荷相互作用,从而导致内皮体不稳定,从而释放LNP和核酸。目前正在研究不同的电离子脂质,以提高LNP分布的功效,以及内分泌逃逸14。
LNP 的其他典型成分包括辅助脂质,如磷脂酰胆碱 (PC) 或磷乙醇胺 (PE) 脂质。1,2-二甲苯-sn-甘油-3-磷乙醇胺(多普),1,2-二乙酰-sn-甘油-3-磷 磷胆碱 (DSPC), 和 1,2 二醇 - sn-甘油-3 磷胆碱 (DOPC) 是常用的辅助脂质24,25.DOPE已被证明形成一个倒置的六边形II(HII)相,并通过膜融合26增强透射,而DSPC已被认为稳定LNPs与圆柱形几何27。胆固醇也被纳入配方,以增加膜刚度,随后有助于LNP的稳定。最后,脂质结合聚乙烯乙二醇(PEG)被纳入配方,以提供必要的石碑屏障,以帮助在粒子自组装27。PEG 还通过防止聚合来提高 LNP 的存储稳定性。此外,PEG 经常被用作隐形组件,可以增加 LNP 的循环时间。然而,这一属性也可能构成挑战,招募LNPs肝细胞通过内源性定位机制驱动的阿波利波蛋白E(ApoE)28。因此,研究已经调查了从LNP扩散PEG的乙酰链长度,发现短长度(C8-14)与LNP分离,更适合ApoE招募相比,更长的乙酰长度28。此外,PEG 与之结合的脂质尾巴饱和程度已证明会影响 LNPs29的组织分布。最近,Tween 20,这是生物药物制剂中常用的表面活性剂,具有长期不饱和脂质的尾巴,与PEG-DSPE相比,在排出淋巴结方面具有很高的转化性,PEG-DSPE主要在注射部位29处对肌肉进行透射。此参数可以优化,以实现所需的 LNP 生物分布。
传统的LNP形成方法包括薄膜水化法和乙醇注射法27。虽然这些是现成的技术,他们也是劳动密集型的,可能会导致低封装效率,并具有挑战性地扩大27。混合技术的进步使得方法更易放大,同时开发出更均匀的粒子27。这些方法包括T结混合,交错鱼骨混合,微流体流体动力学聚焦27。每种方法都有独特的结构,但都允许快速混合含有核酸的一个液态与含有脂质成分的有机相,从而产生高封装的核酸27。在此协议中,利用通过微流体墨盒进行快速和可控的混合,采用交错的鱼骨混合设计。本协议概述了含有 LNPs 的核酸的制备、组装和定性。
研究方案
图1提供了整个过程的示意图。
1. 准备缓冲器
注意:这里强烈建议对缓冲器进行无菌过滤,以去除可能影响核酸和 LNP 质量的任何颗粒物。
- 磷酸盐缓冲盐水 (PBS)
- 使用 8 mM Na2HPO 4、2 mM KH2PO4、137 mM NaCl 和 2.7 mM KCl 在核酸酶无水中准备 1x PBS,并将 pH 值调整为 7.4。
- 使用 0.22 μm 孔径过滤器进行真空过滤消毒。
- 柠檬酸盐缓冲器
- 使用 5 mM 柠檬酸钠、5 mM 柠檬酸和 150 mM 氯化钠在无核酸水中准备柠檬酸盐缓冲器,并调整到 pH 4.5。
- 使用 0.22 μm 孔径过滤器进行真空过滤消毒。
注:只有在 mRNA 是将封装在 LNP 中的核酸时,才需要准备柠檬酸盐缓冲器。如果DNA将被封装跳过1.2,并继续到1.3。
- 乳酸缓冲器
- 使用20mM乳酸和30mM氯化钠在无核酸水中准备乳酸缓冲器,并调整到pH3.0。
- 使用 0.22 μm 孔径过滤器进行真空过滤消毒。
注:只有当DNA是将封装在LNP中的核酸时,才需要准备乳酸缓冲器。如果要封装 mRNA,请跳过 1.3。柠檬酸盐缓冲用于 mRNA 封装,因为带乳酸缓冲器的 3.0 的低 pH 值可能导致 mRNA 降解的可能性增加。协议可以在此处暂停。
2. 脂质混合物的制备
- 如果库存脂质为粉末状,则以纯 200 证明乙醇溶液。
- 根据所需的摩尔比率计算所需的脂质成分组合。50:10:39:1(离子脂质:辅助脂质:胆固醇:PEG)的摩尔比将在这里用作总脂质浓度为10mM的示例。 表 1 显示每个组件所需的浓度和体积。
注:在计算微流体混合器乙醇 (EtOH) 中实现脂质混合浓度所需的体积时,会考虑总体积,以确保 EtOH 的添加不会影响脂质浓度。例如,通过将乙醇中的 5 mM 浓度乘以 533 μL 的总脂质混合体积,然后除以 38.9 mM 的库存脂质浓度来计算 68.5 μL 的电离子脂质体积。 - 将每个脂质库存溶液的适当数量添加到玻璃瓶中,使组件与间歇性涡流混合。加入200种证明乙醇,总混合物为533微升。例如,表 1,这是254微升乙醇。
注:要单次运行以生产 1 mL 的 LNPs,需要 342.5 μL 的脂质溶液。这是由于3:1混合了液态核酸到有机脂溶液,在样品收集前后丢弃了一些体积。混合 533 μL 以补偿超标。
3. 核酸溶液的制备
注:核酸溶液的准备和处理将在无菌和无砷的环境中尽可能进行。尽可能用核酸在生物安全柜中工作。
- 计算市盈率。N/P 比率是可电离子脂胺组 (N) 与负电压核酸磷酸盐组 (P) 的总数。N/P 比率通常是在 LNP 形成期间可以优化的参数。按照下面的步骤操作。
- 使用以下公式计算 N 单位的数量:
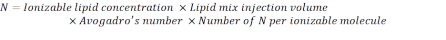
注:电离子脂质浓度(表1)为5mM,相当于5×10-6摩尔/mL。所需的脂质注射量为 0.3425 mL。例如,如果每个分子的 N 单位数为 1,则使用上述方程,脂质混合物中有 1.03 x10 18 N 单位。 - 计算所需 N/P 比率的 P 单位。例如,这里使用了 N/P = 36。
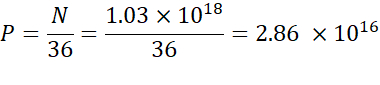
- 使用以下公式计算 N 单位的数量:
- 使用以下方程计算必要的核酸浓度,以获得 2.86 x10 16 P 单位。
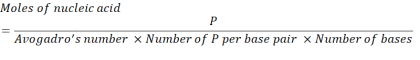
其中,mRNA 每碱基对的 P 单位数为 1,DNA 为 2。对于具有 1,200 个碱基的 mRNA,N/P = 36 所需的 mRNA 量为 3.96 x 10-11 摩尔。 - 使用以下方程计算 N/P = 36 所需的 mRNA 质量浓度。
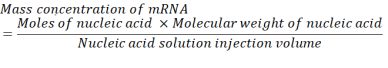
核糖核苷酸单磷酸盐单位的平均分子量为322克/摩尔30。mRNA的分子量为1,200基mRNA,分子量为386,400克/摩尔。核酸溶液所需的注射量为 1.028 mL。因此,所需的 mRNA 浓度为 1.488x10-5 g/mL,即 14.88 μg/mL。 - 在柠檬酸盐缓冲区中,组成 1.5 mL 的 14.88 μg/mL 的 mRNA。
注:当DNA将核酸封装时,使用乳酸缓冲剂来组成核酸溶液。
4. 启动微流体通道
注:此协议根据仪器制造商的准则进行修改。
- 单击相应的字段(表 2)将启动参数输入到仪器软件中。
注:建议流量比为3:1,流量为4-12 mL/min。。。这已被证明是最好的研究在这里提出,以及制造商。如果对申请感兴趣,情况可能会有所不同。 - 打开仪表盖,将微流体墨盒放入旋转块中。
- 将至少 0.5 mL 的乙醇抽入 1 mL 注射器中,确保注射器尖端没有气泡或空气间隙。将此注射器加载到墨盒的右入口。
- 用1.5兆L的排液缓冲器填充3mL注射器(RNA的柠檬酸盐和DNA的乳酸),确保没有气泡或间隙。将此注射器加载到墨盒的左入口。
- 在夹子支架中插入两个 15 mL 圆锥形管,用作废容器。
- 单击" 运行" 仪器软件开始混合,确保参数输入正确。
- 当仪器停止启动时,由底部蓝光关闭指示,打开盖子并正确处理锥形管和注射器。
5. LNP 编队
注:此协议根据仪器制造商的准则进行修改。
- 点击相应的字段(表2),用配方参数更新软件。
- 将 1 mL 注射器与脂质混合物一起填充(在第 2 步中准备)。去除注射器尖端的任何气隙或气泡,并将注射器插入墨盒的右侧。
- 将核酸溶液(在第 3 步中准备)绘制到 3 mL 注射器中,确保注射器尖端没有气泡或气隙。将注射器插入墨盒的左入口。
注:提供卷,使LNPs的1ml解决方案。该仪器可以集成高达 10 mL 的注射器尺寸,并且体积可以相应地缩放,不会对结果造成影响。一次制备中可制备的 LNP 的最大容量为 12 mL。 - 将一个 15 mL 无 RNase 的锥形管标记为样本名称,并插入到左管夹中。将 15 mL 废圆锥体放在右管夹中。
- 在确认参数的正确输入后,关闭仪表盖并单击 "运行"。
- 仪器运行完后,正确丢弃废容器和墨盒。保留带有 LNP 样品的圆锥管。
- 用 PBS 稀释 LNP 5x,将乙醇降至 <5% (v/v)。
注:在微流体混合后,尽快稀释PBS中的LNPs,以防止降解,这一点很重要。始终在生物安全柜中执行稀释,并在整个缓冲交换期间继续在生物安全柜中工作。
6. 缓冲交换
注:提供使用超离心机过滤器的协议。虽然此方法可更及时高效地交换缓冲器,但透析可以在此处替代。
- 通过 1000 x g 的离心机离心,预洗 2 mL PBS 的超离心机过滤器(100 kDa 孔径大小),持续 5 分钟。从底部隔间清空 PBS。
注:选择PBS将pH值提高到7.4±0.2,这在生理上是相关的,将导致电离子脂具有中性电荷。 - 将稀释的 LNPs 添加到预洗超离心机滤清器的顶舱中,以 1000 x g 为离心机,持续 12 分钟。
- 丢弃从底部隔间流过的流量。每次在超离心机滤清器中加入 5 mL 的 PBS,再进行两次清洗。以相同的参数离心。没有需要保持的最大音量。
注:如果准备了放大的 LNP 体积,则相应地增加每次洗涤的 PBS 体积。例如,如果单次运行时准备了 2 mL 的 LNPs,则建议每次洗涤 10 mL PBS。 - 将 LNP 解决方案对超离心机滤光片的墙壁进行几次,以最大限度地减少 LNP 损失。从超离心机过滤器中取出 LNP 溶液并存放在无核素小瓶中。如果需要,添加 PBS 以实现 1 mL 的 LNP 解决方案的最终体积。
- 如有必要,通过预湿的 0.2 μm 注射器过滤器进行过滤。
注:协议可以在此处暂停。
7. 测量封装效率
- 通过在 PBS 中对工作核酸溶液进行 2 倍串序稀释,从最高浓度 500 ng/mL 开始,并至少进行 5 次稀释,从而准备标准曲线。将 PBS 用作空白。
- 准备 LNP 样品稀释。用 PBS 稀释 LNP 样品,以实现围绕标准曲线中点的大致理论浓度(例如,从初始浓度估计的 250 ng/mL 核酸)。
- 准备使用 TritonX-100 的 RNA 定量试剂(用于 mRNA 测量)的解决方案,以破坏 LNPs 并测量 LNP 内外的核酸总量。此解决方案包含 0.5% (v/v) RNA 试剂、0.4% (v/v) TritonX-100 和 99.1% (v/v) PBS。
- 准备一个没有 TritonX-100 的试剂溶液,以测量 LNPs 中未封装的核酸量。此解决方案包含 0.5% (v/v) RNA 试剂和 99.5% (v/v) PBS。
注:如果 LNPs 封装双搁浅 DNA (dsDNA),如质粒 DNA,则按照相同的程序在 7.3 和 7.4 中使用 dsDNA 试剂。 - 在 96 井黑色荧光板中,装载至少四个复制的 LNP 和核酸标准溶液,分别以 7.1 和 7.2 表示。
- 在标准和样品的复制品中,增加一个包含 TritonX-100 的试剂的等量。这将量化核酸的总量。
- 在剩余的标准和样品井中,添加具有 TritonX-100 的同等数量的试剂。这将量化LNP中未封装的核酸量。
- 在室温下摇动板5分钟,确保将标准和样品与添加的试剂彻底混合,采取预防措施避免光线照射。
- 使用微板读取器测量荧光,激发波长为 480 nm,发射波长为 520 nm。
- 使用添加没有 TritonX-100 的试剂所制定的标准曲线计算 LNP 以外的核酸浓度。乘以 7.2 中使用的稀释因子。
- 使用添加含有 TritonX-100 的试剂所制定的标准曲线计算 LNP 内外核酸的浓度。乘以 7.2 中使用的稀释因子。
- 通过从内外核酸的总浓度中减去核酸的浓度(从第7.10步计算),计算核酸内部的浓度(从第7.11步计算)
- 从LNP内核酸浓度(从第7.12步计算)和核酸总浓度(从第7.11步计算)中量化封装效率。
注:协议可以在此处暂停。
8. 浓度调整
- 如有必要,使用封装效率的结果调整 LNP 溶液中的核酸浓度。
- 如果需要不太集中的解决方案,则用 PBS 稀释溶液以实现所需的浓度。
- 如果需要更集中的解决方案,则使用超离心机过滤器进行额外的离心运行。
注:协议可以在此处暂停。
9. 测量LNP流体动力大小和多分散性
- 将 LNP 解决方案的引文稀释 40 倍,与 PBS 配合在一起,以获得 1 mL 的最终体积。
注意:如果需要,可能会更改此稀释。建议此稀释值,因为它使用少量的 LNP 库存解决方案,同时提供质量结果。 - 使用半微微晶圈,测量流体动力直径和多分散度指数。将 LNP 解决方案添加到库维特并插入仪器中。在仪器软件中设置操作程序,包括测量类型、样品详细信息(材料、分散剂、温度和细胞类型)和测量说明(运行次数)。当准备开始测量采集时,单击 "开始 "。
10. 衡量LNP泽塔潜力
- 用无核酸酶水稀释 LNP 溶液 40 倍的酸液,以获得 1 mL 的最终体积。
注:无核酸酶水用作zeta潜在测量的溶剂,以尽量减少高盐缓冲对电导率的影响。 - 使用折叠毛细细的泽塔细胞,测量泽塔的潜力。
- 将 LNP 解决方案添加到填充线的库维特中。插入仪器,确保电极与仪器接触。
- 在仪器软件中设置操作程序,包括测量类型、样品详细信息(材料、分散剂、温度和细胞类型)和测量说明(运行次数)。当准备开始测量采集时,单击 "开始 "。
结果
在不同的天开发了多批具有相同脂质配方和6的NPP,以证明该技术的可重复性。第1批和第2批导致大小分布重叠,具有类似的多散(图2A),在两个不同批次之间的大小或封装效率方面没有显著差异(图2B)。每批封装效率高(>98.5%),尺寸与77纳米LNP直径相似。颗粒均匀,第 1 批的平均多分散度指数 (PDI) 为 0.15,第 2 批的平均...
讨论
与其他现有方法(如脂膜水化和乙醇注射)相比,可重复性、速度和低体积筛选是使用微流体混合形成 LNP 的重要优势。我们已经证明了这种方法的可重复性,对用不同的LNP批次观察到的封装效率或颗粒大小没有影响。这是任何治疗,包括LNPs,成为临床可用的基本标准。
这里描述的技术采用交错的鱼骨微流体混合,这导致LNP形成的时间尺度只有几分钟。这种混合使用混沌的?...
披露声明
所有作者都是萨诺菲的员工。作者宣称他们没有利益冲突或相互竞争的经济利益。
致谢
感谢阿图尔·萨卢贾、亚廷·戈卡恩、玛丽亚-特雷莎·佩拉基亚、沃尔特·施文格和菲利普·扎卡斯对LNP发展的指导和贡献。
材料
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (C-14 PEG) | Avanti Polar Lipids | 880151P | |
| 10 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1121-3810 | |
| 1000 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1111-2831 | |
| 20 µl Beveled Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-1810 | |
| 200 µl Graudated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-8810 | |
| 3β-Hydroxy-5-cholestene, 5-Cholesten-3β-ol (Cholesterol) | Sigma-Aldrich | C8667 | |
| BD Slip Tip Sterile Syringes (1 ml syringe) | Thermo Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes (3 ml syringe) | Thermo Fisher Scientific | 14-823-436 | |
| BD Vacutainer General Use Syringe Needles (BD Blunt Fill Needle 18G) | Thermo Fisher Scientific | 23-021-020 | |
| Benchtop Centrifuge | Beckman coulter | ||
| Black 96 well plates | Thermo Fisher Scientific | 14-245-177 | |
| BrandTech BRAND BIO-CERT RNase-, DNase-, DNA-free microcentrifuge tubes (1.5mL) | Thermo Fisher Scientific | 14-380-813 | |
| Citric Acid | Fisher Scientific | 02-002-611 | |
| Corning 500ml Vacuum Filter/Storage Bottle System, 0.22 um pore | Corning | 430769 | |
| Disposable folded capillary cells | Malvern | DTS1070 | |
| Ethyl Alcohol, Pure 200 proof | Sigma-Aldrich | 459844 | |
| Fisher Brand Semi-Micro Cuvette | Thermo Fisher Scientific | 14955127 | |
| Invitrogen Conical Tubes (15 mL) (DNase-RNase-free) | Thermo Fisher Scientific | AM12500 | |
| MilliporeSigma Amicon Ultra Centrifugal Filter Units | Thermo Fisher Scientific | UFC901024 | |
| NanoAssemblr Benchtop | Precision Nanyosystems | ||
| Nuclease-free water | Thermo Fisher Scientific | AM9930 | |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9624 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Thermo Fisher Scientific | P7589 | |
| Quant-iT RiboGreen RNA Assay Kit | Thermo Fisher Scientific | R11490 | |
| Sodium Chloride | Fisher Scientific | 02-004-036 | |
| Sodium Citrate, Dihydrate, granular | Fisher Scientific | 02-004-056 | |
| SpectraMax i3x | Molecular Devices | ||
| Zetasizer Nano | Malvern |
参考文献
- Mitchell, M. J., Billingsley, M. M., Haley, R. M., Wechsler, M. E., Peppas, N. A., Langer, R., et al. Engineering precision nanoparticles for drug delivery. Nature Reviews Drug Discovery. , 1-24 (2020).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nanoscience and technology: A collection of reviews from nature journals. (239), 250 (2010).
- Patra, J. K., Das, G., Fraceto, L. F., et al. Nano based drug delivery systems: recent developments and future prospects. J Nanobiotechnol. 16 (71), (2018).
- Rai, R., Alwani, S., Badea, I. Polymeric nanoparticles in gene therapy: New avenues of design and optimization for delivery applications. Polymers. 11 (4), 745 (2019).
- Bailey, C. M., Nagarajan, R., Camesano, T. A. Designing polymer micelles of controlled size, stability, and functionality for siRNA delivery. ACS Symposium Series. 1271, 35-70 (2017).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Bailey-Hytholt, C. M., Nagarajan, R., Camesano, T. A. Förster resonance energy transfer probing of assembly and disassembly of short interfering RNA/Poly(ethylene glycol)-Poly-L-Lysine polyion complex micelles. Molecular Assemblies: Characterization and Applications. , 47-60 (2020).
- Puri, A., Loomis, K., Smith, B. Lipid-based nanoparticles as pharmaceutical drug carriers: from concepts to clinic. Crit Rev Ther Drug Carrier Syst. 26 (6), 523-580 (2009).
- Cullis, P. R., Hope, M. J. Lipid nanoparticle systems for enabling gene therapies. Molecular Therapy. 25 (7), 1467-1475 (2017).
- Munsell, E. V., Ross, N. L., Sullivan, M. O. Journey to the center of the cell: Current Nanocarrier design strategies targeting biopharmaceuticals to the cytoplasm an nucleus. Current Pharmaceutical Design. 22 (9), 1227-1244 (2016).
- Zhao, Y., Huang, L. Lipid nanoparticles for gene delivery. Advances in Genetics. 88, 13-36 (2014).
- Chen, S., et al. Influence of particle size on the in vivo potency of lipid nanoparticle formulations of siRNA. Journal of Controlled Release. 235, 236-244 (2016).
- Wan, C., Allen, T. M., Cullis, P. R. Lipid nanoparticle delivery systems for siRNA-based therapeutics. Drug Delivery and Translational Research. 4 (1), 74-83 (2014).
- Kulkarni, J. A., Cullis, P. R., Van Der Meel, R. Lipid nanoparticles enabling gene therapies: From concepts to clinical utility. Nucleic Acid Therapeutics. 28 (3), 146-157 (2018).
- Shin, M. D., et al. COVID-19 vaccine development and a potential nanomaterial path forward. Nature Nanotechnology. 15 (8), 646-655 (2020).
- Thanh Le, T., et al. The COVID-19 vaccine development landscape. Nature Reviews. Drug Discovery. 19 (5), 305-306 (2020).
- Tam, Y. Y. C., Chen, S., Cullis, P. R. Advances in lipid nanoparticles for siRNA delivery. Pharmaceutics. 5 (3), 498-507 (2013).
- Cayabyab, C., Brown, A., Tharmarajah, G., Thomas, A. mRNA lipid nanoparticles. Precision Nanosystems Application Note. , (2019).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nature Biotechnology. 31 (7), 638-646 (2013).
- Suzuki, Y., Ishihara, H. Structure, activity and uptake mechanism of siRNA-lipid nanoparticles with an asymmetric ionizable lipid. International Journal of Pharmaceutics. 510 (1), 350-358 (2016).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Schmid, J. A. The acidic environment in endocytic compartments. Biochemical Journal. 303 (2), 679-680 (1994).
- Maugeri, M., et al. Linkage between endosomal escape of LNP-mRNA and loading into EVs for transport to other cells. Nature Communications. 10 (1), (2019).
- Kulkarni, J. A., Witzigmann, D., Leung, J., Tam, Y., Cullis, P. R. On the role of helper lipids in lipid nanoparticle formulations of siRNA. Nanoscale. (45), (2019).
- Hafez, I. M., Maurer, N., Cullis, P. R. On the mechanism whereby cationic lipids promote intracellular delivery of polynucleic acids. Gene Therapy. 8 (15), 1188-1196 (2001).
- Hafez, I. M., Culis, P. R. Roles of lipid polymorphism in intracellular delivery. Advanced Drug Delivery Reviews. 47 (2-3), 139-148 (2001).
- Evers, M. J. W., et al. State-of-the-art design and rapid-mixing production techniques of lipid nanoparticles for nucleic acid delivery. Small Methods. 2 (9), 1700375 (2018).
- Mui, B. L., et al. Influence of polyethylene glycol lipid desorption rates on pharmacokinetics and pharmacodynamics of siRNA lipid nanoparticles. Molecular Therapy - Nucleic Acids. 2 (139), (2013).
- Zukancic, D., et al. The importance of poly(Ethylene glycol) and lipid structure in targeted gene delivery to lymph nodes by lipid nanoparticles. Pharmaceutics. 12 (11), 1-16 (2020).
- NEBioCalculator. New England BioLabs Inc Available from: https://nebiocalculator.neb.com/#!/formulas (2020)
- Kastner, E., et al. High-throughput manufacturing of size-tuned liposomes by a new microfluidics method using enhanced statistical tools for characterization. International Journal of Pharmaceutics. 477 (1-2), 361-368 (2014).
- Zhigaltsev, I. V., et al. Bottom-up design and synthesis of limit size lipid nanoparticle systems with aqueous and triglyceride cores using millisecond microfluidic mixing. Langmuir. 28 (7), 3633-3640 (2012).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37 (2012).
- Hassett, K. J., et al. Optimization of lipid nanoparticles for intramuscular administration of mRNA vaccines. Molecular Therapy - Nucleic Acids. 15, 1-11 (2019).
- Tanaka, H., et al. The delivery of mRNA to colon inflammatory lesions by lipid-nano-particles containing environmentally-sensitive lipid-like materials with oleic acid scaffolds. Heliyon. 4 (12), 00959 (2018).
- Singh, J., et al. Nucleic acid lipid nanoparticles. Precision Nanosystems Application Note. , (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。