Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Формулирование и характеристика липидных наночастиц для доставки генов с использованием платформы микрофлюидного смешивания
В этой статье
Резюме
Липидные наночастицы разработаны с использованием микрофлюидного подхода к смешиванию платформы для инкапсуляции мРНК и ДНК.
Аннотация
Носители лекарств на основе липидов использовались для клинически и коммерчески доступных систем доставки из-за их небольшого размера, биосовместимости и высокой эффективности инкапсуляции. Использование липидных наночастиц (ЛНФ) для инкапсуляции нуклеиновых кислот выгодно для защиты РНК или ДНК от деградации, а также способствует поглощению клеток. ЛНП часто содержат несколько липидных компонентов, включая ионизируемый липид, хелперный липид, холестерин и конъюгированный липид полиэтиленгликоля (ПЭГ). ЛНФ могут легко инкапсулировать нуклеиновые кислоты благодаря ионизируемому липидному присутствию, которое при низком рН является катионным и позволяет комплексовать с отрицательно заряженной РНК или ДНК. Здесь ЛНП образуются путем инкапсуляции матричной РНК (мРНК) или плазмидной ДНК (пДНК) с использованием быстрого смешивания липидных компонентов в органической фазе и компонента нуклеиновой кислоты в водной фазе. Это смешивание выполняется с использованием точной микрофлюидной платформы смешивания, позволяющей самосборку наночастиц при сохранении ламинарного потока. Гидродинамический размер и полидисперсность измеряются с помощью динамического рассеяния света (DLS). Эффективный поверхностный заряд на LNP определяется путем измерения дзета-потенциала. Эффективность инкапсуляции характеризуется с использованием флуоресцентного красителя для количественной оценки застрявленной нуклеиновой кислоты. Репрезентативные результаты демонстрируют воспроизводимость этого метода и влияние, которое различные рецептурные и технологические параметры оказывают на разработанные ЛМП.
Введение
Лекарственные носители используются для защиты и доставки терапевтических средств с типичными благоприятными свойствами, включая низкую цитотоксичность, повышенную биодоступность и улучшенную стабильность1,2,3. Полимерные наночастицы, мицеллы и частицы на основе липидов ранее были исследованы для инкапсуляции и доставки нуклеиновых кислот4,5,6,7. Липиды были использованы в различных типах нанонесушек, включая липосомы и липидные наночастицы, поскольку они биосовместимы с высокой стабильностью8. ЛНПцы могут легко инкапсулировать нуклеиновые кислоты для доставки генов9,10. Они защищают нуклеиновую кислоту от деградации сывороточными протеазами во время системного кровообращения11 и могут улучшить доставку к определенным участкам, так как топография поверхности и физические свойства ЛМП влияют на их биораспределение12. ЛНПЦ также улучшают проникновение в ткани и клеточное поглощение9. Предыдущие исследования продемонстрировали успех инкапсуляции siRNA в LNP13,включая первый коммерчески доступный LNP, содержащий siRNA терапевтический для лечения полинейропатии наследственного транстиретин-опосредованного амилоидоза14, который был одобрен Управлением по контролю за продуктами и лекарствами США (FDA) и Европейским агентством по лекарственным средствам в 2018 году. Совсем недавно ЛНПц изучаются для доставки более крупных фрагментов нуклеиновых кислот, а именно мРНК и ДНК9. По состоянию на 2018 год было ~ 22 системы доставки нуклеиновых кислот на основе липидов, проходящие клинические испытания14. Кроме того, мРНК, содержащие ЛНВ, в настоящее время являются ведущими кандидатами и используются для вакцины от COVID-1915,16. Потенциальный успех этих невирусных генных терапий требует формирования небольших (~ 100 нм), стабильных и однородных частиц с высокой инкапсуляцией нуклеиновой кислоты.
Использование ионизируемого липида в качестве основного компонента в составе LNP показало преимущества для комплексования, инкапсуляции и эффективности доставки14. Ионизируемые липиды обычно имеют константу кислотной диссоциации (pKa) < 7; например, дилинолейлметил-4-диметиламинобутират (D-Lin-MC3-DMA), ионизируемый липид, используемый в одобренном FDA препарате LNP, имеет pKa 6,4417. При низком рН аминные группы на ионизируемом липиде становятся протонированными и положительно заряженными, что позволяет проводить сборку с отрицательно заряженными фосфатными группами на мРНК и ДНК. Для оптимизации сборки используется отношение аминов, «N», групп к фосфатам, «Р», группам. Соотношение N/P зависит от используемых липидов и нуклеиновых кислот, которое варьируется в зависимости от состава18. После образования рН может быть скорректирован до нейтрального или физиологического рН, чтобы обеспечить терапевтическое введение. При этих значениях рН ионизируемый липид также депротонируется, что придает нейтральный поверхностный заряд LNP.
Ионизируемый липид также помогает в эндосомальномпобеге19,20. ЛНВ подвергаются эндоцитозу во время клеточного поглощения и должны быть освобождены из эндосомы, чтобы доставить груз мРНК в цитоплазму клетки или груз ДНК в ядро21. Внутри эндосомы обычно находится более кислая среда, чем внеклеточная среда, которая делает ионизируемый липид положительно заряженным22,23. Положительно заряженный ионизируемый липид может взаимодействовать с отрицательными зарядами на эндосомальной липидной мембране, что может вызвать дестабилизацию эндосомы, что позволяет высвобождать LNP и нуклеиновую кислоту. Различные ионизируемые липиды в настоящее время изучаются для повышения эффективности как распределения LNP, так и эндосомального побега14.
Другие типичные компоненты LNP включают хелперные липиды, такие как фосфатидилхолин (PC) или фосфоэтаноламин (PE) липид. 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (DOPE), 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC) и 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC) обычно используются хелперные липиды24,25. Было показано, что DOPE образует перевернутую гексагональную фазу II (HII) и усиливает трансфекцию путем слияния мембран26,в то время как DSPC, как полагают, стабилизирует ЛНП с его цилиндрической геометрией27. Холестерин также включен в состав для повышения жесткости мембраны, что впоследствии способствует стабильности LNP. Наконец, липид-конъюгированный полиэтиленгликоль (ПЭГ) включен в состав для обеспечения необходимого стерического барьера для помощи в самосборке частиц27. PEG также повышает стабильность хранения ЛНВ, предотвращая агрегацию. Кроме того, PEG часто используется в качестве скрытого компонента и может увеличить время циркуляции для ЛНП. Однако этот признак может также создавать проблемы для рекрутирования ЛНПц в гепатоциты через эндогенный механизм таргетирования, управляемый аполипопротеином Е (АпоЭ)28. Таким образом, исследования исследовали длину ациловой цепи для диффузии ПЭГ из LNP, обнаружив, что короткие длины (C8-14) диссоциируют от LNP и более поддаются набору ApoE по сравнению с более длинными ациламидлин 28. Кроме того, было показано, что степень насыщения липидного хвоста, с которым конъюгируется ПЭГ, влияет на распределение в тканях ЛНПц29. Недавно было показано, что Tween 20, который является широко используемым поверхностно-активным веществом в составах биологических лекарственных средств и имеет длинный ненасыщенный липидный хвост, имеет высокую трансфекцию в дренируемых лимфатических узлах по сравнению с PEG-DSPE, который в значительной степени трансфицировал мышцу в месте инъекции29. Этот параметр может быть оптимизирован для достижения желаемого биораспределения LNP.
Традиционные способы формирования ЛНФ включают метод тонкопленочной гидратации и метод впрыска этанола27. Хотя это легкодоступные методы, они также являются трудоемкими, могут привести к низкой эффективности инкапсуляции и сложно масштабировать до27. Достижения в методах смешивания привели к тому, что методы более поддаются масштабированию, в то же время разрабатывая более однородные частицы27. Эти методы включают смешивание Т-образных переходов, смешивание елочкой в шахматном порядке и микрофлюидную гидродинамическую фокусировку27. Каждый способ имеет уникальную структуру, но все они позволяют быстро смешивать водный этап, содержащий нуклеиновую кислоту, с органической фазой, содержащей липидные компоненты, что приводит к высокой инкапсуляции нуклеиновой кислоты27. В этом протоколе используется быстрое и контролируемое смешивание через микрофлюидный картридж, который использует конструкцию смешивания елочкой в шахматном порядке. Этот протокол описывает получение, сборку и характеристику нуклеиновых кислот, содержащих ЛНВ.
протокол
Схема всего процесса приведена на рисунке 1.
1. Подготовка буферов
ПРИМЕЧАНИЕ: Стерильная фильтрация буферов здесь настоятельно рекомендуется для удаления любых частиц, которые могут повлиять на качество нуклеиновой кислоты и LNP.
- Фосфатный буферизованный физиологический раствор (PBS)
- Подготовьте 1x PBS, используя8 мМNa 2 HPO4,2 мМ KH2PO4, 137 мМ NaCl и 2,7 мМ KCl в воде без нуклеаз и отрегулируйте рН до 7,4.
- Стерилизуйте вакуумной фильтрацией с помощью фильтра размером пор 0,22 мкм.
- Цитратный буфер
- Приготовьте цитратный буфер, используя 5 мМ цитрата натрия, 5 мМ лимонной кислоты и 150 мМ хлорида натрия в воде без нуклеазы и отрегулируйте рН 4,5.
- Стерилизуйте вакуумной фильтрацией с помощью фильтра размером пор 0,22 мкм.
ПРИМЕЧАНИЕ: Цитратный буфер необходимо готовить только в том случае, если мРНК является нуклеиновой кислотой, которая будет инкапсулирована в LNP. Если ДНК будет инкапсулирована, пропустите 1.2 и перейдите к 1.3.
- Буфер яблочной кислоты
- Приготовьте буфер яблочной кислоты, используя 20 мМ яблочной кислоты и 30 мМ хлорида натрия в воде без нуклеазы и отрегулируйте рН 3,0.
- Стерилизуйте вакуумной фильтрацией с помощью фильтра размером пор 0,22 мкм.
ПРИМЕЧАНИЕ: Буфер яблочной кислоты должен быть подготовлен только в том случае, если ДНК является нуклеиновой кислотой, которая будет инкапсулирована в LNP. Пропустите 1,3, если мРНК должна быть инкапсулирована. Цитратный буфер используется для инкапсуляции мРНК, так как более низкий рН 3,0 с буфером яблочной кислоты может привести к повышенной вероятности деградации мРНК. Здесь протокол можно приостановить.
2. Приготовление липидной смеси
- Если запасы липидов находятся в виде порошка, солюбилизируйте в чистом этаноле 200 пробы.
- Рассчитайте требуемую смесь липидных компонентов на основе желаемого молярного соотношения. Молярное соотношение 50:10:39:1 (ионизируемый липид:хелпер липид:холестерин:ПЭГ) будет использоваться здесь в качестве примера для общей концентрации липидов 10 мМ. В таблице 1 показаны концентрации и объемы, необходимые для каждого из этих компонентов.
ПРИМЕЧАНИЕ: При расчете объема, необходимого для достижения концентрации липидной смеси в этаноле (EtOH) для микрофлюидного смесителя, общий объем учитывается для обеспечения того, чтобы добавление EtOH не влияло на концентрации липидов. Например, ионизируемый липидный объем 68,5 мкл рассчитывается путем умножения концентрации 5 мМ в этаноле на общий объем липидной смеси 533 мкл и последующего деления на концентрацию липидов в запасе 38,9 мМ. - Добавьте соответствующее количество каждого раствора липидов в стеклянный флакон, чтобы компоненты смешивались с прерывистым вихрем. Добавьте 200 пробных этанолов в общую смесь 533 мкл. Для примера в таблице 1это 254 мкл этанола.
ПРИМЕЧАНИЕ: Для одного прогона для получения 1 мл ЛНПН необходимо 342,5 мкл раствора липидов. Это связано со смесью 3:1 водной нуклеиновой кислоты с органическим раствором липидов с некоторым объемом, выброшенным до и после сбора проб. Смесь 533 мкл производится для компенсации избыточного.
3. Приготовление раствора нуклеиновых кислот
ПРИМЕЧАНИЕ: Приготовление и обработка растворов нуклеиновых кислот должны осуществляться в стерильной и свободной от РНКазы среде, где это возможно. Работайте в шкафу биобезопасности, когда это возможно, с нуклеиновой кислотой.
- Рассчитайте соотношение Н/П. Отношение N/P представляет общее число ионизируемых липидных аминных групп (N) к общему числу отрицательно заряженных фосфатных групп нуклеиновых кислот (P). Отношение N/P часто является параметром, который может быть оптимизирован во время формирования LNP. Выполните следующие действия.
- Рассчитайте количество N единиц измерения, используя приведенную ниже формулу:
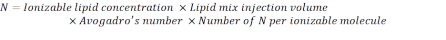
ПРИМЕЧАНИЕ: Концентрация ионизируемых липидов(таблица 1)составляет 5 мМ, что эквивалентно 5 х 10-6 моль/мл. Требуемый объем инъекции липидов составляет 0,3425 мл. Например, если число N единиц на молекулу составляет 1, используя приведенное выше уравнение, в липидной смеси имеется 1,03x 10 18 N единиц. - Рассчитайте единицы P для требуемого соотношения Н/П. Здесь, например, используется N/P = 36.
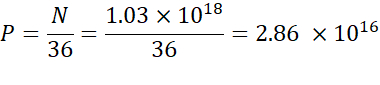
- Рассчитайте количество N единиц измерения, используя приведенную ниже формулу:
- Рассчитайте необходимую концентрацию нуклеиновых кислот для получения 2,86 х 1016 Р единиц, используя приведенное ниже уравнение.
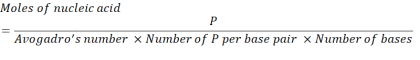
Где число P-единиц на пару оснований для мРНК составляет 1, а ДНК — 2. Для мРНК с 1 200 основаниями количество мРНК, необходимое для N/P = 36, составляет 3,96 х 10-11 молей. - Рассчитайте массовую концентрацию мРНК, необходимую для N/P = 36, используя приведенное ниже уравнение.
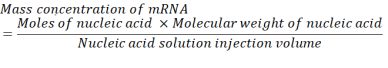
Средняя молекулярная масса единицы монофосфата рибонуклеотида составляет 322 г/моль30. При мРНК с 1 200 основаниями молекулярная масса мРНК составляет 386 400 г/моль. Необходимый объем инъекции раствора нуклеиновой кислоты составляет 1,028 мл. Таким образом, необходимая концентрация мРНК составляет 1,488х10-5 г/мл, что составляет 14,88 мкг/мл. - Составляют 1,5 мл 14,88 мкг/мл мРНК в цитратном буфере.
ПРИМЕЧАНИЕ: Когда ДНК будет инкапсулирована нуклеиновой кислотой, используйте буфер яблочной кислоты для создания раствора нуклеиновой кислоты.
4. Грунтовка микрофлюидных каналов
ПРИМЕЧАНИЕ: Данный протокол адаптирован на 2000 м., взятый из руководящих принципов изготовителя прибора.
- Введите параметры грунтовки в программное обеспечение прибора, нажав на соответствующие поля(таблица 2).
ПРИМЕЧАНИЕ: Соотношение расхода 3:1 и расход 4-12 мл/мин рекомендуется27,31 . Это было показано как оптимальное в исследованиях, представленных здесь, а также производителем. Это может быть изменено, если это представляет интерес для приложения. - Откройте крышку прибора и поместите микрофлюидный картридж во вращающийся блок.
- Втяни не менее 0,5 мл этанола в шприц 1 мл, убедив, что на кончике шприца нет пузырьков или воздушных зазоров. Загрузите этот шприц в правый вход картриджа.
- Заполните шприц 3 мл 1,5 мл водного буфера (цитрат для РНК и яблочная кислота для ДНК), убедив, что нет пузырьков воздуха или зазоров. Загрузите этот шприц в левый вход картриджа.
- Вставьте две конические трубки по 15 мл в держатели зажимов, чтобы они служили контейнерами для отходов.
- Нажмите кнопку Выполнить в программном обеспечении прибора, чтобы начать микширование, убедив, что параметры введены правильно.
- Когда инструмент перестанет грунтовать, что обозначено отключением нижнего синего света, откройте крышку и правильно утилизируйте конические трубки и шприцы.
5. Формирование ЛНП
ПРИМЕЧАНИЕ: Данный протокол адаптирован на 2000 м., взятый из руководящих принципов изготовителя прибора.
- Обновите программное обеспечение параметрами формулировки, нажав на соответствующие поля(таблица 2).
- Наполните шприц 1 мл липидной смесью (приготовленной на этапе 2). Удалите все воздушные зазоры или пузырьки на кончике шприца и вставьте шприц в правую сторону картриджа.
- Втяни раствор нуклеиновой кислоты (приготовленный на этапе 3) в шприц 3 мл, убедив, что в наконечнике шприца нет пузырьков или воздушных зазоров. Вставьте шприц в левое отверстие картриджа.
ПРИМЕЧАНИЕ: Объемы предусмотрены для изготовления раствора ЛНМП объемом 1 мл. Этот инструмент может включать в себя шприцы размером до 10 мл, и объемы могут быть масштабированы соответствующим образом без влияния на результат. Максимальный объем ЛМП, которые могут быть приготовлены за один препарат, составляет 12 мл. - Наклейте этикетку на коническую трубку без РНКазы 15 мл с именем образца и вставьте в левый зажим трубки. Поместите конический отработанных отходов 15 мл в правый зажим трубки.
- Закройте крышку прибора и нажмите Кнопка Выполнить,после подтверждения правильного ввода параметров.
- После того, как инструмент закончит работу, правильно выбросьте контейнер для отходов и картридж. Сохраните коническую трубку с образцом LNP.
- Разбавьте LNP 5x pBS, чтобы свести к минимуму содержание этанола до <5% (v/v).
ПРИМЕЧАНИЕ: Важно разбавлять ЛНФ в PBS как можно скорее после микрофлюидного перемешивания, чтобы предотвратить деградацию. Всегда выполняйте разбавление в шкафу биобезопасности и продолжайте работать в шкафу биобезопасности на протяжении всего буферного обмена.
6. Буферный обмен
ПРИМЕЧАНИЕ: Предусмотрен протокол использования ультрацентрифужных фильтров. Хотя этот метод приводит к более эффективному по времени обмену буферами, диализ может быть заменен здесь.
- Предварительно промыть ультрацентрифужный фильтр (размер пор 100 кДа) 2 мл ПБС центрифугированием при 1000 х г в течение 5 мин. Очистите PBS от нижнего отсека.
ПРИМЕЧАНИЕ: PBS выбран для повышения рН до 7,4 ± 0,2, что физиологически значимо и приведет к тому, что ионизируемый липид будет иметь нейтральный заряд. - Добавьте разбавленные ЛНП в верхний отсек предварительно промытого ультрацентрифужного фильтра и центрифуги при 1000 х г в течение 12 мин.
- Выбросьте проточную часть из нижнего отсека. Выполните еще две промывки, добавляя 5 мл PBS в ультрацентрифужный фильтр каждый раз. Центрифуга при тех же параметрах. Максимальный объем, который необходимо поддерживать, не существует.
ПРИМЕЧАНИЕ: Если был подготовлен увеличенный объем ЛНП, соответственно увеличьте объем PBS для каждой промывки. Например, если за один прогон было приготовлено 2 мл ЛНПН, то предлагается 10 мл PBS на одну промывку. - Пипетка раствором LNP против стенок ультрацентрифуги фильтрует несколько раз, чтобы минимизировать потери LNP. Извлеките раствор LNP из ультрацентрифужного фильтра и храните во флаконе без нуклеазы. Добавьте PBS, если это необходимо для достижения окончательного объема раствора LNP в 1 мл.
- При необходимости процедить через предварительно влажный шприцевой фильтр 0,2 мкм.
ПРИМЕЧАНИЕ: Здесь протокол можно приостановить.
7. Измерение эффективности инкапсуляции
- Подготовьте стандартную кривую, сделав 2-кратное последовательное разведение рабочего раствора нуклеиновой кислоты в PBS, начиная с наибольшей концентрации 500 нг/мл и делая не менее пяти разведений. Используйте PBS в качестве пустого.
- Подготовьте разбавления пробЫ LNP. Разбавьте образцы LNP PBS, чтобы достичь приблизительной теоретической концентрации, которая лежит около средней точки стандартной кривой (например, ~ 250 нг / мл нуклеиновой кислоты, оцененной из начальной концентрации).
- Приготовьте раствор реагента количественной оценки РНК (для измерения мРНК) с TritonX-100 для разрушения LNP и измерения общего количества нуклеиновой кислоты внутри и снаружи LNP. Этот раствор содержит 0,5% (v/v) РНК-реагента, 0,4% (v/v) TritonX-100 и 99,1% (v/v) PBS.
- Готовят раствор реагента без TritonX-100 для измерения количества нуклеиновой кислоты, не инкапсулированной в ЛНПц. Этот раствор содержит 0,5% (v/v) реагента РНК и 99,5% (v/v) PBS.
ПРИМЕЧАНИЕ: Если ЛНПЦ инкапсулируют двухцепочечную ДНК (дцДНК), такую как плазмидная ДНК, используйте реагент dsDNA в 7.3 и 7.4, следуя той же процедуре. - В 96-луночную черную флуоресцентную пластину нагрузят по меньшей мере четыре реплики каждого из стандартных растворов LNP и нуклеиновых кислот, приготовленных в 7.1 и 7.2.
- К половине реплик эталонов и образцов добавляют равный объем реагента, содержащего TritonX-100. Это позволит количественно оценить общее количество нуклеиновой кислоты.
- К остальным колодкам эталонов и образцов добавляют равный объем реагента без ТритонаX-100. Это позволит количественно оценить количество нуклеиновой кислоты, не инкапсулированной внутри LNP.
- Встряхните пластину в течение 5 мин при комнатной температуре, чтобы обеспечить тщательное смешивание стандартов и образцов с добавленным реагентом, принимая меры предосторожности, чтобы избежать воздействия света.
- Измерьте флуоресценцию с помощью микропластинового считывателя с длиной волны возбуждения 480 нм и длиной волны излучения 520 нм.
- Рассчитать концентрацию нуклеиновой кислоты вне ЛНП можно с помощью стандартной кривой, выполненной с добавлением реагента без ТритонХ-100. Умножьте на коэффициент разбавления, используемый в 7,2.
- Рассчитать концентрацию нуклеиновой кислоты как внутри, так и снаружи ЛНП можно с помощью стандартной кривой, выполненной с добавлением реагента, содержащего ТритонХ-100. Умножьте на коэффициент разбавления, используемый в 7,2.
- Рассчитать концентрацию нуклеиновой кислоты внутри путем вычитания концентрации нуклеиновой кислоты снаружи (рассчитанной из шага 7.10) из общей концентрации нуклеиновой кислоты как внутри, так и снаружи (рассчитано из шага 7.11)
- Количественно определить эффективность инкапсуляции из соотношения концентрации нуклеиновой кислоты внутри LNP (рассчитанной из шага 7.12) и общей концентрации нуклеиновой кислоты (рассчитанной из шага 7.11).
ПРИМЕЧАНИЕ: Здесь протокол можно приостановить.
8. Регулировка концентрации
- При необходимости отрегулируйте концентрацию нуклеиновых кислот в растворе LNP, используя результаты эффективности инкапсуляции.
- Если желательна менее концентрированная раствор, разбавьте раствор ПБС для достижения нужной концентрации.
- Если желательна более концентрированная раствор, выполните дополнительные прогоны центрифугирования с использованием ультрацентрифужного фильтра.
ПРИМЕЧАНИЕ: Здесь протокол можно приостановить.
9. Измерение гидродинамического размера и полидисперсности LNP
- Разбавляют аликвотой раствора LNP 40x PBS для получения конечного объема 1 мл.
ПРИМЕЧАНИЕ: При необходимости это разбавление может быть изменено. Это значение разбавления предлагается, поскольку оно использует небольшой объем раствора запасов LNP, обеспечивая при этом качественные результаты. - С помощью полумикрокуветы измерьте гидродинамический диаметр и показатель полидисперсности. Добавьте раствор LNP в кювету и вставьте в инструмент. Настройте в программном обеспечении прибора рабочую процедуру, включающую тип измерения, детали образца (материал, диспергатор, температуру и тип ячейки) и инструкции по измерению (количество прогонов). Нажмите кнопку Пуск, когда будете готовы начать сбор измерений.
10. Измерение дзета-потенциала LNP
- Разбавляют аликвоту раствора LNP 40x водой без нуклеазы для получения конечного объема 1 мл.
ПРИМЕЧАНИЕ: Вода, свободная от нуклеазы, используется в качестве растворителя для измерения дзета-потенциала для минимизации влияния буферов с высоким содержанием соли на проводимость. - Используя сложенную капиллярную дзета-клетку, измерьте дзета-потенциал.
- Добавьте раствор LNP в кювету до линии заполнения. Вставьте в прибор, гарантируя, что электроды контактируют с прибором.
- Настройте в программном обеспечении прибора рабочую процедуру, включающую тип измерения, детали образца (материал, диспергатор, температуру и тип ячейки) и инструкции по измерению (количество прогонов). Нажмите кнопку Пуск, когда будете готовы начать сбор измерений.
Результаты
Несколько партий ЛНП с одинаковым липидным составом и соотношением N/P 6 были разработаны в отдельные дни, чтобы продемонстрировать воспроизводимость метода. Партии 1 и 2 привели к перекрытию размерных распределений с аналогичной полидисперсностью(рисунок 2...
Обсуждение
Воспроизводимость, скорость и малый объем скрининга являются значительными преимуществами использования микрофлюидного смешивания для образования ЛНП по сравнению с другими существующими методами (например, гидратация липидной пленки и инъекция этанола). Мы продемонстрировали вос?...
Раскрытие информации
Все авторы являются сотрудниками Sanofi. Авторы заявляют, что у них нет конфликта интересов или конкурирующих финансовых интересов.
Благодарности
Спасибо Атулу Салудже, Ятину Гокарну, Марии-Терезе Пераккии, Вальтеру Швенгеру и Филипу Закасу за их руководство и вклад в развитие LNP.
Материалы
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (C-14 PEG) | Avanti Polar Lipids | 880151P | |
| 10 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1121-3810 | |
| 1000 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1111-2831 | |
| 20 µl Beveled Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-1810 | |
| 200 µl Graudated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-8810 | |
| 3β-Hydroxy-5-cholestene, 5-Cholesten-3β-ol (Cholesterol) | Sigma-Aldrich | C8667 | |
| BD Slip Tip Sterile Syringes (1 ml syringe) | Thermo Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes (3 ml syringe) | Thermo Fisher Scientific | 14-823-436 | |
| BD Vacutainer General Use Syringe Needles (BD Blunt Fill Needle 18G) | Thermo Fisher Scientific | 23-021-020 | |
| Benchtop Centrifuge | Beckman coulter | ||
| Black 96 well plates | Thermo Fisher Scientific | 14-245-177 | |
| BrandTech BRAND BIO-CERT RNase-, DNase-, DNA-free microcentrifuge tubes (1.5mL) | Thermo Fisher Scientific | 14-380-813 | |
| Citric Acid | Fisher Scientific | 02-002-611 | |
| Corning 500ml Vacuum Filter/Storage Bottle System, 0.22 um pore | Corning | 430769 | |
| Disposable folded capillary cells | Malvern | DTS1070 | |
| Ethyl Alcohol, Pure 200 proof | Sigma-Aldrich | 459844 | |
| Fisher Brand Semi-Micro Cuvette | Thermo Fisher Scientific | 14955127 | |
| Invitrogen Conical Tubes (15 mL) (DNase-RNase-free) | Thermo Fisher Scientific | AM12500 | |
| MilliporeSigma Amicon Ultra Centrifugal Filter Units | Thermo Fisher Scientific | UFC901024 | |
| NanoAssemblr Benchtop | Precision Nanyosystems | ||
| Nuclease-free water | Thermo Fisher Scientific | AM9930 | |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9624 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Thermo Fisher Scientific | P7589 | |
| Quant-iT RiboGreen RNA Assay Kit | Thermo Fisher Scientific | R11490 | |
| Sodium Chloride | Fisher Scientific | 02-004-036 | |
| Sodium Citrate, Dihydrate, granular | Fisher Scientific | 02-004-056 | |
| SpectraMax i3x | Molecular Devices | ||
| Zetasizer Nano | Malvern |
Ссылки
- Mitchell, M. J., Billingsley, M. M., Haley, R. M., Wechsler, M. E., Peppas, N. A., Langer, R., et al. Engineering precision nanoparticles for drug delivery. Nature Reviews Drug Discovery. , 1-24 (2020).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nanoscience and technology: A collection of reviews from nature journals. (239), 250 (2010).
- Patra, J. K., Das, G., Fraceto, L. F., et al. Nano based drug delivery systems: recent developments and future prospects. J Nanobiotechnol. 16 (71), (2018).
- Rai, R., Alwani, S., Badea, I. Polymeric nanoparticles in gene therapy: New avenues of design and optimization for delivery applications. Polymers. 11 (4), 745 (2019).
- Bailey, C. M., Nagarajan, R., Camesano, T. A. Designing polymer micelles of controlled size, stability, and functionality for siRNA delivery. ACS Symposium Series. 1271, 35-70 (2017).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Bailey-Hytholt, C. M., Nagarajan, R., Camesano, T. A. Förster resonance energy transfer probing of assembly and disassembly of short interfering RNA/Poly(ethylene glycol)-Poly-L-Lysine polyion complex micelles. Molecular Assemblies: Characterization and Applications. , 47-60 (2020).
- Puri, A., Loomis, K., Smith, B. Lipid-based nanoparticles as pharmaceutical drug carriers: from concepts to clinic. Crit Rev Ther Drug Carrier Syst. 26 (6), 523-580 (2009).
- Cullis, P. R., Hope, M. J. Lipid nanoparticle systems for enabling gene therapies. Molecular Therapy. 25 (7), 1467-1475 (2017).
- Munsell, E. V., Ross, N. L., Sullivan, M. O. Journey to the center of the cell: Current Nanocarrier design strategies targeting biopharmaceuticals to the cytoplasm an nucleus. Current Pharmaceutical Design. 22 (9), 1227-1244 (2016).
- Zhao, Y., Huang, L. Lipid nanoparticles for gene delivery. Advances in Genetics. 88, 13-36 (2014).
- Chen, S., et al. Influence of particle size on the in vivo potency of lipid nanoparticle formulations of siRNA. Journal of Controlled Release. 235, 236-244 (2016).
- Wan, C., Allen, T. M., Cullis, P. R. Lipid nanoparticle delivery systems for siRNA-based therapeutics. Drug Delivery and Translational Research. 4 (1), 74-83 (2014).
- Kulkarni, J. A., Cullis, P. R., Van Der Meel, R. Lipid nanoparticles enabling gene therapies: From concepts to clinical utility. Nucleic Acid Therapeutics. 28 (3), 146-157 (2018).
- Shin, M. D., et al. COVID-19 vaccine development and a potential nanomaterial path forward. Nature Nanotechnology. 15 (8), 646-655 (2020).
- Thanh Le, T., et al. The COVID-19 vaccine development landscape. Nature Reviews. Drug Discovery. 19 (5), 305-306 (2020).
- Tam, Y. Y. C., Chen, S., Cullis, P. R. Advances in lipid nanoparticles for siRNA delivery. Pharmaceutics. 5 (3), 498-507 (2013).
- Cayabyab, C., Brown, A., Tharmarajah, G., Thomas, A. mRNA lipid nanoparticles. Precision Nanosystems Application Note. , (2019).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nature Biotechnology. 31 (7), 638-646 (2013).
- Suzuki, Y., Ishihara, H. Structure, activity and uptake mechanism of siRNA-lipid nanoparticles with an asymmetric ionizable lipid. International Journal of Pharmaceutics. 510 (1), 350-358 (2016).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Schmid, J. A. The acidic environment in endocytic compartments. Biochemical Journal. 303 (2), 679-680 (1994).
- Maugeri, M., et al. Linkage between endosomal escape of LNP-mRNA and loading into EVs for transport to other cells. Nature Communications. 10 (1), (2019).
- Kulkarni, J. A., Witzigmann, D., Leung, J., Tam, Y., Cullis, P. R. On the role of helper lipids in lipid nanoparticle formulations of siRNA. Nanoscale. (45), (2019).
- Hafez, I. M., Maurer, N., Cullis, P. R. On the mechanism whereby cationic lipids promote intracellular delivery of polynucleic acids. Gene Therapy. 8 (15), 1188-1196 (2001).
- Hafez, I. M., Culis, P. R. Roles of lipid polymorphism in intracellular delivery. Advanced Drug Delivery Reviews. 47 (2-3), 139-148 (2001).
- Evers, M. J. W., et al. State-of-the-art design and rapid-mixing production techniques of lipid nanoparticles for nucleic acid delivery. Small Methods. 2 (9), 1700375 (2018).
- Mui, B. L., et al. Influence of polyethylene glycol lipid desorption rates on pharmacokinetics and pharmacodynamics of siRNA lipid nanoparticles. Molecular Therapy - Nucleic Acids. 2 (139), (2013).
- Zukancic, D., et al. The importance of poly(Ethylene glycol) and lipid structure in targeted gene delivery to lymph nodes by lipid nanoparticles. Pharmaceutics. 12 (11), 1-16 (2020).
- NEBioCalculator. New England BioLabs Inc Available from: https://nebiocalculator.neb.com/#!/formulas (2020)
- Kastner, E., et al. High-throughput manufacturing of size-tuned liposomes by a new microfluidics method using enhanced statistical tools for characterization. International Journal of Pharmaceutics. 477 (1-2), 361-368 (2014).
- Zhigaltsev, I. V., et al. Bottom-up design and synthesis of limit size lipid nanoparticle systems with aqueous and triglyceride cores using millisecond microfluidic mixing. Langmuir. 28 (7), 3633-3640 (2012).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37 (2012).
- Hassett, K. J., et al. Optimization of lipid nanoparticles for intramuscular administration of mRNA vaccines. Molecular Therapy - Nucleic Acids. 15, 1-11 (2019).
- Tanaka, H., et al. The delivery of mRNA to colon inflammatory lesions by lipid-nano-particles containing environmentally-sensitive lipid-like materials with oleic acid scaffolds. Heliyon. 4 (12), 00959 (2018).
- Singh, J., et al. Nucleic acid lipid nanoparticles. Precision Nanosystems Application Note. , (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены