JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
미세 유체 혼합 플랫폼을 사용하여 유전자 전달을 위한 지질 나노 입자 제조 및 특성화
요약
지질 나노 입자는 mRNA 및 DNA 캡슐화를 위한 미세유체 혼합 플랫폼 접근 방식을 사용하여 개발됩니다.
초록
지질 기반 의약품 운반대는 작은 크기, 생체 적합성 및 높은 캡슐화 효율로 인해 임상 및 시판 가능한 전달 시스템에 사용되어 왔습니다. 지질 나노 입자 (LP)를 사용하여 핵산을 캡슐화하는 것은 RNA 또는 DNA를 저하로부터 보호하는 동시에 세포 섭취를 촉진하는 데 유리하다. LP는 종종 이온화 지질, 도우미 지질, 콜레스테롤 및 폴리에틸렌 글리콜 (PEG) 공액 지질을 포함한 여러 지질 성분을 포함한다. LP는 이온화성 지질 존재로 인해 핵산을 쉽게 캡슐화할 수 있으며, 이는 낮은 pH에서 양이온이며 음전하 RNA 또는 DNA로 복합화를 허용합니다. 여기서 LPPs는 수성 상에서 지질 성분의 신속한 혼합을 사용하여 메신저 RNA(mRNA) 또는 플라스미드 DNA(pDNA)를 캡슐화함으로써 형성된다. 이 혼합은 정밀한 미세 유체 혼합 플랫폼을 사용하여 수행되므로 라미나르 흐름을 유지하면서 나노 입자 자체 조립을 허용합니다. 유체역학적 크기와 다분산성은 동적 광 산란(DLS)을 사용하여 측정됩니다. LNP의 유효 표면 전하는 제타 전위를 측정하여 결정됩니다. 캡슐화 효율은 힌지된 핵산을 정량화하기 위해 형광염을 사용하는 것이 특징입니다. 대표적인 결과는 이 방법의 재현성과 상이한 제형 및 공정 파라미터가 개발된 LNP에 미치는 영향을 입증한다.
서문
약물 운반대는 낮은 세포 독성, 생체 이용률 증가 및 향상된 안정성1,2,3을포함한 전형적인 유리한 특성을 가진치료법을보호하고 전달하는 데 사용됩니다. 중합체 나노 입자, 미셀 및 지질 계 입자는 이전에 핵산 캡슐화 및전달을위해 탐구되었다4,5,6,7. 지질은 고안정성8과생체 적합성이기 때문에 지질및 지질 나노입자를 포함한 다양한 유형의 나노캐리어 시스템에서 사용되어 왔다. LP는 유전자전달9,10을위해 핵산을 쉽게 캡슐화할 수 있다. 그들은 전신 순환(11) 동안 혈청 프로테아제에 의한 분해로부터 핵산을 보호하고 LP의 표면 지형 및 물리적 특성이 그들의 생체분포에영향을 미치기 때문에 특정 부위에 대한 전달을 향상시킬 수 있다. LP는 또한 조직 침투 및 세포 섭취를 향상9. 이전 연구는 2018년 미국 식품의약국(FDA)과 유럽의약품청에서 승인한 유전성 트랜스티레틴 매개 아밀로이드증14 치료의 치료 다신경병증치료제를 함유한 최초의 상용 LNP를 포함하여 LNP13내에서 siRNA 캡슐화의 성공을 입증하였다. 최근에는 LNPs가 더 큰 핵산 모이티, 즉 mRNA 및 DNA9의전달을 위해 연구되고 있다. 2018년 현재, 22개의 지질계 핵산 전달 시스템이임상시험(14)을겪고 있었다. 또한, LP를 함유하는 mRNA는 현재 주요 후보이며 COVID-19 백신15,16에채용되었다. 이러한 비 바이러스 유전자 치료에 대한 잠재적 인 성공은 작은 형성을 필요로 (~100 nm), 안정적이고 핵산의 높은 캡슐화와 균일 한 입자.
LNP 제형의 주성분으로서 이온화지질을 사용하는 것은 복합성, 캡슐화 및 전달효율(14)에대한 이점을 보여주었다. 이온화지질은 전형적으로 산성 해리 상수(pKa) < 7을 가지며; 예를 들어, 딜리놀레틸메틸-4-디메틸아미노부티레이트(D-Lin-MC3-DMA)는 FDA 승인 LNP 제형에 사용되는 이온화지질6.4417의pKa를 가지고 있다. 낮은 pH에서, 이온화 지질에 아민 그룹은 양성되고 긍정적으로 충전되어 mRNA 및 DNA에 음전하 인산염 그룹으로 조립할 수 있게 합니다. 아민의 비율, "N", 인산염에 대한 그룹, "P", 그룹은 조립을 최적화하는 데 사용된다. N/P 비는 사용되는 지질 및 핵산에 의존하며, 이는제형(18)에따라 다릅니다. 형성 후, pH는 치료 적 투여를 허용하기 위해 중성 또는 생리적 pH로 조절될 수 있다. 이러한 pH 값에서, 이온화지질은 또한 LNP에 중립 표면 전하를 부여하는 데프로톤화된다.
이온화지질은 또한 내피 탈출19,20에도움이 됩니다. LP는 세포 섭취 중 내분비증을 겪고핵(21)에세포 질 또는 DNA 화물을 세포 세포질 또는 DNA 화물로 전달하기 위해 내성에서 방출되어야 한다. 내분 내부는 전형적으로 세포외 배지보다 더 산성환경이며, 이는 이온화지질을 양산하22,23로렌더링한다. 양전하 이온지질은 내피 지질 막에 대한 음전하와 상호 작용할 수 있으며, 이는 LNP 및 핵산의 방출을 허용하는 내종의 불안정을 유발할 수 있다. 다른 이온화지질은 현재 LNP 분포의 효능을 향상시키기 위해 연구되고 있으며, 내도탈출(14).
LNP의 그밖 전형적인 분대는 인산염 (PC) 또는 인포에탄올라민 (PE) 지질과 같은 도우미 지질을 포함합니다. 1,2-Dioleoyl-sn-글리세로-3-인포에탄탄민(DOPE), 1,2-디스테로일-센-글리세로-3-인포콜린(DSPC), 및 1,2-2-디오레오틸-센-글리세로-3-인포콜린(DOPC)은 일반적으로 사용되며,24. DOPE는 반전 된 육각형 II (HII) 위상을 형성하고 멤브레인 융합(26)에의한 형질을 향상시키는 것으로 나타났으며, DSPC는 원통형 기하학적기하학적 인 27로LP를 안정화시키는 것으로 생각되고 있다. 콜레스테롤은 또한 막 강성을 증가시키기 위하여 제형에 통합되고, 그 후에 LNP의 안정성을 돕습니다. 마지막으로, 지질-공주 폴리에틸렌 글리콜(PEG)은 입자 자가조립(27)을돕는 데 필요한 스테릭 장벽을 제공하는 제형에 포함된다. PEG는 또한 집계를 방지하여 LP의 스토리지 안정성을 향상시킵니다. 또한 PEG는 종종 스텔스 성분으로 사용되며 LP의 순환 시간을 증가시킬 수 있습니다. 그러나, 이 속성은 또한 apolipoprotein E (ApoE)28에의해 구동되는 내인성 표적 화기 장치를 통해 간구에 LP의 모집에 대한 도전을 제기할 수 있다. 따라서, 연구는 LNP에서 PEG의 확산에 대한 아실 사슬 길이를 조사하고, 짧은 길이 (C8-14) LNP에서 해리하고 더 긴 아실 길이에 비해 ApoE 모집에 더 순종발견28. 또한, PEG가 공주되는 지질꼬리의 포화정도는LP(29)의조직 분포에 영향을 미치는 것으로 나타났다. 최근에는 생물학적 약물 제품 제형에 일반적으로 사용되는 계면활성제이고 오랫동안 불포화지질꼬리를 가진 트위엔(20)은 주사부위(29)에서근육을 크게 감염시킨 PEG-DSPE에 비해 림프절배수에 높은 트랜스페션을 갖는 것으로 나타났다. 이 매개 변수는 원하는 LNP 바이오 분배를 달성하기 위해 최적화 될 수있다.
종래의 LP 성형 방법은 박막 수화 방법 및 에탄올 주입방법(27)을포함한다. 이들은 쉽게 사용할 수있는 기술이지만, 그들은 또한 노동 집약적이며, 낮은 캡슐화 효율을 초래할 수 있으며,27을확장하는 데 어려움을 겪고 있습니다. 혼합 기술의 발전으로 인해 더 균일한입자(27)를개발하면서 확장할 수 있는 방법이 더 많아졌다. 이러한 방법에는 T-접합 혼합, 비틀거림 헤링본 혼합, 및 미세 유체 유체 유체 역학초점(27)이 포함됩니다. 각 방법은 독특한 구조를 가지고 있지만, 모두 지질 성분을 함유하는 유기상으로 핵산을 함유하는 수상의 신속한 혼합을 허용하여핵산(27)의높은 캡슐화를 초래한다. 이 프로토콜에서는 미세 유체 카트리지를 통한 신속하고 제어된 혼합이 사용되며, 이는 비틀거리는 헤링본 혼합 설계를 사용합니다. 이 프로토콜은 LP를 포함하는 핵산의 준비, 조립 및 특성화를 간략하게 설명합니다.
프로토콜
전체 프로세스의 회로도는 그림 1에서제공됩니다.
1. 버퍼 준비
참고: 완충제의 멸균 여과는 핵산 및 LNP 품질에 영향을 미칠 수 있는 미립자를 제거하기 위해 여기에서 매우 권장됩니다.
- 인산염 완충식식염수(PBS)
- 8m Na2HPO4,2mM KH2PO4, 137 mM NaCl, 2.7 mM KCl을 사용하여 1x PBS를 뉴클레아제 자유수역에서 준비하고 pH를 7.4로 조정한다.
- 0.22 μm 모공 크기의 필터를 사용하여 진공 여과로 살균하십시오.
- 체연성 버퍼
- 5mM 나트륨 구연산, 5mMM 구연산, 150mMM나트륨염화를 뉴클레아제 자유수분으로 사용하여 구연산 완충제를 준비하고 pH 4.5에 적응한다.
- 0.22 μm 모공 크기의 필터를 사용하여 진공 여과로 살균하십시오.
참고: 구연산 버퍼는 mRNA가 LNP에서 캡슐화될 핵산인 경우에만 준비되어야 합니다. DNA가 캡슐화될 경우 1.2를 건너뛰고 1.3으로 진행한다.
- 말릭산 완충제
- 20mM 말산과 30mM나트륨염화나트륨을 뉴클레아제 자유물로 사용하여 사과산 완충제를 준비하고 pH 3.0에 적응한다.
- 0.22 μm 모공 크기의 필터를 사용하여 진공 여과로 살균하십시오.
참고: 말산 완충제는 DNA가 LNP에 캡슐화될 핵산인 경우에만 준비되어야 합니다. mRNA를 캡슐화하려면 1.3을 건너뜁니다. 구연산 완충제는 mRNA 캡슐화에 사용되며, 말산 완충액을 가진 3.0의 하부 pH는 mRNA 분해가능성을 증가시킬 수 있다. 프로토콜은 여기에서 일시 중지할 수 있습니다.
2. 지질 믹스의 준비
- 육수 지질이 분말 형태로 있으면 순수 200 증거 에탄올로 용해하십시오.
- 원하는 어금니 비율을 기준으로 지질 성분의 필요한 혼합을 계산합니다. 50:10:39:1의 어금니 비율 (이온화 지질:도우미 지질:콜레스테롤:PEG)은 10mM의 총 지질 농도에 대한 예로 여기에서 사용될 것이다. 표 1은 이러한 각 구성 요소에 필요한 농도와 볼륨을 표시합니다.
참고: 미세유체 믹서에 대한 에탄올(EtOH)에서 지질 혼합 농도를 달성하는 데 필요한 부피를 계산할 때, EtOH의 첨가가 지질 농도에 영향을 미치지 않도록 총 부피가 고려된다. 예를 들어, 68.5 μL의 이온화성 지질 부피는 에탄올에서 5mM 농도를 533 μL의 총 지질 혼합 부피를 곱한 다음 38.9 mMMM의 육수 지질 농도로 나누어 계산된다. - 각 지질 스톡 용액을 유리 바이알에 적당히 추가하여 구성 요소가 간헐적인 소용돌이와 혼합할 수 있도록 합니다. 533 μL의 총 혼합물에 대한 200 증거 에탄올을 추가합니다. 표 1의예에서, 이것은 에탄올의 254 μL입니다.
참고: LP 1mL을 생산하는 단일 실행의 경우 지질 용액의 342.5 μL이 필요합니다. 이는 수성 핵산이 추출 물 수집 전후에 버려진 일부 부피를 가진 유기 지질 용액에 3:1 혼합되기 때문입니다. 533 μL의 혼합은 초과로 보상하기 위해 만들어집니다.
3. 핵산 용액 의 준비
참고: 핵산 용액의 준비 및 취급은 가능한 한 멸균 및 RNase 가 없는 환경에서 수행되어야 합니다. 핵산으로 가능한 한 생물 안전 캐비닛에서 작업하십시오.
- N/P 비율을 계산합니다. N/P 비는 이온화성 지질 아민 군(N)의 총 수로 음전하 핵산 인산염 군(P)의 총 수이다. N/P 비율은 종종 LNP 형성 중에 최적화할 수 있는 매개 변수입니다. 아래 단계를 따르십시오.
- 아래 수식을 사용하여 N 단위 수를 계산합니다.
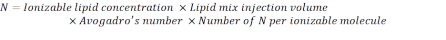
참고: 이온화지질농도(표 1)는5 mM로, 이는 5 x10-6 mol/mL에 해당합니다. 필요한 지질 사출 부피는 0.3425 mL입니다. 예를 들어, 분자당 N 단위의 수가 1인 경우 위의 방정식을 사용하여 지질 혼합물에 1.03 x10 18 N 단위가 있다. - 원하는 N/P 비율에 대해 P 단위를 계산합니다. 여기에 N/P = 36이 예를 들어 사용됩니다.
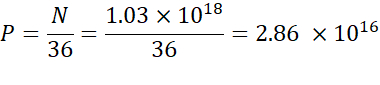
- 아래 수식을 사용하여 N 단위 수를 계산합니다.
- 아래 방정식을 사용하여 2.86 x 1016 P 단위를 얻기 위해 필요한 핵산 농도를 계산한다.
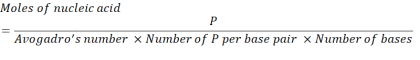
여기서, mRNA를 위한 베이스 쌍 당 P 단위의 수는 1이고 DNA는 2입니다. 1,200개의 염기의 mRNA의 경우, N/P= 36에 필요한 mRNA의 양은 3.96 x10-11 두더지이다. - 아래 방정식을 사용하여 N/P = 36에 필요한 mRNA의 질량 농도를 계산합니다.
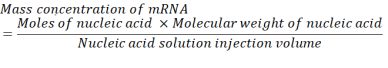
리보뉴클레오티드 모노인산염 기의 평균 분자량은 322 g/mol30이다. 1,200-염기 mRNA를 가진, mRNA의 분자량은 386,400 g/mol입니다. 핵산 용액의 필요한 분사 부피는 1.028 mL이다. 따라서, 필요한 mRNA의 농도는 14.88 μg/mL인 1.488x10-5 g/mL이다. - 구연산 완충에서 mRNA의 14.88 μg/mL의 1.5mL를 구성한다.
참고: DNA가 캡슐화된 핵산이 될 때, 말산 완충제를 사용하여 핵산 용액을 구성한다.
4. 미세 유체 채널을 프라이밍
참고: 이 프로토콜은 계측기 제조업체의 지침에서 적용됩니다.
- 적절한필드(표 2)를클릭하여 프라이밍 매개 변수를 계측기 소프트웨어에 입력합니다.
참고: 3:1의 유동비와 4-12mL/min의 유량은27,31을 권장합니다. 이것은 여기에 제시 된 연구에서 최적의 것으로 나타났습니다., 뿐만 아니라 제조 업체에 의해. 응용 프로그램에 관심이 있는 경우 이 용도가 변경될 수 있습니다. - 기기 뚜껑을 열고 미세유체 카트리지를 회전 블록에 놓습니다.
- 1mL 주사기에 에탄올의 0.5mL 이상을 그려 주사기 팁에 거품이나 공기 간격이 없도록 합니다. 이 주사기를 카트리지의 오른쪽 입구에 로드합니다.
- 수성 완충제(DNA용 RNA 및 성산용 구연산용 구연산)로 3mL 주사기를 채우면 기포나 틈이 없습니다. 이 주사기를 카트리지의 왼쪽 입구에 로드합니다.
- 클립 홀더에 15mL 원문 튜브 2개를 삽입하여 폐기물 용기역할을 합니다.
- 계측기 소프트웨어에서 실행을 클릭하여 믹싱을 시작하여 매개 변수가 올바르게 입력되도록 합니다.
- 계측기가 프라이밍을 중지하면 아래 파란색 표시등이 차단되어 뚜껑을 열고 원문 튜브와 주사기를 적절히 폐기합니다.
5. LNP 형성
참고: 이 프로토콜은 계측기 제조업체의 지침에서 적용됩니다.
- 적절한필드(표 2)를클릭하여 제형 매개변수로 소프트웨어를 업데이트합니다.
- 지질 혼합물로 1mL 주사기를 채우세요(2단계에서 준비). 주사기 팁의 공기 간격이나 거품을 제거하고 주사기를 카트리지의 오른쪽에 삽입합니다.
- 핵산 용액(3단계에서 제조)을 3mL 주사기로 끌어주어 주사기 팁에 거품이나 공기 갭이 없도록 합니다. 주사기를 카트리지의 왼쪽 입구에 삽입합니다.
참고: LP의 1mL 솔루션을 만들기 위해 볼륨이 제공됩니다. 이 계측기는 최대 10mL의 주사기 크기를 통합할 수 있으며, 결과에 영향을 미치지 않고 그에 따라 볼륨을 확장할 수 있습니다. 한 번의 준비로 준비할 수 있는 최대 LP의 최대 부피는 12mL입니다. - 샘플 이름으로 15mL RNase 가 없는 원식 튜브에 라벨을 부착하고 왼쪽 튜브 클립에 삽입합니다. 오른쪽 튜브 클립에 15mL 폐기물 원식을 놓습니다.
- 매개 변수의 올바른 입력을 확인 한 후 계측기 뚜껑을 닫고 실행을클릭합니다.
- 기기가 실행이 끝나면 폐기물 용기와 카트리지를 올바르게 폐기하십시오. LNP 샘플로 원물 튜브를 유지합니다.
- 에탄올을 <5%(v/v)로 최소화하기 위해 LNP 5x를 PBS로 희석합니다.
참고: 저분해성 혼합 후 가능한 한 빨리 PBS에서 LP를 희석하여 분해를 방지하는 것이 중요합니다. 항상 바이오 세이프티 캐비닛에서 희석을 수행하고 버퍼 교환 을 통해 생물 안전 캐비닛에서 계속 작동합니다.
6. 버퍼 교환
참고: 초원심분리기 필터 를 사용하기 위한 프로토콜이 제공됩니다. 이 방법은 버퍼의 보다 시간 효율적인 교환을 초래하지만 투석은 여기에서 대체 될 수 있습니다.
- PBS 2mL의 초원심분리기 필터(100kDa 모공 크기)를 5분 동안 1000 x g에서 원심분리하여 미리 세척합니다. 아래쪽 구획에서 PBS를 비웁니다.
참고: PBS는 pH를 7.4± 0.2로 증가시키기 위해 선택되며, 이는 생리학적으로 관련이 있으며 중성 전하를 갖는 이온화성 지질을 초래할 것이다. - 미리 세척된 초원심분리기 필터의 상단 구획에 희석된 LP를 12분 동안 1000 x g의 원심분리기를 추가합니다.
- 아래쪽 구획에서 흐름 통과를 폐기합니다. 매번 초원심분리기 필터에 PBS 5mL을 추가하여 2mL의 세서스를 더 수행합니다. 동일한 매개 변수에서 원심 분리기입니다. 유지 관리해야 하는 최대 볼륨은 없습니다.
참고: LP의 스케일업 볼륨이 준비된 경우, 그에 따라 각 세척에 대한 PBS의 부피를 늘립니다. 예를 들어, LP의 2mL가 한 번의 실행으로 제조된 경우, 세척당 10mL PBS가 제안됩니다. - LNP 손실을 최소화하기 위해 초원심분리기 필터의 벽에 대한 LNP 용액을 몇 번 피펫합니다. 초원심분리기 필터에서 LNP 용액을 제거하고 뉴클레아제 프리 바이알에 저장하십시오. 1mL의 LNP 솔루션의 최종 볼륨을 달성하는 데 필요한 경우 PBS를 추가합니다.
- 필요한 경우 습식 0.2 μm 주사기 필터를 필터링합니다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다.
7. 캡슐화 효율 측정
- PBS에서 작동하는 핵산 용액의 2배 연속 희석을 500 ng/mL의 최고 농도로 시작하여 최소 5개의 희석제를 만들어 표준 곡선을 준비합니다. PBS를 빈 공백으로 사용합니다.
- LNP 샘플 희석을 준비합니다. PBS를 사용하여 LNP 샘플을 희석하여 표준 곡선의 중간 점 주위에 있는 대략적인 이론적 농도를 달성한다(예를 들어 초기 농도에서 추정되는 핵산의 250 ng/mL).
- TRItonX-100을 사용하여 RNA 정량화 시약(mRNA 측정용)의 용액을 준비하여 LP를 방해하고 LNP 내부 및 외부의 총 핵산 양을 측정한다. 이 솔루션에는 RNA 시약0.5% (v/v) RNA 시약, 0.4% (v/v) TritonX-100 및 99.1% (v/v) PBS가 포함되어 있습니다.
- TritonX-100 없이 시약의 용액을 준비하여 LP에 캡슐화되지 않은 핵산의 양을 측정한다. 이 솔루션에는 0.5% (v/v) RNA 시약 및 99.5% (v/v) PBS가 포함되어 있습니다.
참고: LP가 플라스미드 DNA와 같은 이중 좌초 DNA(dsDNA)를 캡슐화하는 경우 동일한 절차에 따라 dsDNA 시약을 7.3 및 7.4로 사용합니다. - 96-well 블랙 형광 능력 플레이트에서 7.1 및 7.2로 제조된 LNP 및 핵산 표준 용액각각의 적어도 4개의 복제를 적재한다.
- 표준 및 샘플 복제의 절반에 TritonX-100을 포함하는 시약의 동일한 볼륨을 추가합니다. 이것은 핵산의 총 양을 정량화할 것입니다.
- 표준 및 샘플의 나머지 우물에 TritonX-100 없이 시약의 동일한 볼륨을 추가합니다. 이것은 LNP 내부에 캡슐화되지 않은 핵산의 양을 정량화할 것이다.
- 실온에서 5분 동안 접시를 흔들어 표준과 시약을 철저히 혼합하여 광 노출을 방지하기 위한 예방 조치를 취하십시오.
- 마이크로 플레이트 판독기를 사용하여 형광을 측정하고 480 nm의 난초 파장과 520 nm의 방출 파장을 제공합니다.
- TritonX-100 없이 시약의 첨가로 만들어진 표준 곡선을 사용하여 LNP 외부의 핵산 농도를 계산한다. 7.2에서 사용되는 희석 계수를 곱합니다.
- TritonX-100을 함유하는 시약의 첨가로 만들어진 표준 곡선을 사용하여 LNP 내부 및 외부의 핵산 농도를 계산한다. 7.2에서 사용되는 희석 계수를 곱합니다.
- 핵산의 농도를 외부의 핵산 농도(7.10단계에서 계산)를 내부및 외부의 핵산 농도로부터 빼서 내부핵산의 농도를 계산합니다(7.11단계에서 계산)
- LNP 내부의 핵산 농도(7.12단계에서 계산) 및 핵산의 총 농도(7.11단계에서 계산)의 캡슐화 효율을 정량화한다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다.
8. 농도 조정
- 필요한 경우 캡슐화 효율에서 의 결과를 사용하여 LNP 용액 내에서 핵산 농도를 조정합니다.
- 덜 농축 된 용액이 원하는 경우, 원하는 농도를 달성하기 위해 PBS로 용액을 희석.
- 보다 농축된 용액이 원하는 경우 초원심분리기 필터를 사용하여 추가 원심분리 실행을 수행합니다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다.
9. LNP 유체 역학 크기 및 다분산성 측정
- 1 mL의 최종 볼륨을 얻기 위해 PBS와 LNP 용액 40x의 알리쿼트희석.
참고: 필요한 경우 이 희석이 변경될 수 있습니다. 이 희석 값은 품질 결과를 제공하면서 LNP 주식 솔루션의 소량을 사용하기 때문에 제안됩니다. - 세미 마이크로 큐벳을 사용하여 유체 역학 직경 및 다분산지수를 측정합니다. LNP 용액을 큐벳에 추가하고 계측기에 삽입합니다. 계측기 소프트웨어에 측정 유형, 샘플 세부 사항(재료, 분산제, 온도 및 셀 유형) 및 측정 지침(실행 수)을 포함하도록 작동 절차를 설정합니다. 측정 수집을 시작할 준비가 되면 시작을 클릭합니다.
10. LNP 제타 잠재력 측정
- 1 mL의 최종 부피를 얻기 위해 핵자유수분으로 LNP 용액 40배의 알리쿼트를 희석한다.
참고: 뉴클레아제 프리 워터는 전도도에 높은 염완충제의 영향을 최소화하기 위해 제타 전위 측정용매로 사용된다. - 접힌 모세관 제타 세포를 사용하여 제타 전위를 측정합니다.
- LNP 용액을 큐벳에 채우기 라인까지 추가합니다. 전극이 계측기와 접촉하고 있는지 확인하는 계측기에 삽입합니다.
- 계측기 소프트웨어에 측정 유형, 샘플 세부 사항(재료, 분산제, 온도 및 셀 유형) 및 측정 지침(실행 수)을 포함하도록 작동 절차를 설정합니다. 측정 수집을 시작할 준비가 되면 시작을 클릭합니다.
결과
동일한 지질 제형 및 6의 N/P 비율을 가진 LP의 다중 배치는 기술의 재현성을 입증하기 위하여 별도의 일에 개발되었다. 배치 1 과 2 유사한 다분산성과 겹치는 크기 분포를 초래하였다(도2A)두 개의 상이한 배치(도2B)사이의 크기 또는 캡슐화 효율에서 유의한 차이가 관찰되지 않았다. 캡슐화 효율은 각 배치(>98.5%)에 대해 높았으며...
토론
재현성, 속도 및 저부피 스크리닝은 다른 기존 방법(예: 지질 필름 수화 및 에탄올 주입)에 비해 LP를 형성하기 위해 미세유체 혼합을 사용하는 데 상당한 이점이 있습니다. 우리는 다른 LNP 배치로 관찰 된 캡슐화 효율이나 입자 크기에 영향을 미치지 않고이 방법의 재현성을 입증했습니다. 이것은 LP를 포함하여 어떤 치료든지, 임상적으로 유효하게 하기 위한 필수적인 기준입니다.
공개
모든 저자는 사오피의 직원입니다. 저자는 이해 상충이나 경쟁적인 재정적 이익이 없다고 선언합니다.
감사의 말
아툴 살루자, 야틴 고칸, 마리아 테레사 페라키아, 월터 슈벵거, 필립 자카스가 LNP 개발에 대한 지도와 공헌에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (C-14 PEG) | Avanti Polar Lipids | 880151P | |
| 10 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1121-3810 | |
| 1000 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1111-2831 | |
| 20 µl Beveled Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-1810 | |
| 200 µl Graudated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-8810 | |
| 3β-Hydroxy-5-cholestene, 5-Cholesten-3β-ol (Cholesterol) | Sigma-Aldrich | C8667 | |
| BD Slip Tip Sterile Syringes (1 ml syringe) | Thermo Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes (3 ml syringe) | Thermo Fisher Scientific | 14-823-436 | |
| BD Vacutainer General Use Syringe Needles (BD Blunt Fill Needle 18G) | Thermo Fisher Scientific | 23-021-020 | |
| Benchtop Centrifuge | Beckman coulter | ||
| Black 96 well plates | Thermo Fisher Scientific | 14-245-177 | |
| BrandTech BRAND BIO-CERT RNase-, DNase-, DNA-free microcentrifuge tubes (1.5mL) | Thermo Fisher Scientific | 14-380-813 | |
| Citric Acid | Fisher Scientific | 02-002-611 | |
| Corning 500ml Vacuum Filter/Storage Bottle System, 0.22 um pore | Corning | 430769 | |
| Disposable folded capillary cells | Malvern | DTS1070 | |
| Ethyl Alcohol, Pure 200 proof | Sigma-Aldrich | 459844 | |
| Fisher Brand Semi-Micro Cuvette | Thermo Fisher Scientific | 14955127 | |
| Invitrogen Conical Tubes (15 mL) (DNase-RNase-free) | Thermo Fisher Scientific | AM12500 | |
| MilliporeSigma Amicon Ultra Centrifugal Filter Units | Thermo Fisher Scientific | UFC901024 | |
| NanoAssemblr Benchtop | Precision Nanyosystems | ||
| Nuclease-free water | Thermo Fisher Scientific | AM9930 | |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9624 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Thermo Fisher Scientific | P7589 | |
| Quant-iT RiboGreen RNA Assay Kit | Thermo Fisher Scientific | R11490 | |
| Sodium Chloride | Fisher Scientific | 02-004-036 | |
| Sodium Citrate, Dihydrate, granular | Fisher Scientific | 02-004-056 | |
| SpectraMax i3x | Molecular Devices | ||
| Zetasizer Nano | Malvern |
참고문헌
- Mitchell, M. J., Billingsley, M. M., Haley, R. M., Wechsler, M. E., Peppas, N. A., Langer, R., et al. Engineering precision nanoparticles for drug delivery. Nature Reviews Drug Discovery. , 1-24 (2020).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nanoscience and technology: A collection of reviews from nature journals. (239), 250 (2010).
- Patra, J. K., Das, G., Fraceto, L. F., et al. Nano based drug delivery systems: recent developments and future prospects. J Nanobiotechnol. 16 (71), (2018).
- Rai, R., Alwani, S., Badea, I. Polymeric nanoparticles in gene therapy: New avenues of design and optimization for delivery applications. Polymers. 11 (4), 745 (2019).
- Bailey, C. M., Nagarajan, R., Camesano, T. A. Designing polymer micelles of controlled size, stability, and functionality for siRNA delivery. ACS Symposium Series. 1271, 35-70 (2017).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Bailey-Hytholt, C. M., Nagarajan, R., Camesano, T. A. Förster resonance energy transfer probing of assembly and disassembly of short interfering RNA/Poly(ethylene glycol)-Poly-L-Lysine polyion complex micelles. Molecular Assemblies: Characterization and Applications. , 47-60 (2020).
- Puri, A., Loomis, K., Smith, B. Lipid-based nanoparticles as pharmaceutical drug carriers: from concepts to clinic. Crit Rev Ther Drug Carrier Syst. 26 (6), 523-580 (2009).
- Cullis, P. R., Hope, M. J. Lipid nanoparticle systems for enabling gene therapies. Molecular Therapy. 25 (7), 1467-1475 (2017).
- Munsell, E. V., Ross, N. L., Sullivan, M. O. Journey to the center of the cell: Current Nanocarrier design strategies targeting biopharmaceuticals to the cytoplasm an nucleus. Current Pharmaceutical Design. 22 (9), 1227-1244 (2016).
- Zhao, Y., Huang, L. Lipid nanoparticles for gene delivery. Advances in Genetics. 88, 13-36 (2014).
- Chen, S., et al. Influence of particle size on the in vivo potency of lipid nanoparticle formulations of siRNA. Journal of Controlled Release. 235, 236-244 (2016).
- Wan, C., Allen, T. M., Cullis, P. R. Lipid nanoparticle delivery systems for siRNA-based therapeutics. Drug Delivery and Translational Research. 4 (1), 74-83 (2014).
- Kulkarni, J. A., Cullis, P. R., Van Der Meel, R. Lipid nanoparticles enabling gene therapies: From concepts to clinical utility. Nucleic Acid Therapeutics. 28 (3), 146-157 (2018).
- Shin, M. D., et al. COVID-19 vaccine development and a potential nanomaterial path forward. Nature Nanotechnology. 15 (8), 646-655 (2020).
- Thanh Le, T., et al. The COVID-19 vaccine development landscape. Nature Reviews. Drug Discovery. 19 (5), 305-306 (2020).
- Tam, Y. Y. C., Chen, S., Cullis, P. R. Advances in lipid nanoparticles for siRNA delivery. Pharmaceutics. 5 (3), 498-507 (2013).
- Cayabyab, C., Brown, A., Tharmarajah, G., Thomas, A. mRNA lipid nanoparticles. Precision Nanosystems Application Note. , (2019).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nature Biotechnology. 31 (7), 638-646 (2013).
- Suzuki, Y., Ishihara, H. Structure, activity and uptake mechanism of siRNA-lipid nanoparticles with an asymmetric ionizable lipid. International Journal of Pharmaceutics. 510 (1), 350-358 (2016).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Schmid, J. A. The acidic environment in endocytic compartments. Biochemical Journal. 303 (2), 679-680 (1994).
- Maugeri, M., et al. Linkage between endosomal escape of LNP-mRNA and loading into EVs for transport to other cells. Nature Communications. 10 (1), (2019).
- Kulkarni, J. A., Witzigmann, D., Leung, J., Tam, Y., Cullis, P. R. On the role of helper lipids in lipid nanoparticle formulations of siRNA. Nanoscale. (45), (2019).
- Hafez, I. M., Maurer, N., Cullis, P. R. On the mechanism whereby cationic lipids promote intracellular delivery of polynucleic acids. Gene Therapy. 8 (15), 1188-1196 (2001).
- Hafez, I. M., Culis, P. R. Roles of lipid polymorphism in intracellular delivery. Advanced Drug Delivery Reviews. 47 (2-3), 139-148 (2001).
- Evers, M. J. W., et al. State-of-the-art design and rapid-mixing production techniques of lipid nanoparticles for nucleic acid delivery. Small Methods. 2 (9), 1700375 (2018).
- Mui, B. L., et al. Influence of polyethylene glycol lipid desorption rates on pharmacokinetics and pharmacodynamics of siRNA lipid nanoparticles. Molecular Therapy - Nucleic Acids. 2 (139), (2013).
- Zukancic, D., et al. The importance of poly(Ethylene glycol) and lipid structure in targeted gene delivery to lymph nodes by lipid nanoparticles. Pharmaceutics. 12 (11), 1-16 (2020).
- NEBioCalculator. New England BioLabs Inc Available from: https://nebiocalculator.neb.com/#!/formulas (2020)
- Kastner, E., et al. High-throughput manufacturing of size-tuned liposomes by a new microfluidics method using enhanced statistical tools for characterization. International Journal of Pharmaceutics. 477 (1-2), 361-368 (2014).
- Zhigaltsev, I. V., et al. Bottom-up design and synthesis of limit size lipid nanoparticle systems with aqueous and triglyceride cores using millisecond microfluidic mixing. Langmuir. 28 (7), 3633-3640 (2012).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37 (2012).
- Hassett, K. J., et al. Optimization of lipid nanoparticles for intramuscular administration of mRNA vaccines. Molecular Therapy - Nucleic Acids. 15, 1-11 (2019).
- Tanaka, H., et al. The delivery of mRNA to colon inflammatory lesions by lipid-nano-particles containing environmentally-sensitive lipid-like materials with oleic acid scaffolds. Heliyon. 4 (12), 00959 (2018).
- Singh, J., et al. Nucleic acid lipid nanoparticles. Precision Nanosystems Application Note. , (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유