Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mikroakışkan Karıştırma Platformu Kullanarak Gen Teslimatı için Lipid Nanopartiküllerinin Formülei ve Karakterizasyonsu
Bu Makalede
Özet
Lipid nanopartikülleri mRNA ve DNA kapsülleme için mikroakışkan karıştırma platformu yaklaşımı kullanılarak geliştirilmiştir.
Özet
Lipid bazlı ilaç taşıyıcıları, küçük boyutları, biyouyumlulukları ve yüksek kapsülleme verimlilikleri nedeniyle klinik ve ticari olarak mevcut doğum sistemleri için kullanılmıştır. Nükleik asitleri kapsüllemek için lipid nanopartiküllerinin (LNP) kullanılması, RNA veya DNA'yı bozulmaya karşı korurken hücresel alımı teşvik etmek için avantajlıdır. LNP'ler genellikle iyotlu lipid, yardımcı lipid, kolesterol ve polietilen glikol (PEG) konjuge lipid dahil olmak üzere birden fazla lipit bileşeni içerir. LNP'ler, düşük pH'da katyonik olan ve negatif yüklü RNA veya DNA ile komplekslenme sağlayan iyonizlenebilir lipid varlığı nedeniyle nükleik asitleri kolayca kapsülleyebilir. Burada LNP'ler, lipid bileşenlerinin organik bir fazda ve nükleik asit bileşeninin sulu bir fazda hızlı bir şekilde karıştırılması kullanılarak haberci RNA (mRNA) veya plazmid DNA'nın (pDNA) kapsüllenerek oluşturulur. Bu karıştırma, laminar akışı korurken nanopartikül kendi kendine montajına izin vererek hassas bir mikroakışkan karıştırma platformu kullanılarak gerçekleştirilir. Hidrodinamik boyut ve polidisperite dinamik ışık saçılımı (DLS) kullanılarak ölçülür. LNP üzerindeki etkili yüzey yükü, zeta potansiyeli ölçülerek belirlenir. Kapsülleme verimliliği, tuzaklanmış nükleik asidi ölçmek için floresan bir boya kullanılarak karakterize edilir. Temsili sonuçlar, bu yöntemin tekrarlanabilirliğini ve farklı formülasyon ve işlem parametrelerinin geliştirilen LNP'ler üzerindeki etkisini göstermektedir.
Giriş
İlaç taşıyıcıları, düşük sitotoksiklik, artan biyoyararlanlık ve gelişmiş stabilite1,2,3dahil olmak üzere tipik elverişli özelliklere sahip bir terapötik korumak ve sunmak için kullanılır. Polimerik nanopartiküller, miseller ve lipid bazlı parçacıklar daha önce nükleik asit kapsülleme ve teslimi için araştırılmıştır4,5,6,7. Lipitler, yüksek stabilite ile biyouyumlu oldukları için lipozomlar ve lipid nanopartiküller de dahil olmak üzere farklı nanokarrier sistemlerinde kullanılmıştır8. LNP'ler gen iletimi için nükleik asitleri kolayca kapsülleyebilir9,10. Sistemik dolaşım11 sırasında nükleik asidi serum proteazları tarafından bozulmaya karşı korurlar ve LNP'lerin yüzey topografyası ve fiziksel özellikleri biyodistribution12'yietkilediği için belirli bölgelere teslimatı artırabilirler. LNP'ler ayrıca doku penetrasyonunu ve hücresel alımı iyileştirir9. Önceki çalışmalar, 2018 yılında Amerika Birleşik Devletleri Gıda ve İlaç İdaresi (FDA) ve Avrupa İlaç Ajansı tarafından onaylanan kalıtsal transtiretein aracılı amiloidoz14 tedavisinin tedavi polinöropatisi için siRNA terapötik içeren ilk ticari olarak mevcut LNP de dahil olmak üzere, bir LNP13içinde siRNA kapsüllemenin başarısını göstermiştir. Daha yakın zamanda, LNP'ler daha büyük nükleik asit moieties, yani mRNA ve DNA9'unteslimi için çalışılmaktadır. 2018 itibariyle, klinik çalışmalardan geçen ~ 22 lipid bazlı nükleik asit iletim sistemi vardı14. Ek olarak, LNP'leri içeren mRNA şu anda önde gelen adaylardır ve COVID-19 aşısı15,16için istihdam edilmiştir. Bu viral olmayan gen tedavileri için potansiyel başarı, nükleik asidin yüksek kapsüllenmesine sahip küçük (~100 nm), kararlı ve düzgün parçacıklar oluşturmayı gerektirir.
LNP formülasyonunda ana bileşen olarak iyotlu bir lipit kullanımı karmaşıklık, kapsülleme ve teslimat efekti14için avantajlar göstermiştir. Iyâne edilebilir lipitler tipik olarak 7 < asit ayrışma sabiti (pKa) vardır; örneğin, DILINOLEYLMETHYL-4-dimetilaminobütirat (D-Lin-MC3-DMA), FDA onaylı LNP formülasyonunda kullanılan iyonlaşabilir lipit, 6.4417pKa'ya sahiptir. Düşük pH'da, iyotlanabilir lipid üzerindeki amin grupları protonlanır ve pozitif olarak şarj edilir, bu da mRNA ve DNA'da negatif yüklü fosfat grupları ile montaja izin verir. Amin oranı, "N", gruplar fosfat, "P", gruplar montajı optimize etmek için kullanılır. Yok oranı, formülasyona bağlı olarak değişen lipitlere ve kullanılan nükleik asitlere bağlıdır18. Oluşumdan sonra, pH terapötik uygulama için nötr veya fizyolojik bir pH'a ayarlanabilir. Bu pH değerlerinde, iyotlanabilir lipit de LNP'ye nötr yüzey yükü veren deprotonated edilir.
Iyotlu lipid ayrıca endosomal kaçış19,20. LNP'ler hücresel alım sırasında endositoz geçirir ve mRNA kargosunu hücre sitoplazması veya DNA kargosuna çekirdek21'eteslim etmek için endozomdan salınmalıdır. Endozom içinde tipik olarak hücre dışı ortamdan daha asidik bir ortam vardır, bu da iyotlanabilir lipidi pozitif yüklü hale getirir22,23. Pozitif yüklü iyonizlenebilir lipid, endosomal lipid zarındaki negatif yüklerle etkileşime girebilir, bu da endozomun LNP ve nükleik asidin salınmasına izin veren istikrarsızlaşmasına neden olabilir. Farklı iyotlanabilir lipitler şu anda hem LNP dağılımının hem de endosomal kaçış14'ün etkinliğini artırmak için incelenmektedir.
Bir LNP'nin diğer tipik bileşenleri arasında fosfatidikolin (PC) veya fosfotitananolamin (PE) lipid gibi yardımcı lipitler bulunur. 1,2-Dioleoyl-sn-glisero-3-fosphoethanolamine (DOPE), 1,2-distearoyl-sn-glisero-3-fosphocholine (DSPC) ve 1,2-dioleoyl-sn-glisero-3-fosfokolin (DOPC) yaygın olarak kullanılan yardımcı lipitler24,25. DOPE'un ters altıgen II (HII) fazı oluşturduğu ve membran füzyonu26ile transfeksiyonu artırdığı gösterilmiştir, DSPC'nin silindirik geometrisi27ile LNP'leri stabilize ettiği düşünülmektedir. Kolesterol ayrıca membran sertliğini artırmak için formülasyona dahil edilir ve daha sonra LNP'nin stabilitesine yardımcı olan. Son olarak, lipid konjuge polietilen glikol (PEG), parçacık kendi kendine montajına yardımcı olmak için gerekli sterik bariyeri sağlamak için formülasyona dahil edilir27. PEG ayrıca toplamayı önleyerek LNP'lerin depolama kararlılığını artırır. Ayrıca, PEG genellikle gizli bir bileşen olarak kullanılır ve LNP'ler için dolaşım süresini artırabilir. Bununla birlikte, bu özellik, apolipoprotein E (ApoE)28tarafından yönlendirilen endojen bir hedefleme mekanizması aracılığıyla LNP'lerin hepatositlere işe alınması için de zorluklar doğurabilir. Bu nedenle, çalışmalar PEG'in LNP'den yayılması için acyl zincir uzunluğunu araştırmıştır, kısa uzunlukların (C8-14) LNP'den ayrıştığını ve daha uzun acyl uzunluklarına kıyasla ApoE işe alımına daha uygun olduğunu tespitederek 28. Ayrıca, PEG'in eşlendiği lipid kuyruğunun doygunluk derecesinin LNP'lerin doku dağılımını etkilediği gösterilmiştir29. Son zamanlarda, biyolojik ilaç ürünü formülasyonlarında yaygın olarak kullanılan bir yüzey aktif madde olan ve uzun bir doymamış lipit kuyruğuna sahip olan Tween 20'nin, enjeksiyon bölgesinde kası büyük ölçüde transktasyon yapan PEG-DSPE'ye kıyasla lenf düğümlerinin boşaltılmasında yüksek transfeksiyona sahip olduğu gösterilmiştir29. Bu parametre istenen LNP biyodistribution elde etmek için optimize edilebilir.
LNP'leri oluşturmanın geleneksel yöntemleri ince film hidrasyon yöntemini ve etanol enjeksiyon yönteminiiçerir 27. Bunlar kolayca kullanılabilen teknikler olsa da, aynı zamanda emek yoğundur, düşük kapsülleme verimliliğine neden olabilir ve27'yiölçeklendirmek zordur. Karıştırma tekniklerindeki gelişmeler, daha düzgün parçacıklar geliştirirken, ölçek büyütmek için daha uygun yöntemlerle sonuçlanmıştır27. Bu yöntemler arasında T-junction karıştırma, sendelemiş balıksırtı karıştırma ve mikroakışkan hidrodinamik odaklama27bulunur. Her yöntemin benzersiz bir yapısı vardır, ancak hepsi nükleik asidi içeren sulu bir fazın lipid bileşenlerini içeren organik bir fazla hızlı bir şekilde karıştırılmasına izin verir ve bu da nükleik asidin yüksek kapsüllenmesine neden27. Bu protokolde, kademeli balıksırtı karıştırma tasarımını kullanan mikroakışkan bir kartuş aracılığıyla hızlı ve kontrollü karıştırma kullanılır. Bu protokol, LNP'ler içeren nükleik asidin hazırlanmasını, montajını ve karakterizasyonunu özetler.
Protokol
Şekil 1 'de genel işlemin şeması verilmiştir.
1. Tamponların hazırlanması
NOT: Tamponların steril filtrelanması, nükleik asit ve LNP kalitesini etkileyebilecek partikülleri çıkarmak için burada şiddetle tavsiye edilir.
- Fosfat Tamponlu Tuzlu (PBS)
- Nükleaz içermeyen suda 8 mM Na2HPO4,2 mM KH2PO4, 137 mM NaCl ve 2,7 mM KCl kullanarak 1x PBS hazırlayın ve pH'ı 7,4'e ayarlayın.
- 0,22 μm gözenek boyutunda bir filtre kullanarak vakum filtrasyonu ile sterilize edin.
- Sitrat Arabelleği
- Nükleoz içermeyen suda 5 mM sodyum sitrat, 5 mM sitrik asit ve 150 mM sodyum klorür kullanarak sitrat tamponu hazırlayın ve pH 4.5'e ayarlayın.
- 0,22 μm gözenek boyutunda bir filtre kullanarak vakum filtrasyonu ile sterilize edin.
NOT: Sitrat tamponun sadece mRNA LNP'de kapsüllenecek nükleik asit ise hazırlanması gerekir. DNA kapsüllenecekse 1.2'yi atla ve 1.3'e geç.
- Malic Asit Tamponu
- Çekirdeksiz suda 20 mM malik asit ve 30 mM sodyum klorür kullanarak malik asit tamponu hazırlayın ve pH 3.0'a ayarlayın.
- 0,22 μm gözenek boyutunda bir filtre kullanarak vakum filtrasyonu ile sterilize edin.
NOT: Malik asit tamponu sadece DNA LNP'de kapsüllenecek nükleik asit ise hazırlanması gerekir. mRNA kapsüllenecekse 1.3'i atlayın. Citrate tampon mRNA kapsülleme için kullanılır, çünkü malik asit tamponu ile 3.0'ın alt pH'ı mRNA bozulması olasılığının artmasına neden olabilir. Protokol burada duraklatılabilir.
2. Lipit karışımının hazırlanması
- Stok lipitler toz halindeyse, saf 200 kanıt etanolde çözün.
- İstenilen azı dişi oranına göre lipid bileşenlerinin gerekli karışımını hesaplayın. Burada 10 mM'lik toplam lipit konsantrasyonu için örnek olarak 50:10:39:1 molar oranı (iyinil lipid:yardımcı lipid:kolesterol:PEG) kullanılacaktır. Tablo 1, bu bileşenlerin her biri için gereken konsantrasyonları ve hacimleri gösterir.
NOT: Mikroakışkan mikser için etanol (EtOH) içinde lipid karışım konsantrasyonunu elde etmek için gereken hacim hesaplanırken, EtOH ilavesinin lipit konsantrasyonlarını etkilemediğinden emin olmak için toplam hacim hesaba katlanır. Örneğin, 68,5 μL'lik iyotlu bir lipit hacmi, etanoldeki 5 mM konsantrasyonunun toplam 533 μL lipit karışım hacmi ile çarpması ve daha sonra 38,9 mM'lik stok lipit konsantrasyonuna bölünmesiyle hesaplanır. - Bileşenlerin aralıklı girdapla karışmasını sağlamak için her lipid stok çözeltisinin uygun miktarını bir cam şişeye ekleyin. Toplam 533 μL karışımı için 200 prova etanol ekleyin. Örneğin Tablo 1, bu 254 μL etanoldür.
NOT: 1 mL LNP üretmek için tek bir çalışma için 342,5 μL lipid çözeltisi gerekir. Bunun nedeni, numune toplamadan önce ve sonra atılan bir miktar hacim ile organik lipid çözeltisine 3:1 sulu nükleik asit karışımıdır. Fazlalık olarak telafi etmek için 533 μL'lik bir karışım yapılır.
3. Nükleik asit çözeltisinin hazırlanması
NOT: Nükleik asit çözeltilerinin hazırlanması ve işlenmesi mümkün olan her yerde steril ve RNase içermeyen bir ortamda yapılmalıdır. Nükleik asitle mümkün olduğunda bir biyogüvenlik kabininde çalışın.
- Yok oranını hesapla. N/P oranı, iyotlanabilir lipid amin gruplarının (N) negatif yüklü nükleik asit fosfat gruplarının (P) toplam sayısına kadar olan toplam sayısıdır. Yok oranı genellikle LNP oluşumu sırasında optimize edilebilen bir parametredir. Aşağıdaki adımları izleyin.
- Aşağıdaki formülü kullanarak N birimlerinin sayısını hesaplayın:
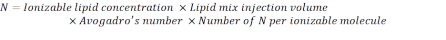
NOT: Iyinilenebilir lipit konsantrasyonu (Tablo 1) 5 x 10-6 mol / mL'ye eşdeğer olan 5 mM'dir. Gerekli lipit enjeksiyon hacmi 0.3425 mL'dir. Örneğin, molekül başına N birimi sayısı 1 ise, yukarıdaki denklemi kullanarak, lipid karışımında 1,03 x10 18 N birim vardır. - İstediğiniz YOK oranı için P birimlerini hesaplayın. Burada örneğin bir YOK = 36 kullanılır.
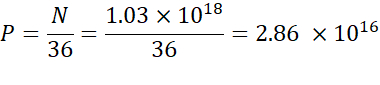
- Aşağıdaki formülü kullanarak N birimlerinin sayısını hesaplayın:
- Aşağıdaki denklemi kullanarak 2,86 x 1016 P birim elde etmek için gerekli nükleik asit konsantrasyonu hesaplayın.
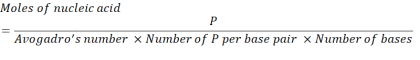
Burada, mRNA için baz çifti başına P birimi sayısı 1 ve DNA 2'dir. 1.200 baza sahip bir mRNA için, N/P = 36 için gereken mRNA miktarı 3,96 x 10-11 bendir. - Aşağıdaki denklemi kullanarak N/P = 36 için gereken mRNA kütle konsantrasyonunun hesapını hesaplayın.
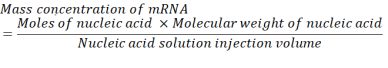
Ribonükleotid monofosfat ünitesinin ortalama moleküler ağırlığı 322 g/mol30'dur. 1.200 baz mRNA ile mRNA'nın moleküler ağırlığı 386.400 g/mol'dir. Nükleik asit çözeltisinin gerekli enjeksiyon hacmi 1.028 mL'dir. Böylece, ihtiyaç duyulan mRNA konsantrasyonu 1.488x10-5 g/mL'dir, bu da 14.88 μg / mL'dir. - Sitrat tamponunda 1,5 mL 14,88 μg/mL mRNA yapın.
NOT: DNA nükleik asit kapsüllendiğinde, nükleik asit çözeltisini oluşturan malik asit tamponu kullanın.
4. Mikroakışkan kanalların astarlandırılması
NOT: Bu protokol, cihaz üreticisinin yönergelerinden uyarlanmıştır.
- Uygun alanlara tıklayarak astar parametrelerini enstrüman yazılımına girin (Tablo 2).
NOT: 3:1 akış oranı ve 4-12 mL/dk akış hızı27,31 önerilir. Bu, üretici tarafından olduğu kadar burada sunulan çalışmalarda da optimal olduğu gösterilmiştir. Uygulamaya yönelik ilgi çekiciyse, bu değiştirilebilir. - Cihazın kapağını açın ve dönen bloğa bir mikroakışkan kartuş yerleştirin.
- Şırınna ucunda kabarcık veya hava boşluğu olmadığından emin olarak 1 mL şırındağa en az 0,5 mL etanol çizin. Bu şırınnayı kartuşun sağ girişine yükleyin.
- 3 mL'lik bir şırınnayı 1,5 mL sulu tamponla doldurun (RNA için sitrat ve DNA için malik asit), hava kabarcıkları veya boşluklar olmadığından emin olun. Bu şırınnayı kartuşun sol girişine yükleyin.
- Atık konteyneri olarak hizmet vermek için klips tutuculara iki adet 15 mL konik tüp yerleştirin.
- Parametrelerin doğru girilmesini sağlayarak karıştırmaya başlamak için Enstrüman yazılımında Çalıştır'a tıklayın.
- Cihaz, alt mavi ışığın kapanmasıyla belirtilen astarlamayı durdurduğunda, kapağı açın ve konik tüpleri ve şırıngları düzgün bir şekilde atın.
5. LNP oluşumu
NOT: Bu protokol, cihaz üreticisinin yönergelerinden uyarlanmıştır.
- Uygun alanları tıklatarak yazılımı formülasyon parametreleriyle güncelleştirin (Tablo 2).
- 1 mL'lik bir şırınnayı lipit karışımı ile doldurun (adım 2'de hazırlanır). Şırınd ucundaki hava boşluklarını veya kabarcıkları çıkarın ve şırınnayı kartuşun sağ tarafına yerleştirin.
- Nükleik asit çözeltisini (adım 3'te hazırlanmış) 3 mL şırınna çekerek şırınna ucunda kabarcık veya hava boşluğu olmadığından emin olun. Şırındıcı kartuşun sol girişine yerleştirin.
NOT: LNP'lerin 1 mL'lik bir çözümünü yapmak için birimler sağlanır. Bu cihaz 10 mL'ye kadar şırıng boyutlarını bir araya getirebilir ve hacimler sonuç üzerinde hiçbir etkisi olmadan buna göre ölçeklendirilebilir. Bir preparatta hazırlanabilecek maksimum LNP hacmi 12 mL'dir. - 15 mL RNase içermeyen konik tüpü örnek adıyla etiketlenin ve sol tüp klipsine yerleştirin. Doğru tüp klipsine 15 mL atık konik yerleştirin.
- Parametrelerin doğru girişini onayladıktan sonra cihazın kapağını kapatın ve Çalıştır'ı tıklatın.
- Cihazın çalışması bittikten sonra, atık kabını ve kartuşu düzgün bir şekilde atın. Konik tüpü LNP örneğiyle tutun.
- Etanol'ü %5 (v/v) < en aza indirmek için LNP 5x'i PBS ile seyreltin.
NOT: Bozulmayı önlemek için mikroakışkan karıştırmadan sonra LNP'lerin PBS'de mümkün olan en kısa sürede seyreltmesi önemlidir. Seyreltmeyi her zaman bir biyogüvenlik kabininde gerçekleştirin ve tampon değişimleri boyunca biyogüvenlik kabininde çalışmaya devam edin.
6. Tampon değişimi
NOT: Ultra santrifüj filtreleri kullanma protokolü sağlanmıştır. Bu yöntem tamponların daha verimli bir şekilde değiştirilmesine neden olurken, diyaliz burada değiştirilebilir.
- 5 dakika boyunca 1000 x g'da santrifüjleme yaparak 2 mL PBS'lik ultra santrifüj filtresini (100 kDa gözenek boyutu) önceden yıkayın. PBS'i alt bölmeden boşaltın.
NOT: PBS, pH'ı fizyolojik olarak alakalı olan ve iyotlu lipitin nötr bir yüke sahip olmasına neden olacak 7,4 ± 0,2'ye çıkarmak için seçilir. - Önceden yıkanmış ultra santrifüj filtresinin üst bölmesine seyreltilmiş LNP'ler ve 12 dakika boyunca 1000 x g'da santrifüj ekleyin.
- Akış akışını alt bölmeden atın. Her seferinde ultra santrifüj filtresine 5 mL PBS ekleyerek iki yıkama daha gerçekleştirin. Aynı parametrelerde santrifüj. Korunması gereken en fazla birim yoktur.
NOT: Ölçeklenmiş bir LNP hacmi hazırlanmışsa, her yıkama için PBS hacmini buna göre artırın. Örneğin, tek bir çalıştırmada 2 mL LNP hazırlanmışsa, yıkama başına 10 mL PBS önerilir. - LNP kaybını en aza indirmek için LNP solüsyonunun ultra santrifüj filtresinin duvarlarına birkaç kez karşı borulayın. LNP çözümünü ultra santrifüj filtresinden çıkarın ve çekirdeksiz bir şişede saklayın. 1 mL'lik LNP çözümünün son hacmini elde etmek için gerekirse PBS ekleyin.
- Gerekirse önceden ıslanmış 0,2 μm şırınna filtresinden filtreleyin.
NOT: Protokol burada duraklatılabilir.
7. Kapsülleme verimliliğini ölçün
- PBS'de çalışan nükleik asit çözeltisinin 2 kat seri seyreltmelerini yaparak, en yüksek 500 ng/mL konsantrasyondan başlayarak ve en az beş seyreltme yaparak standart bir eğri hazırlayın. PBS'i boş olarak kullanın.
- LNP numune seyreltmelerini hazırlayın. Standart eğrinin orta noktası etrafında yatan yaklaşık bir teorik konsantrasyon elde etmek için LNP örneklerini PBS ile seyreltin (örneğin, ilk konsantrasyondan tahmin edilen 250 ng/mL nükleik asit).
- LNP'leri bozmak ve LNP'nin içindeki ve dışındaki toplam nükleik asit miktarını ölçmek için TritonX-100 ile RNA nicelik reaktifinin (mRNA ölçümleri için) bir çözümünü hazırlayın. Bu çözüm %0,5 (v/v) RNA reaktifi, %0,4 (v/v) TritonX-100 ve %99,1 (v/v) PBS içerir.
- LNP'lerde kapsüllenmemiş nükleik asit miktarını ölçmek için TritonX-100 olmadan reaktifin bir çözeltisini hazırlayın. Bu çözüm %0,5 (v/v) RNA reaktif ve %99,5 (v/v) PBS içerir.
NOT: LNP'ler plazmid DNA gibi çift iplikli DNA'yı (dsDNA) kapsüllerse, aynı prosedürü izleyerek dsDNA reaktifini 7.3 ve 7.4'te kullanın. - 96 kuyulu siyah floresan kapasiteli bir plakada, 7.1 ve 7.2'de hazırlanan LNP ve nükleik asit standart çözeltilerinin her birinin en az dört çoğaltmasını yükleyin.
- Standartların ve örneklerin kopyalarının yarısına, TritonX-100 içeren reaktifin eşit hacmini ekleyin. Bu, toplam nükleik asit miktarını ölçecektir.
- Kalan standart ve numune kuyularına TritonX-100 olmadan eşit miktarda reaktif ekleyin. Bu, LNP içinde kapsüllenmemiş nükleik asit miktarını ölçecektir.
- Standartların ve numunelerin ilave reaktifle iyice karıştırılmasını sağlamak için plakayı oda sıcaklığında 5 dakika sallayın ve ışığa maruz kalmamak için önlemler alın.
- 480 nm'lik bir ekscitasyon dalga boyu ve 520 nm emisyon dalga boyu ile bir mikro plaka okuyucu kullanarak floresan ölçün.
- TritonX-100 olmadan reaktifin eklenmesiyle yapılan standart eğriyi kullanarak LNP dışındaki nükleik asit konsantrasyonu hesaplayın. 7.2'de kullanılan seyreltme faktörü ile çarpın.
- TritonX-100 içeren reaktifin eklenmesiyle yapılan standart eğriyi kullanarak LNP'nin hem içinde hem de dışında nükleik asit konsantrasyonu hesaplayın. 7.2'de kullanılan seyreltme faktörü ile çarpın.
- Dışarıdaki nükleik asit konsantrasyonundan (adım 7.10'dan hesaplanır) hem içerideki hem de dışarıdaki toplam nükleik asit konsantrasyonundan çıkararak içerideki nükleik asit konsantrasyonunun hesapını hesaplayın (adım 7.11'den hesaplanır)
- Kapsülleme verimliliğini LNP içindeki nükleik asit konsantrasyonunun (adım 7.12'den hesaplanır) ve toplam nükleik asit konsantrasyonunun (adım 7.11'den hesaplanır) oranından ölçün.
NOT: Protokol burada duraklatılabilir.
8. Konsantrasyon ayarlamaları
- Gerekirse, kapsülleme verimliliğinden elde edilen sonuçları kullanarak LNP çözeltisi içindeki nükleik asit konsantrasyonunu ayarlayın.
- Daha az konsantre bir çözelti isteniyorsa, istenen konsantrasyonu elde etmek için çözeltiyi PBS ile seyreltin.
- Daha konsantre bir çözüm isteniyorsa, ultra santrifüj filtresi kullanarak ek santrifüjleme çalıştırmaları gerçekleştirin.
NOT: Protokol burada duraklatılabilir.
9. LNP hidrodinamik boyutunu ve polidispersiteyi ölçün
- LNP çözeltisinin bir aliquot'ını PBS ile 40x seyrelterek 1 mL'lik son bir hacim elde edin.
NOT: Gerekirse bu seyreltme değiştirilebilir. Bu seyreltme değeri, kaliteli sonuçlar sağlarken küçük bir LNP stok çözümü hacmi kullandığı için önerilir. - Yarı mikro bir cuvette kullanarak hidrodinamik çapı ve polidispersite indeksini ölçün. LNP çözeltisini cuvette içine ekleyin ve cihaza yerleştirin. Ölçüm türünü, örnek ayrıntılarını (malzeme, dağıtıcı, sıcaklık ve hücre tipi) ve ölçüm talimatlarını (çalıştırma sayısı) içerecek şekilde cihaz yazılımında bir çalışma prosedürü ayarlayın. Ölçüm alımına başlamak için Hazır olduğunda Başlat'ı tıklatın.
10. LNP zeta potansiyelini ölçün
- LNP çözeltisinin bir aliquot'ını 40x çekirdeksiz su ile seyrelterek 1 mL'lik son bir hacim elde edin.
NOT: Nükleaz içermeyen su, yüksek tuz tamponlarının iletkenlik üzerindeki etkisini en aza indirmek için zeta potansiyel ölçümleri için çözücü olarak kullanılır. - Katlanmış kılcal zeta hücresi kullanarak, zeta potansiyelini ölçün.
- LNP çözümünü dolgu satırına kadar cuvette içine ekleyin. Elektrotların cihazla temas etmesini sağlamak için cihaza yerleştirin.
- Ölçüm türünü, örnek ayrıntılarını (malzeme, dağıtıcı, sıcaklık ve hücre tipi) ve ölçüm talimatlarını (çalıştırma sayısı) içerecek şekilde cihaz yazılımında bir çalışma prosedürü ayarlayın. Ölçüm alımına başlamak için Hazır olduğunda Başlat'ı tıklatın.
Sonuçlar
Tekniğin tekrarlanabilirliğini göstermek için ayrı günlerde aynı lipit formülasyonuna ve 6 N/P oranına sahip birden fazla LNP grubu geliştirilmiştir. Toplu iş 1 ve 2, benzer polidispersiteye sahip boyut dağılımlarının çakışmasına neden oldu (Şekil 2A) İki farklı parti arasındaki boyut veya kapsülleme verimliliğinde önemli bir fark gözlenmedi (Şekil 2B). Kapsülleme verimliliği her parti için yükse...
Tartışmalar
Tekrarlanabilirlik, hız ve düşük hacimli tarama, diğer mevcut yöntemlere (örneğin, lipid film hidrasyon ve etanol enjeksiyonu) kıyasla LNP'leri oluşturmak için mikroakışkan karıştırma kullanmanın önemli avantajlarıdır. Bu yöntemin tekrarlanabilirliğini, farklı LNP partileriyle gözlenen kapsülleme verimliliği veya partikül boyutu üzerinde hiçbir etkisi olmadan gösterdik. Bu, LNP'ler de dahil olmak üzere herhangi bir terapötik tedavinin klinik olarak kullanılabilir hale gelmesi için gerekl...
Açıklamalar
Tüm yazarlar Sanofi'nin çalışanlarıdır. Yazarlar, çıkar çatışması veya rakip finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Atul Saluja, Yatin Gokarn, Maria-Teresa Peracchia, Walter Schwenger ve Philip Zakas'a LNP gelişimine yönelik rehberlikleri ve katkıları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (C-14 PEG) | Avanti Polar Lipids | 880151P | |
| 10 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1121-3810 | |
| 1000 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1111-2831 | |
| 20 µl Beveled Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-1810 | |
| 200 µl Graudated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-8810 | |
| 3β-Hydroxy-5-cholestene, 5-Cholesten-3β-ol (Cholesterol) | Sigma-Aldrich | C8667 | |
| BD Slip Tip Sterile Syringes (1 ml syringe) | Thermo Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes (3 ml syringe) | Thermo Fisher Scientific | 14-823-436 | |
| BD Vacutainer General Use Syringe Needles (BD Blunt Fill Needle 18G) | Thermo Fisher Scientific | 23-021-020 | |
| Benchtop Centrifuge | Beckman coulter | ||
| Black 96 well plates | Thermo Fisher Scientific | 14-245-177 | |
| BrandTech BRAND BIO-CERT RNase-, DNase-, DNA-free microcentrifuge tubes (1.5mL) | Thermo Fisher Scientific | 14-380-813 | |
| Citric Acid | Fisher Scientific | 02-002-611 | |
| Corning 500ml Vacuum Filter/Storage Bottle System, 0.22 um pore | Corning | 430769 | |
| Disposable folded capillary cells | Malvern | DTS1070 | |
| Ethyl Alcohol, Pure 200 proof | Sigma-Aldrich | 459844 | |
| Fisher Brand Semi-Micro Cuvette | Thermo Fisher Scientific | 14955127 | |
| Invitrogen Conical Tubes (15 mL) (DNase-RNase-free) | Thermo Fisher Scientific | AM12500 | |
| MilliporeSigma Amicon Ultra Centrifugal Filter Units | Thermo Fisher Scientific | UFC901024 | |
| NanoAssemblr Benchtop | Precision Nanyosystems | ||
| Nuclease-free water | Thermo Fisher Scientific | AM9930 | |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9624 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Thermo Fisher Scientific | P7589 | |
| Quant-iT RiboGreen RNA Assay Kit | Thermo Fisher Scientific | R11490 | |
| Sodium Chloride | Fisher Scientific | 02-004-036 | |
| Sodium Citrate, Dihydrate, granular | Fisher Scientific | 02-004-056 | |
| SpectraMax i3x | Molecular Devices | ||
| Zetasizer Nano | Malvern |
Referanslar
- Mitchell, M. J., Billingsley, M. M., Haley, R. M., Wechsler, M. E., Peppas, N. A., Langer, R., et al. Engineering precision nanoparticles for drug delivery. Nature Reviews Drug Discovery. , 1-24 (2020).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nanoscience and technology: A collection of reviews from nature journals. (239), 250 (2010).
- Patra, J. K., Das, G., Fraceto, L. F., et al. Nano based drug delivery systems: recent developments and future prospects. J Nanobiotechnol. 16 (71), (2018).
- Rai, R., Alwani, S., Badea, I. Polymeric nanoparticles in gene therapy: New avenues of design and optimization for delivery applications. Polymers. 11 (4), 745 (2019).
- Bailey, C. M., Nagarajan, R., Camesano, T. A. Designing polymer micelles of controlled size, stability, and functionality for siRNA delivery. ACS Symposium Series. 1271, 35-70 (2017).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Bailey-Hytholt, C. M., Nagarajan, R., Camesano, T. A. Förster resonance energy transfer probing of assembly and disassembly of short interfering RNA/Poly(ethylene glycol)-Poly-L-Lysine polyion complex micelles. Molecular Assemblies: Characterization and Applications. , 47-60 (2020).
- Puri, A., Loomis, K., Smith, B. Lipid-based nanoparticles as pharmaceutical drug carriers: from concepts to clinic. Crit Rev Ther Drug Carrier Syst. 26 (6), 523-580 (2009).
- Cullis, P. R., Hope, M. J. Lipid nanoparticle systems for enabling gene therapies. Molecular Therapy. 25 (7), 1467-1475 (2017).
- Munsell, E. V., Ross, N. L., Sullivan, M. O. Journey to the center of the cell: Current Nanocarrier design strategies targeting biopharmaceuticals to the cytoplasm an nucleus. Current Pharmaceutical Design. 22 (9), 1227-1244 (2016).
- Zhao, Y., Huang, L. Lipid nanoparticles for gene delivery. Advances in Genetics. 88, 13-36 (2014).
- Chen, S., et al. Influence of particle size on the in vivo potency of lipid nanoparticle formulations of siRNA. Journal of Controlled Release. 235, 236-244 (2016).
- Wan, C., Allen, T. M., Cullis, P. R. Lipid nanoparticle delivery systems for siRNA-based therapeutics. Drug Delivery and Translational Research. 4 (1), 74-83 (2014).
- Kulkarni, J. A., Cullis, P. R., Van Der Meel, R. Lipid nanoparticles enabling gene therapies: From concepts to clinical utility. Nucleic Acid Therapeutics. 28 (3), 146-157 (2018).
- Shin, M. D., et al. COVID-19 vaccine development and a potential nanomaterial path forward. Nature Nanotechnology. 15 (8), 646-655 (2020).
- Thanh Le, T., et al. The COVID-19 vaccine development landscape. Nature Reviews. Drug Discovery. 19 (5), 305-306 (2020).
- Tam, Y. Y. C., Chen, S., Cullis, P. R. Advances in lipid nanoparticles for siRNA delivery. Pharmaceutics. 5 (3), 498-507 (2013).
- Cayabyab, C., Brown, A., Tharmarajah, G., Thomas, A. mRNA lipid nanoparticles. Precision Nanosystems Application Note. , (2019).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nature Biotechnology. 31 (7), 638-646 (2013).
- Suzuki, Y., Ishihara, H. Structure, activity and uptake mechanism of siRNA-lipid nanoparticles with an asymmetric ionizable lipid. International Journal of Pharmaceutics. 510 (1), 350-358 (2016).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Schmid, J. A. The acidic environment in endocytic compartments. Biochemical Journal. 303 (2), 679-680 (1994).
- Maugeri, M., et al. Linkage between endosomal escape of LNP-mRNA and loading into EVs for transport to other cells. Nature Communications. 10 (1), (2019).
- Kulkarni, J. A., Witzigmann, D., Leung, J., Tam, Y., Cullis, P. R. On the role of helper lipids in lipid nanoparticle formulations of siRNA. Nanoscale. (45), (2019).
- Hafez, I. M., Maurer, N., Cullis, P. R. On the mechanism whereby cationic lipids promote intracellular delivery of polynucleic acids. Gene Therapy. 8 (15), 1188-1196 (2001).
- Hafez, I. M., Culis, P. R. Roles of lipid polymorphism in intracellular delivery. Advanced Drug Delivery Reviews. 47 (2-3), 139-148 (2001).
- Evers, M. J. W., et al. State-of-the-art design and rapid-mixing production techniques of lipid nanoparticles for nucleic acid delivery. Small Methods. 2 (9), 1700375 (2018).
- Mui, B. L., et al. Influence of polyethylene glycol lipid desorption rates on pharmacokinetics and pharmacodynamics of siRNA lipid nanoparticles. Molecular Therapy - Nucleic Acids. 2 (139), (2013).
- Zukancic, D., et al. The importance of poly(Ethylene glycol) and lipid structure in targeted gene delivery to lymph nodes by lipid nanoparticles. Pharmaceutics. 12 (11), 1-16 (2020).
- NEBioCalculator. New England BioLabs Inc Available from: https://nebiocalculator.neb.com/#!/formulas (2020)
- Kastner, E., et al. High-throughput manufacturing of size-tuned liposomes by a new microfluidics method using enhanced statistical tools for characterization. International Journal of Pharmaceutics. 477 (1-2), 361-368 (2014).
- Zhigaltsev, I. V., et al. Bottom-up design and synthesis of limit size lipid nanoparticle systems with aqueous and triglyceride cores using millisecond microfluidic mixing. Langmuir. 28 (7), 3633-3640 (2012).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37 (2012).
- Hassett, K. J., et al. Optimization of lipid nanoparticles for intramuscular administration of mRNA vaccines. Molecular Therapy - Nucleic Acids. 15, 1-11 (2019).
- Tanaka, H., et al. The delivery of mRNA to colon inflammatory lesions by lipid-nano-particles containing environmentally-sensitive lipid-like materials with oleic acid scaffolds. Heliyon. 4 (12), 00959 (2018).
- Singh, J., et al. Nucleic acid lipid nanoparticles. Precision Nanosystems Application Note. , (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır