A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
גיבוש ואפיון חלקיקי שומנים בדם לאספקת גנים באמצעות פלטפורמת ערבוב מיקרופלואידית
In This Article
Summary
חלקיקי שומנים מפותחים באמצעות גישה פלטפורמת ערבוב microfluidic עבור mRNA ו- DNA אנקפסולציה.
Abstract
נשאי תרופות מבוססי שומנים שימשו למערכות אספקה זמינות קלינית ומסחרית בשל גודלן הקטן, תאימות ביולוגית ויעילות אנקפסולציה גבוהה. השימוש בננו-חלקיקי שומנים בדם (LNPs) כדי לתמצת חומצות גרעין הוא יתרון כדי להגן על ה- RNA או ה- DNA מפני השפלה, תוך קידום ספיגת התאים. LNPs מכילים לעתים קרובות רכיבי שומנים מרובים כולל שומנים מיומנים, שומנים עוזרים, כולסטרול, פוליאתילן גליקול (PEG) שומנים מצומדים. LNPs יכול בקלות לתמצת חומצות גרעין בשל נוכחות שומנים מיונן, אשר ב- pH נמוך הוא קטי ומאפשר קומפלקס עם RNA טעון שלילית או DNA. כאן LNPs נוצרים על ידי אנקפסולציה RNA messenger (mRNA) או DNA plasmid (pDNA) באמצעות ערבוב מהיר של רכיבי השומנים בשלב אורגני ואת רכיב חומצת הגרעין בשלב מימי. ערבוב זה מתבצע באמצעות פלטפורמת ערבוב מיקרופלואידית מדויקת, המאפשרת הרכבה עצמית ננו-חלקיקית תוך שמירה על זרימת למינאר. הגודל ההידרודינמי והפולידיספרסיות נמדדים באמצעות פיזור אור דינמי (DLS). מטען פני השטח היעיל על LNP נקבע על ידי מדידת פוטנציאל הזטה. יעילות אנקפסולציה מאופיינת באמצעות צבע פלואורסצנטי כדי לכמת חומצת גרעין לכודה. תוצאות מייצגות מדגימות את יכולת הרבייה של שיטה זו ואת ההשפעה שיש לפרמטרים שונים של ניסוח ותהליכים על ה- LNPs המפותחים.
Introduction
נשאי סמים משמשים כדי להגן ולספק טיפול עם תכונות חיוביות טיפוסיות כולל ציטוטוקסיות נמוכה, זמינות ביולוגית מוגברת, ויציבות משופרת1,2,3. חלקיקים פולימריים, מיצלים וחלקיקים מבוססי שומנים נחקרו בעבר עבור אנקפסולציה של חומצת גרעין ואספקה4,5,6,7. שומנים שימשו סוגים שונים של מערכות nanocarrier, כולל ליפוזומים, חלקיקי שומנים בדם, כפי שהם תואמים ביולוגית עם יציבות גבוהה8. LNPs יכול בקלות לתמצת חומצות גרעין עבור אספקתגנים 9,10. הם מגנים על חומצת הגרעין מפני השפלה על ידי פרוטאזים בסרום במהלך מחזור מערכתי11 ויכולים לשפר את המסירה לאתרים ספציפיים, כמו טופוגרפיה פני השטח ואת המאפיינים הפיזיים של LNPs להשפיע על ייחוס ביולוגישלהם 12. LNPs גם לשפר את חדירת הרקמות ואת ספיגת התא9. מחקרים קודמים הדגימו את ההצלחה של אנקפסולציה siRNA בתוך LNP13, כולל LNP הראשון זמין מסחרית המכיל siRNA טיפולי לטיפול polyneuropathy של עמילואידוזיס תורשתי בתיווך transthyretin14 טיפול שאושר על ידי מינהל המזון והתרופות האמריקאי (FDA) וסוכנות התרופות האירופית בשנת 2018. לאחרונה, LNPs נחקרים על משלוח של moieties חומצת גרעין גדולה יותר, כלומר mRNA ו- DNA9. נכון ל-2018, היו ~ 22 מערכות אספקת חומצת גרעין מבוססות שומנים שעברו ניסויים קליניים14. בנוסף, mRNA המכיל LNPs הם כיום מועמדים מובילים והם מועסקים עבור חיסון COVID-1915,16. ההצלחה הפוטנציאלית של טיפולים גנטיים לא ויראליים אלה דורשת יצירת חלקיקים קטנים (~ 100 ננומטר), יציבים ואחידים עם אנקפסולציה גבוהה של חומצת הגרעין.
השימוש בשומנים מיינים כמרכיב עיקרי בניסוח LNP הראה יתרונות לתת-עור, אנקפסולציה וגמישות מסירה14. שומנים יונים בדרך כלל יש קבוע דיסוציאציה חומצה (pKa) < 7; לדוגמה, דילינולימלמתיל-4-דימתילאמינובוטיראט (D-Lin-MC3-DMA), השומנים היוניים המשמשים בניסוח LNP שאושר על ידי ה-FDA, יש pKa של 6.4417. ברמת ה-pH הנמוכה, קבוצות האמין על השומנים היונים הופכות פרוטוניות וטעונות באופן חיובי, ומאפשרות את ההרכבה עם קבוצות פוספט טעונות שליליות על mRNA ו- DNA. היחס של אמין, "N", קבוצות פוספט, "P", קבוצות משמש כדי לייעל את ההרכבה. יחס N/P תלוי שומנים וחומצות גרעין בשימוש, אשר משתנה בהתאם ניסוח18. לאחר היווצרות, ה- pH יכול להיות מותאם ל- pH נייטרלי או פיזיולוגי כדי לאפשר ניהול טיפולי. בערכי pH אלה, השומנים היוניים הוא גם deprotonated אשר מחדיר מטען משטח נייטרלי LNP.
השומנים היוניים מסייעים גם בבריחה אנדוסומלית19,20. LNPs עוברים אנדוציטוזיס במהלך ספיגת התא ויש לשחרר מן endosome על מנת להעביר את המטען mRNA לתוך ציטופלסמה התא או מטען DNA לגרעין21. בתוך אנדוזום היא בדרך כלל סביבה חומצית יותר מאשר המדיום החוץ תאי, אשר הופך את השומנים היונים טעון חיובי22,23. השומנים היונים הטעונים באופן חיובי יכולים לקיים אינטראקציה עם מטענים שליליים על קרום השומנים האנדוזום, אשר יכול לגרום לערעור היציבות של אנדוזום המאפשר את שחרורו של LNP וחומצת גרעין. שומנים שונים מיומנים נחקרים כעת לשיפור היעילות של הפצת LNP, כמו גם בריחה אנדוסומלית14.
רכיבים אופייניים אחרים של LNP כוללים שומנים עוזרים, כגון פוספטידילכולין (PC) או פוספוטנולמין (PE) שומנים. 1,2-דיאולאויל-סן-גליצרי-3-פוספוטנולמין (DOPE), 1,2-דיסטרויל-סן-גליצרי-3-פוספוצולין (DSPC), ו-1,2-דיאולאויל-סן-גליצרי-3-פוספוצולין (DOPC) הם ליפידים עוזרים נפוצים24,25. DOPE הוכח ליצור שלב משושה II הפוך (HII) ולשפר את transfection על ידי היתוךממברנה 26, בעוד DSPC נחשב לייצב LNPs עם הגיאומטריה הגלילית שלה27. כולסטרול משולב גם ניסוח על מנת להגביר את קשיחות הממברנה, לאחר מכן סיוע ביציבות של LNP. לבסוף, פוליאתילן גליקול מצומד שומנים בדם (PEG) כלול בניסוח כדי לספק את המחסום הסיסטרי הדרוש כדי לסייע בהרכבה עצמית חלקיקים27. PEG גם משפר את יציבות האחסון של LNPs על-ידי מניעת צבירה. יתר על כן, PEG משמש לעתים קרובות כרכיב התגנבות והוא יכול להגדיל את זמן זרימת הדם עבור LNPs. עם זאת, תכונה זו יכולה גם להציב אתגרים לגיוס LNPs להפטוציטים באמצעות מנגנון פילוח אנדוגני המונע על ידי apolipoprotein E (ApoE)28. לכן, מחקרים חקרו את אורך שרשרת האציל לפיזור PEG מה- LNP, ומצאו כי אורכים קצרים (C8-14) מנותקים מה- LNP והם נוחים יותר לגיוס ApoE בהשוואה לאורכים ארוכים יותרשל אציל 28. כמו כן, מידת הרוויה של זנב השומנים כי PEG הוא מצומד הוכח להשפיע על התפלגות הרקמה של LNPs29. לאחרונה, Tween 20, שהוא חומר פעילי שטח נפוץ בפורמולציות של מוצרי תרופות ביולוגיות ויש לו זנב שומנים ארוך ולא רווי, הוכח כבעל transfection גבוה בניקוז בלוטות הלימפה בהשוואה PEG-DSPE, אשר במידה רבה עבר את השריר באתר ההזרקה29. פרמטר זה יכול להיות ממוטב כדי להשיג את ההפצה הביולוגית הרצויה LNP.
שיטות קונבנציונליות ליצירת LNPs כוללות את שיטת הידרציה סרט דק שיטת הזרקת אתנול27. בעוד אלה הן טכניקות זמינות, הם גם עבודה אינטנסיבית, יכול לגרום יעילות אנקפסולציה נמוכה, והם מאתגרים להגדילאת 27. ההתקדמות בטכניקות ערבוב הביאה לשיטות נוחות יותר להרחבה, תוך פיתוח חלקיקים אחידים יותר27. שיטות אלה כוללות ערבוב צומת T, ערבוב הרינגבון מתנודד, ומיקוד הידרודינמי מיקרופלואידי27. לכל שיטה מבנה ייחודי, אך כולם מאפשרים ערבוב מהיר של שלב מימי המכיל את חומצת הגרעין עם שלב אורגני המכיל את רכיבי השומנים, וכתוצאה מכך אנקפסולציה גבוהה של חומצת הגרעין27. בפרוטוקול זה, נעשה שימוש בערבוב מהיר ומבוקר באמצעות מחסנית מיקרופלואידית, המשתמשת בעיצוב ערבוב הרינגבון המהדהד. פרוטוקול זה מתאר את ההכנה, ההרכבה והאפיון של חומצת גרעין המכילה LNPs.
Protocol
תרשים של התהליך הכולל מסופק באיור 1.
1. הכנת מאגרים
הערה: סינון סטרילי של המאגרים מומלץ מאוד כאן כדי להסיר כל חלקיקים אשר עשוי להשפיע על חומצת הגרעין ואיכות LNP.
- תמיסת מלח חוצץ פוספט (PBS)
- הכן 1x PBS באמצעות 8 mM Na2HPO4, 2 mM KH2PO4, 137 מ"מ NaCl, ו 2.7 mM KCl במים ללא גרעין ולהתאים את ה- pH ל 7.4.
- לחטא על ידי סינון ואקום באמצעות מסנן בגודל נקבובית 0.22 מיקרומטר.
- מאגר ציטוטים
- הכן חוצץ ציטראט באמצעות 5 mM נתרן ציטראט, 5 mM חומצת לימון, ו 150 mM נתרן כלורי במים ללא נוקלאז ולהתאים pH 4.5.
- לחטא על ידי סינון ואקום באמצעות מסנן בגודל נקבובית 0.22 מיקרומטר.
הערה: חוצץ סיטראט צריך להיות מוכן רק אם mRNA היא חומצת הגרעין כי יהיה אנקפסולציה ב- LNP. אם הדנ"א יתמצת, דלג על 1.2 ותמשיך ל-1.3.
- חוצץ חומצה מאלית
- הכן חוצץ חומצה מאלית באמצעות 20 mM חומצה מאלית ו 30 mM נתרן כלורי במים ללא נוקלאז ולהתאים pH 3.0.
- לחטא על ידי סינון ואקום באמצעות מסנן בגודל נקבובית 0.22 מיקרומטר.
הערה: מאגר חומצה מאלית צריך להיות מוכן רק אם DNA הוא חומצת הגרעין כי יהיה encapsulated ב- LNP. דלג על 1.3 אם יש לתמצת את mRNA. מאגר ציטוט משמש אנקפסולציה mRNA, כמו pH התחתון של 3.0 עם חוצץ חומצה מאלית עלול להוביל לסבירות מוגברת של השפלת mRNA. הפרוטוקול יכול להיות מושהה כאן.
2. הכנת תערובת שומנים בדם
- אם שומנים במלאי הם בצורת אבקה, solubilize אתנול טהור 200 הוכחה.
- חשב את התערובת הנדרשת של רכיבי השומנים בהתבסס על יחס הטוחנת הרצוי. יחס טוחנת של 50:10:39:1 (שומנים מיוניים:עוזר שומנים:כולסטרול:PEG) ישמש כאן כדוגמה לריכוז שומנים כולל של 10 מ"ר. טבלה 1 מציגה את הריכוזים והנפחים הדרושים לכל אחד מרכיבים אלה.
הערה: בעת חישוב הנפח הדרוש כדי להשיג את ריכוז תערובת השומנים באתנול (EtOH) עבור מערבל microfluidic, הנפח הכולל הוא בחשבון כדי להבטיח כי התוספת של EtOH אינו משפיע על ריכוזי השומנים. לדוגמה, נפח שומנים מיונן של 68.5 μL מחושב על ידי הכפלת ריכוז 5 mM באתנול על ידי נפח תערובת שומנים של 533 μL ולאחר מכן חלוקה על ידי ריכוז השומנים מלאי של 38.9 מ"מ. - מוסיפים את הכמות המתאימה של כל תמיסת ציר שומנים ל בקבוקון זכוכית כדי לאפשר לרכיבים לערבב עם מערבולת לסירוגין. מוסיפים 200 אתנול הוכחה לתערובת כוללת של 533 μL. לדוגמה בטבלה 1, זהו 254 μL של אתנול.
הערה: עבור ריצה אחת כדי לייצר 1 מ"ל של LNPs, 342.5 μL של פתרון שומנים בדם יש צורך. הסיבה לכך היא תערובת 3:1 של חומצת גרעין מימית לתמיסת שומנים אורגנית עם נפח מסוים שהושלך לפני ואחרי איסוף מדגם. תערובת של 533 μL נעשה כדי לפצות על עודף.
3. הכנת פתרון חומצת גרעין
הערה: הכנה וטיפול בפתרונות חומצת גרעין יבוצע בסביבה סטרילית ונדאית ל- RNase בכל מקום אפשרי. לעבוד בארון בטיחות ביולוגית במידת האפשר עם חומצת הגרעין.
- חשב יחס N/P. יחס N/P הוא המספר הכולל של קבוצות אמין שומנים יונים (N) למספר הכולל של קבוצות פוספט חומצת גרעין טעון שלילית (P). יחס N/P הוא לעתים קרובות פרמטר שניתן למטב במהלך היווצרות LNP. בצע את השלבים הבאים.
- חשב את מספר יחידות N באמצעות הנוסחה שלהלן:
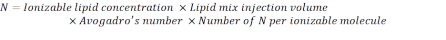
הערה: ריכוז השומנים היוני(טבלה 1)הוא 5 מ"מ, שווה ערך ל 5 x 10-6 מול / מ"ל. נפח הזרקת השומנים הנדרש הוא 0.3425 מ"ל. לדוגמה, אם מספר יחידות N למולקולה הוא 1, באמצעות המשוואה לעיל, יש 1.03 x 1018 N יחידות בתערובת השומנים. - חשב את יחידות ה- P עבור יחס ה- N/P הרצוי. כאן N/P = 36 משמש למשל.
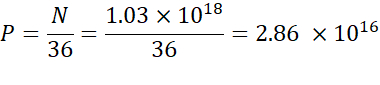
- חשב את מספר יחידות N באמצעות הנוסחה שלהלן:
- חשב את ריכוז חומצת הגרעין הדרוש כדי להשיג 2.86 x 1016 יחידות P באמצעות המשוואה שלהלן.
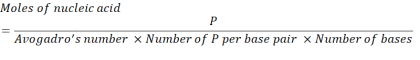
כאשר, מספר יחידות P לכל זוג בסיס עבור mRNA הוא 1 ו- DNA הוא 2. עבור mRNA עם 1,200 בסיסים, כמות ה- mRNA הנדרשת עבור N/P = 36 היא 3.96 x 10-11 מולים. - חשב את ריכוז המסה של mRNA הנדרש עבור N/P = 36 באמצעות המשוואה שלהלן.
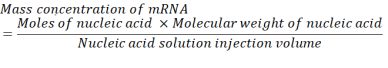
המשקל המולקולרי הממוצע של יחידת מונופוספט ריבונוקלאוטיד הוא 322 גרם / מול30. עם 1,200 mRNA בסיס, המשקל המולקולרי של mRNA הוא 386,400 גרם / מול. נפח ההזרקה הנדרש של תמיסת חומצת גרעין הוא 1.028 מ"ל. לכן, הריכוז של mRNA הדרוש הוא 1.488x10-5 גרם / מ"ל, שהוא 14.88 מיקרוגרם / מ"ל. - הפוך 1.5 מ"ל של 14.88 מיקרוגרם / mL של mRNA במאגר סיטראט.
הערה: כאשר DNA יהיה חומצת גרעין encapsulated, להשתמש חוצץ חומצה מאלית כדי לפצות את פתרון חומצת גרעין.
4. תפיק את הערוצים המיקרופלואידיים
הערה: פרוטוקול זה מותאם להנחיות יצרן המכשירים.
- הזן את הפרמטרים הראשוניים לתוך תוכנת המכשיר על ידי לחיצה על השדות המתאימים (טבלה 2).
הערה: יחס זרימה של 3:1 וקצב זרימה של 4-12 מ"ל / דקה מומלץ27,31 . זה הוכח להיות אופטימלי במחקרים המוצגים כאן, כמו גם על ידי היצרן. זה יכול להיות מגוון אם זה עניין כלפי היישום. - פתח את מכסה המכשיר והכנס מחסנית מיקרופלואידית לבלוק המסתובב.
- צייר לפחות 0.5 מ"ל של אתנול לתוך מזרק 1 מ"ל, להבטיח שאין בועות או מרווחי אוויר בקצה המזרק. טען מזרק זה לתוך הכניסה הימנית של המחסנית.
- מלא מזרק 3 מ"ל עם 1.5 מ"ל של חוצץ מימי (ציטוט עבור RNA וחומצה מאלית עבור DNA), להבטיח שאין בועות אוויר או פערים. טען מזרק זה לתוך הכניסה השמאלית של המחסנית.
- הכנס שני צינורות חרוט 15 מ"ל במחזיקי קליפ לשמש מיכלי פסולת.
- לחץ על הפעל בתוכנת המכשיר כדי להתחיל את הערבוב, להבטיח כי הפרמטרים הם קלט כראוי.
- כאשר המכשיר מפסיק להתגבש, המצוין על ידי כיבוי האור הכחול התחתון, פתח את המכסה והיפטר כראוי מהצינורות והמזרקים החרוטיים.
5. היווצרות LNP
הערה: פרוטוקול זה מותאם להנחיות יצרן המכשירים.
- עדכן את התוכנה עם הפרמטרים ניסוח על ידי לחיצה על השדות המתאימים (טבלה 2).
- ממלאים מזרק בגודל 1 מ"ל בתערובת השומנים (מוכנים בשלב 2). הסר את כל מרווחי האוויר או בועות בקצה המזרק ולהכניס את המזרק לצד ימין של המחסנית.
- צייר את תמיסת חומצת הגרעין (מוכן בשלב 3) לתוך מזרק 3 מ"ל, להבטיח שאין בועות או מרווחי אוויר בקצה המזרק. הכנס את המזרק לתוך הכניסה השמאלית של המחסנית.
הערה: אמצעי אחסון מסופקים כדי ליצור פתרון של 1 מ"ל של LNPs. מכשיר זה יכול לשלב גדלי מזרק עד 10 מ"ל, וניתן לשנות את קנה המידה של הנפחים בהתאם ללא השפעה על התוצאה. הנפח המרבי של LNPs שניתן להכין בהכנה אחת הוא 12 מ"ל. - סמן צינור חרוט ללא RNase בגודל 15 מ"ל עם שם המדגם והוסף לקליפ הצינור השמאלי. מניחים חרוט פסולת 15 מ"ל בצינור הימני.
- סגור את מכסה המכשיר ולחץ על הפעל, לאחר אישור קלט נכון של פרמטרים.
- לאחר סיום הפעלת המכשיר, יש להשליך כראוי את מיכל הפסולת ואת המחסנית. שמור על הצינור החרוט עם דגימת LNP.
- לדלל את LNP 5x עם PBS כדי למזער את האתנול ל -<5% (v / v).
הערה: חשוב לדלל את LNPs ב- PBS בהקדם האפשרי לאחר ערבוב microfluidic כדי למנוע השפלה. תמיד לבצע את הדילול בארון בטיחות ביולוגית ולהמשיך לעבוד בארון הבטיחות הביולוגית לאורך חילופי החיץ.
6. חילופי חוצצים
הערה: פרוטוקול לשימוש במסנני צנטריפוגות אולטרה מסופק. בעוד ששיטה זו גורמת לחילופי מאגרים יעילים יותר בזמן, ניתן להחליף כאן דיאליזה.
- יש לשטוף מראש מסנן אולטרה-צנטריפוגות (גודל נקבובית של 100 kDa) עם 2 מ"ל של PBS על ידי צנטריפוגה ב-1000 x גרם למשך 5 דקות. רוקן את ה-PBS מהתא התחתון.
הערה: PBS נבחר להגדיל את ה- pH ל- 7.4 ± 0.2, שהוא רלוונטי מבחינה פיזיולוגית ויביא לכך שלשומנים היונים יהיה מטען נייטרלי. - הוסיפו LNPs מדוללים לתא העליון של מסנן הצנטריפוגות האולטרה-שטוף מראש וצנטריפוגה ב-1000 x גרם למשך 12 דקות.
- זרוק את הזרימה דרך מהתא התחתון. בצע שתי כביסות נוספות על-ידי הוספת 5 מ"ל של PBS למסנן הצנטריפוגות האולטרה בכל פעם. צנטריפוגה באותם פרמטרים. אין אמצעי אחסון מרבי שיש לשמור עליו.
הערה: אם הוכנו נפח מוגדל של LNPs, הגדל את נפח ה- PBS עבור כל שטיפה בהתאם. לדוגמה, אם 2 מ"ל של LNPs הוכנו בריצה אחת, אז 10 מ"ל PBS לכביסה מוצע. - Pipette פתרון LNP נגד הקירות של מסנן צנטריפוגות אולטרה כמה פעמים כדי למזער את אובדן LNP. הסר את פתרון LNP מסנן צנטריפוגות אולטרה ולאחסן בחתונה ללא נוקלאז. הוסף PBS במידת הצורך כדי להשיג נפח סופי של פתרון LNP של 1 מ"ל.
- סנן דרך מסנן מזרק 0.2 מיקרומטר רטוב מראש, במידת הצורך.
הערה: ניתן להשהות את הפרוטוקול כאן.
7. מדוד יעילות אנקפסולציה
- הכן עקומה סטנדרטית על ידי ביצוע דילול טורי פי 2 של תמיסת חומצת גרעין עובדת ב- PBS, החל בריכוז הגבוה ביותר של 500 ננוגרם/מ"ל, וביצוע לפחות חמישה דילולים. השתמש ב- PBS כריקים.
- הכן את דילול דגימת LNP. לדלל דגימות LNP עם PBS, כדי להשיג ריכוז תיאורטי משוער השוכן סביב נקודת האמצע של העקומה הסטנדרטית (למשל ~ 250 ng/mL של חומצת גרעין מוערך מהריכוז הראשוני).
- הכן פתרון של ריאגנט כימות הרנ"א (למדידות mRNA) עם TritonX-100 כדי לשבש את ה- LNPs ולמדוד את הכמות הכוללת של חומצת גרעין בתוך ומחוץ ל- LNP. פתרון זה מכיל 0.5% (v/v) ריאגנט RNA, 0.4% (v/v) TritonX-100 ו- 99.1% (v/v) PBS.
- הכן פתרון של ריאגנט ללא TritonX-100 כדי למדוד את כמות חומצת הגרעין לא עטופה ב- LNPs. פתרון זה מכיל 0.5% (v/v) ריאגנט RNA ו- 99.5% (v/v) PBS.
הערה: אם LNPs לתמצת DNA כפול תקוע (dsDNA), כגון DNA plasmid, להשתמש ריאגנט dsDNA ב 7.3 ו 7.4 במקום, בעקבות אותו הליך. - בלוח בעל יכולת פלואורסצנטיות שחורה 96 באר, טען לפחות ארבעה שכפולים של כל אחד מהפתרונות הסטנדרטיים של LNP וחומצת גרעין שהוכנו ב-7.1 ו-7.2.
- למחצית מהשכפולים של תקנים ודגימות, הוסף נפח שווה של ריאגנט המכיל TritonX-100. זה יהיה לכמת את הכמות הכוללת של חומצת גרעין.
- לבארות הנותרות של תקנים ודגימות, הוסף נפח שווה של ריאגנט ללא TritonX-100. זה יהיה לכמת את כמות חומצת גרעין לא encapsulated בתוך LNP.
- לנער את הצלחת במשך 5 דקות בטמפרטורת החדר כדי להבטיח ערבוב יסודי של סטנדרטים ודגימות עם ריאגנט נוסף, נקיטת אמצעי זהירות כדי למנוע חשיפה לאור.
- מדוד את הפלואורסצנטיות באמצעות קורא מיקרו-לוחית, עם אורך גל עירור של 480 ננומטר ואורך גל פליטה של 520 ננומטר.
- חשב את הריכוז של חומצת גרעין מחוץ LNP באמצעות העקומה הסטנדרטית שנעשו עם תוספת של ריאגנט ללא TritonX-100. הכפל בגורם הדילול המשמש ב- 7.2.
- חשב את הריכוז של חומצת גרעין הן בתוך ומחוץ LNP באמצעות העקומה הסטנדרטית שנעשו עם תוספת של ריאגנט המכיל TritonX-100. הכפל בגורם הדילול המשמש ב- 7.2.
- חשב את הריכוז של חומצת גרעין בפנים על ידי חיסור הריכוז של חומצת גרעין בחוץ (מחושב בשלב 7.10) מהריכוז הכולל של חומצת גרעין הן בפנים והן מבחוץ (מחושב בשלב 7.11)
- לכמת את יעילות אנקפסולציה מהיחס של ריכוז חומצת הגרעין בתוך LNP (מחושב בשלב 7.12) ואת הריכוז הכולל של חומצת גרעין (מחושב בשלב 7.11).
הערה: ניתן להשהות את הפרוטוקול כאן.
8. התאמות ריכוז
- במידת הצורך, להתאים את ריכוז חומצת הגרעין בתוך פתרון LNP באמצעות התוצאות של יעילות אנקפסולציה.
- אם יש צורך בפתרון פחות מרוכז, לדלל את הפתרון עם PBS כדי להשיג את הריכוז הרצוי.
- אם רצוי פתרון מרוכז יותר, בצע צנטריפוגה נוספת באמצעות מסנן צנטריפוגות אולטרה.
הערה: ניתן להשהות את הפרוטוקול כאן.
9. מדוד גודל הידרודינמי LNP ופולידיספרטיות
- לדלל aliquot של פתרון LNP 40x עם PBS כדי לקבל נפח סופי של 1 מ"ל.
הערה: דילול זה עשוי להשתנות במידת הצורך. ערך דילול זה מוצע מכיוון שהוא משתמש בנפח קטן של פתרון מלאי LNP תוך מתן תוצאות איכותיות. - באמצעות cuvette מיקרו למחצה, למדוד את הקוטר ההידרודינמי ואת אינדקס polydispersity. הוסף את פתרון LNP לתוך cuvette ולהכניס לתוך המכשיר. הגדר הליך הפעלה בתוכנת המכשיר כך שיכלול את סוג המדידה, פרטי המדגם (חומר, פיזור, טמפרטורה וסוג תא) והוראות מדידה (מספר ריצות). לחץ על התחל כאשר תהיה מוכן להתחיל ברכישת המדידה.
10. למדוד פוטנציאל זטה LNP
- לדלל aliquot של פתרון LNP 40x עם מים חינם נוקלאז כדי להשיג נפח סופי של 1 מ"ל.
הערה: מים ללא נוקלאז משמשים כממס למדידות פוטנציאליות של זטה כדי למזער את ההשפעה של מאגרי מלח גבוהים על מוליכות. - באמצעות תא זטה נימי מקופל, למדוד את פוטנציאל זטה.
- הוסף את פתרון LNP לקוביט עד לשונת המילוי. הכנס לתוך המכשיר להבטיח כי האלקטרודות יוצרות קשר עם המכשיר.
- הגדר הליך הפעלה בתוכנת המכשיר כך שיכלול את סוג המדידה, פרטי המדגם (חומר, פיזור, טמפרטורה וסוג תא) והוראות מדידה (מספר ריצות). לחץ על התחל כאשר תהיה מוכן להתחיל ברכישת המדידה.
תוצאות
אצוות מרובות של LNPs עם אותו ניסוח שומנים ויחס N/ P של 6 פותחו בימים נפרדים כדי להפגין רבייה של הטכניקה. אצווה 1 ו-2 הביאה לחלוקת גודל חופפת עם פולידיספרסיות דומה (איור 2A)לא נצפה הבדל משמעותי בגודל או ביעילות אנקפסולציה בין שתי האצוות השונות (איור 2B).
Discussion
רבייה, מהירות, הקרנה בנפח נמוך הם יתרונות משמעותיים של שימוש בערבוב microfluidic כדי ליצור LNPs לעומת שיטות קיימות אחרות (למשל, הידרציה סרט השומנים הזרקת אתנול). הדגמנו את יכולת הרבייה של שיטה זו ללא השפעה על יעילות אנקפסולציה או גודל חלקיקים שנצפו עם אצוות LNP שונות. זהו קריטריון חיוני עבור כל טיפול...
Disclosures
כל המחברים הם עובדים של סאנופי. המחברים מצהירים כי אין להם ניגוד אינטרסים או אינטרסים פיננסיים מתחרים.
Acknowledgements
תודה לאטול סלוג'ה, יאטין גוקארן, מריה-תרזה פראצ'יה, וולטר שוונגר ופיליפ זאקאס על הדרכתם ותרומתם לפיתוח LNP.
Materials
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (C-14 PEG) | Avanti Polar Lipids | 880151P | |
| 10 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1121-3810 | |
| 1000 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1111-2831 | |
| 20 µl Beveled Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-1810 | |
| 200 µl Graudated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-8810 | |
| 3β-Hydroxy-5-cholestene, 5-Cholesten-3β-ol (Cholesterol) | Sigma-Aldrich | C8667 | |
| BD Slip Tip Sterile Syringes (1 ml syringe) | Thermo Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes (3 ml syringe) | Thermo Fisher Scientific | 14-823-436 | |
| BD Vacutainer General Use Syringe Needles (BD Blunt Fill Needle 18G) | Thermo Fisher Scientific | 23-021-020 | |
| Benchtop Centrifuge | Beckman coulter | ||
| Black 96 well plates | Thermo Fisher Scientific | 14-245-177 | |
| BrandTech BRAND BIO-CERT RNase-, DNase-, DNA-free microcentrifuge tubes (1.5mL) | Thermo Fisher Scientific | 14-380-813 | |
| Citric Acid | Fisher Scientific | 02-002-611 | |
| Corning 500ml Vacuum Filter/Storage Bottle System, 0.22 um pore | Corning | 430769 | |
| Disposable folded capillary cells | Malvern | DTS1070 | |
| Ethyl Alcohol, Pure 200 proof | Sigma-Aldrich | 459844 | |
| Fisher Brand Semi-Micro Cuvette | Thermo Fisher Scientific | 14955127 | |
| Invitrogen Conical Tubes (15 mL) (DNase-RNase-free) | Thermo Fisher Scientific | AM12500 | |
| MilliporeSigma Amicon Ultra Centrifugal Filter Units | Thermo Fisher Scientific | UFC901024 | |
| NanoAssemblr Benchtop | Precision Nanyosystems | ||
| Nuclease-free water | Thermo Fisher Scientific | AM9930 | |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9624 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Thermo Fisher Scientific | P7589 | |
| Quant-iT RiboGreen RNA Assay Kit | Thermo Fisher Scientific | R11490 | |
| Sodium Chloride | Fisher Scientific | 02-004-036 | |
| Sodium Citrate, Dihydrate, granular | Fisher Scientific | 02-004-056 | |
| SpectraMax i3x | Molecular Devices | ||
| Zetasizer Nano | Malvern |
References
- Mitchell, M. J., Billingsley, M. M., Haley, R. M., Wechsler, M. E., Peppas, N. A., Langer, R., et al. Engineering precision nanoparticles for drug delivery. Nature Reviews Drug Discovery. , 1-24 (2020).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nanoscience and technology: A collection of reviews from nature journals. (239), 250 (2010).
- Patra, J. K., Das, G., Fraceto, L. F., et al. Nano based drug delivery systems: recent developments and future prospects. J Nanobiotechnol. 16 (71), (2018).
- Rai, R., Alwani, S., Badea, I. Polymeric nanoparticles in gene therapy: New avenues of design and optimization for delivery applications. Polymers. 11 (4), 745 (2019).
- Bailey, C. M., Nagarajan, R., Camesano, T. A. Designing polymer micelles of controlled size, stability, and functionality for siRNA delivery. ACS Symposium Series. 1271, 35-70 (2017).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Bailey-Hytholt, C. M., Nagarajan, R., Camesano, T. A. Förster resonance energy transfer probing of assembly and disassembly of short interfering RNA/Poly(ethylene glycol)-Poly-L-Lysine polyion complex micelles. Molecular Assemblies: Characterization and Applications. , 47-60 (2020).
- Puri, A., Loomis, K., Smith, B. Lipid-based nanoparticles as pharmaceutical drug carriers: from concepts to clinic. Crit Rev Ther Drug Carrier Syst. 26 (6), 523-580 (2009).
- Cullis, P. R., Hope, M. J. Lipid nanoparticle systems for enabling gene therapies. Molecular Therapy. 25 (7), 1467-1475 (2017).
- Munsell, E. V., Ross, N. L., Sullivan, M. O. Journey to the center of the cell: Current Nanocarrier design strategies targeting biopharmaceuticals to the cytoplasm an nucleus. Current Pharmaceutical Design. 22 (9), 1227-1244 (2016).
- Zhao, Y., Huang, L. Lipid nanoparticles for gene delivery. Advances in Genetics. 88, 13-36 (2014).
- Chen, S., et al. Influence of particle size on the in vivo potency of lipid nanoparticle formulations of siRNA. Journal of Controlled Release. 235, 236-244 (2016).
- Wan, C., Allen, T. M., Cullis, P. R. Lipid nanoparticle delivery systems for siRNA-based therapeutics. Drug Delivery and Translational Research. 4 (1), 74-83 (2014).
- Kulkarni, J. A., Cullis, P. R., Van Der Meel, R. Lipid nanoparticles enabling gene therapies: From concepts to clinical utility. Nucleic Acid Therapeutics. 28 (3), 146-157 (2018).
- Shin, M. D., et al. COVID-19 vaccine development and a potential nanomaterial path forward. Nature Nanotechnology. 15 (8), 646-655 (2020).
- Thanh Le, T., et al. The COVID-19 vaccine development landscape. Nature Reviews. Drug Discovery. 19 (5), 305-306 (2020).
- Tam, Y. Y. C., Chen, S., Cullis, P. R. Advances in lipid nanoparticles for siRNA delivery. Pharmaceutics. 5 (3), 498-507 (2013).
- Cayabyab, C., Brown, A., Tharmarajah, G., Thomas, A. mRNA lipid nanoparticles. Precision Nanosystems Application Note. , (2019).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nature Biotechnology. 31 (7), 638-646 (2013).
- Suzuki, Y., Ishihara, H. Structure, activity and uptake mechanism of siRNA-lipid nanoparticles with an asymmetric ionizable lipid. International Journal of Pharmaceutics. 510 (1), 350-358 (2016).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Schmid, J. A. The acidic environment in endocytic compartments. Biochemical Journal. 303 (2), 679-680 (1994).
- Maugeri, M., et al. Linkage between endosomal escape of LNP-mRNA and loading into EVs for transport to other cells. Nature Communications. 10 (1), (2019).
- Kulkarni, J. A., Witzigmann, D., Leung, J., Tam, Y., Cullis, P. R. On the role of helper lipids in lipid nanoparticle formulations of siRNA. Nanoscale. (45), (2019).
- Hafez, I. M., Maurer, N., Cullis, P. R. On the mechanism whereby cationic lipids promote intracellular delivery of polynucleic acids. Gene Therapy. 8 (15), 1188-1196 (2001).
- Hafez, I. M., Culis, P. R. Roles of lipid polymorphism in intracellular delivery. Advanced Drug Delivery Reviews. 47 (2-3), 139-148 (2001).
- Evers, M. J. W., et al. State-of-the-art design and rapid-mixing production techniques of lipid nanoparticles for nucleic acid delivery. Small Methods. 2 (9), 1700375 (2018).
- Mui, B. L., et al. Influence of polyethylene glycol lipid desorption rates on pharmacokinetics and pharmacodynamics of siRNA lipid nanoparticles. Molecular Therapy - Nucleic Acids. 2 (139), (2013).
- Zukancic, D., et al. The importance of poly(Ethylene glycol) and lipid structure in targeted gene delivery to lymph nodes by lipid nanoparticles. Pharmaceutics. 12 (11), 1-16 (2020).
- NEBioCalculator. New England BioLabs Inc Available from: https://nebiocalculator.neb.com/#!/formulas (2020)
- Kastner, E., et al. High-throughput manufacturing of size-tuned liposomes by a new microfluidics method using enhanced statistical tools for characterization. International Journal of Pharmaceutics. 477 (1-2), 361-368 (2014).
- Zhigaltsev, I. V., et al. Bottom-up design and synthesis of limit size lipid nanoparticle systems with aqueous and triglyceride cores using millisecond microfluidic mixing. Langmuir. 28 (7), 3633-3640 (2012).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37 (2012).
- Hassett, K. J., et al. Optimization of lipid nanoparticles for intramuscular administration of mRNA vaccines. Molecular Therapy - Nucleic Acids. 15, 1-11 (2019).
- Tanaka, H., et al. The delivery of mRNA to colon inflammatory lesions by lipid-nano-particles containing environmentally-sensitive lipid-like materials with oleic acid scaffolds. Heliyon. 4 (12), 00959 (2018).
- Singh, J., et al. Nucleic acid lipid nanoparticles. Precision Nanosystems Application Note. , (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved