Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Uso de oxígeno hiperbárico para mejorar la radiosensibilidad de las células de glioma U251 humano
En este artículo
Resumen
Este protocolo muestra que el oxígeno hiperbárico puede mejorar la inhibición de la proliferación y la apoptosis de las células de glioma U251 tratadas con irradiación de rayos X mediante el bloqueo de las células en la fase G2/M. Esto mejora la radiosensibilidad de las líneas celulares de glioma humano.
Resumen
El objetivo de este estudio fue explorar el uso del oxígeno hiperbárico para mejorar la radiosensibilidad de las células de glioma humano. Las células de glioma humano U251 subcultivadas se dividieron aleatoriamente en cuatro grupos: un grupo de control no tratado, células tratadas solo con oxígeno hiperbárico (HBO), células tratadas solo con irradiación de rayos X (rayos X) y células tratadas con HBO y rayos X. En estos grupos se observó la morfología celular, la actividad de proliferación celular, la distribución del ciclo celular y la apoptosis para evaluar el papel de la HBO en la mejora de la radiosensibilidad de las células de glioma. Con el aumento de las dosis de rayos X (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy), la fracción de supervivencia (SF) de las células de glioma disminuyó gradualmente.
Se observó una SF significativamente menor para las células tratadas con el HBO y los rayos X juntos que en el grupo de rayos X para cada dosis (todos los P < 0,05). La inhibición de la proliferación fue significativamente mayor en el grupo de HBO combinado con rayos X que en el grupo de rayos X para cada dosis (todos los P < 0,05) para la línea celular U251. El porcentaje de células de fase G2/M fue significativamente mayor en el grupo de HBO combinado con rayos X (2 Gy) (26,70% ± 2,46%) y en el grupo de HBO (22,36% ± 0,91%) que en el grupo de control (11,56% ± 2,01%) y en el grupo de rayos X (2 Gy) (10,35% ± 2,69%) (todos P < 0,05). La apoptosis de las células U251 fue significativamente mayor en el grupo de HBO combinado con rayos X (2 Gy) que en el grupo de HBO, el grupo de rayos X (2 Gy) y el grupo de control (todos los P < 0,05). Concluimos que el HBO puede mejorar la inhibición de la proliferación y la apoptosis de las células de glioma U251 mediante el bloqueo de las células de glioma en la fase G2/M y mejorar la radiosensibilidad de las células de glioma U251.
Introducción
El glioma es un tumor intracraneal primario que se origina a partir de las células gliales del sistema nervioso central1. La estrategia de tratamiento actual para el glioma es la cirugía combinada con radioterapia y quimioterapia. La radioterapia postoperatoria para el glioma puede proporcionar beneficios de supervivencia (evidencia de grado I), y la radioterapia postoperatoria temprana puede prolongar eficazmente la supervivencia del paciente (evidencia de grado II)2. Para los gliomas de grado superior (grado III o IV), especialmente los glioblastomas altamente malignos e invasivos (evidencia de grado III)3, la radioterapia postoperatoria debe realizarse lo antes posible (<6 semanas). Sin embargo, a pesar de la intervención temprana, el glioma sigue teniendo una tasa alta de recurrencia y un mal pronóstico después del tratamiento integral. Estos resultados se asocian principalmente con la baja radiosensibilidad del glioma. Los factores relacionados con la radiosensibilidad tumoral incluyen la radiosensibilidad inherente de las células tumorales, las células tumorales hipóxicas o no hipóxicas, la proporción de células tumorales hipóxicas y la capacidad del tejido peritumoral para reparar el daño por radiación4.
Entre estos factores, las células tumorales hipóxicas o no hipóxicas y la proporción de células tumorales hipóxicas tienen efectos importantes sobre la radiosensibilidad tumoral. El oxígeno hiperbárico (HBO) puede mejorar el almacenamiento de oxígeno en los tejidos al aumentar la tensión de oxígeno en los tejidos y la difusión de oxígeno en la sangre. El HBO también puede producir una serie de efectos bioquímicos, citológicos y fisiológicos beneficiosos5. Por ejemplo, el HBO tiene un marcado efecto reparador sobre el daño por radiación inducido por la radioterapia. Aunque se ha informado que la HBO combinada con radioterapia o quimioterapia mejora la eficacia clínica de la radioterapia o la quimioterapia para el glioma6, existe un debate considerable sobre cómo la HBO sola afecta el crecimiento del glioma maligno. Ding et al.7 y Wang et al.8 demostraron que el HBO promueve el crecimiento del glioma in situ en ratones a través de mecanismos que involucran la inhibición de la apoptosis y la promoción de la angiogénesis tumoral. En condiciones fisiológicas, se ha reportado que el HBO promueve la angiogénesis tumoral al inducir estrés oxidativo9.
Sin embargo, un estudio indicó que la exposición a corto plazo al HBO promueve la proliferación de células tumorales, mientras que la exposición prolongada al HBO promueve la apoptosis e inhibe la proliferación10. Por lo tanto, se necesitan más estudios para explorar si la HBO promueve o inhibe el crecimiento del glioma y cómo la HBO combinada con radioterapia o quimioterapia puede inducir la sensibilización terapéutica. En particular, se necesitan detalles mecanicistas sobre cómo la HBO mejora la radiosensibilidad del glioma. Para explorar cómo el HBO mejora la radiosensibilidad de las células de glioma U251 humano en este estudio, utilizamos HBO combinado con irradiación de rayos X sobre la proliferación de células de glioma y observamos los efectos sobre la distribución del ciclo celular y la apoptosis.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los métodos de estudio fueron aprobados por la Junta de Revisión Institucional y el Comité de Ética del Segundo Hospital Afiliado a la Universidad de Lanzhou y se realizaron de acuerdo con las directrices y regulaciones pertinentes.
1. Tratamiento de las células de glioma
NOTA: En este experimento se utilizó la línea celular de glioma U251.
- Cultivo celular U251
- Siembre células U251 en múltiples placas con DMEM que contengan un 10% de suero fetal bovino (FBS) y cultívelas a 37 °C con 5% de CO2.
- Al alcanzar el 50%-60% de confluencia, disocie las células usando una solución de tripsina-EDTA (0,25%, sin rojo fenol) y luego permita que crezcan hasta el 80% de confluencia.
- Irradiación de rayos X
- Cubra las placas de cultivo o matraces con un compensador de tejido equivalente de hasta 1 cm de grosor. A continuación, exponga las células a la irradiación de rayos X emitida por un acelerador lineal de 6 MV con una distancia fuente-célula de 100 cm, ajustada haciendo clic en el botón de rotación del panel de control remoto.
- Pídale a un físico que mida la dosis de radiación y corrija la atenuación. Como control, coloque matraces que contengan medios en un detector antes de la irradiación de rayos X.
- Oxígeno hiperbárico (HBO)
- Desinfecte la cámara de HBO encendiendo la luz ultravioleta durante 15 minutos y luego inñéguela con 0,02 MPa de oxígeno puro durante 5 minutos.
- Después de colocar las células en placas o matraces de cultivo en la cámara, haga clic en el botón del regulador de presión en el tablero de control fuera de la cámara para aumentar la presión de HBO en la cámara a 0,2 MPa (2,0 ATA) dentro de los 30 minutos posteriores a la irradiación.
- Treinta minutos después, haga clic en el botón del regulador de presión para disminuir la presión del HBO al nivel de presión anterior (0,1 MPpa). Luego, trate los frascos o platos de cultivo con HBO 1 vez al día durante 3 días consecutivos.
2. Células de glioma U251 en diferentes grupos
- Establezca un grupo de control, un grupo de rayos X (2 Gy) y un HBO combinado con un grupo de rayos X (2 Gy) para calcular las curvas de crecimiento celular.
- Prepare suspensiones unicelulares a partir de las células del glioma U251 que muestren las tasas máximas de crecimiento (ver paso 1.1.2). Ajuste la densidad celular a 1 × 106/mL contando las células con un portaobjetos de hemocitómetro. A continuación, añadir 1 mL de la suspensión celular a un frasco de cultivo (densidad celular: 1 × 106/frasco) con tres frascos separados para cada grupo.
- Evalúe la morfología celular con un aumento de 100x con un microscopio de campo claro para enumerar las células adherentes a las 24 h, 48 h y 72 h de cultivo.
3. Radiosensibilidad de las células de glioma U251 (ensayo de formación de clones) dentro de los 30 minutos posteriores a la HBO
- Siembre la suspensión unicelular U251 a lo largo de los pocillos a 5 × 102 células/mL en placas de 6 pocillos y luego exponga a la dosis indicada de irradiación de rayos X (0 Gy, 2 Gy, 4 Gy, 6 Gy y 8 Gy), examinando tres muestras paralelas para cada dosis de rayos X.
- Para el grupo de HBO combinado con rayos X (2 Gy), exponga las células a la irradiación de rayos X dentro de los 30 minutos posteriores al tratamiento con HBO. Después del tratamiento, cultivar las células a 37 °C con 5% de CO2 durante 14 días.
- Una vez que los clones sean visibles, retire el medio y lave los clones 2 veces con PBS.
- Fije las células en 1 mL de metanol al 10% durante 15 min antes de teñir con 1 mL de violeta cristalino al 0,1% durante 20 min.
- Después de la tinción, lave las células con 6 ml de agua destilada con una pipeta y luego aspire la solución de violeta cristalina. Deja que las celdas se sequen al aire.
- Cuente los clones con un diámetro entre 0,3 mm y 1,0 mm bajo un microscopio para asegurarse de que haya >50 células por clon.
- Calcule la fracción de supervivencia (SF) usando la ecuación (1):
SF =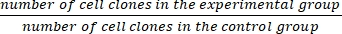 × 100% (1)
× 100% (1) - Utilizando software estadístico, genere una curva de dosis de radiación-supervivencia basada en el modelo multiobjetivo de un solo impacto (SHMT) utilizando la ecuación (2):
S = 1 - (1 -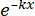 )N (2)
)N (2)
Donde S = la probabilidad de supervivencia; k = la dosis letal media (la dosis que causa una media de un impacto por célula); x = el número de aciertos por celda; N = el número de objetivos (el número de impactos para la muerte de la célula). - Calcular los parámetros radiobiológicos, incluyendo la dosis letal media (D0), la dosis cuasiumbral (Dq), el número de extrapolación (N), la fracción de supervivencia a una dosis de irradiación de 2 Gy (SF2), el índice de mejora de la sensibilización (D0) (SER = D0 en el grupo de control/D0 en el grupo experimental) y SER (Dq) (SER = Dq en el grupo de control/Dq en el grupo experimental) para evaluar el efecto de la HBO sobre la radiosensibilidad de las células de glioma U251.
Donde D0 = el valor recíproco de la pendiente de la porción lineal de la curva de supervivencia (la dosis reduce la tasa de supervivencia en un 63%)
N = el valor del punto de intersección formado por la extrapolación de la porción lineal para cumplir con la ordenada (lo que refleja la capacidad celular para reparar el daño causado por la radiación)
Dq = el valor del punto proyectivo de intersección en la abscisa y la intersección formada trazando una línea a través de 1.0 en la ordenada y paralela a la abscisa para encontrarse con la línea de extrapolación.
4. Ensayo de recuento celular para evaluar la proliferación celular del glioma U251
- Establezca un grupo de control, un grupo de HBO y grupos tratados con rayos X (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy) solos o combinados con HBO.
- Ajuste la densidad celular a 1 × 104 celdas/mL utilizando celdas U251 en suspensiones de una sola celda.
- Siembre las suspensiones celulares (100 μL, densidad: 1 × 103/pocillo) en placas de 96 pocillos (cinco pocillos por grupo). Realice el ensayo de recuento de células (consulte la Tabla de materiales) y, a continuación, determine la densidad óptica (DO) a 450 nm utilizando un lector de microplacas después de 48 h de cultivo con el reactivo.
- Calcular la tasa de inhibición de la proliferación celular (IR) según la ecuación (3):
IR =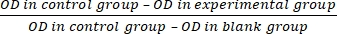 × 100% (3)
× 100% (3)
5. Detección de apoptosis de células de glioma U251
- Establezca grupos de control, HBO, rayos X (2 Gy) y HBO combinados con rayos X (2 Gy).
- Retire el medio después del cultivo y lave las células con 1x PBS.
- Separe las células con tripsina y luego desactive la tripsina agregando DMEM cuando se observe una morfología celular redondeada bajo un microscopio.
- Transfiera las celdas a un tubo de centrífuga y centrifugue durante 5 minutos a 200 × g.
- Deseche el sobrenadante, agregue 3 mL de 1x PBS al pellet y pipetee suavemente para resuspender las células.
- Vuelva a centrifugar las células a 200 × g durante 5 min. A continuación, aspire el sobrenadante PBS y lave las células 2 veces antes de volver a suspenderlas con un pipeteo suave en 50 μL de tampón de unión.
- Añadir 5 μL de anexina V-FITC a las células a 4 °C e incubar las células en la oscuridad a 4 °C durante 15 min antes de añadir 400 μL de tampón de unión. Transfiera la mezcla a un tubo de citometría de flujo que contenga 5 μL de solución de colorante de yoduro de propidio (PI) (10 mg/mL). Detección de células apoptóticas 5 min después por citometría de flujo11.
- Registre la fluorescencia roja en la onda de excitación de 488 nm, introdúzcala en una computadora para analizar el porcentaje de cada ciclo celular en 5.000 células y luego imprima los picos de las células apoptóticas.
- Recoja la fluorescencia roja y verde mediante el doble etiquetado de anexina V y PI, ingresélas en la computadora para analizarlas y luego imprima el diagrama de puntos.
6. Detección de la distribución del ciclo celular del glioma U251
- Lave las células mencionadas anteriormente 2 veces con 1 mL de PBS antes de tratarlas con tripsina.
- Cuando se detecte una morfología de células redondeadas mediante microscopía óptica, agregue DMEM que contenga un 10% de FBS.
- Centrifugar las células durante 5 min a 200 × g a temperatura ambiente.
- Retire el sobrenadante y vuelva a suspender estas células en 1 mL de PBS antes de agregar una solución de etanol al 75% preenfriada.
- Incubar la mezcla durante al menos 4 h o toda la noche a -20 °C.
- Lave las células 2 veces con PBS helado y 180 μL de EDTA (0,1 mM, 3,7 mg de EDTA + 100 mL de PBS), 20 μL de RNasa A (10 mg/mL), 35 μL de Triton X-100 (2%, 2 mL de Triton + 98 mL de FBS) y 96,5 μL de PBS. A continuación, añada 17,5 μL de solución de PI (1 mg/mL).
- Incubar la mezcla a 4 °C en la oscuridad durante 10 min.
- Lavar las células en 200 μL de PBS y luego colocarlas en un citómetro de flujo para evaluar la distribución del ciclo celular, como se describió anteriormente12.
- Opere el citómetro de flujo en modo de excitación de espacio tridimensional de doble láser con un tamaño de punto de 22 μm x 66 μm y 13 μm x 66 μm. Utilice una sala de flujo de 430 μm x 180 μm, espectro de 300-1.100 nm, detectabilidad MESF de ≤100 y resolución CV <2%. A continuación, exponga las células a una luz de excitación de 488 nm y detecte y mida las señales de fluorescencia con el software del instrumento para determinar la distribución del ciclo celular13.
- Determine el contenido de ADN y luego, de acuerdo con el contenido de ADN, analice el ciclo celular.
7. Análisis estadístico
- Realizar análisis estadísticos.
- Presente los datos como media ± desviación estándar.
- Utilice una prueba t de Student para comparar los grupos, con una significación estadística establecida como P < 0,05.
Access restricted. Please log in or start a trial to view this content.
Resultados
Cultivo de células de glioma U251
Las células de glioma U251 tenían una forma fusiforme de 24 h a 48 h después del cultivo en DMEM y se adherieron. Estas células se utilizaron para estudios posteriores (Figura 1).
Morfología y recuento de células de glioma
Los recuentos celulares de las células de glioma U251 en el grupo de HBO combinado con rayos X (2 Gy) fueron significativamente m...
Access restricted. Please log in or start a trial to view this content.
Discusión
La línea celular de glioma U251 es una de las líneas celulares de glioma humano más clásicas y se utiliza ampliamente como modelo de glioma en muchos estudios.
Efectos del HBO en la proliferación de células de glioma U251
La HBO generalmente se refiere a respirar oxígeno puro (100% de concentración de oxígeno) en una cámara sellada con una presión 1,5-3 veces más alta que la presión atmosférica normal, lo que puede aumentar el...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Ninguno.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Binding Buffer | Dickinson and Company | RH10 9RR | |
| CCK-8 test kit | DOJINDO | NJ | Cell counting assay |
| CELL FIT | cell cycle analysis (DNA content) | ||
| CELLQUEST | apoptotic cell analysis | ||
| DMEM and Annexin V-FITC | Gibco BRL | ||
| flow cytometer | Dickinson | ||
| Glioma U251 and U87 cell line | Shanghai Institute of Cell Biology | ||
| hyperbaric oxygen chamber | Hongyuan Institute | ||
| medical linear accelerator | Elekta Limited Company | ||
| microplate reader | |||
| MOD FITLT formac v1.01 | cell analysis--cell cycle phase | ||
| trypsin | Hyclone Laboratories Inc |
Referencias
- Louis, D. N., et al. The 2016 World Health Organization Classification the Central Nervous System: A summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Sun, M. Z., et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. Journal of Neurosurgery. 122 (5), 1144-1150 (2015).
- Hegi, M. E., et al. MGMT gene silencing and benefit from temoozolomide in glioblastoma. New England Journal of Medicine. 352 (10), 997-1003 (2005).
- Zhu, Y., et al. Involvement of decreased hypoxia-inducible factor 1 activity and resultant G1-S cell cycle transition in radioresistance of perinecrotic tumor cells. Oncogene. 32 (16), 2058-2068 (2013).
- Kohshi, K., et al. Potential roles of hyperbaric oxygenation in the treatments of brain tumors. Undersea and Hyperbaric Medicine. 40 (4), 351-362 (2013).
- Aghajan, Y., Grover, I., Gorsi, H., Tumblin, M., Crawford, J. R. Use of hyperbaric oxygen therapy in pediatric neuro-oncology: a single institutional experience. Journal Neurooncology. 141 (1), 151-158 (2019).
- Ding, J. B., Chen, J. R., Xu, H. Z., Qin, Z. Y. Effect of hyperbaric oxygen on the growth of intracranial glioma in rats. Chinese Medical Journal. 128 (23), 3197-3203 (2015).
- Wang, Y. G., et al. Hyperbaric oxygen promotes malignant glioma cell growth and inhibits cell apoptosis. Oncology Letters. 10 (1), 189-195 (2015).
- Milovanova, T. N., et al. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. Journal of Applied Physiology. 106 (2), 711-728 (2009).
- Conconi, M. T., et al. Effects of hyperbaric oxygen on proliferative and apoptotic activities and reactive oxygen species generation in mouse fibroblast 3T3/J2 cell line. Journal of Investigative Medicine. 51 (4), 227-232 (2003).
- Vermes, I., Haanen, C., Steffiens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Cui, W., Niu, F. -L., He, L. -Y., W, S. -R. Comparison of two softwares for analysing apoptosis with flow cytometry. Journal of Beijing University of Traditional Chinese Medicine. 24 (6), 45-47 (2001).
- Cecchini, M. J., Amiri, M., Dick, F. A. Analysis of cell cycle position in mammalian cells. Journal of Visualized Experiments. (59), e3491(2012).
- Resanovic, I., et al. Effects of hyperbaric oxygen on inducible nitric oxide synthase activity/expression in lymphocytes of type 1 diabetes patients: A prospective pilot study. International Journal of Endocrinology. 2019, 2328505(2019).
- Stuhr, L. E., et al. Hyperoxia retards growth and induces apoptosis, changes in vascular density and gene expression in transplanted gliomas in nude rats. Journal of Neuro-Oncology. 85 (2), 191-202 (2007).
- Biollaz, G., et al. Site-specific anti-tumor immunity: differences in DC function, TGF-beta production and numbers of intratumoral Foxp3+ Treg. European Journal of Immunology. 39 (5), 1323-1333 (2009).
- McKenna, F. W., Ahmad, S. Fitting techniques of cell survival curves in high-dose region for use in stereotactic body radiation therapy. Physics in Medicine and Biology. 54 (6), 1593-1608 (2009).
- Malaise, E. P., Lambin, P., Joiner, M. C. Radiosensitivity of human cell lines to small doses. Are there some clinical implications. Radiation Research. 138, S25-S27 (1994).
- Björk-Eriksson, T., West, C., Karlsson, E., Mercke, C. Tumor radiosensitivity (SF2) is a prognostic factor for local control in head and neck cancers. International Journal of Radiation Oncology Biology Physics. 46 (1), 13-19 (2000).
- Bromfield, G. P., Meng, A., Warde, P., Bristow, R. G. Cell death in irradiated prostate epithelial cells: Role of apoptotic and clonogenic cell kill. Prostate Cancer and Prostatic Diseases. 6 (1), 73-85 (2003).
- Kalns, J. E., Piepmeier, E. H. Exposure to hyperbaric oxygen induces cell cycle perturbation in prostate cancer cells. In Vitro Cellular & Developmental Biology - Animal. 35 (2), 98-101 (1999).
- Lakka, S. S., et al. Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion, tumor growth and angiogenesis. Oncogene. 23 (27), 4681-4689 (2004).
- Li, S., Shi, D., Zhang, L., Yang, F., Cheng, G. Oridonin enhances the radiosensitivity of lung cancer cells by upregulating Bax and downregulating Bcl-2. Experimental and Therapeutic Medicine. 16 (6), 4859-4864 (2018).
- Campbell, K. J., Tait, S. W. G. Targeting BCL-2 regulated apoptosis in cancer. Open Biology. 8 (5), 180002(2018).
- Rengarajan, T., et al. D-pinitol promotes apoptosis in MCF-7 cells via induction of p53 and Bax and inhibition of Bcl-2 and NF-κB. Asian Pacific Journal of Cancer Prevention. 15 (4), 1757-1762 (2014).
- Shinagawa, A., et al. The potent peptide antagonist to angiogenesis, C16Y and cisplatin act synergistically in the down-regulation of the Bcl-2/Bax ratio and the induction of apoptosis in human ovarian cancer cells. International Journal of Radiation Oncology Biology Physics. 39 (6), 135-164 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados