É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Usando oxigênio hiperbárico para melhorar a radiossensibilidade de células de glioma U251 humano
Neste Artigo
Resumo
Este protocolo mostra que o oxigênio hiperbárico pode aumentar a proliferação, inibição e apoptose de células de glioma U251 tratadas com irradiação de raios-X, bloqueando as células na fase G2/M. Isso melhora a radiossensibilidade das linhagens celulares de glioma humano.
Resumo
O objetivo deste estudo foi explorar o uso de oxigênio hiperbárico para aumentar a radiossensibilidade das células de glioma humano. As células de glioma humano U251 subcultivadas foram divididas aleatoriamente em quatro grupos: um grupo de controle não tratado, células tratadas apenas com oxigênio hiperbárico (HBO), células tratadas apenas com irradiação de raios-X (raios-X) e células tratadas com HBO e raios-X. Morfologia celular, atividade de proliferação celular, distribuição do ciclo celular e apoptose foram observadas nesses grupos para avaliar o papel da OHB na melhoria da radiossensibilidade das células de glioma. Com o aumento das doses de raios-X (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy), a fração de sobrevivência (SF) das células de glioma diminuiu gradualmente.
Observou-se SF significativamente menor para as células tratadas com HBO e raios-X juntos do que no grupo de raios-X para cada dose (todos P < 0,05). A inibição da proliferação foi significativamente maior no grupo HBO combinado com raios-X do que no grupo raios-X para cada dose (todos os P < 0,05) para a linhagem celular U251. A porcentagem de células da fase G2/M foi significativamente maior no grupo OHB combinado com raios-X (2 Gy) (26,70% ± 2,46%) e no grupo OHB (22,36% ± 0,91%) do que no grupo controle (11,56% ± 2,01%) e no grupo raios-X (2 Gy) (10,35% ± 2,69%) (todos P < 0,05). A apoptose de células U251 foi significativamente maior no grupo HBO combinado com raios-X (2 Gy) do que no grupo HBO, no grupo raio-X (2 Gy) e no grupo controle (todos P < 0,05). Concluímos que a HBO pode aumentar a proliferação, inibição e apoptose das células de glioma U251, bloqueando as células de glioma na fase G2 / M e melhorar a radiossensibilidade das células de glioma U251.
Introdução
O glioma é um tumor intracraniano primário que se origina das células gliais do sistema nervoso central1. A estratégia atual de tratamento para o glioma é a cirurgia combinada com radioterapia e quimioterapia. A radioterapia pós-operatória para glioma pode fornecer benefícios de sobrevida (evidência grau I), e a radioterapia pós-operatória precoce pode efetivamente prolongar a sobrevida do paciente (evidência grau II)2. Para gliomas de alto grau (grau III ou IV), especialmente glioblastoma altamente maligno e invasivo (evidência de grau III)3, a radioterapia pós-operatória deve ser realizada o mais cedo possível (<6 semanas). No entanto, apesar da intervenção precoce, o glioma ainda apresenta uma alta taxa de recorrência e mau prognóstico após tratamento abrangente. Esses resultados estão associados principalmente à baixa radiossensibilidade do glioma. Os fatores relacionados à radiossensibilidade tumoral incluem a radiossensibilidade inerente das células tumorais, células tumorais hipóxicas ou não hipóxicas, a proporção de células tumorais hipóxicas e a capacidade do tecido peritumoral de reparar danos causados pela radiação4.
Dentre esses fatores, as células tumorais hipóxicas ou não hipóxicas e a proporção de células tumorais hipóxicas têm efeitos importantes sobre a radiossensibilidade tumoral. O oxigênio hiperbárico (OHB) pode melhorar o armazenamento de oxigênio nos tecidos, aumentando a tensão de oxigênio nos tecidos e a difusão de oxigênio no sangue. A OHB também pode produzir uma série de efeitos bioquímicos, citológicos e fisiológicos benéficos5. Por exemplo, a OHB tem um efeito reparador marcante nos danos causados pela radiação induzida por radioterapia. Embora a OHB combinada com radioterapia ou quimioterapia seja relatada para melhorar a eficácia clínica da radioterapia ou quimioterapia para o glioma6, há um debate considerável sobre como a OHB sozinha afeta o crescimento do glioma maligno. Ding et al.7 e Wang et al.8 demonstraram que a OHB promove o crescimento de glioma in situ em camundongos por meio de mecanismos que envolvem a inibição da apoptose e a promoção da angiogênese tumoral. Em condições fisiológicas, a OHB promove a angiogênese tumoral por induzir estresse oxidativo9.
No entanto, um estudo indicou que a exposição a curto prazo à OHB promove a proliferação de células tumorais, enquanto a exposição prolongada à OHB promove a apoptose e inibe a proliferação10. Portanto, mais estudos são necessários para explorar se a OHB promove ou inibe o crescimento do glioma e como a OHB combinada com radioterapia ou quimioterapia pode induzir sensibilização terapêutica. Em particular, são necessários detalhes mecanicistas sobre como a HBO melhora a radiossensibilidade do glioma. Para explorar como a HBO melhora a radiossensibilidade das células de glioma U251 humanas neste estudo, usamos HBO combinada com irradiação de raios-X na proliferação de células de glioma e observamos os efeitos na distribuição do ciclo celular e na apoptose.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os métodos de estudo foram aprovados pelo Conselho de Revisão Institucional e pelo Comitê de Ética do Segundo Hospital Afiliado à Universidade de Lanzhou e foram realizados de acordo com as diretrizes e regulamentos relevantes.
1. Tratamento de células de glioma
NOTA: A linha celular de glioma U251 foi usada neste experimento.
- Cultura de células U251
- Semeie células U251 em várias placas com DMEM contendo 10% de soro fetal bovino (FBS) e cultive-as a 37 ° C com 5% de CO2.
- Ao atingir 50%-60% de confluência, dissocie as células usando solução de tripsina-EDTA (0,25%, sem vermelho de fenol) e deixe-as crescer até 80% de confluência.
- Irradiação de raios X
- Cobrir as placas ou balões de cultura com um compensador tecidual equivalente com uma espessura máxima de 1 cm. Em seguida, exponha as células à irradiação de raios X fornecida por um acelerador linear de 6 MV com uma distância fonte-célula de 100 cm, ajustada clicando no botão de rotação na placa de controle remoto.
- Peça a um físico que meça a dose de radiação e corrija a atenuação. Como controle, coloque frascos contendo meios em um detector antes da irradiação de raios-X.
- Oxigênio hiperbárico (OHB)
- Desinfete a câmara HBO ligando a luz ultravioleta por 15 min e depois inunde-a com 0.02 MPa de oxigênio puro por 5 min.
- Depois de colocar as células em placas ou frascos de cultura na câmara, clique no botão regulador de pressão na placa de controle fora da câmara para aumentar a pressão HBO na câmara para 0.2 MPa (2.0 ATA) dentro de 30 minutos de irradiação.
- Trinta minutos depois, clique no botão regulador de pressão para diminuir a pressão HBO para o nível de pressão anterior (0.1 MPpa). Em seguida, trate os frascos ou placas de cultura com HBO 1x por dia durante 3 dias consecutivos.
2. Células de glioma U251 em diferentes grupos
- Defina um grupo de controle, grupo de raios-X (2 Gy) e HBO combinado com grupo de raios-X (2 Gy) para calcular as curvas de crescimento celular.
- Prepare suspensões unicelulares a partir das células do glioma U251 mostrando as taxas máximas de crescimento (consulte a etapa 1.1.2). Ajuste a densidade celular para 1 × 106 / mL contando as células usando uma lâmina de hemocitômetro. Em seguida, adicionar 1 ml da suspensão celular a um frasco de cultura (densidade celular: 1 × 106/frasco) com três frascos separados para cada grupo.
- Avalie a morfologia celular com ampliação de 100x com um microscópio de campo claro para enumerar as células aderentes em 24 h, 48 h e 72 h de cultura.
3. Radiossensibilidade das células de glioma U251 (ensaio de formação de clones) dentro de 30 minutos após HBO
- Semeie a suspensão unicelular U251 em todos os poços a 5 × 102 células/mL em placas de 6 poços e, em seguida, exponha-os à dose indicada de irradiação de raios-X (0 Gy, 2 Gy, 4 Gy, 6 Gy e 8 Gy), com três amostras paralelas sendo examinadas para cada dose de raios-X.
- Para o grupo HBO combinado com raios-X (2 Gy), exponha as células à irradiação de raios-X dentro de 30 minutos após o tratamento com OHB. Após o tratamento, cultivar as células a 37 °C com 5% de CO2 durante 14 dias.
- Depois que os clones estiverem visíveis, remova o meio e lave os clones 2x com PBS.
- Fixe as células em 1 mL de metanol a 10% por 15 min antes de corar com 1 mL de violeta cristal a 0,1% por 20 min.
- Após a coloração, lave as células com 6 mL de água destilada usando uma pipeta e, em seguida, aspire a solução de cristal violeta. Deixe as células secarem ao ar.
- Conte os clones com um diâmetro entre 0,3 mm e 1,0 mm ao microscópio para garantir que haja >50 células por clone.
- Calcular a fração de sobrevivência (SF) utilizando a equação (1):
SF =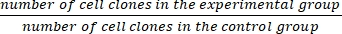 × 100% (1)
× 100% (1) - Usando software estatístico, gere uma curva de sobrevivência de dose de radiação com base no modelo multialvo de acerto único (SHMT) usando a equação (2):
S = 1 - (1 -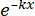 )N (2)
)N (2)
Onde S = probabilidade de sobrevivência; k = dose letal média (a dose que causa uma resposta positiva média por célula); x = o número de ocorrências por célula; N = o número de alvos (o número de acertos para morte celular). - Calcule os parâmetros radiobiológicos, incluindo a dose letal média (D0), dose quase-limiar (Dq), número de extrapolação (N), fração de sobrevivência em uma dose de irradiação de 2 Gy (SF2), taxa de aumento de sensibilização (D0) (SER = D0 no grupo controle / D0 no grupo experimental) e SER (Dq) (SER = Dq no grupo controle / Dq no grupo experimental) para avaliar o efeito da HBO na radiossensibilidade das células de glioma U251.
Em que D0 = valor recíproco da inclinação da porção linear da curva de sobrevivência (a dose reduz a taxa de sobrevivência em 63%)
N = o valor do ponto de interseção formado pela extrapolação da porção linear para encontrar a ordenada (refletindo a capacidade celular de reparar o dano causado pela radiação)
Dq = valor do ponto projetivo de intersecção na abscissa e da intersecção formada pelo desenho de uma linha que passa por 1,0 na ordenada e paralela à abscissa para encontrar a recta de extrapolação.
4. Ensaio de contagem de células para avaliar a proliferação de células de glioma U251
- Defina um grupo de controle, um grupo HBO e grupos tratados com raios-X (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy) sozinho ou combinado com HBO.
- Ajuste a densidade celular para 1 × 104 células/mL usando células U251 em suspensões unicelulares.
- Semeie as suspensões celulares (100 μL, densidade: 1 × 103 / poço) em placas de 96 poços (cinco poços por grupo). Efectuar o ensaio de contagem de células (ver Tabela de Materiais) e, em seguida, determinar a densidade óptica (DO) a 450 nm utilizando um leitor de microplacas após 48 h de cultura com o reagente.
- Calcular a taxa de inibição da proliferação celular (IR) de acordo com a equação (3):
IR =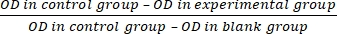 × 100% (3)
× 100% (3)
5. Detecção de apoptose de células de glioma U251
- Controle de conjunto, HBO, raio-X (2 Gy) e HBO combinados com grupos de raios-X (2 Gy).
- Remova o meio após a cultura e lave as células com 1x PBS.
- Separe as células com tripsina e, em seguida, desative a tripsina adicionando DMEM quando uma morfologia celular arredondada for observada ao microscópio.
- Transferir as células para um tubo de centrifugação e centrifugar durante 5 min a 200 × g.
- Descarte o sobrenadante, adicione 3 mL de 1x PBS ao pellet e pipete suavemente para ressuspender as células.
- Centrifugue as células novamente a 200 × g por 5 min. Em seguida, aspire o PBS sobrenadante e lave as células 2x antes de ressuspendê-las com pipetagem suave em 50 μL de tampão de ligação.
- Adicione 5 μL de anexina V-FITC às células a 4 ° C e incube as células no escuro a 4 ° C por 15 min antes de adicionar 400 μL de tampão de ligação. Transferir a mistura para um tubo de citometria de fluxo contendo 5 μl de solução de corante de iodeto de propídio (PI) (10 mg/ml). Detecte células apoptóticas 5 min depois por citometria de fluxo11.
- Registre a fluorescência vermelha na onda de excitação de 488 nm, insira-a em um computador para analisar a porcentagem de cada ciclo celular em 5.000 células e, em seguida, imprima os picos das células apoptóticas.
- Colete a fluorescência vermelha e verde por anexina V e rotulagem dupla PI, insira-as no computador para analisar e, em seguida, imprima o gráfico de pontos.
6. Detecção da distribuição do ciclo celular do glioma U251
- Lave as células mencionadas acima 2x com 1 mL de PBS antes de tratá-las com tripsina.
- Quando uma morfologia celular arredondada for detectada por microscopia de luz, adicione DMEM contendo 10% de FBS.
- Centrifugue as células por 5 min a 200 × g à temperatura ambiente.
- Remova o sobrenadante e ressuspenda essas células em 1 mL de PBS antes de adicionar solução pré-resfriada de etanol a 75%.
- Incubar a mistura durante pelo menos 4 h ou durante a noite a -20 °C.
- Lave as células 2x com PBS gelado e 180 μL de EDTA (0,1 mM, 3,7 mg de EDTA + 100 mL de PBS), 20 μL de RNase A (10 mg/mL), 35 μL de Triton X-100 (2%, 2 mL de Triton + 98 mL de FBS) e 96,5 μL de PBS. Em seguida, adicione 17,5 μL de solução de IP (1 mg/mL).
- Incubar a mistura a 4 °C na escuridão durante 10 min.
- Lave as células em 200 μL de PBS e, em seguida, coloque-as em um citômetro de fluxo para avaliar a distribuição do ciclo celular, conforme descrito anteriormente12.
- Opere o citômetro de fluxo no modo de excitação de laser duplo, espaço tridimensional, com um tamanho de ponto de 22 μm x 66 μm e 13 μm x 66 μm. Use uma sala de fluxo de 430 μm x 180 μm, espectro de 300-1.100 nm, detectabilidade ≤100 MESF e resolução CV <2%. Em seguida, exponha as células à luz de excitação de 488 nm e detecte e meça os sinais de fluorescência com o software do instrumento para determinar a distribuição do ciclo celular13.
- Determine o conteúdo de DNA e, de acordo com o conteúdo de DNA, analise o ciclo celular.
7. Análise estatística
- Realizar análises estatísticas.
- Apresente os dados como média ± desvio padrão.
- Utilizar o teste t de Student para comparar os grupos, com significância estatística definida como P < 0,05.
Access restricted. Please log in or start a trial to view this content.
Resultados
Cultura de células de glioma U251
As células de glioma U251 apresentaram formato fusiforme 24 h a 48 h após o cultivo em DMEM e foram aderentes. Essas células foram utilizadas para estudo posterior (Figura 1).
Morfologia e contagem de células de glioma
As contagens de células para as células de glioma U251 no grupo HBO combinado com raios-X (2 Gy) foram significativamente menores do q...
Access restricted. Please log in or start a trial to view this content.
Discussão
A linhagem celular de glioma U251 é uma das linhagens celulares de glioma humano mais clássicas e é amplamente utilizada como modelo de glioma em muitos estudos.
Efeitos da OHB na proliferação de células de glioma U251
HBO normalmente se refere à respiração de oxigênio puro (concentração de oxigênio de 100%) em uma câmara selada com uma pressão 1,5-3 vezes maior que a pressão atmosférica normal, o que pode aumentar o conte?...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Nenhum.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Binding Buffer | Dickinson and Company | RH10 9RR | |
| CCK-8 test kit | DOJINDO | NJ | Cell counting assay |
| CELL FIT | cell cycle analysis (DNA content) | ||
| CELLQUEST | apoptotic cell analysis | ||
| DMEM and Annexin V-FITC | Gibco BRL | ||
| flow cytometer | Dickinson | ||
| Glioma U251 and U87 cell line | Shanghai Institute of Cell Biology | ||
| hyperbaric oxygen chamber | Hongyuan Institute | ||
| medical linear accelerator | Elekta Limited Company | ||
| microplate reader | |||
| MOD FITLT formac v1.01 | cell analysis--cell cycle phase | ||
| trypsin | Hyclone Laboratories Inc |
Referências
- Louis, D. N., et al. The 2016 World Health Organization Classification the Central Nervous System: A summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Sun, M. Z., et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. Journal of Neurosurgery. 122 (5), 1144-1150 (2015).
- Hegi, M. E., et al. MGMT gene silencing and benefit from temoozolomide in glioblastoma. New England Journal of Medicine. 352 (10), 997-1003 (2005).
- Zhu, Y., et al. Involvement of decreased hypoxia-inducible factor 1 activity and resultant G1-S cell cycle transition in radioresistance of perinecrotic tumor cells. Oncogene. 32 (16), 2058-2068 (2013).
- Kohshi, K., et al. Potential roles of hyperbaric oxygenation in the treatments of brain tumors. Undersea and Hyperbaric Medicine. 40 (4), 351-362 (2013).
- Aghajan, Y., Grover, I., Gorsi, H., Tumblin, M., Crawford, J. R. Use of hyperbaric oxygen therapy in pediatric neuro-oncology: a single institutional experience. Journal Neurooncology. 141 (1), 151-158 (2019).
- Ding, J. B., Chen, J. R., Xu, H. Z., Qin, Z. Y. Effect of hyperbaric oxygen on the growth of intracranial glioma in rats. Chinese Medical Journal. 128 (23), 3197-3203 (2015).
- Wang, Y. G., et al. Hyperbaric oxygen promotes malignant glioma cell growth and inhibits cell apoptosis. Oncology Letters. 10 (1), 189-195 (2015).
- Milovanova, T. N., et al. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. Journal of Applied Physiology. 106 (2), 711-728 (2009).
- Conconi, M. T., et al. Effects of hyperbaric oxygen on proliferative and apoptotic activities and reactive oxygen species generation in mouse fibroblast 3T3/J2 cell line. Journal of Investigative Medicine. 51 (4), 227-232 (2003).
- Vermes, I., Haanen, C., Steffiens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Cui, W., Niu, F. -L., He, L. -Y., W, S. -R. Comparison of two softwares for analysing apoptosis with flow cytometry. Journal of Beijing University of Traditional Chinese Medicine. 24 (6), 45-47 (2001).
- Cecchini, M. J., Amiri, M., Dick, F. A. Analysis of cell cycle position in mammalian cells. Journal of Visualized Experiments. (59), e3491(2012).
- Resanovic, I., et al. Effects of hyperbaric oxygen on inducible nitric oxide synthase activity/expression in lymphocytes of type 1 diabetes patients: A prospective pilot study. International Journal of Endocrinology. 2019, 2328505(2019).
- Stuhr, L. E., et al. Hyperoxia retards growth and induces apoptosis, changes in vascular density and gene expression in transplanted gliomas in nude rats. Journal of Neuro-Oncology. 85 (2), 191-202 (2007).
- Biollaz, G., et al. Site-specific anti-tumor immunity: differences in DC function, TGF-beta production and numbers of intratumoral Foxp3+ Treg. European Journal of Immunology. 39 (5), 1323-1333 (2009).
- McKenna, F. W., Ahmad, S. Fitting techniques of cell survival curves in high-dose region for use in stereotactic body radiation therapy. Physics in Medicine and Biology. 54 (6), 1593-1608 (2009).
- Malaise, E. P., Lambin, P., Joiner, M. C. Radiosensitivity of human cell lines to small doses. Are there some clinical implications. Radiation Research. 138, S25-S27 (1994).
- Björk-Eriksson, T., West, C., Karlsson, E., Mercke, C. Tumor radiosensitivity (SF2) is a prognostic factor for local control in head and neck cancers. International Journal of Radiation Oncology Biology Physics. 46 (1), 13-19 (2000).
- Bromfield, G. P., Meng, A., Warde, P., Bristow, R. G. Cell death in irradiated prostate epithelial cells: Role of apoptotic and clonogenic cell kill. Prostate Cancer and Prostatic Diseases. 6 (1), 73-85 (2003).
- Kalns, J. E., Piepmeier, E. H. Exposure to hyperbaric oxygen induces cell cycle perturbation in prostate cancer cells. In Vitro Cellular & Developmental Biology - Animal. 35 (2), 98-101 (1999).
- Lakka, S. S., et al. Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion, tumor growth and angiogenesis. Oncogene. 23 (27), 4681-4689 (2004).
- Li, S., Shi, D., Zhang, L., Yang, F., Cheng, G. Oridonin enhances the radiosensitivity of lung cancer cells by upregulating Bax and downregulating Bcl-2. Experimental and Therapeutic Medicine. 16 (6), 4859-4864 (2018).
- Campbell, K. J., Tait, S. W. G. Targeting BCL-2 regulated apoptosis in cancer. Open Biology. 8 (5), 180002(2018).
- Rengarajan, T., et al. D-pinitol promotes apoptosis in MCF-7 cells via induction of p53 and Bax and inhibition of Bcl-2 and NF-κB. Asian Pacific Journal of Cancer Prevention. 15 (4), 1757-1762 (2014).
- Shinagawa, A., et al. The potent peptide antagonist to angiogenesis, C16Y and cisplatin act synergistically in the down-regulation of the Bcl-2/Bax ratio and the induction of apoptosis in human ovarian cancer cells. International Journal of Radiation Oncology Biology Physics. 39 (6), 135-164 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados