Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan U251 Glioma Hücrelerinin Radyosensitivitesini Artırmak için Hiperbarik Oksijen Kullanımı
Bu Makalede
Özet
Bu protokol, hiperbarik oksijenin, G2/M fazındaki hücreleri bloke ederek X-ışını ışınlaması ile tedavi edilen U251 glioma hücrelerinin proliferasyonunu, inhibisyonunu ve apoptozunu artırabileceğini göstermektedir. Bu, insan glioma hücre hatlarının radyosensitivitesini artırır.
Özet
Bu çalışmanın amacı, insan glioma hücrelerinin radyosensitivitesini arttırmak için hiperbarik oksijen kullanımını araştırmaktı. Alt kültürlenmiş U251 insan glioma hücreleri rastgele dört gruba ayrıldı: tedavi edilmemiş bir kontrol grubu, sadece hiperbarik oksijen (HBO) ile tedavi edilen hücreler, sadece X-ışını ışınlaması (X-ışını) ile tedavi edilen hücreler ve hem HBO hem de X-ışını ile tedavi edilen hücreler. Glioma hücrelerinin radyosensitivitesini iyileştirmede HBO'nun rolünü değerlendirmek için bu gruplarda hücre morfolojisi, hücre proliferasyon aktivitesi, hücre döngüsü dağılımı ve apoptoz gözlendi. X-ışını dozlarındaki artışla (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy), glioma hücrelerinin hayatta kalma fraksiyonu (SF) yavaş yavaş azaldı.
HBO ve X-ışını ile birlikte tedavi edilen hücreler için, her doz için X-ışını grubuna göre önemli ölçüde daha düşük SF gözlenmiştir (tüm P < 0.05). Proliferasyon inhibisyonu, U251 hücre hattı için her doz için (tüm P < 0.05) X-ışını grubu ile kombine HBO'da X-ışını grubuna göre anlamlı derecede daha yüksekti. HBO'da X-ışını (2 Gy) grubunda (%26.70 ± %2.46) ve HBO grubunda (%22.36 ± %0.91) G2/M faz hücrelerinin yüzdesi, kontrol grubuna (%11.56 ± %2.01) ve X-ışını (2 Gy) grubuna (%10.35 ± %2.69) göre anlamlı olarak daha yüksekti (tüm P < 0.05). U251 hücre apoptozu, X-ışını (2 Gy) ile kombine HBO'da HBO grubu, X-ışını (2 Gy) grubuna ve kontrol grubuna göre anlamlı olarak daha yüksekti (tümü P < 0.05). HBO'nun G2/M fazındaki glioma hücrelerini bloke ederek glioma U251 hücrelerinin proliferasyonunu, inhibisyonunu ve apoptozunu artırabileceği ve U251 glioma hücrelerinin radyosensitivitesini iyileştirebileceği sonucuna vardık.
Giriş
Glioma, merkezi sinir sistemi glial hücrelerinden köken alan primer bir intrakraniyal tümördür1. Glioma için güncel tedavi stratejisi, radyoterapi ve kemoterapi ile kombine edilen cerrahidir. Glioma için postoperatif radyoterapi sağkalım faydaları sağlayabilir (derece I kanıt) ve erken postoperatif radyoterapi hasta sağkalımını etkili bir şekilde uzatabilir (derece II kanıt)2. Daha yüksek dereceli gliomlar (derece III veya IV), özellikle yüksek derecede malign ve invaziv glioblastom (derece III kanıt)3 için, postoperatif radyoterapi mümkün olduğunca erken (<6 hafta) yapılmalıdır. Bununla birlikte, erken müdahaleye rağmen, glioma kapsamlı tedaviden sonra hala yüksek nüks oranına ve kötü prognoza sahiptir. Bu sonuçlar esas olarak gliomun düşük radyosensitivitesi ile ilişkilidir. Tümör radyosensitivitesi ile ilgili faktörler arasında tümör hücrelerinin, hipoksik veya hipoksik olmayan tümör hücrelerinin doğal radyosensitivitesi, hipoksik tümör hücrelerinin oranı ve peritümöral dokunun radyasyon hasarını onarma kapasitesi yer alır4.
Bu faktörler arasında hipoksik veya hipoksik olmayan tümör hücreleri ve hipoksik tümör hücrelerinin oranı tümör radyosensitivitesi üzerinde önemli etkilere sahiptir. Hiperbarik oksijen (HBO), doku oksijen gerginliğini ve kan oksijen difüzyonunu artırarak doku oksijen depolamasını iyileştirebilir. HBO ayrıca bir dizi faydalı biyokimyasal, sitolojik ve fizyolojik etki üretebilir5. Örneğin, HBO'nun radyoterapiye bağlı radyasyon hasarı üzerinde belirgin bir onarıcı etkisi vardır. Radyoterapi veya kemoterapi ile kombine edilen HBO'nun glioma6 için radyoterapi veya kemoterapinin klinik etkinliğini artırdığı bildirilse de, HBO'nun tek başına malign glioma büyümesini nasıl etkilediği konusunda önemli tartışmalar vardır. Ding ve ark.7 ve Wang ve ark.8'in her ikisi de HBO'nun farelerde apoptozun inhibisyonunu ve tümör anjiyogenezinin teşvikini içeren mekanizmalar yoluyla in situ glioma büyümesini desteklediğini göstermiştir. Fizyolojik koşullar altında, HBO'nun oksidatif stresi indükleyerek tümör anjiyogenezini teşvik ettiği bildirilmektedir9.
Bununla birlikte, bir çalışma, kısa süreli HBO maruziyetinin tümör hücresi proliferasyonunu teşvik ettiğini, uzun süreli HBO maruziyetinin ise apoptozu teşvik ettiğini ve proliferasyonu inhibe ettiğini göstermiştir10. Bu nedenle, HBO'nun glioma büyümesini destekleyip desteklemediğini veya inhibe edip etmediğini ve HBO'nun radyoterapi veya kemoterapi ile birlikte terapötik duyarlılığı nasıl indükleyebileceğini araştırmak için daha fazla çalışmaya ihtiyaç vardır. Özellikle, HBO'nun glioma'nın radyosensitivitesini nasıl geliştirdiğine dair mekanik detaylara ihtiyaç vardır. Bu çalışmada HBO'nun insan U251 glioma hücrelerinin radyosensitivitesini nasıl geliştirdiğini keşfetmek için, glioma hücre proliferasyonu üzerinde X-ışını ışınlaması ile birlikte HBO'yu kullandık ve hücre döngüsü dağılımı ve apoptoz üzerindeki etkilerini gözlemledik.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm çalışma yöntemleri, Lanzhou Üniversitesi'ne Bağlı İkinci Hastanenin Kurumsal İnceleme Kurulu ve Etik Kurulu tarafından onaylandı ve ilgili yönergelere ve düzenlemelere uygun olarak gerçekleştirildi.
1. Glioma hücrelerinin tedavisi
NOT: Bu deneyde U251 glioma hücre hattı kullanılmıştır.
- U251 hücre kültürü
- U251 hücrelerini% 10 fetal sığır serumu (FBS) içeren DMEM ile birden fazla tabakta tohumlayın ve 37 ° C'de% 5 CO2 ile kültürleyin.
- % 50 -% 60 birleşmeye ulaştıktan sonra, hücreleri tripsin-EDTA çözeltisi (% 0.25, fenol kırmızısı olmadan) kullanarak ayırın ve ardından% 80 birleşmeye kadar büyümelerine izin verin.
- X-ışını ışınlaması
- Kültür plakalarını veya şişelerini 1 cm kalınlığa kadar eşdeğer bir doku kompansatörü ile örtün. Ardından, hücreleri, uzaktan kumanda panosundaki döndürme düğmesine tıklanarak ayarlanan, kaynak hücre mesafesi 100 cm olan 6 MV'lik bir lineer hızlandırıcıdan gelen X-ışını ışınlamasına maruz bırakın.
- Bir fizikçiye radyasyon dozunu ölçmesini ve zayıflamayı düzeltmesini sağlayın. Bir kontrol olarak, ortam içeren şişeleri X-ışını ışınlamasından önce bir dedektöre yerleştirin.
- Hiperbarik oksijen (HBO)
- Ultraviyole ışığını 15 dakika boyunca açarak HBO odasını dezenfekte edin ve ardından 5 dakika boyunca 0,02 MPa saf oksijenle doldurun.
- Hücreleri haznedeki plakalara veya kültür şişelerine yerleştirdikten sonra, haznedeki HBO basıncını ışınlamadan sonraki 30 dakika içinde 0,2 MPa'ya (2,0 ATA) çıkarmak için haznenin dışındaki kontrol panosundaki basınç regülatörü düğmesine tıklayın.
- Otuz dakika sonra, HBO basıncını önceki basınç seviyesine (0,1 MPpa) düşürmek için basınç regülatörü düğmesine tıklayın. Ardından, kültür şişelerini veya plakalarını art arda 3 gün boyunca günde 1x HBO ile muamele edin.
2. Farklı gruplarda U251 glioma hücreleri
- Hücre büyüme eğrilerini hesaplamak için bir kontrol grubu, X-ışını (2 Gy) grubu ve HBO'yu X-ışını (2 Gy) grubu ile birlikte ayarlayın.
- Glioma U251 hücrelerinden maksimum büyüme oranlarını gösteren tek hücreli süspansiyonlar hazırlayın (bkz. adım 1.1.2). Bir hemositometre lamı kullanarak hücreleri sayarak hücre yoğunluğunu 1 × 106 / mL'ye ayarlayın. Daha sonra, her grup için üç ayrı şişe ile bir kültür şişesine (hücre yoğunluğu: 1 × 106 / şişe) 1 mL hücre süspansiyonu ekleyin.
- Yapışık hücreleri 24 saat, 48 saat ve 72 saat kültürde numaralandırmak için parlak alan mikroskobu ile 100x büyütmede hücre morfolojisini değerlendirin.
3. HBO'dan 30 dakika sonra U251 glioma hücrelerinin (klon oluşum testi) radyosensitivitesi.
- U251 tek hücreli süspansiyonu kuyucuklar boyunca 5 × 102 hücre / mL'de 6 oyuklu plakalarda tohumlayın ve daha sonra bunları belirtilen X-ışını ışınlama dozuna (0 Gy, 2 Gy, 4 Gy, 6 Gy ve 8 Gy) maruz bırakın, her X-ışını dozu için üç paralel numune incelenir.
- X-ışını (2 Gy) grubu ile birleştirilmiş HBO için, hücreleri HBO tedavisinden sonraki 30 dakika içinde X-ışını ışınlamasına maruz bırakın. Tedaviden sonra, hücreleri 14 gün boyunca% 5 CO2 ile 37 ° C'de kültürleyin.
- Klonlar göründükten sonra, ortamı çıkarın ve klonları PBS ile 2 kez yıkayın.
- 20 dakika boyunca 1 mL %0.1 kristal viyole ile boyamadan önce hücreleri 1 mL %10 metanol içinde 15 dakika sabitleyin.
- Boyamadan sonra, hücreleri bir pipet kullanarak 6 mL damıtılmış su ile yıkayın ve ardından kristal viyole çözeltisini aspire edin. Hücrelerin kurumasına izin verin.
- Klon başına >50 hücre olduğundan emin olmak için mikroskop altında 0,3 mm ile 1,0 mm arasında bir çapa sahip klonları sayın.
- Denklem (1)'i kullanarak hayatta kalma fraksiyonunu (SF) hesaplayın:
SF =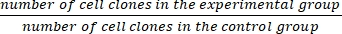 × %100 (1)
× %100 (1) - İstatistiksel yazılımı kullanarak, denklem (2)'yi kullanarak tek vuruşlu çok hedefli (SHMT) modeline dayalı bir radyasyon dozu-sağkalım eğrisi oluşturun:
S = 1 - (1 -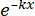 )N (2)
)N (2)
Burada S = hayatta kalma olasılığı; k = ortalama öldürücü doz (hücre başına ortalama bir isabete neden olan doz); x = hücre başına isabet sayısı; N = hedef sayısı (hücre ölümü için isabet sayısı). - HBO'nun U251 glioma hücrelerinin radyosensitivitesi üzerindeki etkisini değerlendirmek için ortalama ölümcül doz (D0), yarı eşik doz (Dq), ekstrapolasyon sayısı (N), 2 Gy ışınlama dozunda hayatta kalma fraksiyonu (SF2), duyarlılık artırma oranı (D0) (SER = D0 kontrol grubunda / D0 deney grubunda) ve SER (Dq) (SER = Dq kontrol grubunda / deney grubunda Dq) dahil olmak üzere radyobiyolojik parametreleri hesaplayın.
Burada D0 = sağkalım eğrisinin doğrusal kısmının eğiminin karşılıklı değeri (hayatta kalma oranını% 63 azaltan doz)
N = ordinatı karşılamak için doğrusal kısmın ekstrapolasyonu ile oluşturulan kesişme noktasının değeri (radyasyonun neden olduğu hasarı onarmak için hücresel yeteneği yansıtır)
Dq = apsis üzerindeki kesişim-izdüşüm noktasının ve ekstrapolasyon çizgisini karşılamak için ordinatta ve apsise paralel olarak 1.0 boyunca bir çizgi çizilerek oluşturulan kesişimin değeri.
4. U251 glioma hücre proliferasyonunu değerlendirmek için hücre sayımı testi
- Bir kontrol grubu, bir HBO grubu ve tek başına veya HBO ile birlikte X-ışını ile tedavi edilen grupları (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy) ayarlayın.
- Tek hücreli süspansiyonlarda U251 hücreleri kullanarak hücre yoğunluğunu 1 ×10 4 hücre / mL'ye ayarlayın.
- Hücre süspansiyonlarını (100 μL, yoğunluk: 1 × 103 / kuyucuk) 96 oyuklu plakalarda (grup başına beş kuyucuk) tohumlayın. Hücre sayım testini gerçekleştirin ( Malzeme Tablosuna bakın) ve ardından reaktifle 48 saatlik kültürden sonra bir mikroplaka okuyucu kullanarak 450 nm'de optik yoğunluğu (OD) belirleyin.
- Denklem (3)'e göre hücre proliferasyon inhibisyon oranını (IR) hesaplayın:
IR =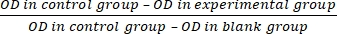 × %100 (3)
× %100 (3)
5. U251 glioma hücrelerinin apoptozunun tespiti
- Set kontrolü, HBO, X-ışını (2 Gy) ve HBO, X-ışını (2 Gy) gruplarıyla birlikte.
- Kültürden sonra ortamı çıkarın ve hücreleri 1x PBS ile yıkayın.
- Hücreleri tripsin ile ayırın ve daha sonra mikroskop altında yuvarlak bir hücre morfolojisi gözlendiğinde DMEM ekleyerek tripsini devre dışı bırakın.
- Hücreleri bir santrifüj tüpüne aktarın ve 200 × g'da 5 dakika santrifüjleyin.
- Süpernatanı atın, pelete 3 mL 1x PBS ekleyin ve hücreleri yeniden süspanse etmek için hafifçe pipetleyin.
- Hücreleri tekrar 200 × g'da 5 dakika santrifüj edin. Ardından, süpernatan PBS'yi aspire edin ve hücreleri 50 μL Bağlayıcı Tamponda hafif pipetleme ile yeniden süspanse etmeden önce 2 kez yıkayın.
- Hücrelere 4 ° C'de 5 μL annexin V-FITC ekleyin ve 400 μL Bağlayıcı Tampon eklemeden önce hücreleri karanlıkta 4 ° C'de 15 dakika inkübe edin. Karışımı, 5 μL propidyum iyodür (PI) Boya Çözeltisi (10 mg / mL) içeren bir akış sitometri tüpüne aktarın. Apoptotik hücreleri 5 dakika sonra akış sitometrisi11 ile tespit edin.
- 488 nm uyarma dalgasında kırmızı floresan kaydedin, 5.000 hücredeki her hücre döngüsünün yüzdesini analiz etmek için bunları bir bilgisayara girin ve ardından apoptotik hücrelerin tepe noktalarını yazdırın.
- Ek V ve PI çift etiketleme ile kırmızı ve yeşil floresan toplayın, analiz etmek için bilgisayara girin ve ardından nokta grafiğini yazdırın.
6. U251 glioma hücre döngüsü dağılımının tespiti
- Yukarıda belirtilen hücreleri tripsin ile işlemden önce 2x 1 mL PBS ile yıkayın.
- Işık mikroskobu ile yuvarlak bir hücre morfolojisi tespit edildiğinde,% 10 FBS içeren DMEM ekleyin.
- Hücreleri oda sıcaklığında 200 × g'da 5 dakika santrifüjleyin.
- Süpernatanı çıkarın ve önceden soğutulmuş% 75 etanol çözeltisi eklemeden önce bu hücreleri 1 mL PBS'de yeniden süspanse edin.
- Karışımı en az 4 saat veya gece boyunca -20 °C'de inkübe edin.
- Hücreleri 2x buz gibi soğuk PBS ve 180 μL EDTA (0.1 mM, 3.7 mg EDTA + 100 mL PBS), 20 μL RNase A (10 mg / mL), 35 μL Triton X-100 (% 2, 2 mL Triton + 98 mL FBS) ve 96.5 μL PBS ile yıkayın. Daha sonra 17.5 μL PI çözeltisi (1 mg / mL) ekleyin.
- Karışımı 4 °C'de karanlıkta 10 dakika inkübe edin.
- Hücreleri 200 μL PBS'de yıkayın ve daha önce tarif edildiği gibi hücre döngüsü dağılımını değerlendirmek için bir akış sitometresine yerleştirin12.
- Akış sitometresini çift lazerli, üç boyutlu uzayda, 22 μm x 66 μm ve 13 μm x 66 μm nokta boyutuna sahip uyarma modunda çalıştırın. 430 μm x 180 μm, 300-1.100 nm spektrum, ≤100 MESF algılanabilirlik ve CV %<2 çözünürlüğe sahip bir akış odası kullanın. Ardından, hücreleri 488 nm uyarma ışığına maruz bırakın ve hücre döngüsü dağılımını13 belirlemek için floresan sinyallerini cihaz yazılımı ile tespit edin ve ölçün.
- DNA içeriğini belirleyin ve ardından DNA içeriğine göre hücre döngüsünü analiz edin.
7. İstatistiksel analiz
- İstatistiksel analizler yapın.
- Verileri ortalama ± standart sapma olarak sunun.
- Grupları karşılaştırmak için bir Öğrenci t-testi kullanın ve istatistiksel anlamlılık P < 0.05 olarak ayarlanmıştır.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
U251 glioma hücrelerinin kültürü
U251 glioma hücreleri, DMEM'de kültürden 24 saat ila 48 saat sonra fusiform bir şekle sahipti ve yapışıktı. Bu hücreler daha ileri çalışmalar için kullanıldı (Şekil 1).
Glioma hücre morfolojisi ve sayımı
HBO'daki U251 glioma hücreleri için X-ışını (2 Gy) grubu ile kombine hücre sayıları, 24 saat, 48 saat ve 72 saat hücre kült...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Glioma hücre hattı U251, en klasik insan glioma hücre hatlarından biridir ve birçok çalışmada glioma modeli olarak yaygın olarak kullanılmaktadır.
HBO'nun U251 glioma hücre proliferasyonu üzerindeki etkileri
HBO tipik olarak, mikrovasküler plazmadaki oksijen içeriğini artırabilen, normal atmosfer basıncından 1.5-3 kat daha yüksek bir basınca sahip kapalı bir odada saf oksijenin (% 100 oksijen konsantrasyonu) solunması...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Hiç kimse.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Binding Buffer | Dickinson and Company | RH10 9RR | |
| CCK-8 test kit | DOJINDO | NJ | Cell counting assay |
| CELL FIT | cell cycle analysis (DNA content) | ||
| CELLQUEST | apoptotic cell analysis | ||
| DMEM and Annexin V-FITC | Gibco BRL | ||
| flow cytometer | Dickinson | ||
| Glioma U251 and U87 cell line | Shanghai Institute of Cell Biology | ||
| hyperbaric oxygen chamber | Hongyuan Institute | ||
| medical linear accelerator | Elekta Limited Company | ||
| microplate reader | |||
| MOD FITLT formac v1.01 | cell analysis--cell cycle phase | ||
| trypsin | Hyclone Laboratories Inc |
Referanslar
- Louis, D. N., et al. The 2016 World Health Organization Classification the Central Nervous System: A summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Sun, M. Z., et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. Journal of Neurosurgery. 122 (5), 1144-1150 (2015).
- Hegi, M. E., et al. MGMT gene silencing and benefit from temoozolomide in glioblastoma. New England Journal of Medicine. 352 (10), 997-1003 (2005).
- Zhu, Y., et al. Involvement of decreased hypoxia-inducible factor 1 activity and resultant G1-S cell cycle transition in radioresistance of perinecrotic tumor cells. Oncogene. 32 (16), 2058-2068 (2013).
- Kohshi, K., et al. Potential roles of hyperbaric oxygenation in the treatments of brain tumors. Undersea and Hyperbaric Medicine. 40 (4), 351-362 (2013).
- Aghajan, Y., Grover, I., Gorsi, H., Tumblin, M., Crawford, J. R. Use of hyperbaric oxygen therapy in pediatric neuro-oncology: a single institutional experience. Journal Neurooncology. 141 (1), 151-158 (2019).
- Ding, J. B., Chen, J. R., Xu, H. Z., Qin, Z. Y. Effect of hyperbaric oxygen on the growth of intracranial glioma in rats. Chinese Medical Journal. 128 (23), 3197-3203 (2015).
- Wang, Y. G., et al. Hyperbaric oxygen promotes malignant glioma cell growth and inhibits cell apoptosis. Oncology Letters. 10 (1), 189-195 (2015).
- Milovanova, T. N., et al. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. Journal of Applied Physiology. 106 (2), 711-728 (2009).
- Conconi, M. T., et al. Effects of hyperbaric oxygen on proliferative and apoptotic activities and reactive oxygen species generation in mouse fibroblast 3T3/J2 cell line. Journal of Investigative Medicine. 51 (4), 227-232 (2003).
- Vermes, I., Haanen, C., Steffiens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Cui, W., Niu, F. -L., He, L. -Y., W, S. -R. Comparison of two softwares for analysing apoptosis with flow cytometry. Journal of Beijing University of Traditional Chinese Medicine. 24 (6), 45-47 (2001).
- Cecchini, M. J., Amiri, M., Dick, F. A. Analysis of cell cycle position in mammalian cells. Journal of Visualized Experiments. (59), e3491(2012).
- Resanovic, I., et al. Effects of hyperbaric oxygen on inducible nitric oxide synthase activity/expression in lymphocytes of type 1 diabetes patients: A prospective pilot study. International Journal of Endocrinology. 2019, 2328505(2019).
- Stuhr, L. E., et al. Hyperoxia retards growth and induces apoptosis, changes in vascular density and gene expression in transplanted gliomas in nude rats. Journal of Neuro-Oncology. 85 (2), 191-202 (2007).
- Biollaz, G., et al. Site-specific anti-tumor immunity: differences in DC function, TGF-beta production and numbers of intratumoral Foxp3+ Treg. European Journal of Immunology. 39 (5), 1323-1333 (2009).
- McKenna, F. W., Ahmad, S. Fitting techniques of cell survival curves in high-dose region for use in stereotactic body radiation therapy. Physics in Medicine and Biology. 54 (6), 1593-1608 (2009).
- Malaise, E. P., Lambin, P., Joiner, M. C. Radiosensitivity of human cell lines to small doses. Are there some clinical implications. Radiation Research. 138, S25-S27 (1994).
- Björk-Eriksson, T., West, C., Karlsson, E., Mercke, C. Tumor radiosensitivity (SF2) is a prognostic factor for local control in head and neck cancers. International Journal of Radiation Oncology Biology Physics. 46 (1), 13-19 (2000).
- Bromfield, G. P., Meng, A., Warde, P., Bristow, R. G. Cell death in irradiated prostate epithelial cells: Role of apoptotic and clonogenic cell kill. Prostate Cancer and Prostatic Diseases. 6 (1), 73-85 (2003).
- Kalns, J. E., Piepmeier, E. H. Exposure to hyperbaric oxygen induces cell cycle perturbation in prostate cancer cells. In Vitro Cellular & Developmental Biology - Animal. 35 (2), 98-101 (1999).
- Lakka, S. S., et al. Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion, tumor growth and angiogenesis. Oncogene. 23 (27), 4681-4689 (2004).
- Li, S., Shi, D., Zhang, L., Yang, F., Cheng, G. Oridonin enhances the radiosensitivity of lung cancer cells by upregulating Bax and downregulating Bcl-2. Experimental and Therapeutic Medicine. 16 (6), 4859-4864 (2018).
- Campbell, K. J., Tait, S. W. G. Targeting BCL-2 regulated apoptosis in cancer. Open Biology. 8 (5), 180002(2018).
- Rengarajan, T., et al. D-pinitol promotes apoptosis in MCF-7 cells via induction of p53 and Bax and inhibition of Bcl-2 and NF-κB. Asian Pacific Journal of Cancer Prevention. 15 (4), 1757-1762 (2014).
- Shinagawa, A., et al. The potent peptide antagonist to angiogenesis, C16Y and cisplatin act synergistically in the down-regulation of the Bcl-2/Bax ratio and the induction of apoptosis in human ovarian cancer cells. International Journal of Radiation Oncology Biology Physics. 39 (6), 135-164 (2011).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır