このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
高圧酸素を使用してヒトU251神経膠腫細胞の放射線感受性を改善する
要約
このプロトコルは、高圧酸素が X線照射で治療された U251 神経膠腫細胞の増殖阻害とアポトーシスを増強できることを示しています G2/M 期の細胞をブロックすることにより。これにより、ヒト神経膠腫細胞株の放射線感受性が向上します。
要約
この研究の目的は、ヒト神経膠腫細胞の放射線感受性を高めるための高圧酸素の使用を調査することでした。継代培養したU251ヒト神経膠腫細胞を、未処理の対照群、高圧酸素(HBO)のみで処理した細胞、X線照射(X線)のみで処理した細胞、HBOとX線の両方で処理した細胞の4つのグループに無作為に分けました。これらのグループでは、細胞形態、細胞増殖活性、細胞周期分布、およびアポトーシスが観察され、神経膠腫細胞の放射線感受性の改善におけるHBOの役割が評価されました。X線線量の増加(0Gy、2Gy、4Gy、6Gy、8Gy)により、神経膠腫細胞の生存率(SF)は徐々に減少していった。
HBOとX線を一緒に処理した細胞では、各線量についてX線群よりも有意に低いSFが観察されました(すべて P < 0.05)。増殖阻害は、U251細胞株の各用量(すべて P < 0.05)について、HBOとX線線を組み合わせた群の方が有意に高かった。G2/M期細胞の割合は、X線(2Gy)群(26.70%±2.46%)およびHBO群(22.36%±0.91%)と組み合わせたHBO群の方が、対照群(11.56%±2.01%)およびX線(2Gy)群(10.35%±2.69%)(すべて P < 0.05)よりも有意に高かった。U251細胞のアポトーシスは、HBOとX線(2 Gy)を組み合わせた群で、HBO群、X線(2 Gy)群、および対照群(すべて P < 0.05)よりも有意に高かった。HBOは、G2/M期の神経膠腫細胞をブロックすることにより、神経膠腫U251細胞の増殖阻害とアポトーシスを強化し、U251神経膠腫細胞の放射線感受性を改善できると結論付けています。
概要
神経膠腫は、中枢神経系のグリア細胞1に由来する原発性頭蓋内腫瘍です。神経膠腫の現在の治療戦略は、放射線療法と化学療法を組み合わせた手術です。神経膠腫に対する術後放射線療法は生存利益をもたらすことができ(グレードIのエビデンス)、術後早期の放射線療法は患者の生存期間を効果的に延長することができる(グレードIIのエビデンス)2。高悪性度神経膠腫(グレードIIIまたはIV)、特に悪性度の高い浸潤性膠芽腫(グレードIIIの証拠)3の場合、術後放射線療法はできるだけ早く(<6週間)実施すべきである。しかし、早期の介入にもかかわらず、神経膠腫は依然として再発率が高く、包括的な治療後の予後は不良です。これらの転帰は、主に神経膠腫の放射線感受性が低いことに関連しています。腫瘍の放射線感受性に関連する因子には、腫瘍細胞、低酸素または非低酸素の腫瘍細胞の固有の放射線感受性、低酸素性腫瘍細胞の割合、および腫瘍周囲組織の放射線損傷を修復する能力が含まれます4。
これらの因子の中で、低酸素または非低酸素の腫瘍細胞と低酸素腫瘍細胞の割合は、腫瘍の放射線感受性に重要な影響を及ぼします。高圧酸素(HBO)は、組織酸素の張力と血中酸素の拡散を増加させることにより、組織酸素の貯蔵を改善することができます。HBOはまた、一連の有益な生化学的、細胞学的、および生理学的効果を生み出す可能性があります5。例えば、HBOは放射線療法による放射線損傷に対して顕著な修復効果を持っています。HBOと放射線療法または化学療法の併用は、神経膠腫に対する放射線療法または化学療法の臨床効果を改善すると報告されています6が、HBO単独が悪性神経膠腫の成長にどのように影響するかについてはかなりの議論があります。Ding et al.7 と Wang et al.8 はどちらも、HBO がアポトーシスの阻害と腫瘍血管新生の促進に関与するメカニズムを介して、マウスの上皮内神経膠腫の成長を促進することを示しました。生理学的条件下では、HBOは酸化ストレスを誘導することにより腫瘍血管新生を促進することが報告されている9。
しかし、ある研究では、HBOへの短期的な曝露は腫瘍細胞の増殖を促進するのに対し、HBOへの長時間の曝露はアポトーシスを促進し、増殖を阻害することが示されました10。したがって、HBOが神経膠腫の成長を促進するのか阻害するのか、またHBOと放射線療法または化学療法の併用がどのように治療感作を誘発できるのかを調査するには、さらなる研究が必要である。特に、HBOが神経膠腫の放射線感受性をどのように改善するかについてのメカニズムの詳細が必要です。この研究では、HBOがヒトU251神経膠腫細胞の放射線感受性をどのように改善するかを調査するために、HBOと神経膠腫細胞の増殖に対するX線照射を組み合わせて使用し、細胞周期の分布とアポトーシスへの影響を観察しました。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての研究方法は、蘭州大学と提携している第二病院の治験審査委員会および倫理委員会によって承認され、関連するガイドラインおよび規制に従って実施されました。
1. 神経膠腫細胞の治療
注:この実験では、U251神経膠腫細胞株を使用しました。
- U251細胞培養
- U251細胞を10%ウシ胎児血清(FBS)を含むDMEMで複数のディッシュに播種し、5%CO2で37°Cで培養します。
- 50%〜60%のコンフルエントに達したら、トリプシン-EDTA溶液(0.25%、フェノールレッドなし)を使用して細胞を解離し、80%のコンフルエントまで成長させます。
- X線照射
- 培養プレートまたはフラスコを、厚さ1cmまでの同等の組織補償器で覆います。次に、リモートコントロールボードの 回転 ボタンをクリックして調整した、ソース-セル距離100cmの6MV線形加速器から供給されるX線照射に細胞をさらします。
- 物理学者に放射線量を測定してもらい、減衰を補正してもらいます。対照として、X線照射前に検出器に媒体の入ったフラスコを置きます。
- 高圧酸素(HBO)
- HBOチャンバーを紫外線で15分間オンにしてから、0.02MPaの純酸素を5分間浸水させて消毒します。
- 細胞をチャンバー内のプレートまたは培養フラスコに入れた後、チャンバー外の制御盤にある 圧力調整 器ボタンをクリックして、照射後30分以内にチャンバー内のHBO圧力を0.2MPa(2.0ATA)に上げます。
- 30分後、 圧力調整器 ボタンをクリックして、HBOの圧力を前の圧力レベル(0.1 MPpa)に下げます。次に、培養ボトルまたはプレートをHBOで1日1回、3日間連続して処理します。
2. U251神経膠腫細胞の異なる群
- 細胞増殖曲線を計算するために、コントロールグループ、X線(2 Gy)グループ、およびHBOとX線(2 Gy)グループを組み合わせて設定します。
- 最大増殖速度を示す神経膠腫U251細胞から単一細胞懸濁液を調製します(ステップ1.1.2を参照)。血球計算盤スライドを使用して細胞をカウントすることにより、細胞密度を1×106 / mLに調整します。その後、細胞懸濁液1 mLを培養ボトル(細胞密度:1 × 106 /ボトル)に、各グループに3本の別々のボトルを加えます。
- 明視野顕微鏡で100倍の倍率で細胞形態を評価し、培養の24時間、48時間、および72時間の接着細胞を列挙します。
3. HBO後30分以内のU251神経膠腫細胞の放射線感受性(クローン形成アッセイ)
- U251シングルセル懸濁液をウェル全体に5×102 細胞/mLの6ウェルプレートで播種し、指示線量のX線照射(0 Gy、2 Gy、4 Gy、6 Gy、8 Gy)に曝露し、各X線量に対して3つの並行サンプルを検査します。
- HBOとX線(2Gy)を併用した場合、HBO治療後30分以内に細胞をX線照射します。処理後、細胞を5%CO2 で37°Cで14日間培養します。
- クローンが見えたら、培地を取り出し、クローンをPBSで2回洗浄します。
- 細胞を10%メタノール1 mLで15分間固定した後、0.1%クリスタルバイオレット1 mLで20分間染色します。
- 染色後、ピペットを使用して細胞を6mLの蒸留水で洗浄し、クリスタルバイオレット溶液を吸引します。細胞を風乾させます。
- 顕微鏡で直径0.3mmから1.0mmのクローンを数え、クローンあたり>50個の細胞があることを確認します。
- 式 (1) を使用して生存率 (SF) を計算します。
SF =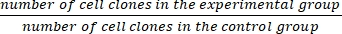 × 100% (1)
× 100% (1) - 統計ソフトウェアを使用して、式 (2) を使用して、シングルヒットマルチターゲット (SHMT) モデルに基づく放射線量-生存曲線を生成します。
S = 1 - (1 -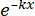 )N (2)
)N (2)
ここで、S =生存の確率。 k = 平均致死量(細胞ごとに平均1ヒットを引き起こす線量)。 x = セルあたりのヒット数。N = ターゲットの数 (細胞死のヒット数)。 - 平均致死線量(D0)、準閾値線量(Dq)、外挿数(N)、2Gy放射線量での生存率(SF2)、感作増強率(D0)(対照群SER=D0 /実験群D0 )、SER(Dq)(対照群SER=Dq/実験群Dq)などの放射線生物学的パラメータを計算して、U251神経膠腫細胞の放射線感受性に対するHBOの影響を評価します。
ここで、D0 = 生存曲線の線形部分の傾きの逆数 (生存率を 63% 低下させる用量)
N = 線形部分を縦座標に合うように外挿することによって形成される交点の値 (放射線による損傷を修復する細胞の能力を反映している)
Dq = 横軸上の交点射影点と、外挿線を満たすために縦座標で横軸に平行な 1.0 を通る線を引くことによって形成される交点の値。
4. U251神経膠腫細胞の増殖を評価するための細胞計数アッセイ
- 対照群、HBO群、およびX線治療群(0 Gy、2 Gy、4 Gy、6 Gy、8 Gy)を単独またはHBOと組み合わせて設定します。
- 単一細胞懸濁液中のU251細胞を使用して、細胞密度を1×104 細胞/mLに調整します。
- 細胞懸濁液(100 μL、密度:1 × 103/ウェル)を96ウェルプレート(グループあたり5ウェル)に播種します。セルカウンティングアッセイ( 材料表を参照)を実施し、試薬で培養してから48時間後にマイクロプレートリーダーを使用して450 nmの光学密度(OD)を決定します。
- 式(3)に従って細胞増殖阻害率(IR)を計算します。
IR=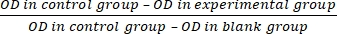 ×100%(3)
×100%(3)
5. U251神経膠腫細胞のアポトーシス検出
- セットコントロール、HBO、X線(2Gy)、HBOとX線(2Gy)グループの組み合わせ。
- 培養後に培地を取り出し、1x PBSで細胞を洗浄します。
- トリプシンで細胞を剥離し、顕微鏡で丸みを帯びた細胞形態が観察されたときにDMEMを添加してトリプシンを不活性化します。
- 細胞を遠心チューブに移し、200 × gで5分間遠心分離します。
- 上清を捨て、1x PBSを3 mLペレットに加え、静かにピペットで細胞を再懸濁します。
- 細胞を再び200 × g で5分間遠心分離します。次に、上清PBSを吸引し、細胞を2回洗浄してから、50 μLのBinding Bufferで穏やかにピペッティングして細胞を再懸濁します。
- 5 μLのアネキシンV-FITCを4°Cの細胞に添加し、暗所4°Cで15分間インキュベートした後、400 μLのBinding Bufferを添加します。混合物を、5 μLのヨウ化プロピジウム(PI)色素溶液(10 mg/mL)が入ったフローサイトメトリーチューブに移します。5分後にフローサイトメトリーによりアポトーシス細胞を検出します11。
- 488nmの励起波で赤色蛍光を記録し、コンピューターに入力して5,000個の細胞の各細胞周期の割合を解析し、アポトーシス細胞のピークを印刷します。
- アネキシンVとPIの二重標識により赤と緑の蛍光を収集し、コンピューターに入力して分析した後、ドットプロットを印刷します。
6. U251神経膠腫の細胞周期分布の検出
- 上記の細胞をトリプシンで処理する前に、1mLのPBSで2回洗浄します。
- 光学顕微鏡で丸みを帯びた細胞形態が検出された場合は、10%FBSを含むDMEMを添加します。
- 細胞を室温で200 × g で5分間遠心分離します。
- 上清を取り除き、これらの細胞を1 mLのPBSに再懸濁してから、予冷した75%エタノール溶液を添加します。
- 混合物を少なくとも4時間または-20°Cで一晩インキュベートします。
- 氷冷したPBSと180 μLのEDTA(0.1 mM、3.7 mg EDTA + 100 mLのPBS)、20 μLのRNase A(10 mg / mL)、35 μLのTriton X-100(2%、2 mLのTriton + 98 mLのFBS)、および96.5 μLのPBSで細胞を2回洗浄します。次に、17.5 μLのPI溶液(1 mg/mL)を加えます。
- 混合物を4°Cの暗所で10分間インキュベートします。
- 細胞を200μLのPBSで洗浄し、次にフローサイトメーターに細胞を置いて、前述のように細胞周期の分布を評価します12。
- フローサイトメーターは、22 μm x 66 μmおよび13 μm x 66 μmのスポットサイズのデュアルレーザー、3次元空間、励起モードで操作します。430 μm x 180 μm、300-1,100 nmスペクトル、≤ 100 MESF検出可能性、CV <2%の分解能のフロールームを使用します。次いで、細胞を488nmの励起光に曝露し、装置ソフトウェアを用いて蛍光シグナルを検出・測定し、細胞周期分布13を決定する。
- DNA含有量を決定し、DNA含有量に従って細胞周期を分析します。
7. 統計解析
- 統計分析を実行します。
- データを平均±標準偏差として表示します。
- スチューデントの t検定を使用して、統計的有意性を P <0.05として設定したグループを比較します。
Access restricted. Please log in or start a trial to view this content.
結果
U251神経膠腫細胞の培養
U251神経膠腫細胞は、DMEMでの培養後24時間から48時間後に紡錘状形状を示し、接着していました。これらの細胞は、さらなる研究に使用されました(図1)。
神経膠腫細胞の形態と数
HBOとX線(2Gy)を組み合わせた群のU251神経膠腫細胞の細胞数は、細胞培養の24時間後、48時間後?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
神経膠腫細胞株U251は、最も古典的なヒト神経膠腫細胞株の1つであり、多くの研究で神経膠腫モデルとして広く使用されています。
U251神経膠腫細胞の増殖に対するHBOの影響
HBOは通常、通常の大気圧の1.5〜3倍高い圧力で密閉されたチャンバー内で純粋な酸素(100%酸素濃度)を呼吸することを指し、これにより微小血管血漿中の酸素含...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
何一つ。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Binding Buffer | Dickinson and Company | RH10 9RR | |
| CCK-8 test kit | DOJINDO | NJ | Cell counting assay |
| CELL FIT | cell cycle analysis (DNA content) | ||
| CELLQUEST | apoptotic cell analysis | ||
| DMEM and Annexin V-FITC | Gibco BRL | ||
| flow cytometer | Dickinson | ||
| Glioma U251 and U87 cell line | Shanghai Institute of Cell Biology | ||
| hyperbaric oxygen chamber | Hongyuan Institute | ||
| medical linear accelerator | Elekta Limited Company | ||
| microplate reader | |||
| MOD FITLT formac v1.01 | cell analysis--cell cycle phase | ||
| trypsin | Hyclone Laboratories Inc |
参考文献
- Louis, D. N., et al. The 2016 World Health Organization Classification the Central Nervous System: A summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Sun, M. Z., et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. Journal of Neurosurgery. 122 (5), 1144-1150 (2015).
- Hegi, M. E., et al. MGMT gene silencing and benefit from temoozolomide in glioblastoma. New England Journal of Medicine. 352 (10), 997-1003 (2005).
- Zhu, Y., et al. Involvement of decreased hypoxia-inducible factor 1 activity and resultant G1-S cell cycle transition in radioresistance of perinecrotic tumor cells. Oncogene. 32 (16), 2058-2068 (2013).
- Kohshi, K., et al. Potential roles of hyperbaric oxygenation in the treatments of brain tumors. Undersea and Hyperbaric Medicine. 40 (4), 351-362 (2013).
- Aghajan, Y., Grover, I., Gorsi, H., Tumblin, M., Crawford, J. R. Use of hyperbaric oxygen therapy in pediatric neuro-oncology: a single institutional experience. Journal Neurooncology. 141 (1), 151-158 (2019).
- Ding, J. B., Chen, J. R., Xu, H. Z., Qin, Z. Y. Effect of hyperbaric oxygen on the growth of intracranial glioma in rats. Chinese Medical Journal. 128 (23), 3197-3203 (2015).
- Wang, Y. G., et al. Hyperbaric oxygen promotes malignant glioma cell growth and inhibits cell apoptosis. Oncology Letters. 10 (1), 189-195 (2015).
- Milovanova, T. N., et al. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. Journal of Applied Physiology. 106 (2), 711-728 (2009).
- Conconi, M. T., et al. Effects of hyperbaric oxygen on proliferative and apoptotic activities and reactive oxygen species generation in mouse fibroblast 3T3/J2 cell line. Journal of Investigative Medicine. 51 (4), 227-232 (2003).
- Vermes, I., Haanen, C., Steffiens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Cui, W., Niu, F. -L., He, L. -Y., W, S. -R. Comparison of two softwares for analysing apoptosis with flow cytometry. Journal of Beijing University of Traditional Chinese Medicine. 24 (6), 45-47 (2001).
- Cecchini, M. J., Amiri, M., Dick, F. A. Analysis of cell cycle position in mammalian cells. Journal of Visualized Experiments. (59), e3491(2012).
- Resanovic, I., et al. Effects of hyperbaric oxygen on inducible nitric oxide synthase activity/expression in lymphocytes of type 1 diabetes patients: A prospective pilot study. International Journal of Endocrinology. 2019, 2328505(2019).
- Stuhr, L. E., et al. Hyperoxia retards growth and induces apoptosis, changes in vascular density and gene expression in transplanted gliomas in nude rats. Journal of Neuro-Oncology. 85 (2), 191-202 (2007).
- Biollaz, G., et al. Site-specific anti-tumor immunity: differences in DC function, TGF-beta production and numbers of intratumoral Foxp3+ Treg. European Journal of Immunology. 39 (5), 1323-1333 (2009).
- McKenna, F. W., Ahmad, S. Fitting techniques of cell survival curves in high-dose region for use in stereotactic body radiation therapy. Physics in Medicine and Biology. 54 (6), 1593-1608 (2009).
- Malaise, E. P., Lambin, P., Joiner, M. C. Radiosensitivity of human cell lines to small doses. Are there some clinical implications. Radiation Research. 138, S25-S27 (1994).
- Björk-Eriksson, T., West, C., Karlsson, E., Mercke, C. Tumor radiosensitivity (SF2) is a prognostic factor for local control in head and neck cancers. International Journal of Radiation Oncology Biology Physics. 46 (1), 13-19 (2000).
- Bromfield, G. P., Meng, A., Warde, P., Bristow, R. G. Cell death in irradiated prostate epithelial cells: Role of apoptotic and clonogenic cell kill. Prostate Cancer and Prostatic Diseases. 6 (1), 73-85 (2003).
- Kalns, J. E., Piepmeier, E. H. Exposure to hyperbaric oxygen induces cell cycle perturbation in prostate cancer cells. In Vitro Cellular & Developmental Biology - Animal. 35 (2), 98-101 (1999).
- Lakka, S. S., et al. Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion, tumor growth and angiogenesis. Oncogene. 23 (27), 4681-4689 (2004).
- Li, S., Shi, D., Zhang, L., Yang, F., Cheng, G. Oridonin enhances the radiosensitivity of lung cancer cells by upregulating Bax and downregulating Bcl-2. Experimental and Therapeutic Medicine. 16 (6), 4859-4864 (2018).
- Campbell, K. J., Tait, S. W. G. Targeting BCL-2 regulated apoptosis in cancer. Open Biology. 8 (5), 180002(2018).
- Rengarajan, T., et al. D-pinitol promotes apoptosis in MCF-7 cells via induction of p53 and Bax and inhibition of Bcl-2 and NF-κB. Asian Pacific Journal of Cancer Prevention. 15 (4), 1757-1762 (2014).
- Shinagawa, A., et al. The potent peptide antagonist to angiogenesis, C16Y and cisplatin act synergistically in the down-regulation of the Bcl-2/Bax ratio and the induction of apoptosis in human ovarian cancer cells. International Journal of Radiation Oncology Biology Physics. 39 (6), 135-164 (2011).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved