È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Utilizzo dell'ossigeno iperbarico per migliorare la radiosensibilità delle cellule di glioma U251 umano
In questo articolo
Riepilogo
Questo protocollo dimostra che l'ossigeno iperbarico può migliorare la proliferazione, l'inibizione e l'apoptosi delle cellule di glioma U251 trattate con irradiazione a raggi X, bloccando le cellule nella fase G2/M. Ciò migliora la radiosensibilità delle linee cellulari di glioma umano.
Abstract
Lo scopo di questo studio era esplorare l'uso dell'ossigeno iperbarico per migliorare la radiosensibilità delle cellule di glioma umano. Le cellule di glioma umano U251 sub-coltivate sono state divise casualmente in quattro gruppi: un gruppo di controllo non trattato, cellule trattate solo con ossigeno iperbarico (HBO), cellule trattate solo con irradiazione a raggi X (raggi X) e cellule trattate sia con HBO che con raggi X. In questi gruppi sono state osservate la morfologia cellulare, l'attività di proliferazione cellulare, la distribuzione del ciclo cellulare e l'apoptosi per valutare il ruolo dell'HBO nel migliorare la radiosensibilità delle cellule di glioma. Con l'aumento delle dosi di raggi X (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy), la frazione di sopravvivenza (SF) delle cellule di glioma è diminuita gradualmente.
È stato osservato un SF significativamente più basso per le cellule trattate con HBO e raggi X insieme rispetto al gruppo a raggi X per ciascuna dose (tutti P < 0,05). L'inibizione della proliferazione era significativamente più alta nel gruppo HBO combinato con i raggi X rispetto al gruppo dei raggi X per ogni dose (tutti P < 0,05) per la linea cellulare U251. La percentuale di cellule in fase G2/M era significativamente più alta nel gruppo HBO combinato con i raggi X (2 Gy) (26,70% ± 2,46%) e nel gruppo HBO (22,36% ± 0,91%) rispetto al gruppo di controllo (11,56% ± 2,01%) e nel gruppo raggi X (2 Gy) (10,35% ± 2,69%) (tutti P < 0,05). L'apoptosi delle cellule U251 era significativamente più alta nel gruppo HBO combinato con raggi X (2 Gy) rispetto al gruppo HBO, al gruppo raggi X (2 Gy) e al gruppo di controllo (tutti P < 0,05). Concludiamo che l'HBO può migliorare la proliferazione, l'inibizione e l'apoptosi delle cellule di glioma U251 bloccando le cellule di glioma nella fase G2/M e migliorando la radiosensibilità delle cellule di glioma U251.
Introduzione
Il glioma è un tumore intracranico primario che origina dalle cellule gliali del sistema nervoso centrale1. L'attuale strategia di trattamento per il glioma è la chirurgia combinata con la radioterapia e la chemioterapia. La radioterapia postoperatoria per il glioma può fornire benefici in termini di sopravvivenza (evidenza di grado I) e la radioterapia postoperatoria precoce può prolungare efficacemente la sopravvivenza del paziente (evidenza di grado II)2. Per i gliomi di grado superiore (grado III o IV), in particolare il glioblastoma altamente maligno e invasivo (evidenza di grado III)3, la radioterapia postoperatoria deve essere eseguita il prima possibile (<6 settimane). Tuttavia, nonostante l'intervento precoce, il glioma ha ancora un alto tasso di recidiva e una prognosi infausta dopo un trattamento completo. Questi esiti sono principalmente associati alla bassa radiosensibilità del glioma. I fattori correlati alla radiosensibilità tumorale includono la radiosensibilità intrinseca delle cellule tumorali, delle cellule tumorali ipossiche o non ipossiche, la proporzione di cellule tumorali ipossiche e la capacità del tessuto peritumorale di riparare il danno da radiazioni4.
Tra questi fattori, le cellule tumorali ipossiche o non ipossiche e la proporzione di cellule tumorali ipossiche hanno effetti importanti sulla radiosensibilità tumorale. L'ossigeno iperbarico (HBO) può migliorare l'immagazzinamento di ossigeno nei tessuti aumentando la tensione dell'ossigeno nei tessuti e la diffusione dell'ossigeno nel sangue. L'HBO può anche produrre una serie di effetti biochimici, citologici e fisiologici benefici5. Ad esempio, l'HBO ha un marcato effetto riparativo sul danno da radiazioni indotto dalla radioterapia. Sebbene sia stato riportato che l'HBO combinato con la radioterapia o la chemioterapia migliora l'efficacia clinica della radioterapia o della chemioterapia per il glioma6, c'è un notevole dibattito su come l'HBO da solo influenzi la crescita del glioma maligno. Ding et al.7 e Wang et al.8 hanno entrambi dimostrato che l'HBO promuove la crescita del glioma in situ nei topi attraverso meccanismi che coinvolgono l'inibizione dell'apoptosi e la promozione dell'angiogenesi tumorale. In condizioni fisiologiche, è stato riportato che l'HBO promuove l'angiogenesi tumorale inducendo stress ossidativo9.
Tuttavia, uno studio ha indicato che l'esposizione a breve termine all'HBO promuove la proliferazione delle cellule tumorali, mentre l'esposizione prolungata all'HBO promuove l'apoptosi e inibisce la proliferazione10. Pertanto, sono necessari ulteriori studi per esplorare se l'HBO promuove o inibisce la crescita del glioma e come l'HBO combinato con la radioterapia o la chemioterapia può indurre la sensibilizzazione terapeutica. In particolare, sono necessari dettagli meccanicistici su come l'HBO migliora la radiosensibilità del glioma. Per esplorare come l'HBO migliora la radiosensibilità delle cellule di glioma U251 umano in questo studio, abbiamo utilizzato l'HBO combinato con l'irradiazione a raggi X sulla proliferazione delle cellule di glioma e abbiamo osservato gli effetti sulla distribuzione del ciclo cellulare e sull'apoptosi.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti i metodi di studio sono stati approvati dal Comitato di revisione istituzionale e dal Comitato etico del secondo ospedale affiliato all'Università di Lanzhou e sono stati eseguiti in conformità con le linee guida e i regolamenti pertinenti.
1. Trattamento delle cellule di glioma
NOTA: In questo esperimento è stata utilizzata la linea cellulare di glioma U251.
- Coltura cellulare U251
- Seminare le cellule U251 in più piastre con DMEM contenente il 10% di siero fetale bovino (FBS) e coltivarle a 37 °C con il 5% di CO2.
- Al raggiungimento della confluenza del 50%-60%, dissociare le cellule utilizzando una soluzione di tripsina-EDTA (0,25%, senza rosso fenolo) e quindi lasciarle crescere fino all'80% di confluenza.
- Irradiazione a raggi X
- Coprire le piastre o i matracci di coltura con un compensatore tissutale equivalente fino a 1 cm di spessore. Quindi, esporre le celle all'irradiazione a raggi X erogata da un acceleratore lineare da 6 MV con una distanza sorgente-cella di 100 cm, regolata facendo clic sul pulsante di rotazione sulla scheda di controllo remoto.
- Chiedi a un fisico di misurare la dose di radiazioni e correggere l'attenuazione. Come controllo, posizionare i palloni contenenti il terreno in un rivelatore prima dell'irradiazione a raggi X.
- Ossigeno iperbarico (HBO)
- Disinfettare la camera HBO accendendo la luce ultravioletta per 15 minuti e poi inondarla con 0,02 MPa di ossigeno puro per 5 minuti.
- Dopo aver posizionato le cellule in piastre o fiasche di coltura nella camera, fare clic sul pulsante del regolatore di pressione sulla scheda di controllo all'esterno della camera per aumentare la pressione HBO nella camera a 0,2 MPa (2,0 ATA) entro 30 minuti dall'irradiazione.
- Trenta minuti dopo, fare clic sul pulsante del regolatore di pressione per ridurre la pressione HBO al livello di pressione precedente (0,1 MPpa). Quindi, trattare le bottiglie o le piastre di coltura con HBO 1 volta al giorno per 3 giorni consecutivi.
2. Cellule di glioma U251 in diversi gruppi
- Impostare un gruppo di controllo, un gruppo di raggi X (2 Gy) e un HBO combinato con un gruppo di raggi X (2 Gy) per calcolare le curve di crescita cellulare.
- Preparare sospensioni unicellulari dalle cellule del glioma U251 che mostrino i tassi di crescita massimi (vedere il passaggio 1.1.2). Regolare la densità cellulare a 1 × 106/mL contando le cellule utilizzando un vetrino emocitometrico. Successivamente, aggiungere 1 mL di sospensione cellulare a un flacone di coltura (densità cellulare: 1 × 106/flacone) con tre flaconi separati per ciascun gruppo.
- Valutare la morfologia cellulare con un ingrandimento di 100x con un microscopio a campo chiaro per enumerare le cellule aderenti a 24 ore, 48 ore e 72 ore di coltura.
3. Radiosensibilità delle cellule di glioma U251 (saggio di formazione di cloni) entro 30 minuti dall'HBO
- Seminare la sospensione unicellulare U251 in tutti i pozzetti a 5 × 102 cellule/mL in piastre a 6 pozzetti e quindi esporle alla dose indicata di irradiazione a raggi X (0 Gy, 2 Gy, 4 Gy, 6 Gy e 8 Gy), con tre campioni paralleli esaminati per ogni dose di raggi X.
- Per l'HBO combinato con il gruppo a raggi X (2 Gy), esporre le cellule all'irradiazione a raggi X entro 30 minuti dal trattamento HBO. Dopo il trattamento, coltivare le cellule a 37 °C con il 5% di CO2 per 14 giorni.
- Dopo che i cloni sono visibili, rimuovere il terreno e lavare i cloni 2 volte con PBS.
- Fissare le cellule in 1 mL di metanolo al 10% per 15 minuti prima di colorare con 1 mL di cristallovioletto allo 0,1% per 20 minuti.
- Dopo la colorazione, lavare le cellule con 6 ml di acqua distillata utilizzando una pipetta, quindi aspirare la soluzione di cristallovioletto. Lasciare asciugare le celle all'aria.
- Contare i cloni con un diametro compreso tra 0,3 mm e 1,0 mm al microscopio per assicurarsi che ci siano >50 cellule per clone.
- Calcola la frazione di sopravvivenza (SF) usando l'equazione (1):
SF =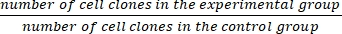 × 100% (1)
× 100% (1) - Utilizzando un software statistico, generare una curva dose-sopravvivenza alle radiazioni basata sul modello single-hit multitarget (SHMT) utilizzando l'equazione (2):
S = 1 - (1 -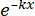 )N (2)
)N (2)
dove S = la probabilità di sopravvivenza; k = la dose letale media (la dose che provoca una media di un colpo per cellula); x = il numero di riscontri per cella; N = il numero di bersagli (il numero di colpi per la morte cellulare). - Calcolare i parametri radiobiologici, tra cui la dose letale media (D0), la dose quasi-soglia (Dq), il numero di estrapolazione (N), la frazione di sopravvivenza a una dose di irradiazione di 2 Gy (SF2), il rapporto di aumento della sensibilizzazione (D0) (SER = D0 nel gruppo di controllo/D0 nel gruppo sperimentale) e SER (Dq) (SER = Dq nel gruppo di controllo/Dq nel gruppo sperimentale) per valutare l'effetto dell'HBO sulla radiosensibilità delle cellule di glioma U251.
Dove D0 = il valore reciproco della pendenza della porzione lineare della curva di sopravvivenza (la dose riduce il tasso di sopravvivenza del 63%)
N = il valore del punto di intersezione formato estrapolando la porzione lineare per incontrare l'ordinata (che riflette la capacità cellulare di riparare il danno causato dalle radiazioni)
Dq = il valore del punto proiettivo di intersezione sull'ascissa e l'intersezione formata tracciando una linea passante per 1.0 all'ordinata e parallela all'ascissa per incontrare la retta di estrapolazione.
4. Saggio di conteggio cellulare per valutare la proliferazione cellulare del glioma U251
- Impostare un gruppo di controllo, un gruppo HBO e gruppi trattati con raggi X (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy) da soli o in combinazione con HBO.
- Regolare la densità cellulare a 1 × 104 cellule/mL utilizzando cellule U251 in sospensioni a cellula singola.
- Seminare le sospensioni cellulari (100 μL, densità: 1 × 103/pozzetto) in piastre da 96 pozzetti (cinque pozzetti per gruppo). Eseguire il saggio di conteggio delle cellule (vedere la Tabella dei materiali), quindi determinare la densità ottica (OD) a 450 nm utilizzando un lettore di micropiastre dopo 48 ore di coltura con il reagente.
- Calcolare il tasso di inibizione della proliferazione cellulare (IR) secondo l'equazione (3):
IR =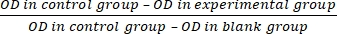 × 100% (3)
× 100% (3)
5. Rilevamento dell'apoptosi delle cellule di glioma U251
- Impostare il controllo, HBO, raggi X (2 Gy) e HBO combinati con gruppi di raggi X (2 Gy).
- Rimuovere il terreno dopo la coltura e lavare le cellule con 1x PBS.
- Staccare le cellule con la tripsina e quindi disattivare la tripsina aggiungendo DMEM quando si osserva una morfologia cellulare arrotondata al microscopio.
- Trasferire le celle in una provetta da centrifuga e centrifugare per 5 minuti a 200 × g.
- Scartare il surnatante, aggiungere 3 mL di 1x PBS al pellet e pipettare delicatamente per risospendere le cellule.
- Centrifugare nuovamente le celle a 200 × g per 5 min. Quindi, aspirare il surnatante PBS e lavare le cellule 2 volte prima di risospenderle con un pipettaggio delicato in 50 μl di tampone legante.
- Aggiungere 5 μL di annessina V-FITC alle cellule a 4 °C e incubare le cellule al buio a 4 °C per 15 minuti prima di aggiungere 400 μL di tampone legante. Trasferire la miscela in una provetta per citometria a flusso contenente 5 μL di soluzione colorante di ioduro di propidio (PI) (10 mg/mL). Rilevare le cellule apoptotiche 5 minuti dopo mediante citometria a flusso11.
- Registra la fluorescenza rossa all'onda di eccitazione di 488 nm, inseriscili in un computer per analizzare la percentuale di ciascun ciclo cellulare in 5.000 cellule, quindi stampa i picchi delle cellule apoptotiche.
- Raccogli la fluorescenza rossa e verde mediante annessina V e doppia marcatura PI, inseriscili nel computer per analizzarli e quindi stampa il grafico a punti.
6. Rilevamento della distribuzione del ciclo cellulare del glioma U251
- Lavare le cellule sopra menzionate 2 volte con 1 mL di PBS prima di trattarle con tripsina.
- Quando la microscopia ottica rileva una morfologia cellulare arrotondata, aggiungere DMEM contenente il 10% di FBS.
- Centrifugare le celle per 5 minuti a 200 × g a temperatura ambiente.
- Rimuovere il surnatante e risospendere queste cellule in 1 mL di PBS prima di aggiungere una soluzione preraffreddata di etanolo al 75%.
- Incubare la miscela per almeno 4 ore o per una notte a -20 °C.
- Lavare le cellule 2 volte con PBS ghiacciato e 180 μL di EDTA (0,1 mM, 3,7 mg di EDTA + 100 mL di PBS), 20 μL di RNasi A (10 mg/mL), 35 μL di Triton X-100 (2%, 2 mL di Triton + 98 mL di FBS) e 96,5 μL di PBS. Quindi, aggiungere 17,5 μL di soluzione PI (1 mg/mL).
- Incubare la miscela a 4 °C al buio per 10 minuti.
- Lavare le cellule in 200 μL di PBS, quindi posizionarle in un citometro a flusso per valutare la distribuzione del ciclo cellulare, come descritto in precedenza12.
- Aziona il citometro a flusso in modalità di eccitazione a doppio laser, spazio tridimensionale, con una dimensione dello spot di 22 μm x 66 μm e 13 μm x 66 μm. Utilizza una camera di flusso di 430 μm x 180 μm, spettro 300-1.100 nm, rilevabilità MESF ≤100 e risoluzione CV <2%. Quindi, esporre le cellule a una luce di eccitazione a 488 nm e rilevare e misurare i segnali di fluorescenza con il software dello strumento per determinare la distribuzione del ciclo cellulare13.
- Determinare il contenuto di DNA e quindi, in base al contenuto di DNA, analizzare il ciclo cellulare.
7. Analisi statistica
- Eseguire analisi statistiche.
- Presenta i dati come media ± deviazione standard.
- Usa un test t di Student per confrontare i gruppi, con la significatività statistica impostata come P < 0,05.
Access restricted. Please log in or start a trial to view this content.
Risultati
Coltura di cellule di glioma U251
Le cellule di glioma U251 avevano una forma fusiforme da 24 a 48 ore dopo la coltura in DMEM ed erano aderenti. Queste cellule sono state utilizzate per ulteriori studi (Figura 1).
Morfologia e conta delle cellule di glioma
La conta cellulare per le cellule di glioma U251 nel gruppo HBO combinato con i raggi X (2 Gy) era significativamente inferiore a quella...
Access restricted. Please log in or start a trial to view this content.
Discussione
La linea cellulare di glioma U251 è una delle linee cellulari di glioma umano più classiche ed è ampiamente utilizzata come modello di glioma in molti studi.
Effetti dell'HBO sulla proliferazione delle cellule di glioma U251
L'HBO si riferisce tipicamente alla respirazione di ossigeno puro (concentrazione di ossigeno al 100%) in una camera sigillata con una pressione 1,5-3 volte superiore alla normale pressione atmosferica, che può aume...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Nessuno.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Binding Buffer | Dickinson and Company | RH10 9RR | |
| CCK-8 test kit | DOJINDO | NJ | Cell counting assay |
| CELL FIT | cell cycle analysis (DNA content) | ||
| CELLQUEST | apoptotic cell analysis | ||
| DMEM and Annexin V-FITC | Gibco BRL | ||
| flow cytometer | Dickinson | ||
| Glioma U251 and U87 cell line | Shanghai Institute of Cell Biology | ||
| hyperbaric oxygen chamber | Hongyuan Institute | ||
| medical linear accelerator | Elekta Limited Company | ||
| microplate reader | |||
| MOD FITLT formac v1.01 | cell analysis--cell cycle phase | ||
| trypsin | Hyclone Laboratories Inc |
Riferimenti
- Louis, D. N., et al. The 2016 World Health Organization Classification the Central Nervous System: A summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Sun, M. Z., et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. Journal of Neurosurgery. 122 (5), 1144-1150 (2015).
- Hegi, M. E., et al. MGMT gene silencing and benefit from temoozolomide in glioblastoma. New England Journal of Medicine. 352 (10), 997-1003 (2005).
- Zhu, Y., et al. Involvement of decreased hypoxia-inducible factor 1 activity and resultant G1-S cell cycle transition in radioresistance of perinecrotic tumor cells. Oncogene. 32 (16), 2058-2068 (2013).
- Kohshi, K., et al. Potential roles of hyperbaric oxygenation in the treatments of brain tumors. Undersea and Hyperbaric Medicine. 40 (4), 351-362 (2013).
- Aghajan, Y., Grover, I., Gorsi, H., Tumblin, M., Crawford, J. R. Use of hyperbaric oxygen therapy in pediatric neuro-oncology: a single institutional experience. Journal Neurooncology. 141 (1), 151-158 (2019).
- Ding, J. B., Chen, J. R., Xu, H. Z., Qin, Z. Y. Effect of hyperbaric oxygen on the growth of intracranial glioma in rats. Chinese Medical Journal. 128 (23), 3197-3203 (2015).
- Wang, Y. G., et al. Hyperbaric oxygen promotes malignant glioma cell growth and inhibits cell apoptosis. Oncology Letters. 10 (1), 189-195 (2015).
- Milovanova, T. N., et al. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. Journal of Applied Physiology. 106 (2), 711-728 (2009).
- Conconi, M. T., et al. Effects of hyperbaric oxygen on proliferative and apoptotic activities and reactive oxygen species generation in mouse fibroblast 3T3/J2 cell line. Journal of Investigative Medicine. 51 (4), 227-232 (2003).
- Vermes, I., Haanen, C., Steffiens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Cui, W., Niu, F. -L., He, L. -Y., W, S. -R. Comparison of two softwares for analysing apoptosis with flow cytometry. Journal of Beijing University of Traditional Chinese Medicine. 24 (6), 45-47 (2001).
- Cecchini, M. J., Amiri, M., Dick, F. A. Analysis of cell cycle position in mammalian cells. Journal of Visualized Experiments. (59), e3491(2012).
- Resanovic, I., et al. Effects of hyperbaric oxygen on inducible nitric oxide synthase activity/expression in lymphocytes of type 1 diabetes patients: A prospective pilot study. International Journal of Endocrinology. 2019, 2328505(2019).
- Stuhr, L. E., et al. Hyperoxia retards growth and induces apoptosis, changes in vascular density and gene expression in transplanted gliomas in nude rats. Journal of Neuro-Oncology. 85 (2), 191-202 (2007).
- Biollaz, G., et al. Site-specific anti-tumor immunity: differences in DC function, TGF-beta production and numbers of intratumoral Foxp3+ Treg. European Journal of Immunology. 39 (5), 1323-1333 (2009).
- McKenna, F. W., Ahmad, S. Fitting techniques of cell survival curves in high-dose region for use in stereotactic body radiation therapy. Physics in Medicine and Biology. 54 (6), 1593-1608 (2009).
- Malaise, E. P., Lambin, P., Joiner, M. C. Radiosensitivity of human cell lines to small doses. Are there some clinical implications. Radiation Research. 138, S25-S27 (1994).
- Björk-Eriksson, T., West, C., Karlsson, E., Mercke, C. Tumor radiosensitivity (SF2) is a prognostic factor for local control in head and neck cancers. International Journal of Radiation Oncology Biology Physics. 46 (1), 13-19 (2000).
- Bromfield, G. P., Meng, A., Warde, P., Bristow, R. G. Cell death in irradiated prostate epithelial cells: Role of apoptotic and clonogenic cell kill. Prostate Cancer and Prostatic Diseases. 6 (1), 73-85 (2003).
- Kalns, J. E., Piepmeier, E. H. Exposure to hyperbaric oxygen induces cell cycle perturbation in prostate cancer cells. In Vitro Cellular & Developmental Biology - Animal. 35 (2), 98-101 (1999).
- Lakka, S. S., et al. Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion, tumor growth and angiogenesis. Oncogene. 23 (27), 4681-4689 (2004).
- Li, S., Shi, D., Zhang, L., Yang, F., Cheng, G. Oridonin enhances the radiosensitivity of lung cancer cells by upregulating Bax and downregulating Bcl-2. Experimental and Therapeutic Medicine. 16 (6), 4859-4864 (2018).
- Campbell, K. J., Tait, S. W. G. Targeting BCL-2 regulated apoptosis in cancer. Open Biology. 8 (5), 180002(2018).
- Rengarajan, T., et al. D-pinitol promotes apoptosis in MCF-7 cells via induction of p53 and Bax and inhibition of Bcl-2 and NF-κB. Asian Pacific Journal of Cancer Prevention. 15 (4), 1757-1762 (2014).
- Shinagawa, A., et al. The potent peptide antagonist to angiogenesis, C16Y and cisplatin act synergistically in the down-regulation of the Bcl-2/Bax ratio and the induction of apoptosis in human ovarian cancer cells. International Journal of Radiation Oncology Biology Physics. 39 (6), 135-164 (2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon