Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Utilisation de l’oxygène hyperbare pour améliorer la radiosensibilité des cellules humaines de gliome U251
Dans cet article
Résumé
Ce protocole montre que l’oxygène hyperbare peut améliorer l’inhibition de la prolifération et l’apoptose des cellules de gliome U251 traitées par irradiation aux rayons X en bloquant les cellules dans la phase G2/M. Cela améliore la radiosensibilité des lignées cellulaires de gliome humain.
Résumé
Le but de cette étude était d’explorer l’utilisation de l’oxygène hyperbare pour améliorer la radiosensibilité des cellules de gliome humain. Des cellules de gliome humain U251 sous-cultivées ont été divisées au hasard en quatre groupes : un groupe témoin non traité, des cellules traitées avec de l’oxygène hyperbare (HBO) uniquement, des cellules traitées avec une irradiation aux rayons X (rayons X) uniquement et des cellules traitées à la fois avec HBO et rayons X. La morphologie cellulaire, l’activité de prolifération cellulaire, la distribution du cycle cellulaire et l’apoptose ont été observées dans ces groupes pour évaluer le rôle de l’HBO dans l’amélioration de la radiosensibilité des cellules de gliome. Avec l’augmentation des doses de rayons X (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy), la fraction de survie (SF) des cellules de gliome a progressivement diminué.
Une SF significativement plus faible a été observée pour les cellules traitées avec l’HBO et les rayons X ensemble que dans le groupe radiologique pour chaque dose (tous les P < 0,05). L’inhibition de la prolifération était significativement plus élevée dans le groupe HBO associé aux rayons X que dans le groupe des rayons X pour chaque dose (tous les P < 0,05) pour la lignée cellulaire U251. Le pourcentage de cellules de phase G2/M était significativement plus élevé dans le groupe HBO combiné au groupe radiologique (2 Gy) (26,70 % ± 2,46 %) et au groupe HBO (22,36 % ± 0,91 %) que dans le groupe témoin (11,56 % ± 2,01 %) et le groupe radiologique (2 Gy) (10,35 % ± 2,69 %) (tous les P < 0,05). L’apoptose des cellules U251 était significativement plus élevée dans le groupe HBO combiné aux rayons X (2 Gy) que dans le groupe HBO, le groupe des rayons X (2 Gy) et le groupe témoin (tous les P < 0,05). Nous concluons que l’HBO peut améliorer l’inhibition de la prolifération et l’apoptose des cellules de gliome U251 en bloquant les cellules de gliome dans la phase G2/M et améliorer la radiosensibilité des cellules de gliome U251.
Introduction
Le gliome est une tumeur intracrânienne primitive qui provient des cellules gliales du système nerveux central1. La stratégie de traitement actuelle du gliome est la chirurgie associée à la radiothérapie et à la chimiothérapie. La radiothérapie postopératoire pour le gliome peut apporter des avantages en termes de survie (preuves de grade I), et la radiothérapie postopératoire précoce peut prolonger efficacement la survie du patient (preuves de grade II)2. Pour les gliomes de haut grade (grade III ou IV), en particulier les glioblastomes hautement malins et invasifs (preuves de grade III)3, une radiothérapie postopératoire doit être effectuée le plus tôt possible (<6 semaines). Cependant, malgré une intervention précoce, le gliome a toujours un taux de récidive élevé et un mauvais pronostic après un traitement complet. Ces résultats sont principalement associés à la faible radiosensibilité du gliome. Les facteurs liés à la radiosensibilité tumorale comprennent la radiosensibilité inhérente des cellules tumorales, des cellules tumorales hypoxiques ou non hypoxiques, la proportion de cellules tumorales hypoxiques et la capacité du tissu péritumoral à réparer les dommages causés par les radiations4.
Parmi ces facteurs, les cellules tumorales hypoxiques ou non hypoxiques et la proportion de cellules tumorales hypoxiques ont des effets importants sur la radiosensibilité tumorale. L’oxygène hyperbare (HBO) peut améliorer le stockage de l’oxygène dans les tissus en augmentant la tension de l’oxygène dans les tissus et la diffusion de l’oxygène dans le sang. L’OHB peut également produire une série d’effets biochimiques, cytologiques et physiologiques bénéfiques5. Par exemple, HBO a un effet réparateur marqué sur les dommages causés par les radiations induits par la radiothérapie. Bien que l’HBO associée à la radiothérapie ou à la chimiothérapie améliore l’efficacité clinique de la radiothérapie ou de la chimiothérapie pour le gliome6, il existe un débat considérable sur la façon dont l’HBO seule affecte la croissance du gliome malin. Ding et al.7 et Wang et al.8 ont tous deux démontré que HBO favorise la croissance du gliome in situ chez la souris via des mécanismes qui impliquent l’inhibition de l’apoptose et la promotion de l’angiogenèse tumorale. Dans des conditions physiologiques, l’HBO favoriserait l’angiogenèse tumorale en induisant un stress oxydatif9.
Cependant, une étude a indiqué que l’exposition à court terme à HBO favorise la prolifération des cellules tumorales, tandis que l’exposition prolongée à HBO favorise l’apoptose et inhibe la prolifération10. Par conséquent, d’autres études sont nécessaires pour déterminer si l’HBO favorise ou inhibe la croissance du gliome et comment l’HBO combinée à la radiothérapie ou à la chimiothérapie peut induire une sensibilisation thérapeutique. En particulier, des détails mécanistes sur la façon dont HBO améliore la radiosensibilité du gliome sont nécessaires. Pour explorer comment HBO améliore la radiosensibilité des cellules de gliome U251 humaines dans cette étude, nous avons utilisé HBO combiné à l’irradiation aux rayons X sur la prolifération des cellules de gliome et observé les effets sur la distribution du cycle cellulaire et l’apoptose.
Protocole
Toutes les méthodes d’étude ont été approuvées par le comité d’examen institutionnel et le comité d’éthique du deuxième hôpital affilié à l’Université de Lanzhou et ont été réalisées conformément aux directives et réglementations pertinentes.
1. Traitement des cellules de gliome
REMARQUE : La lignée cellulaire de gliome U251 a été utilisée dans cette expérience.
- Culture cellulaire U251
- Semez des cellules U251 dans plusieurs boîtes avec du DMEM contenant 10 % de sérum de bovin fœtal (FBS) et cultivez-les à 37 °C avec 5 % de CO2.
- Lorsque vous atteignez une confluence de 50 à 60 %, dissociez les cellules à l’aide d’une solution de trypsine-EDTA (0,25 %, sans rouge de phénol), puis laissez-les croître jusqu’à 80 % de confluence.
- Irradiation aux rayons X
- Recouvrez les plaques ou les flacons de culture d’un compensateur de tissu équivalent d’une épaisseur maximale de 1 cm. Ensuite, exposez les cellules à l’irradiation aux rayons X délivrée par un accélérateur linéaire de 6 MV avec une distance source-cellule de 100 cm, ajustée en cliquant sur le bouton de rotation de la télécommande.
- Demandez à un physicien de mesurer la dose de rayonnement et de corriger l’atténuation. À titre de contrôle, placez les flacons contenant du fluide dans un détecteur avant l’irradiation aux rayons X.
- Oxygène hyperbare (HBO)
- Désinfectez la chambre HBO en allumant la lumière ultraviolette pendant 15 min, puis inondez-la de 0,02 MPa d’oxygène pur pendant 5 min.
- Après avoir placé les cellules dans des plaques ou des flacons de culture dans la chambre, cliquez sur le bouton du régulateur de pression sur le tableau de commande à l’extérieur de la chambre pour augmenter la pression HBO dans la chambre à 0,2 MPa (2,0 ATA) dans les 30 minutes suivant l’irradiation.
- Trente minutes plus tard, cliquez sur le bouton du régulateur de pression pour réduire la pression HBO au niveau de pression précédent (0,1 MPpa). Ensuite, traitez les flacons ou les assiettes de culture avec HBO 1x par jour pendant 3 jours consécutifs.
2. Cellules de gliome U251 en différents groupes
- Définissez un groupe de contrôle, un groupe de rayons X (2 Gy) et un HBO combiné avec un groupe de rayons X (2 Gy) pour calculer les courbes de croissance cellulaire.
- Préparez des suspensions unicellulaires à partir des cellules U251 du gliome montrant les taux de croissance maximaux (voir étape 1.1.2). Ajustez la densité cellulaire à 1 × 106/mL en comptant les cellules à l’aide d’une lame d’hémocytomètre. Par la suite, ajouter 1 mL de suspension cellulaire dans un flacon de culture (densité cellulaire : 1 × 106/bouteille) avec trois flacons distincts pour chaque groupe.
- Évaluez la morphologie cellulaire à un grossissement de 100x à l’aide d’un microscope à fond clair pour dénombrer les cellules adhérentes à 24 h, 48 h et 72 h de culture.
3. Radiosensibilité des cellules de gliome U251 (test de formation de clones) dans les 30 minutes suivant l’HBO
- Ensemencer la suspension unicellulaire U251 dans les puits à raison de 5 × 102 cellules/mL dans des plaques à 6 puits, puis les exposer à la dose indiquée d’irradiation aux rayons X (0 Gy, 2 Gy, 4 Gy, 6 Gy et 8 Gy), en examinant trois échantillons parallèles pour chaque dose de rayons X.
- Pour l’HBO combiné avec le groupe X (2 Gy), exposez les cellules à l’irradiation par rayons X dans les 30 minutes suivant le traitement HBO. Après le traitement, cultivez les cellules à 37 °C avec 5 % de CO2 pendant 14 jours.
- Une fois que les clones sont visibles, retirez le milieu et lavez les clones 2x avec du PBS.
- Fixez les cellules dans 1 mL de méthanol à 10 % pendant 15 min avant de les colorer avec 1 mL de violet cristallin à 0,1 % pendant 20 min.
- Après la coloration, lavez les cellules avec 6 ml d’eau distillée à l’aide d’une pipette, puis aspirez la solution de violet cristallin. Laissez les cellules sécher à l’air.
- Comptez les clones d’un diamètre compris entre 0,3 mm et 1,0 mm au microscope pour vous assurer qu’il y a > 50 cellules par clone.
- Calculer la fraction de survie (SF) à l’aide de l’équation (1) :
SF =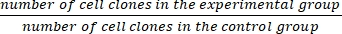 × 100 % (1)
× 100 % (1) - À l’aide d’un logiciel statistique, générer une courbe dose-survie au rayonnement basée sur le modèle multicible à coup unique (SHMT) à l’aide de l’équation (2) :
S = 1 - (1 -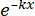 )N (2)
)N (2)
où S = la probabilité de survie ; k = la dose létale moyenne (la dose causant en moyenne un coup par cellule) ; x = le nombre d’accès par cellule ; N = le nombre de cibles (le nombre de résultats pour la mort cellulaire). - Calculer les paramètres radiobiologiques, y compris la dose létale moyenne (D0), la dose quasi-seuil (Dq), le nombre d’extrapolation (N), la fraction de survie à une dose d’irradiation de 2 Gy (SF2), le rapport d’augmentation de la sensibilisation (D0) (SER = D0 dans le groupe témoin/D0 dans le groupe expérimental) et le SER (Dq) (SER = Dq dans le groupe témoin/Dq dans le groupe expérimental) pour évaluer l’effet de l’HBO sur la radiosensibilité des cellules de gliome U251.
où D0 = la valeur réciproque de la pente de la partie linéaire de la courbe de survie (la dose réduisant le taux de survie de 63 %)
N = la valeur du point d’intersection formé en extrapolant la partie linéaire pour rencontrer l’ordonnée (reflétant la capacité cellulaire à réparer les dommages causés par le rayonnement)
Dq = la valeur du point d’intersection-projectif sur l’abscisse et de l’intersection formée en traçant une droite passant par 1,0 à l’ordonnée et parallèle à l’abscisse pour rencontrer la droite d’extrapolation.
4. Test de comptage cellulaire pour évaluer la prolifération des cellules de gliome U251
- Définissez un groupe témoin, un groupe HBO et des groupes traités par rayons X (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy) seuls ou combinés avec HBO.
- Ajustez la densité cellulaire à 1 × 104 cellules/ml en utilisant des cellules U251 dans des suspensions unicellulaires.
- Ensemencer les suspensions cellulaires (100 μL, densité : 1 × 103/puits) dans des plaques de 96 puits (cinq puits par groupe). Effectuez le test de comptage cellulaire (voir le tableau des matériaux), puis déterminez la densité optique (DO) à 450 nm à l’aide d’un lecteur de microplaques après 48 h de culture avec le réactif.
- Calculer le taux d’inhibition de la prolifération cellulaire (IR) selon l’équation (3) :
RI =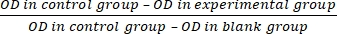 × 100 % (3)
× 100 % (3)
5. Détection de l’apoptose des cellules de gliome U251
- Contrôle de plateau, HBO, rayons X (2 Gy) et HBO combinés avec des groupes de rayons X (2 Gy).
- Retirez le milieu après la culture et lavez les cellules avec 1x PBS.
- Détachez les cellules avec de la trypsine puis désactivez la trypsine en ajoutant du DMEM lorsqu’une morphologie cellulaire arrondie est observée au microscope.
- Transférez les cellules dans un tube à centrifuger et centrifugez pendant 5 min à 200 × g.
- Jetez le surnageant, ajoutez 3 ml de 1x PBS à la pastille et pipetez doucement pour remettre les cellules en suspension.
- Centrifugez à nouveau les cellules à 200 × g pendant 5 min. Ensuite, aspirez le PBS surnageant et lavez les cellules 2 fois avant de les remettre en suspension avec un pipetage doux dans 50 μL de tampon de liaison.
- Ajoutez 5 μL d’annexine V-FITC dans les cellules à 4 °C et incubez les cellules dans l’obscurité à 4 °C pendant 15 min avant d’ajouter 400 μL de tampon de liaison. Transvaser le mélange dans un tube de cytométrie en flux contenant 5 μL de solution de colorant d’iodure de propidium (PI) (10 mg/mL). Détecter les cellules apoptotiques 5 min plus tard par cytométrie en flux11.
- Enregistrez la fluorescence rouge à l’onde d’excitation de 488 nm, saisissez-les dans un ordinateur pour analyser le pourcentage de chaque cycle cellulaire dans 5 000 cellules, puis imprimez les pics de cellules apoptotiques.
- Collectez la fluorescence rouge et verte par double marquage de l’annexine V et PI, saisissez-les dans l’ordinateur pour analyser, puis imprimez le graphique à points.
6. Détection de la distribution du cycle cellulaire du gliome U251
- Lavez les cellules mentionnées ci-dessus 2 fois avec 1 ml de PBS avant de les traiter avec de la trypsine.
- Lorsqu’une morphologie cellulaire arrondie est détectée par microscopie optique, ajoutez du DMEM contenant 10 % de FBS.
- Centrifugez les cellules pendant 5 min à 200 × g à température ambiante.
- Retirer le surnageant et remettre ces cellules en suspension dans 1 mL de PBS avant d’ajouter une solution d’éthanol à 75 % prérefroidie.
- Incuber le mélange pendant au moins 4 h ou toute la nuit à −20 °C.
- Lavez les cellules 2 fois avec du PBS glacé et 180 μL d’EDTA (0,1 mM, 3,7 mg d’EDTA + 100 mL de PBS), 20 μL de RNase A (10 mg/mL), 35 μL de Triton X-100 (2 %, 2 mL de Triton + 98 mL de FBS) et 96,5 μL de PBS. Ajouter ensuite 17,5 μL de solution d’IP (1 mg/mL).
- Incuber le mélange à 4 °C dans l’obscurité pendant 10 min.
- Lavez les cellules dans 200 μL de PBS, puis placez-les dans un cytomètre en flux pour évaluer la distribution du cycle cellulaire, comme décrit précédemment12.
- Faites fonctionner le cytomètre en flux dans un espace tridimensionnel à double laser, en mode d’excitation avec une taille de spot de 22 μm x 66 μm et 13 μm x 66 μm. Utilisez une salle d’écoulement de 430 μm x 180 μm, un spectre de 300 à 1 100 nm, une détectabilité de ≤100 MESF et une résolution CV de <2 %. Ensuite, exposez les cellules à une lumière d’excitation de 488 nm et détectez et mesurez les signaux de fluorescence avec le logiciel de l’instrument pour déterminer la distribution du cycle cellulaire13.
- Déterminez le contenu de l’ADN, puis en fonction du contenu de l’ADN, analysez le cycle cellulaire.
7. Analyse statistique
- Effectuer des analyses statistiques.
- Présentez les données sous forme de moyenne ± d’écart-type.
- Utilisez un test t de Student pour comparer les groupes, avec une signification statistique définie comme P < 0,05.
Résultats
Culture de cellules de gliome U251
Les cellules de gliome U251 avaient une forme fusiforme 24 h à 48 h après la culture dans DMEM et étaient observantes. Ces cellules ont été utilisées pour une étude plus approfondie (Figure 1).
Morphologie et numération des cellules de gliome
Le nombre de cellules du gliome U251 dans le groupe HBO combiné à la radiographie (2 Gy) était significat...
Discussion
La lignée cellulaire de gliome U251 est l’une des lignées cellulaires de gliome humain les plus classiques et est largement utilisée comme modèle de gliome dans de nombreuses études.
Effets de l’HBO sur la prolifération des cellules de gliome U251
L’OHB fait généralement référence à la respiration d’oxygène pur (concentration d’oxygène à 100 %) dans une chambre scellée avec une pression 1,5 à 3 fois supérieure à ...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| Binding Buffer | Dickinson and Company | RH10 9RR | |
| CCK-8 test kit | DOJINDO | NJ | Cell counting assay |
| CELL FIT | cell cycle analysis (DNA content) | ||
| CELLQUEST | apoptotic cell analysis | ||
| DMEM and Annexin V-FITC | Gibco BRL | ||
| flow cytometer | Dickinson | ||
| Glioma U251 and U87 cell line | Shanghai Institute of Cell Biology | ||
| hyperbaric oxygen chamber | Hongyuan Institute | ||
| medical linear accelerator | Elekta Limited Company | ||
| microplate reader | |||
| MOD FITLT formac v1.01 | cell analysis--cell cycle phase | ||
| trypsin | Hyclone Laboratories Inc |
Références
- Louis, D. N., et al. The 2016 World Health Organization Classification the Central Nervous System: A summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Sun, M. Z., et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. Journal of Neurosurgery. 122 (5), 1144-1150 (2015).
- Hegi, M. E., et al. MGMT gene silencing and benefit from temoozolomide in glioblastoma. New England Journal of Medicine. 352 (10), 997-1003 (2005).
- Zhu, Y., et al. Involvement of decreased hypoxia-inducible factor 1 activity and resultant G1-S cell cycle transition in radioresistance of perinecrotic tumor cells. Oncogene. 32 (16), 2058-2068 (2013).
- Kohshi, K., et al. Potential roles of hyperbaric oxygenation in the treatments of brain tumors. Undersea and Hyperbaric Medicine. 40 (4), 351-362 (2013).
- Aghajan, Y., Grover, I., Gorsi, H., Tumblin, M., Crawford, J. R. Use of hyperbaric oxygen therapy in pediatric neuro-oncology: a single institutional experience. Journal Neurooncology. 141 (1), 151-158 (2019).
- Ding, J. B., Chen, J. R., Xu, H. Z., Qin, Z. Y. Effect of hyperbaric oxygen on the growth of intracranial glioma in rats. Chinese Medical Journal. 128 (23), 3197-3203 (2015).
- Wang, Y. G., et al. Hyperbaric oxygen promotes malignant glioma cell growth and inhibits cell apoptosis. Oncology Letters. 10 (1), 189-195 (2015).
- Milovanova, T. N., et al. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. Journal of Applied Physiology. 106 (2), 711-728 (2009).
- Conconi, M. T., et al. Effects of hyperbaric oxygen on proliferative and apoptotic activities and reactive oxygen species generation in mouse fibroblast 3T3/J2 cell line. Journal of Investigative Medicine. 51 (4), 227-232 (2003).
- Vermes, I., Haanen, C., Steffiens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Cui, W., Niu, F. -. L., He, L. -. Y., W, S. -. R. Comparison of two softwares for analysing apoptosis with flow cytometry. Journal of Beijing University of Traditional Chinese Medicine. 24 (6), 45-47 (2001).
- Cecchini, M. J., Amiri, M., Dick, F. A. Analysis of cell cycle position in mammalian cells. Journal of Visualized Experiments. (59), e3491 (2012).
- Resanovic, I., et al. Effects of hyperbaric oxygen on inducible nitric oxide synthase activity/expression in lymphocytes of type 1 diabetes patients: A prospective pilot study. International Journal of Endocrinology. 2019, 2328505 (2019).
- Stuhr, L. E., et al. Hyperoxia retards growth and induces apoptosis, changes in vascular density and gene expression in transplanted gliomas in nude rats. Journal of Neuro-Oncology. 85 (2), 191-202 (2007).
- Biollaz, G., et al. Site-specific anti-tumor immunity: differences in DC function, TGF-beta production and numbers of intratumoral Foxp3+ Treg. European Journal of Immunology. 39 (5), 1323-1333 (2009).
- McKenna, F. W., Ahmad, S. Fitting techniques of cell survival curves in high-dose region for use in stereotactic body radiation therapy. Physics in Medicine and Biology. 54 (6), 1593-1608 (2009).
- Malaise, E. P., Lambin, P., Joiner, M. C. Radiosensitivity of human cell lines to small doses. Are there some clinical implications. Radiation Research. 138, S25-S27 (1994).
- Björk-Eriksson, T., West, C., Karlsson, E., Mercke, C. Tumor radiosensitivity (SF2) is a prognostic factor for local control in head and neck cancers. International Journal of Radiation Oncology Biology Physics. 46 (1), 13-19 (2000).
- Bromfield, G. P., Meng, A., Warde, P., Bristow, R. G. Cell death in irradiated prostate epithelial cells: Role of apoptotic and clonogenic cell kill. Prostate Cancer and Prostatic Diseases. 6 (1), 73-85 (2003).
- Kalns, J. E., Piepmeier, E. H. Exposure to hyperbaric oxygen induces cell cycle perturbation in prostate cancer cells. In Vitro Cellular & Developmental Biology - Animal. 35 (2), 98-101 (1999).
- Lakka, S. S., et al. Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion, tumor growth and angiogenesis. Oncogene. 23 (27), 4681-4689 (2004).
- Li, S., Shi, D., Zhang, L., Yang, F., Cheng, G. Oridonin enhances the radiosensitivity of lung cancer cells by upregulating Bax and downregulating Bcl-2. Experimental and Therapeutic Medicine. 16 (6), 4859-4864 (2018).
- Campbell, K. J., Tait, S. W. G. Targeting BCL-2 regulated apoptosis in cancer. Open Biology. 8 (5), 180002 (2018).
- Rengarajan, T., et al. D-pinitol promotes apoptosis in MCF-7 cells via induction of p53 and Bax and inhibition of Bcl-2 and NF-κB. Asian Pacific Journal of Cancer Prevention. 15 (4), 1757-1762 (2014).
- Shinagawa, A., et al. The potent peptide antagonist to angiogenesis, C16Y and cisplatin act synergistically in the down-regulation of the Bcl-2/Bax ratio and the induction of apoptosis in human ovarian cancer cells. International Journal of Radiation Oncology Biology Physics. 39 (6), 135-164 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon