Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verwendung von hyperbarem Sauerstoff zur Verbesserung der Strahlenempfindlichkeit von humanen U251-Gliomzellen
In diesem Artikel
Zusammenfassung
Dieses Protokoll zeigt, dass hyperbarer Sauerstoff die Proliferationshemmung und Apoptose von U251-Gliomzellen, die mit Röntgenstrahlung behandelt werden, verbessern kann, indem er die Zellen in der G2/M-Phase blockiert. Dadurch wird die Strahlenempfindlichkeit von humanen Gliomzelllinien verbessert.
Zusammenfassung
Das Ziel dieser Studie war es, die Verwendung von hyperbarem Sauerstoff zur Erhöhung der Strahlenempfindlichkeit menschlicher Gliomzellen zu untersuchen. Subkultivierte humane U251-Gliomzellen wurden nach dem Zufallsprinzip in vier Gruppen eingeteilt: eine unbehandelte Kontrollgruppe, Zellen, die nur mit hyperbarem Sauerstoff (HBO) behandelt wurden, Zellen, die nur mit Röntgenstrahlung (Röntgenstrahlen) behandelt wurden, und Zellen, die sowohl mit HBO als auch mit Röntgenstrahlen behandelt wurden. In diesen Gruppen wurden Zellmorphologie, Zellproliferationsaktivität, Zellzyklusverteilung und Apoptose beobachtet, um die Rolle von HBO bei der Verbesserung der Strahlenempfindlichkeit von Gliomzellen zu bewerten. Mit zunehmender Röntgendosis (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy) nahm die Überlebensfraktion (SF) der Gliomzellen allmählich ab.
Bei den Zellen, die zusammen mit HBO und Röntgenstrahlen behandelt wurden, wurde für jede Dosis eine signifikant niedrigere SF beobachtet als in der Röntgengruppe (alle P < 0,05). Die Proliferationshemmung war in der HBO-Gruppe in Kombination mit Röntgenstrahlen signifikant höher als in der Röntgengruppe für jede Dosis (alle P < 0,05) für die U251-Zelllinie. Der Anteil der G2/M-Phasenzellen war in der HBO-Gruppe in Kombination mit der Röntgengruppe (2 Gy) (26,70 % ± 2,46 %) und der HBO-Gruppe (22,36 % ± 0,91 %) signifikant höher als in der Kontrollgruppe (11,56 % ± 2,01 %) und der Röntgengruppe (2 Gy) (10,35 % ± 2,69 %) (alle P < 0,05). Die Apoptose der U251-Zellen war in der HBO-Gruppe in Kombination mit Röntgen (2 Gy) signifikant höher als in der HBO-Gruppe, der Röntgengruppe (2 Gy) und der Kontrollgruppe (alle P < 0,05). Wir kommen zu dem Schluss, dass HBO die Proliferationshemmung und Apoptose von Gliom-U251-Zellen verbessern kann, indem es Gliomzellen in der G2/M-Phase blockiert und die Strahlenempfindlichkeit von U251-Gliomzellen verbessert.
Einleitung
Das Gliom ist ein primärer intrakranieller Tumor, der aus Gliazellen des Zentralnervensystems stammt1. Die derzeitige Behandlungsstrategie für Gliome ist eine Operation in Kombination mit Strahlentherapie und Chemotherapie. Die postoperative Strahlentherapie bei Gliomen kann das Überleben verbessern (Evidenz Grad I), und eine frühe postoperative Strahlentherapie kann das Überleben der Patienten effektiv verlängern (Evidenz Grad II)2. Bei höhergradigen Gliomen (Grad III oder IV), insbesondere bei hochmalignen und invasiven Glioblastomen (Evidenz Grad III)3, sollte eine postoperative Strahlentherapie so früh wie möglich (<6 Wochen) durchgeführt werden. Trotz frühzeitiger Intervention weist das Gliom jedoch nach umfassender Behandlung immer noch eine hohe Rezidivrate und eine schlechte Prognose auf. Diese Ergebnisse sind hauptsächlich mit der geringen Strahlenempfindlichkeit des Glioms verbunden. Zu den Faktoren, die mit der Strahlenempfindlichkeit von Tumoren zusammenhängen, gehören die inhärente Strahlenempfindlichkeit von Tumorzellen, hypoxischen oder nicht-hypoxischen Tumorzellen, der Anteil hypoxischer Tumorzellen und die Fähigkeit des peritumoralen Gewebes, Strahlenschäden zu reparieren4.
Unter diesen Faktoren haben hypoxische oder nicht-hypoxische Tumorzellen und der Anteil hypoxischer Tumorzellen einen wichtigen Einfluss auf die Strahlenempfindlichkeit des Tumors. Hyperbarer Sauerstoff (HBO) kann die Sauerstoffspeicherung im Gewebe verbessern, indem er die Sauerstoffspannung im Gewebe und die Sauerstoffdiffusion im Blut erhöht. HBO kann auch eine Reihe von vorteilhaften biochemischen, zytologischen und physiologischen Wirkungen hervorrufen5. Zum Beispiel hat HBO eine ausgeprägte reparative Wirkung auf strahlentherapieinduzierte Strahlenschäden. Obwohl berichtet wird, dass HBO in Kombination mit Strahlentherapie oder Chemotherapie die klinische Wirksamkeit der Strahlentherapie oder Chemotherapie bei Gliom6 verbessert, gibt es eine erhebliche Debatte darüber, wie HBO allein das Wachstum von malignen Gliomen beeinflusst. Ding et al.7 und Wang et al.8 zeigten beide, dass HBO das Wachstum von in situ Gliomen bei Mäusen über Mechanismen fördert, die die Hemmung der Apoptose und die Förderung der Tumorangiogenese beinhalten. Unter physiologischen Bedingungen wird berichtet, dass HBO die Tumorangiogenese fördert, indem es oxidativen Stress induziert9.
Eine Studie deutete jedoch darauf hin, dass eine kurzfristige HBO-Exposition die Proliferation von Tumorzellen fördert, während eine längere HBO-Exposition die Apoptose fördert und die Proliferation hemmt10. Daher sind weitere Studien erforderlich, um zu untersuchen, ob HBO das Wachstum von Gliomen fördert oder hemmt und wie HBO in Kombination mit Strahlentherapie oder Chemotherapie eine therapeutische Sensibilisierung induzieren kann. Insbesondere sind mechanistische Details darüber erforderlich, wie HBO die Strahlenempfindlichkeit von Gliomen verbessert. Um in dieser Studie zu untersuchen, wie HBO die Strahlenempfindlichkeit menschlicher U251-Gliomzellen verbessert, verwendeten wir HBO in Kombination mit Röntgenstrahlung auf die Gliomzellproliferation und beobachteten die Auswirkungen auf die Zellzyklusverteilung und Apoptose.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle Studienmethoden wurden vom Institutional Review Board und der Ethikkommission des Zweiten Krankenhauses, das der Universität Lanzhou angegliedert ist, genehmigt und in Übereinstimmung mit den einschlägigen Richtlinien und Vorschriften durchgeführt.
1. Behandlung von Gliomzellen
HINWEIS: In diesem Experiment wurde die Gliom-Zelllinie U251 verwendet.
- U251 Zellkultur
- U251-Zellen werden in mehreren Schalen mit DMEM mit 10 % fötalem Rinderserum (FBS) gesät und bei 37 °C mit 5 % CO2 kultiviert.
- Bei Erreichen einer Konfluenz von 50 % bis 60 % dissoziieren Sie die Zellen mit Trypsin-EDTA-Lösung (0,25 %, ohne Phenolrot) und lassen Sie sie dann auf 80 % Konfluenz anwachsen.
- Röntgenbestrahlung
- Decken Sie die Kulturplatten oder -kolben mit einem gleichwertigen Gewebekompensator von bis zu 1 cm Dicke ab. Setzen Sie dann die Zellen der Röntgenstrahlung aus, die von einem 6-MV-Linearbeschleuniger mit einem Abstand von 100 cm zwischen Quelle und Zelle abgegeben wird, der durch Klicken auf die Drehtaste auf der Fernbedienungsplatine eingestellt wird.
- Lassen Sie einen Physiker die Strahlendosis messen und die Dämpfung korrigieren. Zur Kontrolle werden medienhaltige Kolben vor der Röntgenbestrahlung in einen Detektor gelegt.
- Hyperbarer Sauerstoff (HBO)
- Desinfizieren Sie die HBO-Kammer, indem Sie das ultraviolette Licht 15 Minuten lang einschalten und dann 5 Minuten lang mit 0,02 MPa reinem Sauerstoff fluten.
- Nachdem Sie die Zellen in Platten oder Kulturflaschen in der Kammer platziert haben, klicken Sie auf die Druckreglertaste auf der Steuerplatine außerhalb der Kammer, um den HBO-Druck in der Kammer innerhalb von 30 Minuten nach der Bestrahlung auf 0,2 MPa (2,0 ATA) zu erhöhen.
- Klicken Sie dreißig Minuten später auf die Druckreglertaste, um den HBO-Druck auf das vorherige Druckniveau (0,1 MPpa) zu verringern. Behandeln Sie dann die Kulturflaschen oder -teller 1x pro Tag an 3 aufeinanderfolgenden Tagen mit HBO.
2. U251 Gliomzellen in verschiedenen Gruppen
- Legen Sie eine Kontrollgruppe, eine Röntgengruppe (2 Gy) und eine HBO-Gruppe in Kombination mit einer Röntgengruppe (2 Gy) für die Berechnung der Zellwachstumskurven fest.
- Bereiten Sie Einzelzellsuspensionen aus den Gliomzellen U251 vor, die die maximalen Wachstumsraten aufweisen (siehe Schritt 1.1.2). Stellen Sie die Zelldichte auf 1 × 106/ml ein, indem Sie die Zellen mit einem Hämozytometer-Objektträger zählen. Geben Sie anschließend 1 ml der Zellsuspension in eine Kulturflasche (Zelldichte: 1 × 106/Flasche) mit drei separaten Flaschen für jede Gruppe.
- Beurteilen Sie die Zellmorphologie bei 100-facher Vergrößerung mit einem Hellfeldmikroskop, um die adhärenten Zellen nach 24 h, 48 h und 72 h Kultur zu zählen.
3. Strahlenempfindlichkeit von U251-Gliomzellen (Klonbildungsassay) innerhalb von 30 min nach HBO
- Die U251-Einzelzellsuspension wird in den Vertiefungen bei 5 × 102 Zellen/ml in 6-Well-Platten ausgesät und dann der angegebenen Röntgenbestrahlungsdosis (0 Gy, 2 Gy, 4 Gy, 6 Gy und 8 Gy) ausgesetzt, wobei für jede Röntgendosis drei parallele Proben untersucht werden.
- Für die HBO-Gruppe in Kombination mit Röntgen (2 Gy) setzen Sie die Zellen innerhalb von 30 Minuten nach der HBO-Behandlung einer Röntgenbestrahlung aus. Nach der Behandlung werden die Zellen 14 Tage lang bei 37 °C mit 5 % CO2 kultiviert.
- Nachdem die Klone sichtbar sind, entfernen Sie das Medium und waschen Sie die Klone 2x mit PBS.
- Fixieren Sie die Zellen 15 Minuten lang in 1 ml 10 % Methanol, bevor Sie sie 20 Minuten lang mit 1 ml 0,1 % Kristallviolett färben.
- Waschen Sie die Zellen nach dem Färben mit einer Pipette mit 6 ml destilliertem Wasser und aspirieren Sie dann die kristallviolette Lösung. Lassen Sie die Zellen an der Luft trocknen.
- Zählen Sie die Klone mit einem Durchmesser zwischen 0,3 mm und 1,0 mm unter dem Mikroskop, um sicherzustellen, dass >50 Zellen pro Klon vorhanden sind.
- Berechnen Sie den Überlebensanteil (SF) mit Hilfe von Gleichung (1):
SF =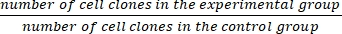 × 100% (1)
× 100% (1) - Generieren Sie mit Hilfe statistischer Software eine Strahlendosis-Überlebenskurve basierend auf dem Single-Hit-Multitarget-Modell (SHMT) unter Verwendung von Gleichung (2):
S = 1 - (1 -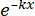 )N (2)
)N (2)
Dabei ist S = die Überlebenswahrscheinlichkeit; k = die mittlere letale Dosis (die Dosis, die einen Mittelwert von einem Treffer pro Zelle verursacht); x = die Anzahl der Treffer pro Zelle; N = die Anzahl der Ziele (die Anzahl der Treffer für den Zelltod). - Berechnen Sie die radiobiologischen Parameter, einschließlich der mittleren letalen Dosis (D0), der Quasi-Schwellendosis (Dq), der Extrapolationszahl (N), der Überlebensfraktion bei einer Bestrahlungsdosis von 2 Gy (SF2), des Sensibilisierungsverstärkungsverhältnisses (D0) (SER =D 0 in der Kontrollgruppe/D0 in der Versuchsgruppe) und SER (Dq) (SER = Dq in der Kontrollgruppe/Dq in der Versuchsgruppe), um die Wirkung von HBO auf die Strahlenempfindlichkeit von U251-Gliomzellen zu bewerten.
Dabei ist D0 = der reziproke Wert der Steigung des linearen Teils der Überlebenskurve (die Dosis, die die Überlebensrate um 63 % verringert)
N = der Wert des Schnittpunkts, der durch Extrapolation des linearen Teils gebildet wird, um die Ordinate zu erfüllen (spiegelt die zelluläre Fähigkeit wider, den durch Strahlung verursachten Schaden zu reparieren)
Dq = der Wert des Schnittpunkts auf der Abszisse und des Schnittpunkts, der gebildet wird, indem eine Linie durch 1,0 an der Ordinate und parallel zur Abszisse gezeichnet wird, um die Extrapolationslinie zu treffen.
4. Zellzählassay zur Beurteilung der Proliferation von U251-Gliomzellen
- Legen Sie eine Kontrollgruppe, eine HBO-Gruppe und Gruppen fest, die allein oder in Kombination mit HBO mit Röntgenstrahlen behandelt wurden (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy).
- Die Zelldichte wird auf 1 × 104 Zellen/ml mit U251-Zellen in Einzelzellsuspensionen eingestellt.
- Die Zellsuspensionen (100 μl, Dichte: 1 × 103/Well) in 96-Well-Platten (fünf Wells pro Gruppe) aussäen. Führen Sie den Zellzählassay durch (siehe Materialtabelle) und bestimmen Sie dann die optische Dichte (OD) bei 450 nm mit einem Mikroplatten-Reader nach 48 Stunden Kultur mit dem Reagenz.
- Berechnen Sie die Zellproliferationshemmrate (IR) nach Gleichung (3):
IR =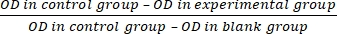 × 100 % (3)
× 100 % (3)
5. Nachweis der Apoptose von U251-Gliomzellen
- Set-Steuerung, HBO, Röntgen (2 Gy) und HBO kombiniert mit Röntgengruppen (2 Gy).
- Entfernen Sie das Medium nach der Kultur und waschen Sie die Zellen mit 1x PBS.
- Trennen Sie die Zellen mit Trypsin und deaktivieren Sie dann das Trypsin durch Zugabe von DMEM, wenn eine abgerundete Zellmorphologie unter dem Mikroskop beobachtet wird.
- Die Zellen in ein Zentrifugenröhrchen umfüllen und 5 min bei 200 × g zentrifugieren.
- Entsorgen Sie den Überstand, fügen Sie dem Pellet 3 ml 1x PBS hinzu und pipettieren Sie vorsichtig, um die Zellen wieder zu suspendieren.
- Zentrifugieren Sie die Zellen erneut bei 200 × g für 5 min. Aspirieren Sie dann den Überstand PBS und waschen Sie die Zellen 2x, bevor Sie sie durch sanftes Pipettieren in 50 μl Bindungspuffer resuspendieren.
- Geben Sie 5 μl Annexin V-FITC bei 4 °C in die Zellen und inkubieren Sie die Zellen 15 Minuten lang im Dunkeln bei 4 °C, bevor Sie 400 μl Bindungspuffer hinzufügen. Übertragen Sie die Mischung in ein Durchflusszytometrieröhrchen mit 5 μl Propidiumiodid (PI)-Farbstofflösung (10 mg/ml). Apoptotische Zellen 5 min später durch Durchflusszytometrienachweisen 11.
- Zeichnen Sie die rote Fluoreszenz bei der 488-nm-Anregungswelle auf, geben Sie sie in einen Computer ein, um den Prozentsatz jedes Zellzyklus in 5.000 Zellen zu analysieren, und drucken Sie dann die Peaks der apoptotischen Zellen aus.
- Erfassen Sie rote und grüne Fluoreszenz durch doppelte Markierung von Annexin V und PI, geben Sie sie zur Analyse in den Computer ein und drucken Sie dann das Punktdiagramm aus.
6. Nachweis der Zellzyklusverteilung des U251-Glioms
- Waschen Sie die oben genannten Zellen 2x mit 1 mL PBS, bevor Sie sie mit Trypsin behandeln.
- Wenn eine abgerundete Zellmorphologie durch Lichtmikroskopie nachgewiesen wird, fügen Sie DMEM mit 10 % FBS hinzu.
- Die Zellen 5 min bei 200 × g bei Raumtemperatur zentrifugieren.
- Entfernen Sie den Überstand und resuspendieren Sie diese Zellen in 1 ml PBS, bevor Sie eine vorgekühlte 75%ige Ethanollösung hinzufügen.
- Die Mischung mindestens 4 h oder über Nacht bei -20 °C inkubieren.
- Waschen Sie die Zellen 2x mit eiskaltem PBS und 180 μl EDTA (0,1 mM, 3,7 mg EDTA + 100 mL PBS), 20 μl RNase A (10 mg/ml), 35 μl Triton X-100 (2%, 2 mL Triton + 98 mL FBS) und 96,5 μl PBS. Fügen Sie dann 17,5 μl PI-Lösung (1 mg/ml) hinzu.
- Die Mischung bei 4 °C im Dunkeln 10 min inkubieren.
- Waschen Sie die Zellen in 200 μl PBS und legen Sie sie dann in ein Durchflusszytometer, um die Zellzyklusverteilung zu beurteilen, wie zuvor beschrieben12.
- Betreiben Sie das Durchflusszytometer im dreidimensionalen Dual-Laser-Raum-Anregungsmodus mit einer Spotgröße von 22 μm x 66 μm und 13 μm x 66 μm. Verwenden Sie einen Flussraum von 430 μm x 180 μm, ein Spektrum von 300 bis 1.100 nm, eine Nachweisbarkeit von ≤100 MESF und eine Auflösung von <2 % CV. Dann werden die Zellen 488 nm Anregungslicht ausgesetzt und die Fluoreszenzsignale mit der Instrumentensoftware detektiert und gemessen, um die Zellzyklusverteilung13 zu bestimmen.
- Bestimmen Sie den DNA-Gehalt und analysieren Sie dann anhand des DNA-Gehalts den Zellzyklus.
7. Statistische Auswertung
- Führen Sie statistische Analysen durch.
- Stellen Sie die Daten als Mittelwert ± Standardabweichung dar.
- Verwenden Sie den t-Test eines Schülers, um die Gruppen zu vergleichen, wobei die statistische Signifikanz auf P < 0,05 festgelegt ist.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Kultur von U251-Gliomzellen
U251-Gliomzellen hatten 24 h bis 48 h nach der Kultivierung in DMEM eine fusiforme Form und waren adhärent. Diese Zellen wurden für weitere Studien verwendet (Abbildung 1).
Morphologie und Anzahl der Gliomzellen
Die Zellzahlen für die U251-Gliomzellen in der HBO-Gruppe in Kombination mit der Röntgengruppe (2 Gy) waren nach 24 h, 48 h und 72 h Zellkultur signif...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Gliom-Zelllinie U251 ist eine der klassischsten humanen Gliom-Zelllinien und wird in vielen Studien häufig als Gliommodell verwendet.
Auswirkungen von HBO auf die Proliferation von U251-Gliomzellen
HBO bezieht sich typischerweise auf das Einatmen von reinem Sauerstoff (100 % Sauerstoffkonzentration) in einer geschlossenen Kammer mit einem Druck, der 1,5- bis 3-mal höher ist als der normale atmosphärische Druck, wodurch der Sauerstoff...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Nichts.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Binding Buffer | Dickinson and Company | RH10 9RR | |
| CCK-8 test kit | DOJINDO | NJ | Cell counting assay |
| CELL FIT | cell cycle analysis (DNA content) | ||
| CELLQUEST | apoptotic cell analysis | ||
| DMEM and Annexin V-FITC | Gibco BRL | ||
| flow cytometer | Dickinson | ||
| Glioma U251 and U87 cell line | Shanghai Institute of Cell Biology | ||
| hyperbaric oxygen chamber | Hongyuan Institute | ||
| medical linear accelerator | Elekta Limited Company | ||
| microplate reader | |||
| MOD FITLT formac v1.01 | cell analysis--cell cycle phase | ||
| trypsin | Hyclone Laboratories Inc |
Referenzen
- Louis, D. N., et al. The 2016 World Health Organization Classification the Central Nervous System: A summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Sun, M. Z., et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. Journal of Neurosurgery. 122 (5), 1144-1150 (2015).
- Hegi, M. E., et al. MGMT gene silencing and benefit from temoozolomide in glioblastoma. New England Journal of Medicine. 352 (10), 997-1003 (2005).
- Zhu, Y., et al. Involvement of decreased hypoxia-inducible factor 1 activity and resultant G1-S cell cycle transition in radioresistance of perinecrotic tumor cells. Oncogene. 32 (16), 2058-2068 (2013).
- Kohshi, K., et al. Potential roles of hyperbaric oxygenation in the treatments of brain tumors. Undersea and Hyperbaric Medicine. 40 (4), 351-362 (2013).
- Aghajan, Y., Grover, I., Gorsi, H., Tumblin, M., Crawford, J. R. Use of hyperbaric oxygen therapy in pediatric neuro-oncology: a single institutional experience. Journal Neurooncology. 141 (1), 151-158 (2019).
- Ding, J. B., Chen, J. R., Xu, H. Z., Qin, Z. Y. Effect of hyperbaric oxygen on the growth of intracranial glioma in rats. Chinese Medical Journal. 128 (23), 3197-3203 (2015).
- Wang, Y. G., et al. Hyperbaric oxygen promotes malignant glioma cell growth and inhibits cell apoptosis. Oncology Letters. 10 (1), 189-195 (2015).
- Milovanova, T. N., et al. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. Journal of Applied Physiology. 106 (2), 711-728 (2009).
- Conconi, M. T., et al. Effects of hyperbaric oxygen on proliferative and apoptotic activities and reactive oxygen species generation in mouse fibroblast 3T3/J2 cell line. Journal of Investigative Medicine. 51 (4), 227-232 (2003).
- Vermes, I., Haanen, C., Steffiens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Cui, W., Niu, F. -L., He, L. -Y., W, S. -R. Comparison of two softwares for analysing apoptosis with flow cytometry. Journal of Beijing University of Traditional Chinese Medicine. 24 (6), 45-47 (2001).
- Cecchini, M. J., Amiri, M., Dick, F. A. Analysis of cell cycle position in mammalian cells. Journal of Visualized Experiments. (59), e3491(2012).
- Resanovic, I., et al. Effects of hyperbaric oxygen on inducible nitric oxide synthase activity/expression in lymphocytes of type 1 diabetes patients: A prospective pilot study. International Journal of Endocrinology. 2019, 2328505(2019).
- Stuhr, L. E., et al. Hyperoxia retards growth and induces apoptosis, changes in vascular density and gene expression in transplanted gliomas in nude rats. Journal of Neuro-Oncology. 85 (2), 191-202 (2007).
- Biollaz, G., et al. Site-specific anti-tumor immunity: differences in DC function, TGF-beta production and numbers of intratumoral Foxp3+ Treg. European Journal of Immunology. 39 (5), 1323-1333 (2009).
- McKenna, F. W., Ahmad, S. Fitting techniques of cell survival curves in high-dose region for use in stereotactic body radiation therapy. Physics in Medicine and Biology. 54 (6), 1593-1608 (2009).
- Malaise, E. P., Lambin, P., Joiner, M. C. Radiosensitivity of human cell lines to small doses. Are there some clinical implications. Radiation Research. 138, S25-S27 (1994).
- Björk-Eriksson, T., West, C., Karlsson, E., Mercke, C. Tumor radiosensitivity (SF2) is a prognostic factor for local control in head and neck cancers. International Journal of Radiation Oncology Biology Physics. 46 (1), 13-19 (2000).
- Bromfield, G. P., Meng, A., Warde, P., Bristow, R. G. Cell death in irradiated prostate epithelial cells: Role of apoptotic and clonogenic cell kill. Prostate Cancer and Prostatic Diseases. 6 (1), 73-85 (2003).
- Kalns, J. E., Piepmeier, E. H. Exposure to hyperbaric oxygen induces cell cycle perturbation in prostate cancer cells. In Vitro Cellular & Developmental Biology - Animal. 35 (2), 98-101 (1999).
- Lakka, S. S., et al. Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion, tumor growth and angiogenesis. Oncogene. 23 (27), 4681-4689 (2004).
- Li, S., Shi, D., Zhang, L., Yang, F., Cheng, G. Oridonin enhances the radiosensitivity of lung cancer cells by upregulating Bax and downregulating Bcl-2. Experimental and Therapeutic Medicine. 16 (6), 4859-4864 (2018).
- Campbell, K. J., Tait, S. W. G. Targeting BCL-2 regulated apoptosis in cancer. Open Biology. 8 (5), 180002(2018).
- Rengarajan, T., et al. D-pinitol promotes apoptosis in MCF-7 cells via induction of p53 and Bax and inhibition of Bcl-2 and NF-κB. Asian Pacific Journal of Cancer Prevention. 15 (4), 1757-1762 (2014).
- Shinagawa, A., et al. The potent peptide antagonist to angiogenesis, C16Y and cisplatin act synergistically in the down-regulation of the Bcl-2/Bax ratio and the induction of apoptosis in human ovarian cancer cells. International Journal of Radiation Oncology Biology Physics. 39 (6), 135-164 (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten