A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש בחמצן היפרברי לשיפור הרגישות לקרינה של תאי גליומה U251 אנושיים
In This Article
Summary
פרוטוקול זה מראה כי חמצן היפרברי יכול להגביר את עיכוב ההתפשטות והאפופטוזיס של תאי גליומה U251 המטופלים בהקרנת רנטגן על ידי חסימת התאים בשלב G2/M. זה משפר את רגישות הקרינה של שורות תאי גליומה אנושיים.
Abstract
מטרת מחקר זה הייתה לחקור את השימוש בחמצן היפרברי כדי להגביר את הרגישות לקרינה של תאי גליומה אנושיים. תאי גליומה אנושיים U251 בתת-תרבית חולקו באופן אקראי לארבע קבוצות: קבוצת ביקורת לא מטופלת, תאים שטופלו בחמצן היפרברי (HBO) בלבד, תאים שטופלו בקרינת רנטגן (רנטגן) בלבד, ותאים שטופלו גם ב-HBO וגם בצילום רנטגן. מורפולוגיה של תאים, פעילות התפשטות תאים, התפלגות מחזור התא ואפופטוזיס נצפו בקבוצות אלה כדי להעריך את תפקידה של HBO בשיפור הרגישות לקרינה של תאי גליומה. עם העלייה במינוני קרני רנטגן (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy), חלק ההישרדות (SF) של תאי גליומה ירד בהדרגה.
SF נמוך משמעותית נצפה עבור התאים שטופלו ב-HBO ובקרני רנטגן יחד מאשר בקבוצת הרנטגן עבור כל מנה (כל ה-P < 0.05). עיכוב ההתפשטות היה גבוה משמעותית בקבוצת HBO בשילוב עם קרני רנטגן מאשר בקבוצת צילומי הרנטגן עבור כל מנה (כל P < 0.05) עבור קו התאים U251. אחוז תאי הפאזה G2/M היה גבוה משמעותית בקבוצת HBO בשילוב עם קבוצת רנטגן (26.70% ±-2.46%) ובקבוצת HBO (22.36% ±-0.91%) מאשר בקבוצת הביקורת (11.56% ±-2.01%) ובקבוצת הרנטגן (10.35% ±-2.69%) (כולם < -0.05). אפופטוזיס של תאי U251 היה גבוה משמעותית בקבוצת HBO בשילוב עם צילום רנטגן (2 Gy) מאשר בקבוצת HBO, קבוצת רנטגן (2 Gy) וקבוצת הביקורת (כולן P < 0.05). אנו מסיקים כי HBO יכולה לשפר את עיכוב ההתפשטות והאפופטוזיס של תאי גליומה U251 על ידי חסימת תאי גליומה בשלב G2/M ולשפר את הרגישות לקרינה של תאי גליומה U251.
Introduction
גליומה היא גידול תוך גולגולתי ראשוני שמקורו בתאי גליה של מערכת העצבים המרכזית1. אסטרטגיית הטיפול הנוכחית בגליומה היא ניתוח בשילוב עם רדיותרפיה וכימותרפיה. רדיותרפיה לאחר ניתוח לגליומה יכולה לספק יתרונות הישרדות (ראיות דרגה I), והקרנות מוקדמות לאחר הניתוח יכולות להאריך ביעילות את הישרדות המטופל (ראיות דרגה II)2. עבור גליומות בדרגה גבוהה יותר (דרגה III או IV), במיוחד גליובלסטומה ממאירה ופולשנית מאוד (עדות דרגה III)3, יש לבצע רדיותרפיה לאחר הניתוח מוקדם ככל האפשר (<6 שבועות). עם זאת, למרות התערבות מוקדמת, לגליומה עדיין יש שיעור הישנות גבוה ופרוגנוזה גרועה לאחר טיפול מקיף. תוצאות אלו קשורות בעיקר לרגישות נמוכה לקרינה של גליומה. גורמים הקשורים לרגישות לקרינה של הגידול כוללים את הרגישות לקרינה המובנית של תאי גידול, תאי גידול היפוקסיים או לא היפוקסיים, שיעור תאי הגידול ההיפוקסיים והיכולת של רקמה פרי-גידולית לתקן נזקי קרינה4.
בין גורמים אלה, לתאי גידול היפוקסיים או לא היפוקסיים ולשיעור תאי הגידול ההיפוקסיים יש השפעות חשובות על רגישות לקרינה של הגידול. חמצן היפרברי (HBO) יכול לשפר את אחסון החמצן ברקמות על ידי הגדלת מתח החמצן ברקמות ופיזור החמצן בדם. HBO עשויה גם לייצר סדרה של השפעות ביוכימיות, ציטולוגיות ופיזיולוגיות מועילות5. לדוגמה, ל-HBO יש השפעה מתקנת ניכרת על נזקי קרינה הנגרמים על ידי רדיותרפיה. למרות שדווח כי HBO בשילוב עם רדיותרפיה או כימותרפיה משפרים את היעילות הקלינית של רדיותרפיה או כימותרפיה לגליומה6, יש ויכוח ניכר לגבי האופן שבו HBO לבדה משפיעה על צמיחת גליומה ממאירה. דינג ואחרים 7 ו-Wang et al.8 הראו שניהם כי HBO מקדמת צמיחה של גליומה באתרה בעכברים באמצעות מנגנונים הכוללים עיכוב אפופטוזיס וקידום אנגיוגנזה של הגידול. בתנאים פיזיולוגיים, HBO מדווח כמקדם אנגיוגנזה של הגידול על ידי גרימת מתח חמצוני9.
עם זאת, מחקר אחד הצביע על כך שחשיפה לטווח קצר של HBO מקדמת את התפשטות תאי הגידול, בעוד שחשיפה ממושכת ל-HBO מקדמת אפופטוזיס ומעכבת התפשטות10. לכן, יש צורך במחקרים נוספים כדי לחקור האם HBO מקדם או מעכב את צמיחת הגליומה וכיצד HBO בשילוב עם הקרנות או כימותרפיה יכולים לגרום לרגישות טיפולית. בפרט, יש צורך בפרטים מכניסטיים על האופן שבו HBO משפרת את הרגישות לקרינה של גליומה. כדי לחקור כיצד HBO משפר את הרגישות לקרינה של תאי גליומה U251 אנושיים במחקר זה, השתמשנו ב-HBO בשילוב עם קרינת רנטגן על התפשטות תאי גליומה וצפינו בהשפעות על התפלגות מחזור התא ואפופטוזיס.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל שיטות המחקר אושרו על ידי מועצת הביקורת המוסדית וועדת האתיקה של בית החולים השני המסונף לאוניברסיטת לאנג'ואו ובוצעו בהתאם להנחיות ולתקנות הרלוונטיות.
1. טיפול בתאי גליומה
הערה: קו תאי הגליומה U251 שימש בניסוי זה.
- תרבית תאים U251
- זרעי תאי U251 במספר מנות עם DMEM המכיל 10% סרום בקר עוברי (FBS) ותרבית אותם ב-37 מעלות צלזיוס עם 5% CO2.
- עם הגעה למפגש של 50%-60%, יש לנתק את התאים באמצעות תמיסת טריפסין-EDTA (0.25%, ללא פנול אדום) ולאחר מכן לאפשר להם לגדול למפגש של 80%.
- הקרנת רנטגן
- מכסים את צלחות התרבות או הצלוחיות במפצה רקמות שווה ערך בעובי של עד 1 ס"מ. לאחר מכן, חשוף את התאים לקרינת רנטגן המועברת ממאיץ ליניארי של 6 MV עם מרחק תא מקור של 100 ס"מ, המותאם על ידי לחיצה על כפתור הסיבוב בלוח השלט הרחוק.
- בקש מפיזיקאי למדוד את מינון הקרינה ולתקן את ההנחתה. כבקרה, הנח צלוחיות המכילות מדיה בגלאי לפני קרינת הרנטגן.
- חמצן היפרברי (HBO)
- חטא את תא HBO על ידי הדלקת האור האולטרה סגול למשך 15 דקות ולאחר מכן הציף אותו ב-0.02 מגה פיקסל של חמצן טהור למשך 5 דקות.
- לאחר הנחת התאים בצלחות או בצלוחיות תרבית בתא, לחץ על כפתור ויסות הלחץ בלוח הבקרה מחוץ לתא כדי להגביר את לחץ ה-HBO בתא ל-0.2 מגה פיקסל (2.0 ATA) תוך 30 דקות מההקרנה.
- שלושים דקות לאחר מכן, לחץ על כפתור ויסות הלחץ כדי להפחית את לחץ ה-HBO לרמת הלחץ הקודמת (0.1 מגה פיקסל). לאחר מכן, פנקו את בקבוקי התרבית או הצלחות עם HBO פעם אחת ביום במשך 3 ימים רצופים.
2. תאי גליומה U251 בקבוצות שונות
- הגדר קבוצת ביקורת, קבוצת רנטגן (2 Gy) וקבוצת HBO בשילוב עם קבוצת רנטגן (2 Gy) לחישוב עקומות גדילת התאים.
- הכן תרחיפים של תאים בודדים מתאי הגליומה U251 המציגים את שיעורי הצמיחה המרביים (ראה שלב 1.1.2). התאם את צפיפות התאים ל-1 ×-106/מ"ל על ידי ספירת התאים באמצעות שקופית המוציטומטר. לאחר מכן, הוסף 1 מ"ל של תרחיף התאים לבקבוק תרבית (צפיפות תאים: 1 × 106 לבקבוק) עם שלושה בקבוקים נפרדים לכל קבוצה.
- הערך את המורפולוגיה של התא בהגדלה של פי 100 עם מיקרוסקופ שדה בהיר כדי לספור את התאים הדבקים בתרבית של 24 שעות, 48 שעות ו-72 שעות.
3. רגישות לקרינה של תאי גליומה U251 (בדיקת היווצרות שיבוט) תוך 30 דקות לאחר HBO
- זרע את התרחיף החד-תאי U251 בכל הבארות ב-5 ×-102 תאים/מ"ל בצלחות של 6 בארות ולאחר מכן חשוף אותם למינון המצוין של הקרנת רנטגן (0 Gy, 2 Gy, 4 Gy, 6 Gy ו-8 Gy), כאשר שלוש דגימות מקבילות נבדקות עבור כל מנת רנטגן.
- עבור קבוצת HBO בשילוב עם קבוצת רנטגן (2 Gy), חשוף את התאים לקרינת רנטגן תוך 30 דקות מהטיפול ב-HBO. לאחר הטיפול יש לתרבית את התאים בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2 למשך 14 יום.
- לאחר שהשיבוטים נראים לעין, הסר את המדיום ושטוף את השיבוטים פי 2 עם PBS.
- תקן את התאים ב -1 מ"ל של 10% מתנול למשך 15 דקות לפני הצביעה עם 1 מ"ל של 0.1% סגול קריסטל למשך 20 דקות.
- לאחר הצביעה יש לשטוף את התאים ב -6 מ"ל מים מזוקקים בעזרת פיפטה, ואז לשאוב את תמיסת הקריסטל הסגולה. הניחו לתאים להתייבש באוויר.
- ספרו את השיבוטים בקוטר שבין 0.3 מ"מ ל-1.0 מ"מ תחת מיקרוסקופ כדי להבטיח שיש >50 תאים לכל שיבוט.
- חשב את שבר ההישרדות (SF) באמצעות משוואה (1):
SF =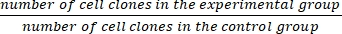 × 100% (1)
× 100% (1) - באמצעות תוכנה סטטיסטית, צור עקומת הישרדות מינון קרינה המבוססת על מודל רב-מטרה חד-פגיעתי (SHMT) באמצעות משוואה (2):
S = 1 - (1 -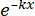 )N (2)
)N (2)
כאשר S = ההסתברות להישרדות; k = המינון הקטלני הממוצע (המינון הגורם לפגיעה אחת בממוצע לכל תא); x = מספר הכניסות לתא; N = מספר המטרות (מספר הפגיעות למוות תאי). - לחשב את הפרמטרים הרדיוביולוגיים, כולל המינון הקטלני הממוצע (D0), מינון מעין סף (Dq), מספר אקסטרפולציה (N), שבר הישרדות במינון קרינה של 2 Gy (SF2), יחס שיפור רגישות (D0) (SER = D0 בקבוצת הביקורת/D0 בקבוצת הניסוי), ו-SER (Dq) (SER = Dq בקבוצת הביקורת/Dq בקבוצת הניסוי) כדי להעריך את ההשפעה של HBO על רגישות הקרינה של תאי גליומה U251.
כאשר D0 = הערך ההדדי של שיפוע החלק הליניארי של עקומת ההישרדות (המינון מפחית את שיעור ההישרדות ב-63%)
N = הערך של נקודת החיתוך שנוצרה על ידי אקסטרפולציה של החלק הליניארי כדי לעמוד בקואורדינטה (המשקף את היכולת התאית לתקן את הנזק שנגרם מהקרינה)
Dq = הערך של נקודת ההצטלבות-פרויקטיבית על האבציסה, והצומת שנוצר על ידי ציור קו דרך 1.0 בקואורדינטה ובמקביל לאבציסה, כדי לעמוד בקו האקסטרפולציה.
4. בדיקת ספירת תאים להערכת התפשטות תאי גליומה U251
- הגדר קבוצת ביקורת, קבוצת HBO וקבוצות שטופלו בצילום רנטגן (0 Gy, 2 Gy, 4 Gy, 6 Gy, 8 Gy) לבד או בשילוב עם HBO.
- התאם את צפיפות התאים ל-1 ×-104 תאים/מ"ל באמצעות תאי U251 בתרחיפים של תא בודד.
- זרע את תרחיפי התאים (100 מיקרוליטר, צפיפות: 1 × 103 / באר) בצלחות של 96 בארות (חמש בארות לקבוצה). בצע את בדיקת ספירת התאים (ראה טבלת החומרים), ולאחר מכן קבע את הצפיפות האופטית (OD) ב-450 ננומטר באמצעות קורא מיקרו-פלטות לאחר 48 שעות של תרבית עם המגיב.
- חשב את קצב עיכוב התפשטות התאים (IR) לפי משוואה (3):
IR =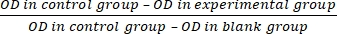 × 100% (3)
× 100% (3)
5. איתור אפופטוזיס של תאי גליומה U251
- בקרת סט, HBO, רנטגן (2 Gy) ו-HBO בשילוב עם קבוצות רנטגן (2 Gy).
- הסר את המדיום לאחר התרבות ושטוף את התאים עם 1x PBS.
- נתק את התאים עם טריפסין ולאחר מכן השבת את הטריפסין על ידי הוספת DMEM כאשר נצפית מורפולוגיה של תאים מעוגלים תחת מיקרוסקופ.
- העבירו את התאים לצינור צנטריפוגה וצנטריפוגה למשך 5 דקות בחום של 200 × גרם.
- השליכו את הסופרנטנט, הוסיפו 3 מ"ל של 1x PBS לגלולה, ופיפטה בעדינות כדי להשעות מחדש את התאים.
- צנטריפוגה את התאים שוב ב -200 × גרם למשך 5 דקות. לאחר מכן, שאפו את ה-PBS הסופרנטנט ושטפו את התאים פעמיים לפני השעיית אותם עם פיפטינג עדין ב-50 מיקרוליטר של מאגר קשירה.
- הוסף 5 מיקרוליטר של אנקסין V-FITC לתאים ב-4 מעלות צלזיוס ודגר את התאים בחושך ב-4 מעלות צלזיוס למשך 15 דקות לפני הוספת 400 מיקרוליטר של מאגר קשירה. העבירו את התערובת לצינור ציטומטריה זרימה המכיל 5 מיקרוליטר של תמיסת צבע פרופידיום יודיד (PI) (10 מ"ג/מ"ל). זיהוי תאים אפופטוטיים 5 דקות לאחר מכן על ידי זרימה ציטומטרית11.
- רשום פלואורסצנטיות אדומה בגל העירור של 488 ננומטר, הזן אותם למחשב כדי לנתח את האחוז של כל מחזור תא ב-5,000 תאים, ולאחר מכן הדפס את הפסגות של תאים אפופטוטיים.
- אסוף פלואורסצנטיות אדומה וירוקה על ידי תיוג כפול של נספח V ו-PI, הזן אותם למחשב כדי לנתח ולאחר מכן הדפס את עלילת הנקודות.
6. זיהוי התפלגות מחזור תאי גליומה U251
- שטפו את התאים הנ"ל פעמיים עם 1 מ"ל PBS לפני הטיפול בהם בטריפסין.
- כאשר מתגלה מורפולוגיה של תא מעוגל על ידי מיקרוסקופ אור, הוסף DMEM המכיל 10% FBS.
- צנטריפוגה את התאים למשך 5 דקות בטמפרטורה של 200 × גרם בטמפרטורת החדר.
- הסר את הסופרנטנט והשהה מחדש את התאים הללו ב-1 מ"ל PBS לפני הוספת תמיסת אתנול מקוררת מראש של 75%.
- דוגרים על התערובת לפחות 4 שעות או לילה בחום של -20 מעלות צלזיוס.
- שטפו את התאים פי 2 עם PBS קר כקרח ו-180 מיקרוליטר של EDTA (0.1 מ"מ, 3.7 מ"ג EDTA + 100 מ"ל PBS), 20 מיקרוליטר של RNase A (10 מ"ג/מ"ל), 35 מיקרוליטר של טריטון X-100 (2%, 2 מ"ל של טריטון + 98 מ"ל של FBS) ו-96.5 מיקרוליטר של PBS. לאחר מכן, הוסף 17.5 מיקרוליטר של תמיסת PI (1 מ"ג/מ"ל).
- דוגרים את התערובת בחום של 4 מעלות צלזיוס בחושך למשך 10 דקות.
- שטפו את התאים ב-200 מיקרוליטר של PBS, ולאחר מכן הניחו אותם בציטומטר זרימה כדי להעריך את התפלגות מחזור התא, כפי שתואר קודם לכן12.
- הפעל את ציטומטר הזרימה במצב עירור לייזר כפול, מרחב תלת מימדי, עם גודל נקודה של 22 מיקרומטר x 66 מיקרומטר וגודל נקודה של 13 מיקרומטר x 66 מיקרומטר. השתמש בחדר זרימה של 430 μm x 180 μm, ספקטרום 300-1,100 nm, יכולת גילוי ≤100 MESF ורזולוציית CV <2%. לאחר מכן, חשוף את התאים לאור עירור של 488 ננומטר וגלה ומדוד את אותות הקרינה באמצעות תוכנת מכשיר כדי לקבוע את התפלגות מחזור התא13.
- קבע את תכולת ה- DNA, ולאחר מכן על פי תכולת ה- DNA, נתח את מחזור התא.
7. ניתוח סטטיסטי
- לבצע ניתוחים סטטיסטיים.
- הצג את הנתונים כממוצע ± סטיית תקן.
- השתמש במבחן t של סטודנט כדי להשוות בין הקבוצות, עם מובהקות סטטיסטית מוגדרת כ-P <-0.05.
Access restricted. Please log in or start a trial to view this content.
תוצאות
תרבית של תאי גליומה U251
לתאי גליומה U251 הייתה צורה פיוזיפורמית 24 שעות עד 48 שעות לאחר התרבית ב-DMEM והיו דבקים. התאים האלה שימשו למחקר נוסף (איור 1).
מורפולוגיה וספירת תאי גליומה
ספירת התאים עבור תאי גליומה U251 בקבוצת HBO בשילו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
קו תאי הגליומה U251 הוא אחד מקווי תאי הגליומה האנושיים הקלאסיים ביותר ונמצא בשימוש נרחב כמודל גליומה במחקרים רבים.
השפעות HBO על התפשטות תאי גליומה U251
HBO מתייחס בדרך כלל לנשימת חמצן טהור (100% ריכוז חמצן) בתא אטום עם לחץ גבוה פי 1.5-3 מהלחץ האטמוספרי הרג?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
ללא.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Binding Buffer | Dickinson and Company | RH10 9RR | |
| CCK-8 test kit | DOJINDO | NJ | Cell counting assay |
| CELL FIT | cell cycle analysis (DNA content) | ||
| CELLQUEST | apoptotic cell analysis | ||
| DMEM and Annexin V-FITC | Gibco BRL | ||
| flow cytometer | Dickinson | ||
| Glioma U251 and U87 cell line | Shanghai Institute of Cell Biology | ||
| hyperbaric oxygen chamber | Hongyuan Institute | ||
| medical linear accelerator | Elekta Limited Company | ||
| microplate reader | |||
| MOD FITLT formac v1.01 | cell analysis--cell cycle phase | ||
| trypsin | Hyclone Laboratories Inc |
References
- Louis, D. N., et al. The 2016 World Health Organization Classification the Central Nervous System: A summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Sun, M. Z., et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. Journal of Neurosurgery. 122 (5), 1144-1150 (2015).
- Hegi, M. E., et al. MGMT gene silencing and benefit from temoozolomide in glioblastoma. New England Journal of Medicine. 352 (10), 997-1003 (2005).
- Zhu, Y., et al. Involvement of decreased hypoxia-inducible factor 1 activity and resultant G1-S cell cycle transition in radioresistance of perinecrotic tumor cells. Oncogene. 32 (16), 2058-2068 (2013).
- Kohshi, K., et al. Potential roles of hyperbaric oxygenation in the treatments of brain tumors. Undersea and Hyperbaric Medicine. 40 (4), 351-362 (2013).
- Aghajan, Y., Grover, I., Gorsi, H., Tumblin, M., Crawford, J. R. Use of hyperbaric oxygen therapy in pediatric neuro-oncology: a single institutional experience. Journal Neurooncology. 141 (1), 151-158 (2019).
- Ding, J. B., Chen, J. R., Xu, H. Z., Qin, Z. Y. Effect of hyperbaric oxygen on the growth of intracranial glioma in rats. Chinese Medical Journal. 128 (23), 3197-3203 (2015).
- Wang, Y. G., et al. Hyperbaric oxygen promotes malignant glioma cell growth and inhibits cell apoptosis. Oncology Letters. 10 (1), 189-195 (2015).
- Milovanova, T. N., et al. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. Journal of Applied Physiology. 106 (2), 711-728 (2009).
- Conconi, M. T., et al. Effects of hyperbaric oxygen on proliferative and apoptotic activities and reactive oxygen species generation in mouse fibroblast 3T3/J2 cell line. Journal of Investigative Medicine. 51 (4), 227-232 (2003).
- Vermes, I., Haanen, C., Steffiens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Cui, W., Niu, F. -L., He, L. -Y., W, S. -R. Comparison of two softwares for analysing apoptosis with flow cytometry. Journal of Beijing University of Traditional Chinese Medicine. 24 (6), 45-47 (2001).
- Cecchini, M. J., Amiri, M., Dick, F. A. Analysis of cell cycle position in mammalian cells. Journal of Visualized Experiments. (59), e3491(2012).
- Resanovic, I., et al. Effects of hyperbaric oxygen on inducible nitric oxide synthase activity/expression in lymphocytes of type 1 diabetes patients: A prospective pilot study. International Journal of Endocrinology. 2019, 2328505(2019).
- Stuhr, L. E., et al. Hyperoxia retards growth and induces apoptosis, changes in vascular density and gene expression in transplanted gliomas in nude rats. Journal of Neuro-Oncology. 85 (2), 191-202 (2007).
- Biollaz, G., et al. Site-specific anti-tumor immunity: differences in DC function, TGF-beta production and numbers of intratumoral Foxp3+ Treg. European Journal of Immunology. 39 (5), 1323-1333 (2009).
- McKenna, F. W., Ahmad, S. Fitting techniques of cell survival curves in high-dose region for use in stereotactic body radiation therapy. Physics in Medicine and Biology. 54 (6), 1593-1608 (2009).
- Malaise, E. P., Lambin, P., Joiner, M. C. Radiosensitivity of human cell lines to small doses. Are there some clinical implications. Radiation Research. 138, S25-S27 (1994).
- Björk-Eriksson, T., West, C., Karlsson, E., Mercke, C. Tumor radiosensitivity (SF2) is a prognostic factor for local control in head and neck cancers. International Journal of Radiation Oncology Biology Physics. 46 (1), 13-19 (2000).
- Bromfield, G. P., Meng, A., Warde, P., Bristow, R. G. Cell death in irradiated prostate epithelial cells: Role of apoptotic and clonogenic cell kill. Prostate Cancer and Prostatic Diseases. 6 (1), 73-85 (2003).
- Kalns, J. E., Piepmeier, E. H. Exposure to hyperbaric oxygen induces cell cycle perturbation in prostate cancer cells. In Vitro Cellular & Developmental Biology - Animal. 35 (2), 98-101 (1999).
- Lakka, S. S., et al. Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion, tumor growth and angiogenesis. Oncogene. 23 (27), 4681-4689 (2004).
- Li, S., Shi, D., Zhang, L., Yang, F., Cheng, G. Oridonin enhances the radiosensitivity of lung cancer cells by upregulating Bax and downregulating Bcl-2. Experimental and Therapeutic Medicine. 16 (6), 4859-4864 (2018).
- Campbell, K. J., Tait, S. W. G. Targeting BCL-2 regulated apoptosis in cancer. Open Biology. 8 (5), 180002(2018).
- Rengarajan, T., et al. D-pinitol promotes apoptosis in MCF-7 cells via induction of p53 and Bax and inhibition of Bcl-2 and NF-κB. Asian Pacific Journal of Cancer Prevention. 15 (4), 1757-1762 (2014).
- Shinagawa, A., et al. The potent peptide antagonist to angiogenesis, C16Y and cisplatin act synergistically in the down-regulation of the Bcl-2/Bax ratio and the induction of apoptosis in human ovarian cancer cells. International Journal of Radiation Oncology Biology Physics. 39 (6), 135-164 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved