Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación e implantación de electrodos para encender eléctricamente ratones VGAT-Cre para generar un modelo para la epilepsia del lóbulo temporal
En este artículo
Resumen
Este informe describe los métodos para generar un modelo de epilepsia del lóbulo temporal basado en el encendido eléctrico de ratones transgénicos VGAT-Cre. Los ratones VGAT-Cre encendidos pueden ser útiles para determinar qué causa la epilepsia y para detectar nuevas terapias.
Resumen
Se descubrió que la excitación eléctrica de los ratones VGAT-Cre condujo a las convulsiones motoras y electrográficas espontáneas. Un artículo reciente se centró en cómo se utilizaron ratones VGAT-Cre únicos en el desarrollo de convulsiones recurrentes espontáneas (SRS) después de encender y un mecanismo probable, la inserción de Cre en el gen VGAT, interrumpió su expresión y redujo el tono GABAérgico. El presente estudio extiende estas observaciones a una cohorte más grande de ratones, centrándose en cuestiones clave como cuánto tiempo continúa el SRS después de encenderse y el efecto del sexo y la edad del animal. Este informe describe los protocolos para los siguientes pasos clave: fabricación de auriculares con electrodos de profundidad del hipocampo para la estimulación eléctrica y para la lectura del electroencefalograma; cirugía para fijar el auricular de forma segura en el cráneo del ratón para que no se caiga; y detalles clave del protocolo de encendido eléctrico, como la duración del pulso, la frecuencia del tren, la duración del tren y la cantidad de corriente inyectada. El protocolo de encendido es robusto, ya que conduce de manera confiable a la epilepsia en la mayoría de los ratones VGAT-Cre, proporcionando un nuevo modelo para probar nuevos medicamentos antiepileptogénicos.
Introducción
La epilepsia es un trastorno neurológico importante con importantes cargas económicas y humanas. NINDS estima que hay 3 millones de estadounidenses con epilepsia. Aproximadamente 0,6 millones de estos pacientes tienen epilepsia del lóbulo temporal (TLE)1. Desafortunadamente, el tratamiento médico de TLE falla en un tercio de los pacientes debido a la ineficacia, el desarrollo de resistencia a los medicamentos o la intolerancia a los efectos secundarios2. Claramente, existe una necesidad significativa de desarrollar nuevas terapias para TLE, una conclusión compartida por el Comité de Ciencias Básicas de la Sociedad Americana de Epilepsia, el Grupo de Trabajo de la Liga Internacional contra la Epilepsia para el Descubrimiento Preclínico de Fármacos para la Epilepsia y el Consejo Asesor Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares 3,4.
Los modelos animales actuales de epilepsia del lóbulo temporal utilizan quimioconvulsivos (p. ej., kainato, pilocarpina) o estimulación eléctrica prolongada para inducir un estado epiléptico duradero 5,6,7. Muchos animales mueren durante el procedimiento (10% -30% en ratas, hasta 90% en ratones8). Los animales que sobreviven y desarrollan epilepsia muestran una muerte neuronal extensa en todo el cerebro 9,10. Esta muerte desencadena una cascada de respuestas, comenzando con la activación de microglía, astrocitos y monocitos infiltrantes. Las respuestas neuronales incluyen la reorganización de circuitos (por ejemplo, brotes de fibras musgosas), el nacimiento de nuevas neuronas que no se integran adecuadamente en los circuitos (por ejemplo, células granulares ectópicas) y cambios intrínsecos que conducen a la hiperexcitabilidad (por ejemplo, regulación positiva de los canales de Na +). Un modelo de epilepsia sin muerte neuronal significativa facilitará la búsqueda de nuevos fármacos antiepilépticos.
Mientras probaba la hipótesis GABA de la epilepsia, se descubrió que el tratamiento de ratones VGAT-Cre con un protocolo de encendido eléctrico leve condujo a las convulsiones motoras y electrográficas espontáneas11. En general, el encendido eléctrico de los roedores no conduce a convulsiones espontáneas que definen la epilepsia, aunque puede, en casos de sobreencendido11. Los ratones VGAT-Cre expresan Cre recombinasa bajo el control del gen transportador vesicular GABA (VGAT), que se expresa específicamente en las neuronas inhibidoras GABAérgicas. Se encontró que la inserción de Cre interrumpió la expresión de VGAT a nivel de ARNm y proteína, perjudicando así la transmisión sináptica GABAérgica en el hipocampo. Se concluyó que los ratones VGAT-Cre encendidos podrían ser útiles para estudiar los mecanismos implicados en la epileptogénesis y para el cribado de nuevas terapias11. En el presente informe se detallan los métodos utilizados para generar el modelo.
Protocolo
El uso de animales siguió las pautas de ARRIVE12 y fue aprobado por el Comité de Cuidado y Uso de Animales de la Universidad de Virginia.
1. Fabricación de auriculares con dos electrodos bipolares (Figura 1)
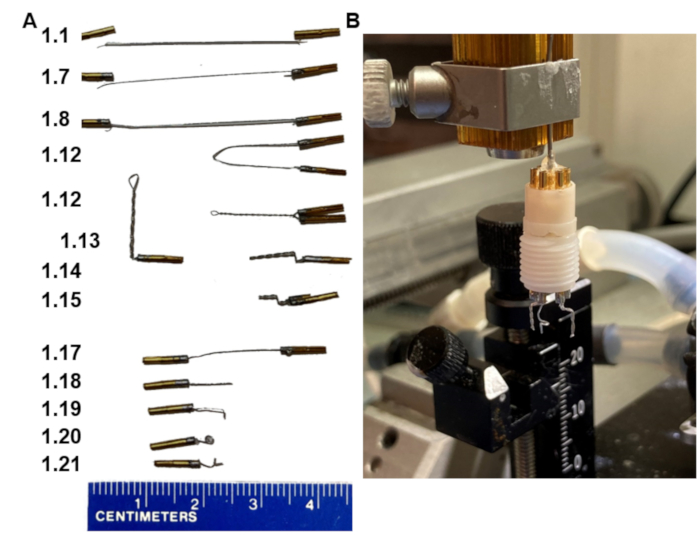
Figura 1: Pasos clave en la fabricación de auriculares EEG. (A) Aparición de los electrodos en los distintos pasos del protocolo (números en el paso de coincidencia izquierda). (B) Una imagen del producto final montado en un soporte casero que se ajuste al marco estereotáxico. Tenga en cuenta que el soporte termina con un conjunto de pasador de collar que encaja en el pedestal del auricular. Haga clic aquí para ver una versión más grande de esta figura.
- Corte 3,5 cm de alambre de acero inoxidable recubierto de politetrafluoroetileno.
- Retire aproximadamente 1 mm de la capa de aislamiento del cable en ambos extremos. No tenga demasiado del alambre pelado.
- Coloque dos pines en un soporte de tornillo con la parte inferior del pasador que tiene una hendidura más larga hacia abajo.
- Aplique fundente en los extremos pelados del cable y en la parte superior de los pines.
- Coloque la parte pelada del cable con la soldadura suficiente para recubrirla.
- Agregue una cantidad mínima de soldadura a la parte superior del pasador sin desbordarse en los lados.
- Coloque un extremo de los extremos pelados del cable en el pasador tan profundo como lo permita mientras se derrite la soldadura.
NOTA: Hay un orificio lateral donde el cable puede salir, no deje que el cable salga del pasador. Todo el cable pelado debe permanecer dentro del pasador. - Repita los pasos 1.6-1.7 para el segundo pin, ahora con los otros extremos pelados del cable.
- Deje que los pines reposen durante 30 s para que se fijen, retírelos del soporte del tornillo y luego tire de ellos para asegurarse de que la conexión entre el cable y los pines sea fuerte y se mantenga.
- Enjuague los alfileres con agua fría y luego séquelos.
- Verifique la conductancia entre el pin 1 y el pin 2 usando un ohmímetro.
- Juntar los pasadores en los extremos del cable; Manténgalos paralelos y ciérrelos. Sujete un hemostático al centro del cable. Luego, gire el hemostático, de modo que el cable se tuerza bastante apretado. Retire el hemostático.
- Sujete una pinza al cable trenzado 2 mm por debajo de los pasadores y doble el cable a 90°.
- Empuje el mismo cable de nuevo 90° hacia atrás sobre las pinzas creando otra curva a 1 mm de la primera.
- Corte el alambre trenzado en un ángulo de 45° por debajo de la curva a 3,5 mm con tijeras pequeñas y afiladas.
- Prepare dos de estos electrodos bipolares (trenzados de doble clavijo) para cada auricular (opcional, el segundo es de respaldo en caso de problemas eléctricos con el primero).
- Prepare un solo electrodo de referencia cortando un alambre con clavijas soldadas en ambos extremos en dos (pasos 1.1-1.17, Figura 1A).
- Corte el cable a 7 mm.
- Dobla el extremo 1 mm por debajo de la punta.
- Luego, cubra la punta doblada de 1 mm del alambre con pinzas y gire el alambre firmemente alrededor de las pinzas para crear un pequeño bucle (1 mm de diámetro).
- Doble el bucle perpendicular a la parte recta del cable para que la punta del cable apunte hacia afuera nuevamente.
- Ensamble los dos electrodos bipolares y el electrodo de referencia único en el pedestal de seis pines de manera que los electrodos bipolares estén uno al lado del otro con una distancia de 6 mm entre ellos, y que el electrodo de referencia se coloque en el orificio exterior central (Figura 1B).
NOTA: Un método alternativo es implantar los electrodos, cementarlos en su lugar y luego insertar sus pasadores en el pedestal.
2. Implantación de electrodos estereotáxicos
- Esterilice todas las herramientas quirúrgicas y el conjunto de electrodos de seis pines en autoclave antes de la cirugía. Se debe mantener un campo quirúrgico estéril durante la cirugía y se deben usar guantes quirúrgicos estériles. Se recomiendan cortinas estériles (por ejemplo, Press n' Seal) para cubrir al animal, excepto el área quirúrgica.
- Use ratones VGAT-Cre de 8 semanas de edad (de la misma edad, tanto machos como hembras) para cirugías 4 semanas después del destete. Registrar el peso del animal antes de la cirugía para permitir la medición de la pérdida de peso postquirúrgica.
- Use un vaporizador de isoflurano certificado o un sistema de anestesia de bajo flujo equipado con una bomba de jeringa de precisión, vaporizador digital integrado y almohadilla térmica de retroalimentación.
NOTA: Los sistemas de bajo flujo son capaces de administrar anestesia a bajas tasas de flujo proporcionales al tamaño del animal en una cámara de inducción o a través de un cono nasal en el marco estereotáxico (70 ml / min, la concentración de isoflurano en el aire es del 4% para la inducción y del 2% para la cirugía). Usar menos anestesia no solo beneficia al animal durante las cirugías, sino que también reduce el riesgo de exposición del personal de laboratorio al isoflurano. - Coloque el animal anestesiado sobre una almohadilla caliente calentada a 37 °C para mantenerlo caliente durante la cirugía. Si utiliza un sistema de temperatura controlada por retroalimentación, inserte la sonda de temperatura ligeramente lubricada en el recto del animal para controlar la temperatura durante la cirugía.
- Monte al animal en el marco estereotáxico colocando suavemente barras para los oídos en las orejas y los dientes superiores frontales en la barra incisiva. Coloque el cono de la nariz sobre la nariz para la administración adecuada de anestesia. Asegúrese de que la cabeza esté nivelada y centrada y no se pueda mover cuando se sondee ligeramente.
- Inyecte por vía subcutánea 0,5 ml de normosol para la hidratación.
- Aplique lubricante ocular para evitar el secado de la córnea.
- Controle la profundidad de la anestesia por la ausencia del reflejo de abstinencia después de pellizcar un dedo del pie de la extremidad posterior, y luego disminuya el isoflurano a 1.5% -2.0% durante la cirugía.
- Elimine el vello en y alrededor del área quirúrgica depilando o usando cortapelos (afeitado) o crema depilatoria, y desinfecte la piel con tres ciclos de aplicación alterna de yodo y etanol, terminando con yodo. Se recomienda eliminar el vello del sitio quirúrgico solo si hay medios para mantener la anestesia en ese lugar. Si es necesario, use aplicadores de punta de algodón humedecidos en alcohol para eliminar el vello del área inmediata que rodea la cabeza. Inyecte 0,05 ml del analgésico local bupivacaína (0,25%) por vía subcutánea.
- Haga una incisión en el cráneo con un bisturí y luego corte una parte de la piel con tijeras quirúrgicas afiladas, exponiendo el cráneo. Empujando la piel a un lado, usando un hisopo de algodón, limpie el cráneo de todos los músculos y tejidos subyacentes que obstruyen la vista.
NOTA: Para detener el sangrado accidental, aplique presión sobre el sitio de sangrado con un hisopo de algodón estéril hasta que se detenga. - Limpie el cráneo con peróxido de hidrógeno usando hisopos de algodón estériles para hacer visibles las suturas del cráneo y tanto bregma como lambda.
- Seque bien el cráneo y luego aplique una gota de adhesivo dental autograbado con su aplicador. Cepíllelo en el cráneo, espere 60 s y cúrelo con una luz UV dental durante 40 s. Una superficie brillante indica que el adhesivo ha sido efectivamente reticulado con el cráneo.
NOTA: Este paso es crítico para la fijación segura de los auriculares. - Utilice una broca de 0,031" (0,79 mm) para perforar dos orificios de rebabas bilateralmente para la implantación de electrodos de profundidad del hipocampo (aproximadamente 5.000 rpm). Perfore un orificio de rebaba adicional para el electrodo de referencia sobre el cerebelo detrás de la lambda.
NOTA: Al perforar, tenga cuidado de bajar el taladro lentamente y evite perforar en el cerebro. - Las coordenadas de los electrodos son las siguientes (de bregma en mm): electrodos del hipocampo a 3 mm posterior, 3 mm lateral y 3 mm de profundidad; y electrodo de referencia cerebeloso a 6 mm posterior, 0 mm lateral y 0 mm de profundidad (subdural).
- Para aumentar la precisión, use un taladro montado estereotaxamente, ponga a cero el eje X / Y del manipulador estereotáxico al tocar bregma: este es el punto de referencia para las coordenadas.
- Ensamble un auricular insertando todos los electrodos en el pedestal de seis pines, asegurándose de que los pines estén empujados hasta el fondo en el pedestal. Monte el pedestal en el soporte del electrodo en un marco estereotáxico (Figura 1B).
- Alinee los electrodos por encima de los orificios de rebabas correspondientes. Implante estereotaxicamente electrodos de alambre bipolar bipolar de acero inoxidable trenzados en el hipocampo derecho e izquierdo y un electrodo de referencia en el cerebelo bajando lentamente los auriculares y guiando los electrodos hacia los orificios de la rebaba.
- Cuando el electrodo de torsión del hipocampo está justo encima del agujero, ponga a cero el eje Z y baje lentamente a -3.0 mm.
- Cubra la superficie del cráneo y los electrodos con cemento dental y rellene el espacio entre la superficie del cráneo y la parte inferior del pedestal. Los bordes de la piel estarán adyacentes al cemento dental, de modo que ningún tejido subyacente quedará expuesto. Espere a que el cemento se seque y se endurezca. Luego retire el soporte del electrodo del brazo estereotáxico y retire el soporte del pedestal.
- Inyecte 0,1 mL de ketoprofeno (1 mg/mL, SC) para analgesia y una segunda dosis de 0,5 mL de normosol (SC) para hidratación y retire al animal del marco estereotáxico.
- Coloque una almohadilla isotérmica precalentada a 37 °C dentro de una jaula de vivero vacía cubierta con una toalla de papel. Una vez que esté completamente despierto, coloque al animal en una jaula limpia con ropa de cama y comida blanda, y devuélvalo al vivero. Los animales se alojan individualmente a partir de este momento para evitar masticar los auriculares de los demás. Las tolvas de barra de alambre no se usan para evitar que los auriculares se atasquen, y en su lugar, las botellas de agua están atadas a la parte inferior de la parte superior de la jaula, y la comida está presente en la ropa de cama.
- Alimente al animal con un poco de alimento blando durante 72 horas después de la cirugía y controle la pérdida de peso y la puntuación de la condición corporal. A los animales deshidratados se les puede administrar 0,5 ml de normosol por vía subcutánea si están deshidratados (pérdida de peso, aumento de la turgencia de la piel, ojos hundidos). El ketoprofeno se puede administrar por vía subcutánea una vez al día durante 2 días más después de la cirugía (siga el régimen de analgesia de acuerdo con las pautas locales de IACUC). Permita que los animales se recuperen completamente en sus jaulas durante 4-7 días antes de transferirlos al sistema de registro de EEG.
3. Protocolo de encendido eléctrico
- Conecte los ratones al sistema de grabación de EEG mediante un cable flexible que se ajuste a los enchufes de la cabeza del ratón y el conmutador (consulte la lista de materiales ). Permita que los animales se aclimaten durante un día antes de proceder con el protocolo de estimulación eléctrica a continuación. Controle su salud general y aclimatación diariamente, y elimínelos del sistema cuando haya signos de enfermedad, angustia y / o pérdida continua de peso corporal superior al 25%
- Conecte ambos cables del electrodo estimulante a la salida de un estimulador de corriente constante.
NOTA: Es muy útil tener una placa de circuito que conmute estos electrodos lejos de la grabadora de EEG y hacia el estimulador. - Ajuste el estimulador para que entregue pulsos de 1 ms a 50 Hz durante una duración de tren de 2 s.
- Ajuste la salida del estimulador a 20 microamperios (μA) y entregue el1er pulso.
- Controle el EEG para detectar una descarga característica posterior de picos de alta frecuencia que duran más que el pulso de estimulación eléctrica.
- Si no se observa descarga, aumente la cantidad de corriente inyectada en incrementos de 20 μA hasta que se active una descarga posterior. La cantidad de corriente requerida es el umbral posterior a la descarga (ADT).
- Las ADT típicas son de 20-50 μA. Si no se observa descarga incluso después de aumentar a 200 μA, se requiere solucionar problemas de conexiones eléctricas y cableado de auriculares con un ohmímetro de alta sensibilidad. Si el problema está en el electrodo estimulante, intente estimular con los otros electrodos de profundidad.
- Los animales se encienden estimulando 2x o 6x por día usando una corriente que es 1.5x el valor de ADT para ese ratón.
- Monitorear la respuesta conductual a la estimulación, que se eleva desde el cambio de estado a convulsiones tónico-clónicas bilaterales con caídas. Puntúe utilizando un sistema de clases Racine modificado11. Para evitar convulsiones tónicas fatales evocadas, se debe pausar el encendido si los estímulos sucesivos conducen a un aumento de la gravedad y la duración de las convulsiones hasta la puntuación de Racine modificada 6 (correr y saltar)
Resultados
Animales
El modelo fue desarrollado originalmente usando ratones VGAT-Cre (Slc32a1tm2(cre)Lowl/J)13 sobre un fondo mixto. Sin embargo, también se ha aplicado a la cepa VGAT-Cre que es congénita con C57BL/6J. No se han observado diferencias en la epilepsia que se desarrolla entre las cepas. Ambas cepas expresan Cre recombinasa bajo el control del promotor transportador vesicular GABA. Estos ratones se generaron golpeando un casete IRES-Cre después del codón de par...
Discusión
Este informe describe un protocolo en el que la activación eléctrica de ratones conduce a la epilepsia. Dado que el electrodo estimulante se coloca en el hipocampo, esta es una epilepsia límbica focal que modela la epilepsia del lóbulo temporal (TLE) en pacientes. Un paso crítico en este protocolo es el uso de ratones VGAT-Cre, que debido a la inserción de un casete de recombinasa IRES-Cre en el gen Vgat , muestra corrientes GABA inhibidoras alteradas11. C57BL / 6 no desarrollan epi...
Divulgaciones
Los autores no tienen conflictos que revelar.
Agradecimientos
Los autores agradecen a John Williamson por sus útiles discusiones sobre este protocolo. Este trabajo fue apoyado por la subvención NS112549 de NIH/NINDS.
Materiales
| Name | Company | Catalog Number | Comments |
| 16 Channel Extracellular Differential AC Amplifier (115V/60Hz) | AD Instruments | AM3500-115-60 | Alternate EEG amplifier |
| 363/CP PLUG COLLAR, PINS SLEEVE | P1 Technologies | 363SLEEVPIN0NL | For electrode holder |
| Cable, 363-363 5CM - 100CM W/MESH 6TCM | P1 Technologies | 363363XXXXCM004 | mouse-to-commutator cable |
| CCTV cameras Qcwox HD Sony IR LED | Sony | QC-SP316 | |
| Commutator SL6C/SB (single brush) | P1 Technologies | 8BSL6CSBC0MT | formerly Plastics One, Inc. |
| Current amplifier | A-M Systems | Model 2100 | |
| Dental cement | Stoelting | 51459 | |
| Drill bits, #75, OD 0.310" LOC 130 PT | Kyocera | 105-0210.310 | |
| E363/0 SOCKET CONTACT SKEWED | P1 Technologies | 8IE3630XXXXE | pins for connector |
| iBond Self Etch glue | Kulzer | CE0197 | |
| MS363 PEDESTAL 2298 6 PIN WHITE | P1 Technologies | 8K000229801F | EEG headset connector |
| Ohmeter | Simpson | 260 | High sensitivity |
| PowerLab 16/35 and LabChart Pro | AD Instruments | PL3516/P | Alternate EEG software |
| SomnoSuite | Kent Scientific Corp. | SS-01 | anesthesia unit & RightTemp monitoring |
| Stereotactic drill and micromotor kit | Foredom Electric Co. | K.1070 | |
| Stereotactic frame | David Kopf Instruments | Model 940 | |
| Teflon-coated wire for depth electrode, OD 0.008' | A-M Systems | 791400 | |
| VGAT-Cre mice on congenic C57BL/6J background | The Jackson Laboratory | 000664 |
Referencias
- Lekoubou, A., Bishu, K. G., Ovbiagele, B. Nationwide trends in medical expenditures among adults with epilepsy: 2003-2014. Journal of the Neurological Sciences. 384, 113-120 (2018).
- Hauser, W. A., Hesdorffer, D. C. Epilepsy: Frequency, Causes, and Consequences. Epilepsy Foundation of America. , (1990).
- Galanopoulou, A. S., et al. Identification of new epilepsy treatments: issues in preclinical methodology. Epilepsia. 53 (3), 571-582 (2012).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Buckmaster, P. S. Laboratory animal models of temporal lobe epilepsy. Comparative Medicine. 54 (5), 473-485 (2004).
- Levesque, M., Avoli, M., Bernard, C. Animal models of temporal lobe epilepsy following systemic chemoconvulsant administration. Journal of Neuroscience Methods. 260, 45-52 (2016).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Wang, L., Liu, Y. H., Huang, Y. G., Chen, L. W. Time-course of neuronal death in the mouse pilocarpine model of chronic epilepsy using Fluoro-Jade C staining. Brain Research. 1241, 157-167 (2008).
- Dey, D., et al. A potassium leak channel silences hyperactive neurons and ameliorates status epilepticus. Epilepsia. 55 (2), 203-213 (2014).
- Straub, J., et al. Characterization of kindled VGAT-Cre mice as a new animal model of temporal lobe epilepsy. Epilepsia. 61 (10), 11 (2020).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biology. 8 (6), 1000412 (2010).
- Vong, L., et al. Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron. 71 (1), 142-154 (2011).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, (2016).
- Lothman, E. W., Bertram, E. H., Bekenstein, J. W., Perlin, J. B. Self-sustaining limbic status epilepticus induced by 'continuous' hippocampal stimulation: electrographic and behavioral characteristics. Epilepsy Research. 3 (2), 107-119 (1989).
- Lothman, E. W., Williamson, J. M. Influence of electrical stimulus parameters on afterdischarge thresholds in the rat hippocampus. Epilepsy Research. 13 (3), 205-213 (1992).
- Lewczuk, E., et al. Electroencephalography and behavior patterns during experimental status epilepticus. Epilepsia. 59 (2), 369-380 (2018).
- Wenker, I. C., et al. Postictal death is associated with tonic phase apnea in a mouse model of sudden unexpected death in epilepsy. Annals of Neurology. 89 (5), 1023-1035 (2021).
- Morimoto, K., Fahnestock, M., Racine, R. J. Kindling and status epilepticus models of epilepsy: rewiring the brain. Progress in Neurobiology. 73 (1), 1-60 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados