È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione e impianto di elettrodi per l'accensione elettrica di topi VGAT-Cre per generare un modello per l'epilessia del lobo temporale
In questo articolo
Riepilogo
Questo rapporto descrive i metodi per generare un modello di epilessia del lobo temporale basato sull'accensione elettrica di topi transgenici VGAT-Cre. I topi Kindled VGAT-Cre possono essere utili per determinare ciò che causa l'epilessia e per lo screening di nuove terapie.
Abstract
È stato scoperto che l'accensione elettrica dei topi VGAT-Cre ha portato alle crisi motorie ed elettrografiche spontanee. Un recente articolo si è concentrato su come i topi VGAT-Cre unici sono stati utilizzati nello sviluppo di crisi ricorrenti spontanee (SRS) dopo l'accensione e un probabile meccanismo - l'inserimento di Cre nel gene VGAT - ha interrotto la sua espressione e ridotto il tono GABAergico. Il presente studio estende queste osservazioni a una coorte più ampia di topi, concentrandosi su questioni chiave come per quanto tempo l'SRS continua dopo l'accensione e l'effetto del sesso e dell'età dell'animale. Questo rapporto descrive i protocolli per i seguenti passaggi chiave: realizzazione di cuffie con elettrodi di profondità ippocampali per la stimolazione elettrica e per la lettura dell'elettroencefalogramma; intervento chirurgico per fissare saldamente l'auricolare sul cranio del topo in modo che non cada; e dettagli chiave del protocollo di accensione elettrica come la durata dell'impulso, la frequenza del treno, la durata del treno e la quantità di corrente iniettata. Il protocollo di accensione è robusto in quanto porta in modo affidabile all'epilessia nella maggior parte dei topi VGAT-Cre, fornendo un nuovo modello per testare nuovi farmaci antiepilettogeni.
Introduzione
L'epilessia è un grave disturbo neurologico con significativi oneri economici e umani. NINDS stima che ci siano 3 milioni di americani con epilessia. Circa 0,6 milioni di questi pazienti sono affetti da epilessia del lobo temporale (TLE)1. Sfortunatamente, il trattamento medico del TLE fallisce in un terzo dei pazienti a causa dell'inefficacia, dello sviluppo di resistenza ai farmaci o dell'intolleranza agli effetti collaterali2. Chiaramente, c'è una significativa necessità di sviluppare nuove terapie per TLE, una conclusione condivisa dall'American Epilepsy Society Basic Science Committee, dall'International League Against Epilepsy Working Group for Preclinical Epilepsy Drug Discovery e dal National Advisory Neurological Disorders and Stroke Council 3,4.
Gli attuali modelli animali di epilessia del lobo temporale utilizzano chemioconvulsivanti (ad esempio, kainato, pilocarpina) o stimolazione elettrica prolungata per indurre uno stato epilettico di lunga durata 5,6,7. Molti animali muoiono durante la procedura (10% -30% nei ratti, fino al 90% nei topi8). Gli animali che sopravvivono e sviluppano l'epilessia mostrano una morte neuronale estesa in tutto il cervello 9,10. Questa morte innesca una cascata di risposte, a partire dall'attivazione di microglia, astrociti e monociti infiltranti. Le risposte neuronali includono la riorganizzazione dei circuiti (ad esempio, la germinazione delle fibre muschiose), la nascita di nuovi neuroni che non riescono a integrarsi correttamente nei circuiti (ad esempio, cellule granulari ectopiche) e cambiamenti intrinseci che portano all'ipereccitabilità (ad esempio, sovraregolazione dei canali Na+). Un modello di epilessia senza morte neuronale significativa faciliterà la ricerca di nuovi farmaci antiepilettici.
Durante il test dell'ipotesi GABA dell'epilessia, è stato scoperto che il trattamento dei topi VGAT-Cre con un lieve protocollo di accensione elettrica ha portato alle crisi motorie ed elettrografiche spontanee11. In generale, l'accensione elettrica dei roditori non porta a convulsioni spontanee che definiscono l'epilessia, sebbene possa, in caso di eccesso di accensione11. I topi VGAT-Cre esprimono Cre ricombinasi sotto il controllo del gene trasportatore vescicolare GABA (VGAT), che è specificamente espresso nei neuroni inibitori GABAergici. È stato riscontrato che l'inserimento di Cre ha interrotto l'espressione di VGAT a livello di mRNA e proteine, compromettendo così la trasmissione sinaptica GABAergica nell'ippocampo. Si è concluso che i topi VGAT-Cre accesi potrebbero essere utili per studiare i meccanismi coinvolti nell'epilettogenesi e per lo screening di nuove terapie11. Il presente rapporto fornisce in dettaglio i metodi utilizzati per generare il modello.
Access restricted. Please log in or start a trial to view this content.
Protocollo
L'uso degli animali ha seguito le linee guida ARRIVE12 ed è stato approvato dal Comitato per la cura e l'uso degli animali dell'Università della Virginia.
1. Realizzazione di cuffie con due elettrodi bipolari (Figura 1)
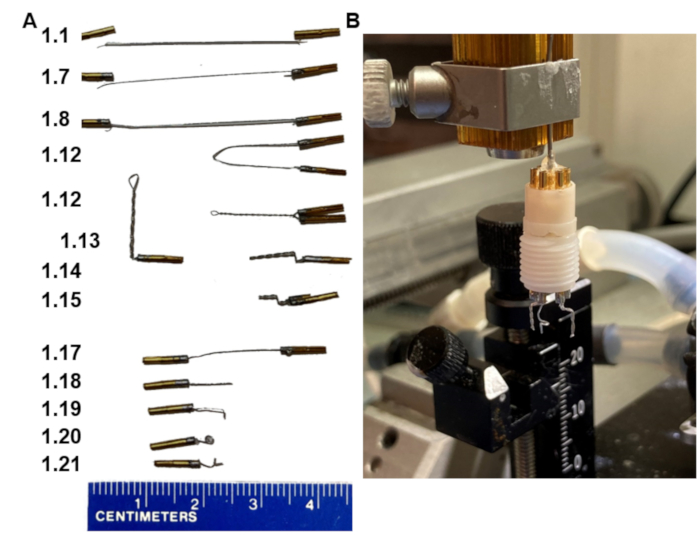
Figura 1: Passaggi chiave nella fabbricazione delle cuffie EEG. (A) Aspetto degli elettrodi nelle varie fasi del protocollo (numeri nella fase di corrispondenza sinistra). (B) Un'immagine del prodotto finale montata in un supporto fatto in casa che si adatta al telaio stereotassico. Nota, il supporto termina con un gruppo di perni del collare che si inserisce nel piedistallo dell'auricolare. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Tagliare 3,5 cm di filo di acciaio inossidabile rivestito in politetrafluoroetilene.
- Rimuovere circa 1 mm del rivestimento isolante dal filo su entrambe le estremità. Non avere troppo filo sverniciato.
- Metti due perni su un portamorsa con la parte inferiore del perno che ha una fessura più lunga rivolta verso il basso.
- Applicare il flusso sulle estremità spogliate del filo e sulla parte superiore dei perni.
- Tappare la parte spogliata del filo con una saldatura sufficiente per rivestirla.
- Aggiungere una quantità minima di saldatura alla parte superiore del perno senza traboccare sui lati.
- Posizionare un'estremità delle estremità spogliate del filo nel perno il più profondo possibile mentre la saldatura viene fusa.
NOTA: C'è un foro laterale dove il filo può uscire - non lasciare che il filo esca dal perno. Tutto il filo strappato deve rimanere all'interno del perno. - Ripetere i passaggi 1.6-1.7 per il secondo perno, ora con le altre estremità spogliate del filo.
- Lasciare riposare i perni per 30 secondi per impostarli, rimuoverli dal supporto della morsa, quindi tirarli per assicurarsi che la connessione tra il filo e i perni sia forte e tiene.
- Risciacquare i perni in acqua fredda e quindi asciugare.
- Verificare la conduttanza tra il pin 1 e il pin 2 utilizzando un ohmmetro.
- Portare i perni alle estremità del filo insieme; Tienili paralleli e vicini. Morsetti un emostatico al centro del filo. Quindi, ruotare l'emostato, in modo che il filo si attorcigli su se stesso abbastanza stretto. Rimuovere l'emostato.
- Bloccare una pinza sul filo intrecciato 2 mm sotto i perni e piegare il filo a 90°.
- Spingere nuovamente lo stesso filo di 90° indietro sopra la pinza creando un'altra curva a 1 mm dalla prima.
- Tagliare il filo intrecciato con un angolo di 45° sotto la curva a 3,5 mm con piccole forbici affilate.
- Preparare due di questi elettrodi bipolari (a doppio perno intrecciato) per ogni auricolare (opzionale, il secondo è il backup in caso di problemi elettrici con il primo).
- Preparare un singolo elettrodo di riferimento tagliando in due un filo con perni saldati su entrambe le estremità (passaggi 1.1-1.17, Figura 1A).
- Tagliare il filo a 7 mm.
- Piegare l'estremità 1 mm sotto la punta.
- Quindi, coprire la punta piegata di 1 mm del filo con una pinza e ruotare il filo stretto attorno alla pinza per creare un piccolo anello (1 mm di diametro).
- Piegare l'anello perpendicolarmente alla parte diritta del filo per far sì che la punta del filo riguardi verso l'esterno.
- Assemblare i due elettrodi bipolari e il singolo elettrodo di riferimento nel piedistallo a sei pin in modo che gli elettrodi bipolari siano affiancati con una distanza di 6 mm tra loro e che l'elettrodo di riferimento sia posizionato nel foro esterno centrale (Figura 1B).
NOTA: Un metodo alternativo consiste nell'impiantare gli elettrodi, cementarli in posizione e quindi inserire i loro perni nel piedistallo.
2. Impianto di elettrodi stereotassici
- Sterilizzare tutti gli strumenti chirurgici e l'assemblaggio dell'elettrodo a sei pin mediante autoclave prima dell'intervento. Durante l'intervento chirurgico deve essere mantenuto un campo chirurgico sterile e devono essere utilizzati guanti chirurgici sterili. Si raccomandano teli sterili (ad esempio, Press n' Seal) per coprire l'animale ad eccezione dell'area chirurgica.
- Utilizzare topi VGAT-Cre di 8 settimane (di età corrispondente, sia maschi che femmine) per interventi chirurgici 4 settimane dopo lo svezzamento. Registrare il peso dell'animale prima dell'intervento chirurgico per consentire la misurazione della perdita di peso post-chirurgica.
- Utilizza un vaporizzatore a isoflurano certificato o un sistema di anestesia a basso flusso dotato di una pompa a siringa di precisione, vaporizzatore digitale integrato e termoforo di feedback.
NOTA: I sistemi a basso flusso sono in grado di erogare l'anestesia a basse portate proporzionate alle dimensioni dell'animale in una camera a induzione o attraverso un cono nasale sul telaio stereotassico (70 ml / min, la concentrazione di isoflurano nell'aria è del 4% per l'induzione e del 2% per la chirurgia). L'uso di meno anestesia non solo avvantaggia l'animale durante gli interventi chirurgici, ma riduce anche il rischio di esposizione del personale di laboratorio all'isoflurano. - Posizionare l'animale anestetizzato su un tampone riscaldato a 37 °C per mantenerlo caldo durante l'intervento chirurgico. Se si utilizza un sistema di temperatura controllato da feedback, inserire la sonda di temperatura leggermente lubrificata nel retto dell'animale per il monitoraggio della temperatura durante l'intervento chirurgico.
- Montare l'animale sul telaio stereotassico posizionando delicatamente le barre auricolari nelle orecchie e i denti superiori anteriori nella barra incisiva. Posizionare il cono del naso sopra il naso per una corretta erogazione dell'anestesia. Assicurarsi che la testa sia livellata e centrata e non possa essere spostata quando leggermente sondata.
- Iniettare per via sottocutanea 0,5 ml di normosol per l'idratazione.
- Applicare lubrificante oculare per prevenire l'essiccazione corneale.
- Monitorare la profondità dell'anestesia dall'assenza del riflesso di ritiro dopo aver pizzicato un dito posteriore, quindi ridurre l'isoflurano all'1,5% -2,0% durante l'intervento chirurgico.
- Rimuovere i peli in corrispondenza e intorno all'area chirurgica strappando o utilizzando tagliacapelli (rasatura) o crema depilatoria e disinfettare la pelle con tre cicli di applicazione alternata di iodio ed etanolo, finendo con iodio. La rimozione dei peli dal sito chirurgico è raccomandata solo se ci sono mezzi per mantenere l'anestesia in quella posizione. Se necessario, utilizzare applicatori di punta di cotone imbevuti di alcol per rimuovere i peli dall'area circostante la testa. Iniettare 0,05 mL di bupivacaina analgesica locale (0,25%) per via sottocutanea.
- Fai un'incisione sul cranio usando un bisturi, quindi ritaglia una parte della pelle con forbici chirurgiche affilate, esponendo il cranio. Spingendo la pelle da parte, usando un batuffolo di cotone, pulire il cranio da tutti i muscoli e i tessuti sottostanti che ostruiscono la vista.
NOTA: Per fermare l'emorragia accidentale, applicare pressione sul sito di sanguinamento con un batuffolo di cotone sterile fino a quando non si ferma. - Pulire il cranio con perossido di idrogeno usando tamponi di cotone sterili per rendere visibili le suture del cranio e sia il bregma che la lambda.
- Asciugare accuratamente il cranio, quindi applicare una goccia di adesivo dentale autoincisivo utilizzando il suo applicatore. Spazzolarlo nel cranio, attendere 60 secondi e curare con una luce UV dentale per 40 secondi. Una superficie lucida indica che l'adesivo è stato efficacemente reticolato con il cranio.
NOTA: questo passaggio è fondamentale per il fissaggio sicuro dell'auricolare. - Utilizzare una punta da 0,031" (0,79 mm) per praticare bilateralmente due fori di bava per l'impianto di elettrodi di profondità dell'ippocampo (circa 5.000 giri/min). Praticare un foro di bava extra per l'elettrodo di riferimento sopra il cervelletto dietro la lambda.
NOTA: Durante la perforazione, fare attenzione ad abbassare lentamente il trapano ed evitare di perforare il cervello. - Le coordinate per gli elettrodi sono le seguenti (da bregma in mm): elettrodi ippocampali a 3 mm posterior, 3 mm lateralmente e 3 mm di profondità; ed elettrodo cerebellare di riferimento a 6 mm posteriormente, 0 mm lateralmente e 0 mm di profondità (subdurale).
- Per aumentare la precisione, utilizzare un trapano montato stereotassicamente, azzerare il manipolatore stereotassico dell'asse X / Y quando si tocca bregma - questo è il punto di riferimento per le coordinate.
- Assemblare una cuffia inserendo tutti gli elettrodi nel piedistallo a sei pin, assicurandosi che i perni siano spinti fino in fondo nel piedistallo. Montare il piedistallo nel supporto dell'elettrodo su un telaio stereotassico (Figura 1B).
- Allineare gli elettrodi sopra i fori di bava corrispondenti. Impiantare stereotassicamente elettrodi bipolari intrecciati in filo di acciaio inossidabile nell'ippocampo destro e sinistro e nell'elettrodo di riferimento nel cervelletto abbassando lentamente l'auricolare e guidando gli elettrodi nei fori di bava.
- Quando l'elettrodo di torsione ippocampale si trova proprio sopra il foro, azzerare l'asse Z e abbassarsi lentamente fino a -3,0 mm.
- Coprire la superficie del cranio e gli elettrodi con cemento dentale e riempire lo spazio tra la superficie del cranio e il fondo del piedistallo. I bordi della pelle saranno adiacenti al cemento dentale in modo tale che nessun tessuto sottostante rimanga esposto. Attendere che il cemento si asciughi e si indurisca. Quindi staccare il supporto dell'elettrodo dal braccio stereotassico e rimuovere il supporto dal piedistallo.
- Iniettare 0,1 mL di ketoprofene (1 mg/mL, SC) per l'analgesia e una seconda dose di 0,5 mL di normosol (SC) per l'idratazione e rimuovere l'animale dal telaio stereotassico.
- Posizionare un tampone isotermico preriscaldato a 37 °C all'interno di una gabbia vuota coperta da un tovagliolo di carta. Una volta che è completamente sveglio, metti l'animale in una gabbia pulita con lettiere e cibo morbido e restituiscilo al vivaio. Gli animali sono alloggiati singolarmente da questo punto in poi per evitare di masticare le cuffie l'uno dell'altro. Le tramogge della barra metallica non vengono utilizzate per evitare che le cuffie si blocchino e, invece, le bottiglie d'acqua sono legate alla parte inferiore delle cime della gabbia e il chow è presente nella biancheria da letto.
- Dai da mangiare all'animale del cibo morbido per 72 ore dopo l'intervento chirurgico e monitora la perdita di peso e il punteggio delle condizioni corporee. Agli animali disidratati possono essere somministrati 0,5 ml di normosol per via sottocutanea se disidratati (perdita di peso, aumento del turgore cutaneo, occhi infossati). Ketoprofene può essere somministrato per via sottocutanea una volta al giorno per altri 2 giorni dopo l'intervento chirurgico (seguire il regime di analgesia secondo le linee guida IACUC locali). Consentire agli animali di riprendersi completamente nelle loro gabbie per 4-7 giorni prima di essere trasferiti al sistema di registrazione EEG.
3. Protocollo di accensione elettrica
- Collegare i mouse al sistema di registrazione EEG utilizzando un cavo flessibile che si adatta alle prese sulla testa del mouse e sul commutatore (vedere l'elenco dei materiali ). Lasciare che gli animali si acclimatino per un giorno prima di procedere con il protocollo di stimolazione elettrica riportato di seguito. Monitorare la loro salute generale e l'acclimatazione su base giornaliera e rimuoverli dal sistema quando ci sono segni di malattia, angoscia e / o perdita di peso corporeo continua superiore al 25%
- Collegare entrambi i cavi dall'elettrodo stimolante all'uscita di uno stimolatore a corrente costante.
NOTA: È molto utile avere un circuito stampato che commuta questi elettrodi lontano dal registratore EEG e allo stimolatore. - Impostare lo stimolatore in modo da erogare impulsi di 1 ms a 50 Hz per una durata del treno di 2 s.
- Impostare l'uscita dello stimolatore a 20 microampere (μA) ed erogare il 1° impulso .
- Monitorare l'EEG per una caratteristica post-scarica di picchi ad alta frequenza che durano più a lungo dell'impulso di stimolazione elettrica.
- Se non si osserva alcuna scarica, aumentare la quantità di corrente iniettata con incrementi di 20 μA fino a quando non viene attivata una scarica post-scarica. La quantità di corrente richiesta è la soglia di post-scarica (ADT).
- Gli ADT tipici sono 20-50 μA. Se non si osserva alcuna scarica anche dopo l'aumento a 200 μA, è necessario risolvere i problemi dei collegamenti elettrici e del cablaggio delle cuffie con un ohmmetro ad alta sensibilità. Se il problema è nell'elettrodo stimolante, prova a stimolare con gli altri elettrodi di profondità.
- Gli animali vengono accesi stimolando 2 volte o 6 volte al giorno utilizzando una corrente che è 1,5 volte il valore ADT per quel mouse.
- Monitorare la risposta comportamentale alla stimolazione, che sale dal cambiamento di stato alle crisi tonico-cloniche bilaterali con caduta. Punteggio utilizzando un sistema di classi Racine modificato11. Per evitare convulsioni toniche fatali evocate, l'accensione dovrebbe essere interrotta se stimoli successivi portano a un aumento della gravità e della durata delle convulsioni fino al punteggio Racine modificato 6 (corsa e salto)
Access restricted. Please log in or start a trial to view this content.
Risultati
Animali
Il modello è stato originariamente sviluppato utilizzando topi VGAT-Cre (Slc32a1tm2(cre)Lowl/J)13 su sfondo misto. Tuttavia, è stato applicato anche al ceppo VGAT-Cre che è congenito con C57BL / 6J. Nessuna differenza è stata osservata nell'epilessia che si sviluppa tra i ceppi. Entrambi i ceppi esprimono Cre ricombinasi sotto il controllo del promotore del trasportatore vescicolare GABA. Questi topi sono stati generati bussando in una cassetta IRES-Cre d...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo rapporto descrive un protocollo in cui l'accensione elettrica dei topi porta all'epilessia. Poiché l'elettrodo stimolante è posizionato nell'ippocampo, questa è un'epilessia limbica focale che modella l'epilessia del lobo temporale (TLE) nei pazienti. Un passo fondamentale in questo protocollo è quello di utilizzare topi VGAT-Cre, che a causa dell'inserimento di una cassetta di ricombinasi IRES-Cre nel gene Vgat , mostra alterate correnti inibitorie GABA11. C57BL / 6 non svilup...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti da rivelare.
Riconoscimenti
Gli autori ringraziano John Williamson per le utili discussioni su questo protocollo. Questo lavoro è stato sostenuto dalla sovvenzione NIH/NINDS NS112549.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 16 Channel Extracellular Differential AC Amplifier (115V/60Hz) | AD Instruments | AM3500-115-60 | Alternate EEG amplifier |
| 363/CP PLUG COLLAR, PINS SLEEVE | P1 Technologies | 363SLEEVPIN0NL | For electrode holder |
| Cable, 363-363 5CM - 100CM W/MESH 6TCM | P1 Technologies | 363363XXXXCM004 | mouse-to-commutator cable |
| CCTV cameras Qcwox HD Sony IR LED | Sony | QC-SP316 | |
| Commutator SL6C/SB (single brush) | P1 Technologies | 8BSL6CSBC0MT | formerly Plastics One, Inc. |
| Current amplifier | A-M Systems | Model 2100 | |
| Dental cement | Stoelting | 51459 | |
| Drill bits, #75, OD 0.310" LOC 130 PT | Kyocera | 105-0210.310 | |
| E363/0 SOCKET CONTACT SKEWED | P1 Technologies | 8IE3630XXXXE | pins for connector |
| iBond Self Etch glue | Kulzer | CE0197 | |
| MS363 PEDESTAL 2298 6 PIN WHITE | P1 Technologies | 8K000229801F | EEG headset connector |
| Ohmeter | Simpson | 260 | High sensitivity |
| PowerLab 16/35 and LabChart Pro | AD Instruments | PL3516/P | Alternate EEG software |
| SomnoSuite | Kent Scientific Corp. | SS-01 | anesthesia unit & RightTemp monitoring |
| Stereotactic drill and micromotor kit | Foredom Electric Co. | K.1070 | |
| Stereotactic frame | David Kopf Instruments | Model 940 | |
| Teflon-coated wire for depth electrode, OD 0.008' | A-M Systems | 791400 | |
| VGAT-Cre mice on congenic C57BL/6J background | The Jackson Laboratory | 000664 |
Riferimenti
- Lekoubou, A., Bishu, K. G., Ovbiagele, B. Nationwide trends in medical expenditures among adults with epilepsy: 2003-2014. Journal of the Neurological Sciences. 384, 113-120 (2018).
- Hauser, W. A., Hesdorffer, D. C. Epilepsy: Frequency, Causes, and Consequences. Epilepsy Foundation of America. , (1990).
- Galanopoulou, A. S., et al. Identification of new epilepsy treatments: issues in preclinical methodology. Epilepsia. 53 (3), 571-582 (2012).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Buckmaster, P. S. Laboratory animal models of temporal lobe epilepsy. Comparative Medicine. 54 (5), 473-485 (2004).
- Levesque, M., Avoli, M., Bernard, C. Animal models of temporal lobe epilepsy following systemic chemoconvulsant administration. Journal of Neuroscience Methods. 260, 45-52 (2016).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Wang, L., Liu, Y. H., Huang, Y. G., Chen, L. W. Time-course of neuronal death in the mouse pilocarpine model of chronic epilepsy using Fluoro-Jade C staining. Brain Research. 1241, 157-167 (2008).
- Dey, D., et al. A potassium leak channel silences hyperactive neurons and ameliorates status epilepticus. Epilepsia. 55 (2), 203-213 (2014).
- Straub, J., et al. Characterization of kindled VGAT-Cre mice as a new animal model of temporal lobe epilepsy. Epilepsia. 61 (10), 11(2020).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biology. 8 (6), 1000412(2010).
- Vong, L., et al. Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron. 71 (1), 142-154 (2011).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, (2016).
- Lothman, E. W., Bertram, E. H., Bekenstein, J. W., Perlin, J. B. Self-sustaining limbic status epilepticus induced by 'continuous' hippocampal stimulation: electrographic and behavioral characteristics. Epilepsy Research. 3 (2), 107-119 (1989).
- Lothman, E. W., Williamson, J. M. Influence of electrical stimulus parameters on afterdischarge thresholds in the rat hippocampus. Epilepsy Research. 13 (3), 205-213 (1992).
- Lewczuk, E., et al. Electroencephalography and behavior patterns during experimental status epilepticus. Epilepsia. 59 (2), 369-380 (2018).
- Wenker, I. C., et al. Postictal death is associated with tonic phase apnea in a mouse model of sudden unexpected death in epilepsy. Annals of Neurology. 89 (5), 1023-1035 (2021).
- Morimoto, K., Fahnestock, M., Racine, R. J. Kindling and status epilepticus models of epilepsy: rewiring the brain. Progress in Neurobiology. 73 (1), 1-60 (2004).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon