このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
側頭葉てんかんモデル作製のためのVGAT-CREマウスの電気的キンドリング電極の作製と移植
要約
本報告では,トランスジェニックVGAT-Creマウスの電気キンドリングに基づいて側頭葉てんかんのモデルを生成する方法について述べる.Kindled VGAT-Creマウスは、てんかんの原因を特定し、新しい治療法をスクリーニングするのに役立つ可能性があります。
要約
VGAT-Creマウスの電気キンドリングが自発的な運動発作と電信発作を引き起こすことが発見されました。最近の論文は、キンドリング後の自然再発発作(SRS)の発症にVGAT-Creマウスがどのように使用されたかに焦点を当て、VGAT遺伝子へのCreの挿入というメカニズムの可能性が高く、その発現が破壊され、GABA作動性トーンが低下しました。本研究では、これらの観察結果をマウスのより大きなコホートに拡張し、キンドリング後のSRSの継続時間や動物の性別と年齢の影響などの重要な問題に焦点を当てています。このレポートでは、次の重要なステップのプロトコルについて説明します:電気刺激と脳波の読み取りのための海馬の深さ電極を備えたヘッドセットの作成。ヘッドセットが脱落しないようにマウスの頭蓋骨にしっかりと固定する手術。パルスの持続時間、列車の周波数、列車の持続時間、注入される電流の量など、電気キンドリングプロトコルの重要な詳細。キンドリングプロトコルは、ほとんどのVGAT-Creマウスでてんかんを確実に引き起こすという点で堅牢であり、新しい抗てんかん原薬をテストするための新しいモデルを提供します。
概要
てんかんは、経済的および人的負担が大きい主要な神経障害です。NINDSは、てんかんを持つアメリカ人が300万人いると推定しています。これらの患者のうち約60万人が側頭葉てんかん(TLE)1を患っています。残念ながら、TLEの治療は、効果がないこと、薬剤耐性の発現、または副作用に対する不耐性のために、患者の3分の1で失敗します2。明らかに、TLEの新しい治療法を開発する必要性は大きく、米国てんかん学会の基礎科学委員会、前臨床てんかん創薬のための国際てんかん対策ワーキンググループ、および全米諮問神経障害および脳卒中評議会3,4によって共有された結論です。
側頭葉てんかんの現在の動物モデルは、化学痙攣薬(例:.、カイネート、ピロカルピン)または長期の電気刺激を使用して、長期にわたるてんかん重積状態を誘発します5,6,7。多くの動物が処置中に死亡する(ラットでは10%〜30%、マウスでは最大90%8)。生き残っててんかんを発症した動物は、脳全体に広範な神経細胞死を示します9,10。この死は、ミクログリア、星状細胞の活性化、および浸潤単球から始まる一連の応答を引き起こします。ニューロンの応答には、回路の再編成(苔状の繊維の発芽など)、回路に適切に統合できない新しいニューロンの誕生(異所性顆粒細胞など)、および過興奮性につながる固有の変化(Na+チャネルのアップレギュレーションなど)が含まれます。有意な神経細胞死のないてんかんモデルは、新しい抗てんかん薬の探索を容易にします。
てんかんのGABA仮説をテストしている間、軽度の電気キンドリングプロトコルでVGAT-Creマウスを治療すると、自発的な運動発作と電信発作につながることが発見されました11。一般に、げっ歯類の電気的キンドリングは、てんかんを定義する自発的な発作にはつながりませんが、過剰にキンドリングする場合には可能です11。VGAT-Creマウスは、GABA作動性抑制ニューロンで特異的に発現する小胞GABAトランスポーター(VGAT)遺伝子の制御下でCreリコンビナーゼを発現します。Creの挿入は、mRNAおよびタンパク質レベルでVGATの発現を破壊し、海馬におけるGABA作動性シナプス伝達を損なうことがわかった。KindleVGAT-Creマウスは、てんかん形成に関与するメカニズムの研究および新規治療法のスクリーニングに役立つ可能性があると結論付けられました11。本報告では、モデルの生成に使用される方法を詳細に提供します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
動物の使用はARRIVE12 ガイドラインに従い、バージニア大学の動物管理および使用委員会によって承認されました。
1. 2つのバイポーラ電極を備えたヘッドセットの作成(図1)
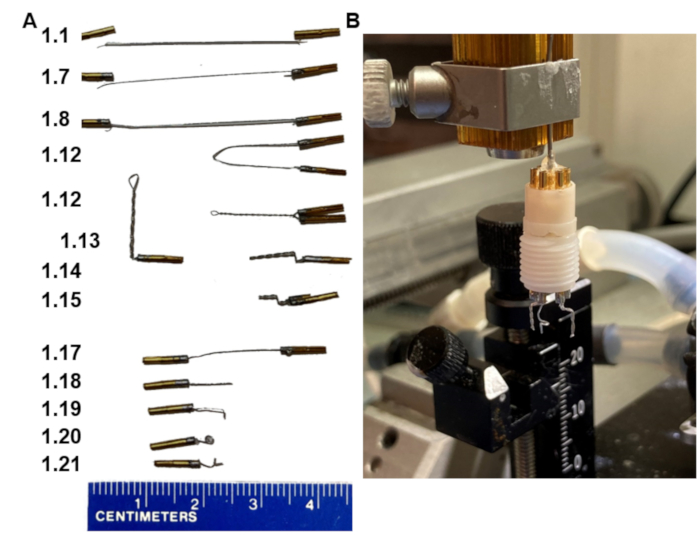
図1:EEGヘッドセット製造の重要なステップ。 (A)プロトコルのさまざまなステップでの電極の外観(左側の一致ステップの番号)。(B)定位固定装置フレームに適合する自家製ホルダーに取り付けられた最終製品の写真。ホルダーは、ヘッドセットの台座に収まるカラーピンアセンブリで終わることに注意してください。 この図の拡大版を表示するには、ここをクリックしてください。
- ステンレスポリテトラフルオロエチレン被覆ステンレス鋼線を3.5cm切断します。
- 両端のワイヤから約1mmの絶縁コートを剥がします。ワイヤーを剥がしすぎないでください。
- 長いスリットのあるピンの下部を下に向けて、万力ホルダーに2本のピンを置きます。
- ワイヤーの剥がした端とピンの上部にフラックスを塗布します。
- ワイヤーの剥がした部分を、コーティングするのに十分なはんだで錫メッキします。
- 側面にオーバーフローすることなく、ピンの上部に最小限のはんだを追加します。
- はんだが溶けている間、ワイヤの剥がされた端の一方の端をピンにできるだけ深く入れます。
注意: ワイヤーが出てくる可能性のあるサイドホールがあります-ワイヤーがピンから出ないようにしてください。剥がしたワイヤはすべてピン内に収まる必要があります。 - 2番目のピンに対して手順1.6〜1.7を繰り返し、ワイヤの他の端を剥がします。
- ピンを30秒間置いてセットし、万力ホルダーから取り外してから引っ張って、ワイヤーとピンの間の接続が強く保持されていることを確認します。
- ピンを冷水ですすぎ、乾かします。
- 抵抗計を使用してピン1とピン2の間のコンダクタンスを確認します。
- ワイヤーの端にあるピンを一緒に持ってきます。それらを平行に保持して閉じます。止血剤をワイヤーの中心に固定します。次に、止血剤を回転させて、ワイヤーがそれ自体をかなりきつくねじるようにします。止血剤を取り外します。
- ピンの2 mm下のツイストワイヤーに鉗子をクランプし、ワイヤーを90°曲げます。
- 同じワイヤーをもう一度鉗子の上に90°押し戻し、最初のワイヤーから1mmの別の曲げを作成します。
- 小さな鋭利なハサミで、ベンドから3.5 mm下の45°の角度でツイストワイヤーを切ります。
- ヘッドセットごとに、これらのバイポーラ(ダブルピンツイスト)電極を2つ準備します(オプション、1つ目は電気的問題が発生した場合のバックアップです)。
- 両端をはんだ付けしたピン付きのワイヤを2つに切断して、1つの参照電極を準備します(手順1.1-1.17、 図1A)。
- ワイヤーを7 mmで切断します。
- 先端を1 mm下に曲げます。
- 次に、ワイヤーの曲がった1 mmの先端を鉗子で覆い、ワイヤーを鉗子の周りでしっかりと回転させて小さなループ(直径1 mm)を作成します。
- ループをワイヤの直線部分に垂直に曲げて、ワイヤの先端が再び外側を向くようにします。
- 2つのバイポーラ電極と単一の参照電極を6ピンの台座に組み立て、バイポーラ電極が6 mmの距離で並んでおり、参照電極が中央の外側の穴に配置されるようにしています(図1B)。
注意: 別の方法は、電極を埋め込み、所定の位置にセメントで固定してから、ピンを台座に挿入することです。
2. 定位固定装置電極埋入術
- 手術前にオートクレーブ滅菌により、すべての手術器具と6ピン電極アセンブリを滅菌します。手術中は無菌の手術野を維持し、無菌の手術用手袋を使用する必要があります。滅菌ドレープ(例:.、プレスアンドシール)は、手術領域を除いて動物を覆うために推奨されます。
- 離乳後8週間の手術には、4週齢のVGAT-Creマウス(年齢が一致した、男性と女性の両方)を使用します。手術前の動物の体重を記録して、手術後の体重減少の測定を可能にします。
- 認定されたイソフルラン気化器、または精密シリンジポンプ、内蔵デジタル気化器、フィードバックヒートパッドを備えた低流量麻酔システムを使用してください。
注:低流量システムは、動物のサイズに比例した低流量で麻酔を誘導室または定位固定フレームのノーズコーンを介して送達することができます(70 mL /分、空気中のイソフルラン濃度は誘導で4%、手術で2%)。より少ない麻酔を使用することは、手術中の動物に利益をもたらすだけでなく、実験室の職員がイソフルランにさらされるリスクも軽減します。 - 麻酔をかけた動物を37°Cに温めた加熱パッドの上に置き、手術中に暖かく保ちます。フィードバック制御温度システムを使用している場合は、手術中の温度監視のために、軽く潤滑された温度プローブを動物の直腸に挿入します。
- イヤーバーを耳に、前上歯を切歯バーにそっと配置して、動物を定位固定装置フレームに取り付けます。適切な麻酔送達のために、鼻の上にノーズコーンを置きます。頭が水平で中央に配置され、少し調べたときに動かせないことを確認してください。
- 水分補給のために0.5mLのノルモソールを皮下注射する。
- 角膜の乾燥を防ぐために眼用潤滑剤を塗布します。
- 後肢のつま先をつまんだ後の離脱反射がないことによって麻酔の深さを監視し、手術中にイソフルランを1.5%〜2.0%に減少させる。
- バリカン(髭剃り)または脱毛クリームを摘採または使用して手術部位とその周辺の毛を取り除き、ヨウ素とエタノールを交互に3サイクル塗布して皮膚を消毒し、ヨウ素で仕上げます。手術部位から脱毛することは、その場所で麻酔を維持する手段がある場合にのみ推奨されます。必要に応じて、アルコールに浸した綿の先端アプリケーターを使用して、頭の周囲のすぐ近くから髪を取り除きます。0.05 mLの局所鎮痛薬ブピバカイン(0.25%)を皮下注射します。.
- メスを使用して頭蓋骨を切開し、鋭利な外科用ハサミで皮膚の一部を切り取り、頭蓋骨を露出させます。綿棒を使用して皮膚を脇に押し、視界を遮っているすべての筋肉とその下にある組織から頭蓋骨をきれいにします。
注意: 偶発的な出血を止めるには、滅菌綿棒で出血部位が止まるまで圧力をかけます。 - 滅菌綿棒を使用して過酸化水素で頭蓋骨を洗浄し、頭蓋骨縫合糸とブレグマとラムダの両方が見えるようにします。
- 頭蓋骨を完全に乾かしてから、アプリケーターを使用してセルフエッチング歯科用接着剤を1滴塗布します。頭蓋骨にブラシをかけ、60秒待ってから、歯科用UVライトで40秒間硬化させます。光沢のある表面は、接着剤が頭蓋骨と効果的に架橋されていることを示します。
注意: この手順は、ヘッドセットを安全に取り付けるために重要です。 - 0.031インチのドリルビット(0.79 mm)を使用して、海馬の深さ電極(約5,000 rpm)を埋め込むために2つのバリ穴を両側に開けます。ラムダの後ろの小脳の上に参照電極用のバリ穴を1つ追加で開けます。
注意: ドリルをゆっくりと下げ、脳にドリルを開けないように注意してください。 - 電極の座標は次のとおりです(mm単位のブレグマから):後方3 mm、横方向3 mm、深さ3 mmの海馬電極。後方6 mm、外側0 mm、深さ0 mm(硬膜下)の小脳参照電極。
- 精度を上げるには、定位固定装置に取り付けられたドリルを使用し、ブレグマに触れるときに定位固定装置マニピュレータのX / Y軸をゼロにします-これが座標の基準点です。
- すべての電極を6ピンの台座に挿入し、ピンが台座に完全に押し込まれていることを確認して、ヘッドセットを組み立てます。台座を固定装置フレームの電極ホルダーに取り付けます(図1B)。
- 対応するバリ穴の上に電極を合わせます。ヘッドセットをゆっくりと下げ、電極をバリ穴に導くことにより、左右の海馬と参照電極を左右の海馬に撚り合わせたバイポーラステンレス鋼線電極を定位固定的に埋め込みます。
- 海馬ツイスト電極が穴の真上にある場合は、Z軸をゼロにし、ゆっくりと-3.0mmまで下げます。
- 頭蓋骨の表面と電極を歯科用セメントで覆い、頭蓋骨の表面と台座の底の間のスペースを埋めます。皮膚の縁は歯科用セメントに隣接しているため、下にある組織が露出したままになることはありません。セメントが乾いて固まるのを待ちます。次に、電極ホルダーを定位固定装置アームから取り外し、ホルダーを台座から取り外します。
- 鎮痛のために0.1 mLのケトプロフェン(1 mg / mL、SC)を注射し、水分補給のために0.5 mLのノルモゾール(SC)の2回目の投与を注射し、動物を脳定位固定装置フレームから取り出します。.
- ペーパータオルで覆われた空のビバリウムケージの中に37°Cに予熱した等温パッドを置きます。完全に目覚めたら、寝具と柔らかい食べ物の入ったきれいなケージに動物を置き、ビバリウムに戻します。動物は、お互いのヘッドセットを噛むのを防ぐために、この時点から単独で飼育されます。ワイヤーバーホッパーはヘッドセットが動かなくなるのを防ぐために使用されず、代わりにウォーターボトルがケージトップの下側に結び付けられ、チャウチャウが寝具に含まれています。
- 手術後72時間動物に柔らかい食べ物を与え、体重減少と体調スコアを監視します。脱水動物は、脱水された場合(体重減少、皮膚の膨満感の増加、沈んだ目)に0.5mLのノルモゾールを皮下投与することができる。ケトプロフェンは、手術後さらに2日間、1日1回皮下投与することができます(地域のIACUCガイドラインに従って鎮痛レジメンに従ってください)。動物がケージ内で4〜7日間完全に回復してから、EEG記録システムに移します。
3.電気キンドリングプロトコル
- マウスヘッドと整流子のソケットに適合するフレキシブルケーブルを使用して、マウスをEEG記録システムに接続します( 材料 リストを参照)。以下の電気刺激プロトコルに進む前に、動物を1日間順応させます。彼らの全体的な健康状態と順応を毎日監視し、病気、苦痛、および/または25%を超える継続的な体重減少の兆候がある場合は、システムからそれらを削除します
- 刺激電極から両方のリード線を定電流刺激装置の出力に接続します。
注:これらの電極をEEGレコーダーから刺激装置に切り替える回路基板があると非常に役立ちます。 - 刺激装置を、1秒の列車持続時間、50Hzで2msパルスを配信するように設定します。
- 刺激装置の出力を20マイクロアンペア(μA)に設定し、1番目の パルスを供給します。
- 電気刺激パルスよりも長持ちする高周波スパイクの特徴的な後放電についてEEGを監視します。
- 放電が観察されない場合は、アフター放電がトリガーされるまで、注入される電流量を20μA刻みで増やします。必要な電流量は、放電後スレッショルド(ADT)です。
- 標準的なADTは20〜50μAです。200μAに増加しても放電が観察されない場合は、高感度抵抗計を使用した電気接続とヘッドセット配線のトラブルシューティングが必要です。問題が刺激電極にある場合は、他の深さの電極で刺激してみてください。
- 動物は、そのマウスのADT値の1.5倍の電流を使用して、1日あたり2倍または6倍のいずれかを刺激することによってキンドリングされます。
- 状態の変化から両側性強直間代発作への落下を伴う刺激に対する行動反応を監視する。修正ラシーンクラスシステム11を用いたスコアリング。誘発された致命的な強直性発作を避けるために、連続した刺激が発作の重症度と長さを変更されたラシーンスコア6(ランニングとジャンプ)までエスカレートさせる場合は、キンドリングを一時停止する必要があります。
Access restricted. Please log in or start a trial to view this content.
結果
動物
このモデルはもともとVGAT-Creマウス(Slc32a1tm2(cre)Lowl/J)13 を混合バックグラウンドで使用して開発されました。ただし、C57BL / 6Jと同遺伝子のVGAT-Cre株にも適用されています。株間で発症するてんかんに違いは観察されていません。両方の株は、小胞性GABAトランスポータープロモーターの制御下でCreリコンビナーゼを発現する。これらのマウスは、
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この報告では、マウスの電気キンドリングがてんかんにつながるプロトコルについて説明します。刺激電極は海馬に配置されているため、これは患者の側頭葉てんかん(TLE)をモデル化する限局性大脳辺縁系てんかんです。このプロトコルにおける重要なステップは、VGAT-Creマウスを使用することであり、これは、 Vgat 遺伝子へのIRES-Creリコンビナーゼカセットの挿入に起因して、阻害性G...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は開示する矛盾はありません。
謝辞
著者らは、このプロトコルに関する有益な議論をしてくれたJohn Williamsonに感謝する。この作業は、NIH / NINDS助成金NS112549によってサポートされました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 16 Channel Extracellular Differential AC Amplifier (115V/60Hz) | AD Instruments | AM3500-115-60 | Alternate EEG amplifier |
| 363/CP PLUG COLLAR, PINS SLEEVE | P1 Technologies | 363SLEEVPIN0NL | For electrode holder |
| Cable, 363-363 5CM - 100CM W/MESH 6TCM | P1 Technologies | 363363XXXXCM004 | mouse-to-commutator cable |
| CCTV cameras Qcwox HD Sony IR LED | Sony | QC-SP316 | |
| Commutator SL6C/SB (single brush) | P1 Technologies | 8BSL6CSBC0MT | formerly Plastics One, Inc. |
| Current amplifier | A-M Systems | Model 2100 | |
| Dental cement | Stoelting | 51459 | |
| Drill bits, #75, OD 0.310" LOC 130 PT | Kyocera | 105-0210.310 | |
| E363/0 SOCKET CONTACT SKEWED | P1 Technologies | 8IE3630XXXXE | pins for connector |
| iBond Self Etch glue | Kulzer | CE0197 | |
| MS363 PEDESTAL 2298 6 PIN WHITE | P1 Technologies | 8K000229801F | EEG headset connector |
| Ohmeter | Simpson | 260 | High sensitivity |
| PowerLab 16/35 and LabChart Pro | AD Instruments | PL3516/P | Alternate EEG software |
| SomnoSuite | Kent Scientific Corp. | SS-01 | anesthesia unit & RightTemp monitoring |
| Stereotactic drill and micromotor kit | Foredom Electric Co. | K.1070 | |
| Stereotactic frame | David Kopf Instruments | Model 940 | |
| Teflon-coated wire for depth electrode, OD 0.008' | A-M Systems | 791400 | |
| VGAT-Cre mice on congenic C57BL/6J background | The Jackson Laboratory | 000664 |
参考文献
- Lekoubou, A., Bishu, K. G., Ovbiagele, B. Nationwide trends in medical expenditures among adults with epilepsy: 2003-2014. Journal of the Neurological Sciences. 384, 113-120 (2018).
- Hauser, W. A., Hesdorffer, D. C. Epilepsy: Frequency, Causes, and Consequences. Epilepsy Foundation of America. , (1990).
- Galanopoulou, A. S., et al. Identification of new epilepsy treatments: issues in preclinical methodology. Epilepsia. 53 (3), 571-582 (2012).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Buckmaster, P. S. Laboratory animal models of temporal lobe epilepsy. Comparative Medicine. 54 (5), 473-485 (2004).
- Levesque, M., Avoli, M., Bernard, C. Animal models of temporal lobe epilepsy following systemic chemoconvulsant administration. Journal of Neuroscience Methods. 260, 45-52 (2016).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Wang, L., Liu, Y. H., Huang, Y. G., Chen, L. W. Time-course of neuronal death in the mouse pilocarpine model of chronic epilepsy using Fluoro-Jade C staining. Brain Research. 1241, 157-167 (2008).
- Dey, D., et al. A potassium leak channel silences hyperactive neurons and ameliorates status epilepticus. Epilepsia. 55 (2), 203-213 (2014).
- Straub, J., et al. Characterization of kindled VGAT-Cre mice as a new animal model of temporal lobe epilepsy. Epilepsia. 61 (10), 11(2020).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biology. 8 (6), 1000412(2010).
- Vong, L., et al. Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron. 71 (1), 142-154 (2011).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, (2016).
- Lothman, E. W., Bertram, E. H., Bekenstein, J. W., Perlin, J. B. Self-sustaining limbic status epilepticus induced by 'continuous' hippocampal stimulation: electrographic and behavioral characteristics. Epilepsy Research. 3 (2), 107-119 (1989).
- Lothman, E. W., Williamson, J. M. Influence of electrical stimulus parameters on afterdischarge thresholds in the rat hippocampus. Epilepsy Research. 13 (3), 205-213 (1992).
- Lewczuk, E., et al. Electroencephalography and behavior patterns during experimental status epilepticus. Epilepsia. 59 (2), 369-380 (2018).
- Wenker, I. C., et al. Postictal death is associated with tonic phase apnea in a mouse model of sudden unexpected death in epilepsy. Annals of Neurology. 89 (5), 1023-1035 (2021).
- Morimoto, K., Fahnestock, M., Racine, R. J. Kindling and status epilepticus models of epilepsy: rewiring the brain. Progress in Neurobiology. 73 (1), 1-60 (2004).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved