A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנה והשתלה של אלקטרודות להצתה חשמלית של עכברי VGAT-Cre ליצירת מודל לאפילפסיה של האונה הרקתית
In This Article
Summary
דו"ח זה מתאר את השיטות ליצירת מודל של אפילפסיה של האונה הרקתית המבוסס על הצתה חשמלית של עכברי VGAT-Cre טרנסגניים. עכברי VGAT-Cre עשויים להיות שימושיים בקביעת הגורמים לאפילפסיה ולהקרנת טיפולים חדשניים.
Abstract
התגלה כי הצתה חשמלית של עכברי VGAT-Cre הובילה להתקפים מוטוריים ואלקטרוגרפיים ספונטניים. מאמר שפורסם לאחרונה התמקד באופן שבו עכברי VGAT-Cre ייחודיים שימשו בפיתוח התקפים חוזרים ספונטניים (SRS) לאחר הדלקה, ומנגנון סביר - החדרת Cre לגן VGAT - שיבש את ביטויו והפחית את הטון GABAergic. המחקר הנוכחי מרחיב את התצפיות הללו לקבוצה גדולה יותר של עכברים, תוך התמקדות בסוגיות מפתח כגון כמה זמן נמשך ה-SRS לאחר ההדלקה והשפעת המין והגיל של החיה. דוח זה מתאר את הפרוטוקולים עבור השלבים העיקריים הבאים: יצירת אוזניות עם אלקטרודות עומק בהיפוקמפוס לגירוי חשמלי ולקריאת האלקטרואנצפלוגרמה; ניתוח כדי להדביק את האוזנייה בבטחה על גולגולת העכבר כך שהוא לא נופל; ופרטים מרכזיים של פרוטוקול הדלקה חשמלית כגון משך הדופק, תדירות הרכבת, משך הרכבת וכמות הזרם המוזרק. פרוטוקול ההדלקה חזק בכך שהוא מוביל באופן אמין לאפילפסיה ברוב עכברי VGAT-Cre, ומספק מודל חדש לבדיקת תרופות אנטי-אפילפטוגניות חדשות.
Introduction
אפילפסיה היא הפרעה נוירולוגית גדולה עם נטל כלכלי ואנושי משמעותי. NINDS מעריך כי ישנם 3 מיליון אמריקאים עם אפילפסיה. כ-0.6 מיליון מהחולים האלה סובלים מאפילפסיה של האונה הרקתית (TLE)1. למרבה הצער, טיפול רפואי ב-TLE נכשל בשליש מהחולים בגלל חוסר יעילות, התפתחות עמידות לתרופות או חוסר סבילות לתופעות לוואי2. ברור שיש צורך משמעותי לפתח טיפולים חדשניים ל-TLE, מסקנה המשותפת לוועדת המדע הבסיסי של האגודה האמריקאית לאפילפסיה, קבוצת העבודה של הליגה הבינלאומית נגד אפילפסיה לגילוי תרופות פרה-קליניות לאפילפסיה, והמועצה הלאומית המייעצת להפרעות נוירולוגיות ושבץ מוחי 3,4.
מודלים עכשוויים של בעלי חיים של אפילפסיה של האונה הרקתית משתמשים בכימוקונפרכוסים (למשל, קאינאט, פילוקרפין) או בגירוי חשמלי ממושך כדי לגרום לאפילפטיקוס סטטוס ארוך טווח 5,6,7. בעלי חיים רבים מתים במהלך ההליך (10%-30% בחולדות, עד 90% בעכברים8). בעלי חיים ששורדים ומפתחים אפילפסיה מראים מוות עצבי נרחב ברחבי המוח 9,10. מוות זה מעורר שרשרת של תגובות, החל מהפעלת מיקרוגליה, אסטרוציטים ומונוציטים חודרים. תגובות עצביות כוללות ארגון מחדש של מעגלים (למשל, הנבטת סיבי טחב), לידה של תאי עצב חדשים שאינם מצליחים להשתלב כראוי במעגלים (למשל, תאי גרגיר חוץ רחמי), ושינויים מהותיים שמובילים לרגישות יתר (למשל, הגברת הוויסות של תעלות Na+). מודל אפילפסיה ללא מוות עצבי משמעותי יקל על החיפוש אחר תרופות אנטי-אפילפטיות חדשות.
בעת בחינת השערת GABA של אפילפסיה, התגלה כי טיפול בעכברי VGAT-Cre עם פרוטוקול הדלקה חשמלית קלה הוביל להתקפים מוטוריים ואלקטרוגרפיים ספונטניים11. באופן כללי, הדלקה חשמלית של מכרסמים אינה מובילה להתקפים ספונטניים המגדירים אפילפסיה, אם כי היא יכולה, במקרים של הדלקת יתר11. עכברי VGAT-Cre מבטאים Cre recombinase תחת שליטת הגן המוביל GABA שלפוחית (VGAT), אשר מתבטא באופן ספציפי בנוירונים מעכבי GABAergic. נמצא כי החדרת Cre שיבשה את הביטוי של VGAT ברמת ה-mRNA והחלבון, ובכך פגעה בשידור הסינפטי GABAergic בהיפוקמפוס. המסקנה הייתה כי עכברי VGAT-Cre עשויים להיות שימושיים לחקר המנגנונים המעורבים באפילפטוגנזה ולהקרנת טיפולים חדשניים11. הדו"ח הנוכחי מספק בפירוט את השיטות המשמשות ליצירת המודל.
Access restricted. Please log in or start a trial to view this content.
Protocol
השימוש בבעלי חיים פעל בהתאם להנחיות ARRIVE12 ואושר על ידי הוועדה לטיפול ושימוש בבעלי חיים של אוניברסיטת וירג'יניה.
1. יצירת אוזניות עם שתי אלקטרודות דו-קוטביות (איור 1)
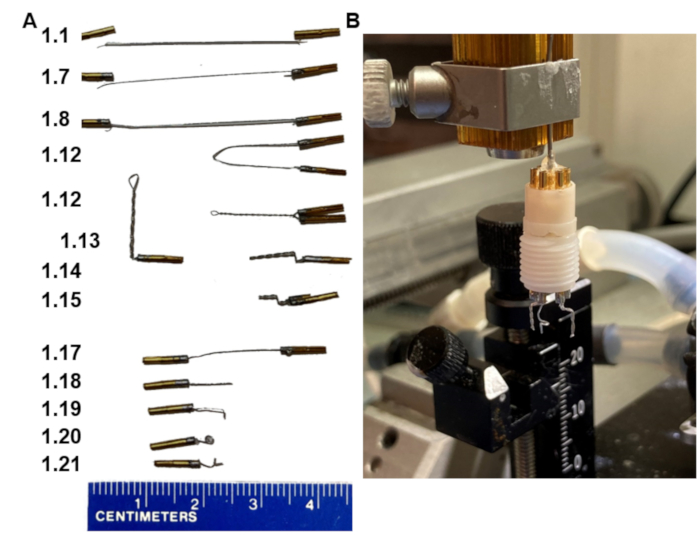
איור 1: שלבי מפתח בייצור אוזניות EEG. (A) הופעת האלקטרודות בשלבים השונים בפרוטוקול (מספרים בשלב ההתאמה השמאלי). (B) תמונה של המוצר הסופי המורכבת במחזיק תוצרת בית המתאים למסגרת הסטריאוטקסית. שימו לב, המחזיק מסתיים במכלול סיכות צווארון שמתאים למעמד האוזניות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- חותכים 3.5 ס"מ של חוט נירוסטה מצופה פוליטטרה-פלואוראתילן.
- הפשיטו כ-1 מ"מ ממעטפת הבידוד מהחוט משני קצותיו. אין להפשיט יותר מדי מהחוט.
- הניחו שני פינים על מחזיק ויזה כאשר החלק התחתון של הסיכה בעל חריץ ארוך יותר פונה כלפי מטה.
- יש למרוח את השטף על הקצוות המופשטים של החוט ועל החלק העליון של הפינים.
- פח את החלק המופשט של החוט עם מספיק הלחמה כדי לצפות אותו.
- הוסיפו כמות מינימלית של הלחמה לחלק העליון של הסיכה מבלי לגלוש לצדדים.
- הכניסו קצה אחד של הקצה המופשט של החוט לתוך הסיכה עמוק ככל שיאפשר בזמן שההלחמה נמסה.
הערה: יש חור צדדי שבו החוט יכול לצאת - אל תתנו לחוט לצאת מהסיכה. כל החוט שהופשט חייב להישאר בתוך הסיכה. - חזור על שלבים 1.6-1.7 עבור הסיכה השנייה, כעת עם הקצוות המופשטים האחרים של החוט.
- הניחו לפינים לשבת במשך 30 שניות, הוציאו אותם ממחזיק הוויזה ולאחר מכן משכו אותם כדי לוודא שהחיבור בין החוט לפינים חזק ומחזיק מעמד.
- יש לשטוף את הפינים במים קרים ולאחר מכן לייבש.
- ודא את המוליכות בין פין 1 לפין 2 באמצעות אוהממטר.
- הביאו את הפינים בקצות החוט יחד; החזיקו אותם במקביל ובקרוב. מהדקים המוסטאט למרכז החוט. לאחר מכן, סובב את hemostat, כך חוט מסתובב סביב עצמו די חזק. הסר את ההמוסטט.
- הדקו מלקחיים על החוט המעוות 2 מ"מ מתחת לפינים וכופפו את החוט ב-90°.
- דחפו את אותו חוט שוב 90° אחורה מעל המלקחיים וצרו כיפוף נוסף 1 מ"מ מהראשון.
- חתכו את החוט המעוות בזווית של 45° מתחת לכיפוף של 3.5 מ"מ בעזרת מספריים קטנים וחדים.
- הכינו שתיים מהאלקטרודות הדו-קוטביות הללו (פין כפול מעוות) לכל אוזנייה (אופציונלי, השנייה היא גיבוי במקרה של בעיות חשמל עם הראשונה).
- הכינו אלקטרודת ייחוס אחת על-ידי חיתוך חוט עם פינים מולחמים משני קצותיו לשניים (שלבים 1.1-1.17, איור 1A).
- חותכים את החוט ב 7 מ"מ.
- כופפו את הקצה 1 מ"מ מתחת לקצה.
- לאחר מכן, כסו את קצה החוט המכופף בקוטר 1 מ"מ במלקחיים וסובבו את החוט בחוזקה סביב המלקחיים ליצירת לולאה קטנה (קוטר 1 מ"מ).
- כופפו את הלולאה בניצב לחלק הישר של החוט כדי לגרום לקצה החוט להצביע שוב כלפי חוץ.
- הרכיבו את שתי האלקטרודות הדו-קוטביות ואת אלקטרודת הייחוס היחידה לתוך הכן בעל ששת הפינים באופן שהאלקטרודות הדו-קוטביות נמצאות זו לצד זו עם מרחק של 6 מ"מ ביניהן, ושאלקטרודת הייחוס ממוקמת בחור החיצוני האמצעי (איור 1B).
הערה: שיטה חלופית היא להשתיל את האלקטרודות, לקבע אותן במקומן ולאחר מכן להכניס את הפינים שלהן לתוך הדום.
2. השתלת אלקטרודה סטריאוטקסית
- לעקר את כל כלי הניתוח ואת הרכבת אלקטרודות שישה פינים על ידי autoclaving לפני הניתוח. יש לשמור על שדה כירורגי סטרילי במהלך הניתוח, ולהשתמש בכפפות כירורגיות סטריליות. וילונות סטריליים (למשל, Press n' Seal) מומלצים לכיסוי בעל החיים למעט אזור הניתוח.
- השתמש בעכברי VGAT-Cre בני 8 שבועות (תואמי גיל, זכר ונקבה כאחד) לניתוחים 4 שבועות לאחר הגמילה. רשום את משקל החיה לפני הניתוח כדי לאפשר מדידה של ירידה במשקל לאחר הניתוח.
- יש להשתמש במכשיר אידוי איזופלורן מוסמך או במערכת הרדמה בזרימה נמוכה המצוידת במשאבת מזרקים מדויקת, וופורייזר דיגיטלי משולב ומשטח חום משוב.
הערה: מערכות זרימה נמוכה מסוגלות לספק הרדמה בקצבי זרימה נמוכים ביחס לגודל בעל החיים לתוך תא אינדוקציה או דרך חרוט אף על המסגרת הסטריאוטקסית (70 מ"ל/דקה, ריכוז איזופלורן באוויר הוא 4% לאינדוקציה ו-2% לניתוח). שימוש בפחות הרדמה לא רק מועיל לבעל החיים במהלך ניתוחים, אלא גם מפחית את הסיכון לחשיפה של צוות המעבדה לאיזופלורן. - הניחו את בעל החיים המרדים על פד מחומם המחומם ל-37°C כדי לשמור על חום גופו במהלך הניתוח. אם אתם משתמשים במערכת טמפרטורה מבוקרת משוב, הכניסו את בדיקת הטמפרטורה המשומנת קלות לפי הטבעת של בעל החיים לצורך ניטור טמפרטורה במהלך הניתוח.
- הרכיבו את בעל החיים על המסגרת הסטריאוטקסית על ידי הצבת מוטות אוזניים עדינים לתוך האוזניים ואת השיניים העליונות הקדמיות לתוך מוט החותכת. הניחו את חרוט האף מעל האף לצורך הרדמה נכונה. יש לוודא שהראש מפולס וממורכז ולא ניתן להזיז אותו כאשר בוחנים אותו מעט.
- תת עורית להזריק 0.5 מ"ל של נורמוזול עבור הידרציה.
- יש למרוח חומר סיכה עיני למניעת התייבשות הקרנית.
- יש לעקוב אחר עומק ההרדמה על ידי היעדר רפלקס הנסיגה לאחר צביטת בוהן בגפה האחורית, ולאחר מכן להקטין את האיזופלורן ל 1.5%-2.0% במהלך הניתוח.
- הסר שיער באזור הניתוח ובסביבתו על ידי מריטה או שימוש בקוצץ (גילוח) או קרם דפילטורי, וחטא את העור בשלושה מחזורים של יישום לסירוגין של יוד ואתנול, תוך גימור יוד. הסרת שיער מאתר הניתוח מומלצת רק אם יש אמצעים לשמור על הרדמה באותו מקום. במידת הצורך, השתמשו באפליקטורים עם קצה כותנה טבולים באלכוהול כדי להסיר שיער מהאזור הקרוב סביב הראש. להזריק 0.05 מ"ל של משכך כאבים מקומי bupivacaine (0.25%) תת עורית.
- בצע חתך על הגולגולת באמצעות אזמל, ולאחר מכן לחתוך חלק של העור עם מספריים כירורגיים חדים, לחשוף את הגולגולת. דוחפים את העור הצידה, באמצעות צמר גפן, מנקים את הגולגולת מכל השרירים והרקמות שמתחתיה וחוסמים את הראייה.
הערה: כדי לעצור דימום בשוגג, יש להפעיל לחץ על אתר הדימום עם צמר גפן סטרילי עד להפסקתו. - נקו את הגולגולת במי חמצן באמצעות צמר גפן סטרילי כדי להפוך את תפרי הגולגולת ואת הברגמה והלמבדה לגלויים.
- יבשו היטב את הגולגולת, ולאחר מכן מרחו טיפה אחת של דבק דנטלי לחריטה עצמית באמצעות המוליך שלו. יש להבריש אותו לתוך הגולגולת, להמתין 60 שניות ולרפא עם אור UV דנטלי למשך 40 שניות. משטח מבריק מצביע על כך שהדבק הוצלב ביעילות עם הגולגולת.
הערה: שלב זה קריטי לחיבור מאובטח של האוזנייה. - השתמש במקדח בקוטר 0.031 אינץ' (0.79 מ"מ) כדי לקדוח שני חורי בור דו-צדדיים להשתלת אלקטרודות עומק בהיפוקמפוס (כ-5,000 סל"ד). קדח חור בור אחד נוסף עבור אלקטרודת הייחוס מעל המוח הקטן מאחורי הלמדא.
הערה: בעת הקידוח, יש להקפיד להוריד את המקדחה לאט ולהימנע מקידוח לתוך המוח. - הקואורדינטות עבור האלקטרודות הן כדלקמן (מברגמה במ"מ): אלקטרודות היפוקמפוס בעומק 3 מ"מ אחורי, 3 מ"מ רוחבי ועומק 3 מ"מ; ואלקטרודת ייחוס צרבלרית בעומק 6 מ"מ אחורי, 0 מ"מ רוחבי ו-0 מ"מ עומק (סובדורלי).
- כדי להגדיל את הדיוק, השתמש מקדחה רכוב סטריאוטקסית, אפס את ציר מניפולטור סטריאוטקסי X / Y כאשר נוגעים bregma - זוהי נקודת ההתייחסות עבור הקואורדינטות.
- הרכיבו אוזניות על ידי הכנסת כל האלקטרודות למעמד של שישה פינים, וודאו שהפינים נדחפים כל הדרך אל הדום. הרכיבו את הכן לתוך מחזיק האלקטרודות על מסגרת סטריאוטקסית (איור 1B).
- יישר אלקטרודות מעל חורי הבור המתאימים. השתלה סטריאוטקסית של אלקטרודות תיל דו-קוטביות מעוותות מפלדת אל-חלד בהיפוקמפוס הימני והשמאלי ואלקטרודת ייחוס לתוך המוח הקטן על ידי הנמכה איטית של האוזניות והנחיית האלקטרודות לתוך חורי הבור.
- כאשר אלקטרודת פיתול ההיפוקמפוס נמצאת ממש מעל החור, אפסו את ציר Z והורידו לאט לאט ל-3.0 מ"מ.
- מכסים את משטח הגולגולת והאלקטרודות במלט דנטלי וממלאים את החלל שבין משטח הגולגולת לתחתית הדום. קצוות העור יהיו צמודים לצמנט הדנטלי כך שאף רקמה תחתיו לא תישאר חשופה. מחכים שהמלט יתייבש ויתקשה. לאחר מכן נתק את מחזיק האלקטרודה מהזרוע הסטריאוטקסית והסר את המחזיק מהכן.
- להזריק 0.1 מ"ל של ketoprofen (1 מ"ג / מ"ל, SC) עבור שיכוך כאבים ומנה שנייה של 0.5 מ"ל של normosol (SC) עבור הידרציה ולהסיר את החיה מן המסגרת סטריאוטקסית.
- הניחו פד איזותרמי שחומם מראש ל-37°C בתוך כלוב ויבריום ריק מכוסה במגבת נייר. ברגע שהוא ער לחלוטין, הניחו את בעל החיים בכלוב נקי עם מצעים ומזון רך, והחזירו אותו לוויבריום. בעלי חיים שוכנים בנפרד מנקודה זו ואילך כדי למנוע לעיסה זה של אוזניות של זה. לא משתמשים במוטות תיל כדי למנוע מהאוזניות להיתקע, ובמקום זאת, בקבוקי מים קשורים לחלק התחתון של צמרות הכלוב, וצ'או נמצא במצעים.
- האכילו את בעל החיים במזון רך במשך 72 שעות לאחר הניתוח, ועקבו אחר ירידה במשקל וציון מצב הגוף. בעלי חיים מיובשים עשויים להיות מנוהלים 0.5 מ"ל של נורמוסול תת עורית אם מיובשים (ירידה במשקל, טורגור עור מוגבר, עיניים שקועות). Ketoprofen ניתן לתת תת עורית פעם ביום במשך 2 ימים נוספים לאחר הניתוח (בצע את משטר שיכוך כאבים על פי הנחיות IACUC המקומי). לאפשר לבעלי חיים להתאושש באופן מלא בכלובים שלהם במשך 4-7 ימים לפני העברתם למערכת רישום EEG.
3. פרוטוקול הדלקה חשמלית
- חבר את העכברים למערכת הקלטת EEG באמצעות כבל גמיש המתאים לשקעים בראש העכבר ובקומוטטור (ראה רשימת חומרים ). אפשרו לבעלי החיים להתאקלם במשך יום אחד לפני שהמשיכו בפרוטוקול הגירוי החשמלי להלן. לעקוב אחר בריאותם הכללית והתאקלמותם על בסיס יומי, ולהוציאם מהמערכת כאשר ישנם סימני מחלה, מצוקה ו/או ירידה מתמשכת במשקל הגוף העולה על 25%
- חבר את שני המובילים מהאלקטרודה המגרה לפלט של מגרה זרם קבוע.
הערה: מועיל מאוד שיהיה לוח מעגלים שמעביר את האלקטרודות האלה ממקליט ה-EEG ומהמגרה. - הגדר את הממריץ לספק פולסים של 1ms ב- 50 Hz למשך רכבת של 2 שניות.
- הגדר את הפלט של הממריץ על 20 מיקרואמפר (μA) וספק את הדופקהראשון st .
- עקוב אחר ה- EEG עבור פריקה אופיינית לאחר פריקה של קוצים בתדר גבוה המחזיקים מעמד מעבר לדופק הגירוי החשמלי.
- אם לא נצפתה פריקה, הגדל את כמות הזרם המוזרק במרווחים של 20 μA עד להפעלת פריקה שלאחר מכן. כמות הזרם הנדרשת היא סף לאחר פריקה (ADT).
- ADT טיפוסי הוא 20-50 μA. אם לא נצפתה פריקה גם לאחר הגדלת ל 200 μA, אז פתרון בעיות חיבורי חשמל חיווט אוזניות עם אומטר רגישות גבוהה נדרש. אם הבעיה היא באלקטרודה המעוררת, נסה לגרות עם אלקטרודות העומק האחרות.
- בעלי חיים נדלקים על ידי גירוי 2x או 6x ליום באמצעות זרם שהוא פי 1.5 מערך ADT עבור עכבר זה.
- עקוב אחר התגובה ההתנהגותית לגירוי, העולה משינוי המצב להתקפים טוניים-קלוניים דו-צדדיים עם נפילה. ניקוד באמצעות מערכת כיתה ראסין שונה11. כדי להימנע מהתקפי טוניק קטלניים, יש להשהות את ההדלקה אם גירויים רצופים מובילים להסלמה בחומרת ההתקפים ובאורך עד לציון ראסין שונה 6 (ריצה וקפיצה)
Access restricted. Please log in or start a trial to view this content.
תוצאות
חיות
המודל פותח במקור באמצעות עכברי VGAT-Cre (Slc32a1tm2(cre)Lowl/J)13 על רקע מעורב. עם זאת, הוא יושם גם על זן VGAT-Cre שהוא קונגני עם C57BL/6J. לא נצפה הבדל באפילפסיה המתפתחת בין הזנים. שני הזנים מבטאים Cre recombinase תחת שליטה של מקדם טרנספורטר GABA שלפוחיתית. עכברים אלה נוצרו על ידי דפיקות ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
דו"ח זה מתאר פרוטוקול שבו הצתה חשמלית של עכברים מובילה לאפילפסיה. מאחר שהאלקטרודה המגרה ממוקמת בהיפוקמפוס, זוהי אפילפסיה לימבית מוקדית המדמה אפילפסיה של האונה הרקתית (TLE) בחולים. שלב קריטי בפרוטוקול זה הוא להשתמש בעכברי VGAT-Cre, אשר עקב החדרת קלטת IRES-Cre recombinase בגן Vgat , מראה זרמי GABA מעכבים ל?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין קונפליקטים לחשוף.
Acknowledgements
המחברים מודים לג'ון ויליאמסון על דיונים מועילים על פרוטוקול זה. עבודה זו נתמכה על ידי מענק NIH/NINDS NS112549.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 16 Channel Extracellular Differential AC Amplifier (115V/60Hz) | AD Instruments | AM3500-115-60 | Alternate EEG amplifier |
| 363/CP PLUG COLLAR, PINS SLEEVE | P1 Technologies | 363SLEEVPIN0NL | For electrode holder |
| Cable, 363-363 5CM - 100CM W/MESH 6TCM | P1 Technologies | 363363XXXXCM004 | mouse-to-commutator cable |
| CCTV cameras Qcwox HD Sony IR LED | Sony | QC-SP316 | |
| Commutator SL6C/SB (single brush) | P1 Technologies | 8BSL6CSBC0MT | formerly Plastics One, Inc. |
| Current amplifier | A-M Systems | Model 2100 | |
| Dental cement | Stoelting | 51459 | |
| Drill bits, #75, OD 0.310" LOC 130 PT | Kyocera | 105-0210.310 | |
| E363/0 SOCKET CONTACT SKEWED | P1 Technologies | 8IE3630XXXXE | pins for connector |
| iBond Self Etch glue | Kulzer | CE0197 | |
| MS363 PEDESTAL 2298 6 PIN WHITE | P1 Technologies | 8K000229801F | EEG headset connector |
| Ohmeter | Simpson | 260 | High sensitivity |
| PowerLab 16/35 and LabChart Pro | AD Instruments | PL3516/P | Alternate EEG software |
| SomnoSuite | Kent Scientific Corp. | SS-01 | anesthesia unit & RightTemp monitoring |
| Stereotactic drill and micromotor kit | Foredom Electric Co. | K.1070 | |
| Stereotactic frame | David Kopf Instruments | Model 940 | |
| Teflon-coated wire for depth electrode, OD 0.008' | A-M Systems | 791400 | |
| VGAT-Cre mice on congenic C57BL/6J background | The Jackson Laboratory | 000664 |
References
- Lekoubou, A., Bishu, K. G., Ovbiagele, B. Nationwide trends in medical expenditures among adults with epilepsy: 2003-2014. Journal of the Neurological Sciences. 384, 113-120 (2018).
- Hauser, W. A., Hesdorffer, D. C. Epilepsy: Frequency, Causes, and Consequences. Epilepsy Foundation of America. , (1990).
- Galanopoulou, A. S., et al. Identification of new epilepsy treatments: issues in preclinical methodology. Epilepsia. 53 (3), 571-582 (2012).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Buckmaster, P. S. Laboratory animal models of temporal lobe epilepsy. Comparative Medicine. 54 (5), 473-485 (2004).
- Levesque, M., Avoli, M., Bernard, C. Animal models of temporal lobe epilepsy following systemic chemoconvulsant administration. Journal of Neuroscience Methods. 260, 45-52 (2016).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Wang, L., Liu, Y. H., Huang, Y. G., Chen, L. W. Time-course of neuronal death in the mouse pilocarpine model of chronic epilepsy using Fluoro-Jade C staining. Brain Research. 1241, 157-167 (2008).
- Dey, D., et al. A potassium leak channel silences hyperactive neurons and ameliorates status epilepticus. Epilepsia. 55 (2), 203-213 (2014).
- Straub, J., et al. Characterization of kindled VGAT-Cre mice as a new animal model of temporal lobe epilepsy. Epilepsia. 61 (10), 11(2020).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biology. 8 (6), 1000412(2010).
- Vong, L., et al. Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron. 71 (1), 142-154 (2011).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, (2016).
- Lothman, E. W., Bertram, E. H., Bekenstein, J. W., Perlin, J. B. Self-sustaining limbic status epilepticus induced by 'continuous' hippocampal stimulation: electrographic and behavioral characteristics. Epilepsy Research. 3 (2), 107-119 (1989).
- Lothman, E. W., Williamson, J. M. Influence of electrical stimulus parameters on afterdischarge thresholds in the rat hippocampus. Epilepsy Research. 13 (3), 205-213 (1992).
- Lewczuk, E., et al. Electroencephalography and behavior patterns during experimental status epilepticus. Epilepsia. 59 (2), 369-380 (2018).
- Wenker, I. C., et al. Postictal death is associated with tonic phase apnea in a mouse model of sudden unexpected death in epilepsy. Annals of Neurology. 89 (5), 1023-1035 (2021).
- Morimoto, K., Fahnestock, M., Racine, R. J. Kindling and status epilepticus models of epilepsy: rewiring the brain. Progress in Neurobiology. 73 (1), 1-60 (2004).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved