Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation et implantation d’électrodes pour allumer électriquement des souris VGAT-Cre afin de générer un modèle pour l’épilepsie du lobe temporal
Dans cet article
Résumé
Ce rapport décrit les méthodes permettant de générer un modèle d’épilepsie du lobe temporal basé sur l’allumage électrique de souris transgéniques VGAT-Cre. Les souris VGAT-Cre allumées peuvent être utiles pour déterminer les causes de l’épilepsie et pour dépister de nouvelles thérapies.
Résumé
Il a été découvert que l’allumage électrique des souris VGAT-Cre a conduit aux crises spontanées motrices et électrographiques. Un article récent s’est concentré sur la façon dont les souris VGAT-Cre uniques ont été utilisées dans le développement de crises spontanées récurrentes (SRS) après l’allumage et un mécanisme probable - l’insertion de Cre dans le gène VGAT - a perturbé son expression et réduit le tonus GABAergique. La présente étude étend ces observations à une plus grande cohorte de souris, en se concentrant sur des questions clés telles que la durée du SRS après l’allumage et l’effet du sexe et de l’âge de l’animal. Ce rapport décrit les protocoles pour les étapes clés suivantes : fabrication de casques avec des électrodes de profondeur hippocampiques pour la stimulation électrique et pour la lecture de l’électroencéphalogramme; chirurgie pour fixer solidement le casque sur le crâne de la souris afin qu’il ne tombe pas; et les détails clés du protocole d’allumage électrique tels que la durée de l’impulsion, la fréquence du train, la durée du train et la quantité de courant injecté. Le protocole d’allumage est robuste en ce sens qu’il conduit de manière fiable à l’épilepsie chez la plupart des souris VGAT-Cre, fournissant un nouveau modèle pour tester de nouveaux médicaments antiépileptogènes.
Introduction
L’épilepsie est un trouble neurologique majeur qui entraîne des charges économiques et humaines importantes. NINDS estime qu’il y a 3 millions d’Américains atteints d’épilepsie. Environ 0,6 million de ces patients souffrent d’épilepsie du lobe temporal (EAL)1. Malheureusement, le traitement médical du TLE échoue chez un tiers des patients en raison de l’inefficacité, du développement d’une résistance aux médicaments ou d’une intolérance aux effets secondaires2. De toute évidence, il existe un besoin important de développer de nouvelles thérapies pour le TLE, une conclusion partagée par le comité scientifique fondamental de l’American Epilepsy Society, le groupe de travail de la Ligue internationale contre l’épilepsie pour la découverte de médicaments précliniques contre l’épilepsie et le National Advisory Neurological Disorders and Stroke Council 3,4.
Les modèles animaux actuels d’épilepsie du lobe temporal utilisent soit des chimioconvulsivants (p. ex. kainate, pilocarpine), soit une stimulation électrique prolongée pour induire un état de mal épileptique de longue durée 5,6,7. De nombreux animaux meurent pendant la procédure (10% à 30% chez le rat, jusqu’à 90% chez la souris8). Les animaux qui survivent et développent l’épilepsie montrent une mort neuronale étendue dans tout le cerveau 9,10. Cette mort déclenche une cascade de réponses, à commencer par l’activation de la microglie, des astrocytes et des monocytes infiltrants. Les réponses neuronales comprennent la réorganisation des circuits (p. ex., germination de fibres moussues), la naissance de nouveaux neurones qui ne s’intègrent pas correctement dans les circuits (p. ex., les cellules granulaires ectopiques) et les changements intrinsèques qui conduisent à l’hyperexcitabilité (p. ex. régulation positive des canaux Na+). Un modèle d’épilepsie sans mort neuronale significative facilitera la recherche de nouveaux médicaments antiépileptiques.
En testant l’hypothèse GABA de l’épilepsie, il a été découvert que le traitement des souris VGAT-Cre avec un protocole d’allumage électrique doux conduisait aux crises spontanées motrices et électrographiques11. En général, l’allumage électrique des rongeurs ne conduit pas à des crises spontanées qui définissent l’épilepsie, bien qu’il le puisse, en cas de surallumage11. Les souris VGAT-Cre expriment la Cre recombinase sous le contrôle du gène du transporteur GABA vésiculaire (VGAT), qui est spécifiquement exprimé dans les neurones inhibiteurs GABAergiques. Il a été constaté que l’insertion de Cre perturbait l’expression de VGAT au niveau de l’ARNm et des protéines, altérant ainsi la transmission synaptique GABAergique dans l’hippocampe. Il a été conclu que les souris allumées VGAT-Cre pourraient être utiles pour étudier les mécanismes impliqués dans l’épileptogenèse et pour le criblage de nouveaux traitements11. Le présent rapport décrit en détail les méthodes utilisées pour générer le modèle.
Protocole
L’utilisation des animaux a suivi les directives ARRIVE12 et a été approuvée par le Comité de soin et d’utilisation des animaux de l’Université de Virginie.
1. Fabrication de casques avec deux électrodes bipolaires (Figure 1)
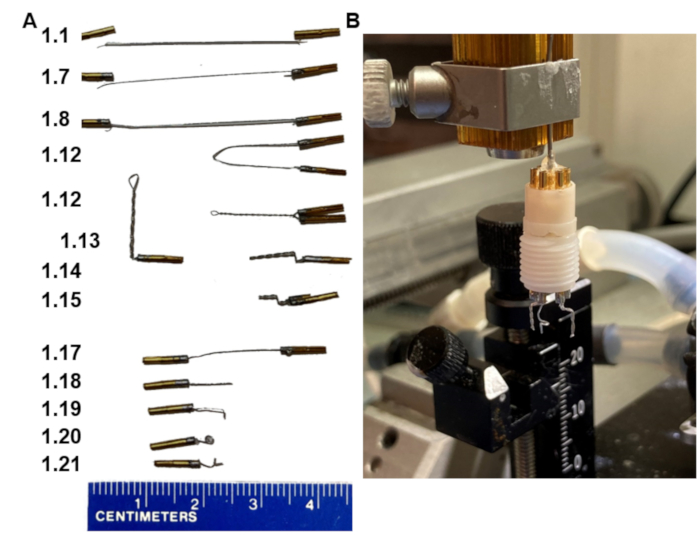
Figure 1 : Étapes clés de la fabrication d’un casque EEG. (A) Apparition des électrodes aux différentes étapes du protocole (nombres dans l’étape de correspondance de gauche). (B) Une image du produit final monté dans un support fait maison qui s’adapte au cadre stéréotaxique. Notez que le support se termine par un ensemble de goupille de collier qui s’insère dans le piédestal du casque. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Couper 3,5 cm de fil d’acier inoxydable revêtu de polytétrafluoroéthylène.
- Enlevez environ 1 mm de la couche isolante du fil aux deux extrémités. Ne pas avoir trop de fil dénudé.
- Placez deux broches sur un support d’étau avec la partie inférieure de la broche qui a une fente plus longue vers le bas.
- Appliquez le flux sur les extrémités dénudées du fil et sur le dessus des broches.
- Étaler la partie dénudée du fil avec juste assez de soudure pour l’enduire.
- Ajoutez une quantité minimale de soudure au sommet de la broche sans déborder sur les côtés.
- Placez une extrémité des extrémités dénudées du fil dans la broche aussi profondément que possible pendant que la soudure est fondue.
REMARQUE: Il y a un trou latéral où le fil peut sortir - ne laissez pas le fil sortir de la broche. Tout le fil dénudé doit rester à l’intérieur de la broche. - Répétez les étapes 1.6 à 1.7 pour la deuxième broche, maintenant avec les autres extrémités dénudées du fil.
- Laissez les broches reposer pendant 30 secondes pour les fixer, retirez-les du support d’étau, puis tirez-les dessus pour vous assurer que la connexion entre le fil et les broches est solide et tient.
- Rincez les broches à l’eau froide, puis séchez-les.
- Vérifiez la conductance entre la broche 1 et la broche 2 à l’aide d’un ohmmètre.
- Rapprochez les broches aux extrémités du fil; Tenez-les parallèles et proches. Serrez un hémostatique au centre du fil. Ensuite, tournez l’hémostatique, de sorte que le fil se tord autour de lui-même assez serré. Retirez l’hémostatique.
- Serrez une pince sur le fil torsadé à 2 mm sous les broches et pliez le fil à 90°.
- Repoussez le même fil de 90° sur la pince en créant un autre virage à 1 mm du premier.
- Couper le fil torsadé à un angle de 45° sous le pli à 3,5 mm avec de petits ciseaux tranchants.
- Préparez deux de ces électrodes bipolaires (à double broche torsadée) pour chaque casque (en option, la seconde est de secours en cas de problèmes électriques avec le premier).
- Préparez une seule électrode de référence en coupant un fil avec des broches soudées aux deux extrémités en deux (étapes 1.1-1.17, Figure 1A).
- Couper le fil à 7 mm.
- Plier l’extrémité 1 mm au-dessous de la pointe.
- Ensuite, couvrez l’extrémité pliée de 1 mm du fil avec une pince et faites pivoter le fil autour de la pince pour créer une petite boucle (1 mm de diamètre).
- Pliez la boucle perpendiculairement à la partie droite du fil pour que la pointe du fil pointe à nouveau vers l’extérieur.
- Assemblez les deux électrodes bipolaires et l’électrode de référence unique dans le piédestal à six broches de manière à ce que les électrodes bipolaires soient côte à côte avec une distance de 6 mm entre elles et que l’électrode de référence soit placée dans le trou extérieur du milieu (Figure 1B).
REMARQUE: Une autre méthode consiste à implanter les électrodes, à les cimenter en place, puis à insérer leurs broches dans le piédestal.
2. Implantation d’électrodes stéréotaxiques
- Stérilisez tous les outils chirurgicaux et l’ensemble électrode à six broches par autoclavage avant la chirurgie. Un champ chirurgical stérile doit être maintenu pendant la chirurgie et des gants chirurgicaux stériles doivent être utilisés. Des champs stériles (p. ex., Press n’Seal) sont recommandés pour couvrir l’animal, à l’exception de la zone chirurgicale.
- Utilisez des souris VGAT-Cre âgées de 8 semaines (appariées selon l’âge, mâles et femelles) pour les chirurgies 4 semaines après le sevrage. Enregistrer le poids de l’animal avant la chirurgie pour permettre la mesure de la perte de poids post-chirurgicale.
- Utilisez un vaporisateur d’isoflurane certifié ou un système d’anesthésie à faible débit équipé d’une pompe à seringue de précision, d’un vaporisateur numérique intégré et d’un coussin chauffant à rétroaction.
REMARQUE : Les systèmes à faible débit sont capables d’administrer l’anesthésie à de faibles débits proportionnels à la taille de l’animal dans une chambre d’induction ou à travers un cône nasal sur le cadre stéréotaxique (70 mL/min, la concentration d’isoflurane dans l’air est de 4 % pour l’induction et de 2 % pour la chirurgie). L’utilisation de moins d’anesthésie profite non seulement à l’animal pendant les chirurgies, mais réduit également le risque d’exposition du personnel de laboratoire à l’isoflurane. - Placez l’animal anesthésié sur un coussin chauffant chauffé à 37 °C pour le garder au chaud pendant la chirurgie. Si vous utilisez un système de température contrôlée par rétroaction, insérez la sonde de température légèrement lubrifiée dans le rectum de l’animal pour surveiller la température pendant la chirurgie.
- Montez l’animal sur le cadre stéréotaxique en plaçant doucement les barres d’oreille dans les oreilles et les dents supérieures antérieures dans la barre d’incisive. Placez le cône nasal sur le nez pour une anesthésie appropriée. Assurez-vous que la tête est nivelée et centrée et ne peut pas être déplacée lorsqu’elle est légèrement sondée.
- Injecter par voie sous-cutanée 0,5 mL de normosol pour l’hydratation.
- Appliquez du lubrifiant oculaire pour prévenir le dessèchement de la cornée.
- Surveillez la profondeur de l’anesthésie par l’absence du réflexe de retrait après avoir pincé un orteil du membre postérieur, puis diminuez l’isoflurane à 1,5%-2,0% pendant la chirurgie.
- Enlevez les poils au niveau et autour de la zone chirurgicale en arrachant ou en utilisant des tondeuses (rasage) ou de la crème dépilatoire, et désinfectez la peau avec trois cycles d’application alternée d’iode et d’éthanol, en terminant avec de l’iode. L’élimination des poils loin du site chirurgical n’est recommandée que s’il existe des moyens de maintenir l’anesthésie à cet endroit. Si nécessaire, utilisez des applicateurs à pointe de coton trempés dans de l’alcool pour enlever les poils de la zone immédiate entourant la tête. Injecter 0,05 mL de bupivacaïne analgésique locale (0,25%) par voie sous-cutanée.
- Faites une incision sur le crâne à l’aide d’un scalpel, puis découpez une partie de la peau avec des ciseaux chirurgicaux tranchants, exposant le crâne. En poussant la peau de côté, à l’aide d’un coton-tige, nettoyez le crâne de tous les muscles et tissus sous-jacents obstruant la vue.
REMARQUE: Pour arrêter le saignement accidentel, appliquez une pression sur le site de saignement avec un coton-tige stérile jusqu’à ce qu’il cesse. - Nettoyez le crâne avec du peroxyde d’hydrogène à l’aide de cotons-tiges stériles pour rendre visibles les sutures du crâne et le bregma et le lambda.
- Séchez soigneusement le crâne, puis appliquez une goutte d’adhésif dentaire auto-gravé à l’aide de son applicateur. Brossez-le dans le crâne, attendez 60 s et durcissez avec une lumière UV dentaire pendant 40 s. Une surface brillante indique que l’adhésif a été efficacement réticulé avec le crâne.
REMARQUE: Cette étape est essentielle pour la fixation sécurisée du casque. - Utilisez un foret de 0,031 po (0,79 mm) pour percer bilatéralement deux trous de bavure pour l’implantation d’électrodes de profondeur de l’hippocampe (environ 5 000 tr/min). Percez un trou de bavure supplémentaire pour l’électrode de référence au-dessus du cervelet derrière le lambda.
REMARQUE: Lors du forage, prenez soin d’abaisser la perceuse lentement et d’éviter de percer dans le cerveau. - Les coordonnées des électrodes sont les suivantes (à partir de bregma en mm): électrodes hippocampiques à 3 mm postérieur, 3 mm latérales et 3 mm de profondeur; et électrode de référence cérébelleuse à 6 mm postérieur, 0 mm latérale et 0 mm de profondeur (sous-durale).
- Pour augmenter la précision, utilisez une perceuse montée en stéréotaxie, mettez à zéro l’axe X / Y du manipulateur stéréotaxique lorsque vous touchez le bregma - c’est le point de référence pour les coordonnées.
- Assemblez un casque en insérant toutes les électrodes dans le piédestal à six broches, en vous assurant que les broches sont enfoncées dans le piédestal. Montez le piédestal dans le porte-électrode sur un cadre stéréotaxique (Figure 1B).
- Alignez les électrodes au-dessus des trous de bavure correspondants. Implantez stéréotaxiquement des électrodes bipolaires en acier inoxydable torsadées dans l’hippocampe droit et gauche et une électrode de référence dans le cervelet en abaissant lentement le casque et en guidant les électrodes dans les trous de bavure.
- Lorsque l’électrode de torsion de l’hippocampe est juste au-dessus du trou, mettez à zéro l’axe Z et abaissez lentement jusqu’à -3,0 mm.
- Couvrez la surface du crâne et les électrodes avec du ciment dentaire et remplissez l’espace entre la surface du crâne et le bas du piédestal. Les bords de la peau seront adjacents au ciment dentaire de sorte qu’aucun tissu sous-jacent ne restera exposé. Attendez que le ciment sèche et durcisse. Ensuite, détachez le porte-électrode du bras stéréotaxique et retirez le support du piédestal.
- Injecter 0,1 mL de kétoprofène (1 mg/mL, SC) pour l’analgésie et une deuxième dose de 0,5 mL de normosol (SC) pour l’hydratation et retirer l’animal du cadre stéréotaxique.
- Placez un tampon isotherme préchauffé à 37 °C dans une cage vide recouverte d’une serviette en papier. Une fois qu’il est complètement réveillé, placez l’animal dans une cage propre avec de la litière et de la nourriture molle, et remettez-le dans le vivarium. Les animaux sont logés individuellement à partir de ce moment pour éviter de mâcher les casques les uns des autres. Les trémies de barre métallique ne sont pas utilisées pour éviter que les casques ne restent coincés, et au lieu de cela, les bouteilles d’eau sont attachées à la face inférieure des dessus de la cage, et du chow est présent dans la literie.
- Nourrissez l’animal avec de la nourriture molle pendant 72 heures après la chirurgie et surveillez la perte de poids et le score d’état corporel. Les animaux déshydratés peuvent recevoir 0,5 mL de normosol par voie sous-cutanée s’ils sont déshydratés (perte de poids, augmentation de la turgescence cutanée, yeux enfoncés). Le kétoprofène peut être administré par voie sous-cutanée une fois par jour pendant 2 jours supplémentaires après la chirurgie (suivez le schéma analgésique conformément aux directives locales de l’IACUC). Permettre aux animaux de récupérer complètement dans leurs cages pendant 4 à 7 jours avant d’être transférés dans le système d’enregistrement EEG.
3. Protocole d’allumage électrique
- Connectez les souris au système d’enregistrement EEG à l’aide d’un câble flexible qui s’adapte aux prises de la tête de souris et du collecteur (voir la liste des matériaux ). Laissez les animaux s’acclimater pendant une journée avant de procéder au protocole de stimulation électrique ci-dessous. Surveiller quotidiennement leur état de santé général et leur acclimatation et les retirer du système lorsqu’il y a des signes de maladie, de détresse et / ou de perte de poids corporelle continue supérieure à 25%
- Connectez les deux fils de l’électrode stimulante à la sortie d’un stimulateur à courant constant.
REMARQUE: Il est très utile d’avoir une carte de circuit imprimé qui commute ces électrodes de l’enregistreur EEG vers le stimulateur. - Réglez le stimulateur pour qu’il délivre des impulsions de 1 ms à 50 Hz pendant une durée de train de 2 s.
- Réglez la sortie du stimulateur à 20 microampères (μA) et délivrez la1ère impulsion .
- Surveillez l’EEG pour une post-décharge caractéristique de pointes à haute fréquence qui durent plus longtemps que l’impulsion de stimulation électrique.
- Si aucune décharge n’est observée, augmenter la quantité de courant injectée par incréments de 20 μA jusqu’à ce qu’une décharge postérieure soit déclenchée. La quantité de courant requise est le seuil après décharge (TDA).
- Les TEA typiques sont de 20 à 50 μA. Si aucune décharge n’est observée, même après une augmentation à 200 μA, le dépannage des connexions électriques et du câblage du casque avec un ohmmètre haute sensibilité est nécessaire. Si le problème est dans l’électrode stimulante, essayez de stimuler avec les autres électrodes de profondeur.
- Les animaux sont allumés en stimulant 2x ou 6x par jour en utilisant un courant qui est 1,5x la valeur ADT pour cette souris.
- Surveillez la réponse comportementale à la stimulation, qui passe du changement d’état aux crises tonico-cloniques bilatérales avec chute. Score à l’aide d’un système de classes Racine modifié11. Pour éviter les crises toniques mortelles évoquées, l’allumage doit être interrompu si des stimuli successifs entraînent une augmentation de la gravité et de la durée des crises jusqu’au score de Racine modifié de 6 (course et saut)
Résultats
Animaux
Le modèle a été développé à l’origine en utilisant des souris VGAT-Cre (Slc32a1tm2(cre)Lowl/J)13 sur fond mixte. Cependant, il a également été appliqué à la souche VGAT-Cre qui est congénique avec C57BL/6J. Aucune différence n’a été observée dans l’épilepsie qui se développe entre les souches. Les deux souches expriment la Cre recombinase sous le contrôle du promoteur transporteur vésiculaire GABA. Ces souris ont été générées en...
Discussion
Ce rapport décrit un protocole où l’allumage électrique de souris conduit à l’épilepsie. Puisque l’électrode stimulante est placée dans l’hippocampe, il s’agit d’une épilepsie limbique focale qui modélise l’épilepsie du lobe temporal (TLE) chez les patients. Une étape critique de ce protocole consiste à utiliser des souris VGAT-Cre qui, en raison de l’insertion d’une cassette de recombinase IRES-Cre dans le gène Vgat , présentent des courants GABA inhibiteurs altérés
Déclarations de divulgation
Les auteurs n’ont aucun conflit à révéler.
Remerciements
Les auteurs remercient John Williamson pour ses discussions utiles sur ce protocole. Ce travail a été soutenu par la subvention NS112549 des NIH/NINDS.
matériels
| Name | Company | Catalog Number | Comments |
| 16 Channel Extracellular Differential AC Amplifier (115V/60Hz) | AD Instruments | AM3500-115-60 | Alternate EEG amplifier |
| 363/CP PLUG COLLAR, PINS SLEEVE | P1 Technologies | 363SLEEVPIN0NL | For electrode holder |
| Cable, 363-363 5CM - 100CM W/MESH 6TCM | P1 Technologies | 363363XXXXCM004 | mouse-to-commutator cable |
| CCTV cameras Qcwox HD Sony IR LED | Sony | QC-SP316 | |
| Commutator SL6C/SB (single brush) | P1 Technologies | 8BSL6CSBC0MT | formerly Plastics One, Inc. |
| Current amplifier | A-M Systems | Model 2100 | |
| Dental cement | Stoelting | 51459 | |
| Drill bits, #75, OD 0.310" LOC 130 PT | Kyocera | 105-0210.310 | |
| E363/0 SOCKET CONTACT SKEWED | P1 Technologies | 8IE3630XXXXE | pins for connector |
| iBond Self Etch glue | Kulzer | CE0197 | |
| MS363 PEDESTAL 2298 6 PIN WHITE | P1 Technologies | 8K000229801F | EEG headset connector |
| Ohmeter | Simpson | 260 | High sensitivity |
| PowerLab 16/35 and LabChart Pro | AD Instruments | PL3516/P | Alternate EEG software |
| SomnoSuite | Kent Scientific Corp. | SS-01 | anesthesia unit & RightTemp monitoring |
| Stereotactic drill and micromotor kit | Foredom Electric Co. | K.1070 | |
| Stereotactic frame | David Kopf Instruments | Model 940 | |
| Teflon-coated wire for depth electrode, OD 0.008' | A-M Systems | 791400 | |
| VGAT-Cre mice on congenic C57BL/6J background | The Jackson Laboratory | 000664 |
Références
- Lekoubou, A., Bishu, K. G., Ovbiagele, B. Nationwide trends in medical expenditures among adults with epilepsy: 2003-2014. Journal of the Neurological Sciences. 384, 113-120 (2018).
- Hauser, W. A., Hesdorffer, D. C. Epilepsy: Frequency, Causes, and Consequences. Epilepsy Foundation of America. , (1990).
- Galanopoulou, A. S., et al. Identification of new epilepsy treatments: issues in preclinical methodology. Epilepsia. 53 (3), 571-582 (2012).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Buckmaster, P. S. Laboratory animal models of temporal lobe epilepsy. Comparative Medicine. 54 (5), 473-485 (2004).
- Levesque, M., Avoli, M., Bernard, C. Animal models of temporal lobe epilepsy following systemic chemoconvulsant administration. Journal of Neuroscience Methods. 260, 45-52 (2016).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Wang, L., Liu, Y. H., Huang, Y. G., Chen, L. W. Time-course of neuronal death in the mouse pilocarpine model of chronic epilepsy using Fluoro-Jade C staining. Brain Research. 1241, 157-167 (2008).
- Dey, D., et al. A potassium leak channel silences hyperactive neurons and ameliorates status epilepticus. Epilepsia. 55 (2), 203-213 (2014).
- Straub, J., et al. Characterization of kindled VGAT-Cre mice as a new animal model of temporal lobe epilepsy. Epilepsia. 61 (10), 11 (2020).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biology. 8 (6), 1000412 (2010).
- Vong, L., et al. Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron. 71 (1), 142-154 (2011).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, (2016).
- Lothman, E. W., Bertram, E. H., Bekenstein, J. W., Perlin, J. B. Self-sustaining limbic status epilepticus induced by 'continuous' hippocampal stimulation: electrographic and behavioral characteristics. Epilepsy Research. 3 (2), 107-119 (1989).
- Lothman, E. W., Williamson, J. M. Influence of electrical stimulus parameters on afterdischarge thresholds in the rat hippocampus. Epilepsy Research. 13 (3), 205-213 (1992).
- Lewczuk, E., et al. Electroencephalography and behavior patterns during experimental status epilepticus. Epilepsia. 59 (2), 369-380 (2018).
- Wenker, I. C., et al. Postictal death is associated with tonic phase apnea in a mouse model of sudden unexpected death in epilepsy. Annals of Neurology. 89 (5), 1023-1035 (2021).
- Morimoto, K., Fahnestock, M., Racine, R. J. Kindling and status epilepticus models of epilepsy: rewiring the brain. Progress in Neurobiology. 73 (1), 1-60 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon