Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка и имплантация электродов для электрического разжигания мышей VGAT-Cre для создания модели височной эпилепсии
В этой статье
Резюме
В этом отчете описаны методы создания модели височной эпилепсии на основе электрического растопления трансгенных мышей VGAT-Cre. Разожженные мыши VGAT-Cre могут быть полезны для определения причин эпилепсии и для скрининга новых методов лечения.
Аннотация
Было обнаружено, что электрическое растопление мышей VGAT-Cre приводило к спонтанным двигательным и электрографическим припадкам. Недавняя статья была посвящена тому, как уникальные мыши VGAT-Cre использовались для развития спонтанных повторяющихся припадков (SRS) после разжигания, и вероятный механизм - вставка Cre в ген VGAT - нарушил его экспрессию и снизил ГАМКергический тонус. Настоящее исследование распространяет эти наблюдения на большую когорту мышей, уделяя особое внимание ключевым вопросам, таким как продолжительность SRS после растопки и влияние пола и возраста животного. В этом отчете описываются протоколы для следующих ключевых этапов: изготовление гарнитур с глубинными электродами гиппокампа для электростимуляции и считывания электроэнцефалограммы; операция по надежному закреплению гарнитуры на черепе мыши, чтобы она не отваливалась; и ключевые детали протокола электрического разжигания, такие как продолжительность импульса, частота поезда, продолжительность поезда и величина вводимого тока. Протокол растопки надежен тем, что он надежно приводит к эпилепсии у большинства мышей VGAT-Cre, предоставляя новую модель для тестирования новых противоэпилептогенных препаратов.
Введение
Эпилепсия является серьезным неврологическим расстройством со значительным экономическим и человеческим бременем. По оценкам NINDS, в мире насчитывается 3 миллиона американцев, страдающих эпилепсией. Примерно 0,6 миллиона из этих пациентов страдают височной эпилепсией (TLE)1. К сожалению, медикаментозное лечение TLE терпит неудачу у одной трети пациентов из-за неэффективности, развития лекарственной устойчивости или непереносимости побочных эффектов2. Очевидно, что существует значительная потребность в разработке новых методов лечения TLE, и этот вывод разделяют Комитет по фундаментальным наукам Американского общества эпилепсии, Рабочая группа Международной лиги по борьбе с эпилепсией по открытию доклинических лекарств от эпилепсии и Национальный консультативный совет по неврологическим расстройствам и инсульту 3,4.
Современные модели височной эпилепсии на животных используют либо химоконсудорожные препараты (например, каинат, пилокарпин), либо длительную электрическую стимуляцию, чтобы вызвать длительный эпилептический статус 5,6,7. Многие животные умирают во время процедуры (10-30% у крыс, до 90% у мышей8). Животные, которые выживают и развивают эпилепсию, демонстрируют обширную гибель нейронов по всему мозгу 9,10. Эта смерть вызывает каскад реакций, начиная с активации микроглии, астроцитов и проникающих моноцитов. Нейронные реакции включают реорганизацию цепей (например, прорастание мшистых волокон), рождение новых нейронов, которые не могут должным образом интегрироваться в цепи (например, эктопические гранулярные клетки), и внутренние изменения, которые приводят к гипервозбудимости (например, активация каналов Na+). Модель эпилепсии без значительной гибели нейронов облегчит поиск новых противоэпилептических препаратов.
При проверке ГАМК-гипотезы эпилепсии было обнаружено, что лечение мышей VGAT-Cre мягким протоколом электрического разжигания приводило к спонтанным моторным и электрографическим припадкам11. В целом, электрическая растопка грызунов не приводит к спонтанным припадкам, определяющим эпилепсию, хотя может, в случаях чрезмерного разжигания11. Мыши VGAT-Cre экспрессируют рекомбиназу Cre под контролем гена везикулярного переносчика ГАМК (VGAT), который специфически экспрессируется в ГАМКергических тормозных нейронах. Было обнаружено, что вставка Cre нарушает экспрессию VGAT на уровне мРНК и белка, тем самым ухудшая ГАМКергическую синаптическую передачу в гиппокампе. Был сделан вывод, что разожженные мыши VGAT-Cre могут быть полезны для изучения механизмов, участвующих в эпилептогенезе, и для скрининга новых терапевтических средств11. В настоящем докладе подробно описываются методы, использованные при создании модели.
Access restricted. Please log in or start a trial to view this content.
протокол
Использование животных соответствовало рекомендациям COME12 и было одобрено Комитетом по уходу за животными и их использованию Университета Вирджинии.
1. Изготовление гарнитур с двумя биполярными электродами (рис. 1)
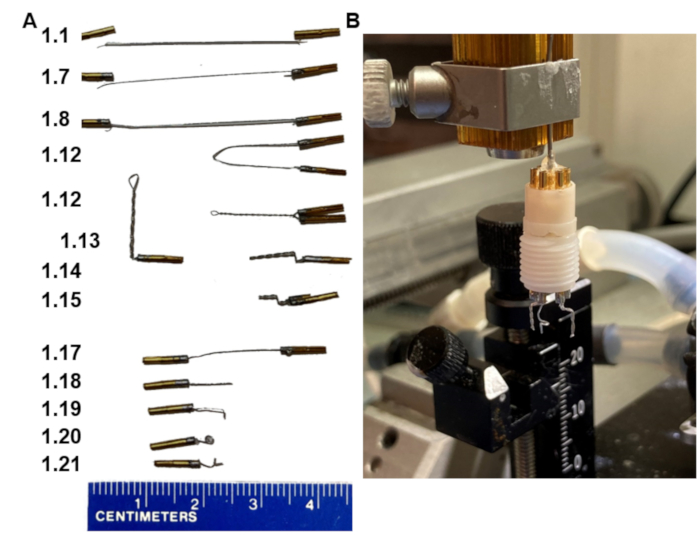
Рисунок 1: Основные этапы изготовления гарнитуры ЭЭГ. (A) Внешний вид электродов на различных этапах протокола (цифры на левом шаге совпадают). (B) Изображение конечного продукта, установленное в самодельном держателе, который подходит к стереотаксической раме. Обратите внимание, что держатель заканчивается узлом штифта воротника, который вставляется в пьедестал гарнитуры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Отрежьте 3,5 см нержавеющей проволоки из нержавеющей стали с покрытием из политетрафторэтилена.
- Снимите около 1 мм изоляционного слоя с провода с обоих концов. Не зачищайте слишком много проволоки.
- Наденьте два штифта на держатель тисков так, чтобы нижняя часть штифта имела более длинную прорезь вниз.
- Нанесите флюс на зачищенные концы проволоки и на верхушки штифтов.
- Зажверните зачищенную часть проволоки ровно столько, сколько нужно, чтобы покрыть ее.
- Добавьте минимальное количество припоя в верхнюю часть штифта, не переливаясь по бокам.
- Поместите один конец зачищенных концов проволоки в штифт настолько глубоко, насколько это позволяет, пока припой расплавляется.
ПРИМЕЧАНИЕ: Есть боковое отверстие, из которого может выйти провод - не позволяйте проводу выходить из штифта. Весь зачищенный провод должен оставаться внутри штифта. - Повторите шаги 1.6-1.7 для второго контакта, теперь с другими зачищенными концами провода.
- Дайте штифтам постоять 30 секунд для схватывания, извлеките их из держателя тисков, а затем потяните за них, чтобы убедиться, что соединение между проводом и штифтами прочное и держится.
- Промойте булавки в холодной воде, а затем высушите.
- Проверьте проводимость между контактом 1 и контактом 2 с помощью омметра.
- Соедините штифты на концах провода вместе; Держите их параллельно и близко. Прижмите гемостат к центру проволоки. Затем поверните гемостат, чтобы провод обвивался вокруг себя довольно туго. Удалите гемостат.
- Прижмите щипцы к скрученной проволоке на 2 мм ниже штифтов и согните проволоку под углом 90°.
- Снова надавите на ту же проволоку на 90° назад на щипцы, создав еще один изгиб на 1 мм от первого.
- Отрежьте скрученную проволоку под углом 45° ниже изгиба на 3,5 мм маленькими острыми ножницами.
- Подготовьте два из этих биполярных (скрученных с двойным контактом) электродов для каждой гарнитуры (опционально, второй является резервным на случай проблем с электричеством с первым).
- Подготовьте один электрод сравнения, разрезав проволоку со штифтами, припаянными на обоих концах, на две части (этапы 1.1-1.17, рис. 1A).
- Отрежьте проволоку на 7 мм.
- Загните конец на 1 мм ниже кончика.
- Затем накройте согнутый 1 мм кончик проволоки щипцами и плотно поверните проволоку вокруг щипцов, чтобы создать небольшую петлю (диаметром 1 мм).
- Согните петлю перпендикулярно прямой части проволоки, чтобы наконечник проволоки снова был направлен наружу.
- Соберите два биполярных электрода и один электрод сравнения в шестиконтактный пьедестал таким образом, чтобы биполярные электроды находились рядом с расстоянием 6 мм между ними, а электрод сравнения был помещен в среднее внешнее отверстие (рис. 1B).
ПРИМЕЧАНИЕ: Альтернативным методом является имплантация электродов, цементирование их на месте, а затем вставка их штифтов в пьедестал.
2. Имплантация стереотаксических электродов
- Перед операцией стерилизуйте все хирургические инструменты и шестиконтактный электродный узел путем автоклавирования. Во время операции необходимо поддерживать стерильное операционное поле и использовать стерильные хирургические перчатки. Стерильные простыни (например, Press n' Seal) рекомендуются для покрытия животного, за исключением хирургической области.
- Используйте 8-недельных мышей VGAT-Cre (соответствующего возраста, как самца, так и самку) для операций через 4 недели после отлучения от груди. Запишите вес животного перед операцией, чтобы можно было измерить послеоперационную потерю веса.
- Используйте сертифицированный испаритель изофлурана или систему анестезии с низким потоком, оснащенную прецизионным шприцевым насосом, встроенным цифровым испарителем и грелкой с обратной связью.
ПРИМЕЧАНИЕ: Системы с низким потоком способны доставлять анестезию с низкой скоростью потока, пропорциональной размеру животного, либо в индукционную камеру, либо через носовой конус на стереотаксическом каркасе (70 мл / мин, концентрация изофлурана в воздухе составляет 4% для индукции и 2% для операции). Использование меньшего количества анестезии не только приносит пользу животному во время операций, но и снижает риск воздействия изофлурана на лабораторный персонал. - Поместите обезболиваемое животное на подогретую подушку, нагретую до 37 °C, чтобы оно оставалось теплым во время операции. Если вы используете температурную систему с обратной связью, вставьте слегка смазанный температурный зонд в прямую кишку животного для контроля температуры во время операции.
- Установите животное на стереотаксическую раму, аккуратно вставив ушные вкладыши в уши, а передние верхние зубы — в резцы. Поместите носовой конус над носом для правильной подачи анестезии. Убедитесь, что головка выровнена и отцентрирована и не может быть перемещена при легком зондировании.
- Подкожно вводят 0,5 мл нормозола для гидратации.
- Нанесите смазку для глаз, чтобы предотвратить высыхание роговицы.
- Следите за глубиной анестезии по отсутствию рефлекса отмены после защемления пальца задней конечности, а затем уменьшите изофлуран до 1,5%-2,0% во время операции.
- Удалите волосы в области операции и вокруг нее, выщипав или используя машинки для стрижки (бритье) или крем для депиляции, и продезинфицируйте кожу тремя циклами чередования применения йода и этанола, заканчивая йодом. Удаление волос вдали от места операции рекомендуется только в том случае, если есть средства для поддержания анестезии в этом месте. При необходимости используйте смоченные в спирте аппликаторы ватных наконечников, чтобы удалить волосы из непосредственной области, окружающей голову. Вводят 0,05 мл местного анальгетика бупивакаина (0,25%) подкожно.
- Сделайте разрез на черепе с помощью скальпеля, а затем вырежьте острыми хирургическими ножницами часть кожи, обнажив череп. Отодвинув кожу в сторону, с помощью ватного тампона очистите череп от всех мышц и подлежащих тканей, препятствующих обзору.
ПРИМЕЧАНИЕ: Чтобы остановить случайное кровотечение, надавите на место кровотечения стерильным ватным тампоном, пока оно не остановится. - Очистите череп перекисью водорода с помощью стерильных ватных тампонов, чтобы сделать видимыми швы черепа, а также брегму и лямбду.
- Тщательно высушите череп, а затем нанесите одну каплю самотравящегося стоматологического клея с помощью его аппликатора. Нанесите его на череп, подождите 60 секунд и вылечите зубным ультрафиолетовым светом в течение 40 секунд. Глянцевая поверхность указывает на то, что клей был эффективно сшит с черепом.
ПРИМЕЧАНИЕ: Этот шаг имеет решающее значение для надежного крепления гарнитуры. - Используйте сверло 0,031 дюйма (0,79 мм) для двустороннего сверления двух отверстий для заусенцев для имплантации глубинных электродов гиппокампа (примерно 5,000 об/мин). Просверлите одно дополнительное отверстие для заусенца для электрода сравнения над мозжечком за лямбдой.
ПРИМЕЧАНИЕ: При сверлении следите за тем, чтобы медленно опускать сверло и избегать сверления мозга. - Координаты электродов следующие (от брегмы в мм): электроды гиппокампа на 3 мм сзади, 3 мм сбоку и 3 мм на глубине; и мозжечковый электрод сравнения на расстоянии 6 мм сзади, 0 мм сбоку и 0 мм на глубине (субдуральный).
- Для повышения точности используйте стереотаксически установленную дрель, обнуляйте ось X/Y стереотаксического манипулятора при касании брегмой – это точка отсчета для координат.
- Соберите гарнитуру, вставив все электроды в шестиконтактный пьедестал, убедившись, что контакты полностью вставлены в пьедестал. Установите пьедестал в держатель электрода на стереотаксической раме (рис. 1B).
- Совместите электроды над соответствующими отверстиями для заусенцев. Стереотаксически имплантируйте скрученные биполярные электроды из проволоки из нержавеющей стали в правый и левый гиппокамп и электрод сравнения в мозжечок, медленно опуская гарнитуру и направляя электроды в отверстия для заусенцев.
- Когда вращающийся электрод гиппокампа находится прямо над отверстием, обнулите ось Z и медленно опустите до -3,0 мм.
- Покройте поверхность черепа и электроды стоматологическим цементом и заполните пространство между поверхностью черепа и дном пьедестала. Края кожи будут прилегать к зубному цементу таким образом, что никакая подлежащая ткань не останется открытой. Подождите, пока цемент высохнет и затвердеет. Затем отсоедините электрододержатель от стереотаксического рычага и снимите держатель с пьедестала.
- Введите 0,1 мл кетопрофена (1 мг / мл,/к) для обезболивания и вторую дозу 0,5 мл нормозола (/к) для гидратации и удалите животное из стереотаксической рамки.
- Поместите изотермическую прокладку, предварительно нагретую до 37 °C, в пустую клетку вивария, накрытую бумажным полотенцем. Как только он полностью проснулся, поместите животное в чистую клетку с подстилкой и мягким кормом и верните его в виварий. С этого момента животные размещаются поодиночке, чтобы не жевать гарнитуры друг друга. Бункеры для проволочных стержней не используются, чтобы гарнитуры не застряли, а вместо этого бутылки с водой привязаны к нижней стороне верхней части клетки, а чау-чау присутствует в подстилке.
- Кормите животное мягкой пищей в течение 72 часов после операции и следите за потерей веса и состоянием тела. Обезвоженным животным можно вводить 0,5 мл нормозола подкожно при обезвоживании (потеря веса, повышение тургора кожи, запавшие глаза). Кетопрофен можно вводить подкожно один раз в день в течение еще 2 дней после операции (соблюдайте режим обезболивания в соответствии с местными рекомендациями IACUC). Дайте животным полностью восстановиться в клетках в течение 4-7 дней, прежде чем переводить на систему записи ЭЭГ.
3. Протокол электрического растопки
- Подключите мыши к системе записи ЭЭГ с помощью гибкого кабеля, который подходит к гнездам на головке мыши и коммутаторе (см. список материалов ). Дайте животным акклиматизироваться в течение одного дня, прежде чем приступить к приведенному ниже протоколу электростимуляции. Ежедневно контролируйте их общее состояние здоровья и акклиматизацию и удаляйте их из организма, когда появляются признаки болезни, дистресса и / или постоянной потери массы тела, превышающей 25%
- Подключите оба провода от стимулирующего электрода к выходу стимулятора постоянного тока.
ПРИМЕЧАНИЕ: Очень полезно иметь печатную плату, которая переключает эти электроды от регистратора ЭЭГ к стимулятору. - Настройте стимулятор на подачу импульсов 1 мс с частотой 50 Гц в течение 2 с.
- Установите выходную мощность стимулятора на 20 микроампер (мкА) и подайте1-й импульс.
- Контролируйте ЭЭГ на предмет характерного послеразрядного высокочастотного всплеска, который переживает импульс электростимуляции.
- Если разряда не наблюдается, то увеличивайте количество вводимого тока с шагом 20 мкА до тех пор, пока не сработает последующий разряд. Требуемая величина тока равна порогу после разряда (ADT).
- Типичные ADT составляют 20-50 мкА. Если разряда не наблюдается даже после увеличения до 200 мкА, то требуется устранение неисправностей электрических соединений и проводки гарнитуры с помощью омметра с высокой чувствительностью. Если проблема в стимулирующем электроде, попробуйте стимулировать с помощью других глубинных электродов.
- Животных разжигают путем стимуляции 2 или 6 раз в день с использованием тока, который в 1,5 раза превышает значение ADT для этой мыши.
- Следите за поведенческой реакцией на стимуляцию, которая повышается от смены состояния до двусторонних тонико-клонических припадков с падением. Оценка с использованием модифицированной системы классов Расина11. Чтобы избежать вызванных смертельных тонических припадков, разжигание следует приостановить, если последовательные стимулы приводят к увеличению тяжести и продолжительности приступов до модифицированной оценки Расина 6 (бег и прыжки)
Access restricted. Please log in or start a trial to view this content.
Результаты
Животные
Первоначально модель была разработана с использованием мышей VGAT-Cre (Slc32a1tm2(cre)Lowl/J)13 на смешанном фоне. Однако он также был применен к штамму VGAT-Cre, который конгенгенен с C57BL / 6J. Никаких различий при эпилепсии, которая развивается между штаммами, не наб?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этом отчете описывается протокол, в котором электрическое разжигание мышей приводит к эпилепсии. Поскольку стимулирующий электрод помещается в гиппокамп, это фокальная лимбическая эпилепсия, которая моделирует височную эпилепсию (TLE) у пациентов. Критическим шагом в этом протоколе ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликтов для раскрытия.
Благодарности
Авторы благодарят Джона Уильямсона за полезное обсуждение этого протокола. Эта работа была поддержана грантом NIH/NINDS NS112549.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 16 Channel Extracellular Differential AC Amplifier (115V/60Hz) | AD Instruments | AM3500-115-60 | Alternate EEG amplifier |
| 363/CP PLUG COLLAR, PINS SLEEVE | P1 Technologies | 363SLEEVPIN0NL | For electrode holder |
| Cable, 363-363 5CM - 100CM W/MESH 6TCM | P1 Technologies | 363363XXXXCM004 | mouse-to-commutator cable |
| CCTV cameras Qcwox HD Sony IR LED | Sony | QC-SP316 | |
| Commutator SL6C/SB (single brush) | P1 Technologies | 8BSL6CSBC0MT | formerly Plastics One, Inc. |
| Current amplifier | A-M Systems | Model 2100 | |
| Dental cement | Stoelting | 51459 | |
| Drill bits, #75, OD 0.310" LOC 130 PT | Kyocera | 105-0210.310 | |
| E363/0 SOCKET CONTACT SKEWED | P1 Technologies | 8IE3630XXXXE | pins for connector |
| iBond Self Etch glue | Kulzer | CE0197 | |
| MS363 PEDESTAL 2298 6 PIN WHITE | P1 Technologies | 8K000229801F | EEG headset connector |
| Ohmeter | Simpson | 260 | High sensitivity |
| PowerLab 16/35 and LabChart Pro | AD Instruments | PL3516/P | Alternate EEG software |
| SomnoSuite | Kent Scientific Corp. | SS-01 | anesthesia unit & RightTemp monitoring |
| Stereotactic drill and micromotor kit | Foredom Electric Co. | K.1070 | |
| Stereotactic frame | David Kopf Instruments | Model 940 | |
| Teflon-coated wire for depth electrode, OD 0.008' | A-M Systems | 791400 | |
| VGAT-Cre mice on congenic C57BL/6J background | The Jackson Laboratory | 000664 |
Ссылки
- Lekoubou, A., Bishu, K. G., Ovbiagele, B. Nationwide trends in medical expenditures among adults with epilepsy: 2003-2014. Journal of the Neurological Sciences. 384, 113-120 (2018).
- Hauser, W. A., Hesdorffer, D. C. Epilepsy: Frequency, Causes, and Consequences. Epilepsy Foundation of America. , (1990).
- Galanopoulou, A. S., et al. Identification of new epilepsy treatments: issues in preclinical methodology. Epilepsia. 53 (3), 571-582 (2012).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Buckmaster, P. S. Laboratory animal models of temporal lobe epilepsy. Comparative Medicine. 54 (5), 473-485 (2004).
- Levesque, M., Avoli, M., Bernard, C. Animal models of temporal lobe epilepsy following systemic chemoconvulsant administration. Journal of Neuroscience Methods. 260, 45-52 (2016).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Wang, L., Liu, Y. H., Huang, Y. G., Chen, L. W. Time-course of neuronal death in the mouse pilocarpine model of chronic epilepsy using Fluoro-Jade C staining. Brain Research. 1241, 157-167 (2008).
- Dey, D., et al. A potassium leak channel silences hyperactive neurons and ameliorates status epilepticus. Epilepsia. 55 (2), 203-213 (2014).
- Straub, J., et al. Characterization of kindled VGAT-Cre mice as a new animal model of temporal lobe epilepsy. Epilepsia. 61 (10), 11(2020).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biology. 8 (6), 1000412(2010).
- Vong, L., et al. Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron. 71 (1), 142-154 (2011).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, (2016).
- Lothman, E. W., Bertram, E. H., Bekenstein, J. W., Perlin, J. B. Self-sustaining limbic status epilepticus induced by 'continuous' hippocampal stimulation: electrographic and behavioral characteristics. Epilepsy Research. 3 (2), 107-119 (1989).
- Lothman, E. W., Williamson, J. M. Influence of electrical stimulus parameters on afterdischarge thresholds in the rat hippocampus. Epilepsy Research. 13 (3), 205-213 (1992).
- Lewczuk, E., et al. Electroencephalography and behavior patterns during experimental status epilepticus. Epilepsia. 59 (2), 369-380 (2018).
- Wenker, I. C., et al. Postictal death is associated with tonic phase apnea in a mouse model of sudden unexpected death in epilepsy. Annals of Neurology. 89 (5), 1023-1035 (2021).
- Morimoto, K., Fahnestock, M., Racine, R. J. Kindling and status epilepticus models of epilepsy: rewiring the brain. Progress in Neurobiology. 73 (1), 1-60 (2004).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены