Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Temporal lob epilepsisi için bir model oluşturmak üzere elektriksel olarak çırılan VGAT-Cre fareleri için elektrotların hazırlanması ve implantasyonu
Bu Makalede
Özet
Bu yazıda, transgenik VGAT-Cre farelerinin elektriksel çıralarına dayanan temporal lob epilepsi modeli oluşturma yöntemleri açıklanmaktadır. Kindled VGAT-Cre fareleri, epilepsiye neyin neden olduğunu belirlemede ve yeni tedavileri taramada yararlı olabilir.
Özet
VGAT-Cre farelerinin elektriksel çıralarının spontan motor ve elektrografik nöbetlere yol açtığı keşfedildi. Yakın tarihli bir makale, benzersiz VGAT-Cre farelerinin çıralamadan sonra spontan tekrarlayan nöbetler (SRS) geliştirmede nasıl kullanıldığına ve olası bir mekanizmanın - Cre'nin VGAT genine yerleştirilmesi - ekspresyonunu bozdu ve GABAerjik tonu azalttı. Bu çalışma, bu gözlemleri daha büyük bir fare kohortuna genişleterek, SRS'nin çıralamadan sonra ne kadar süre devam ettiği ve hayvanın cinsiyetinin ve yaşının etkisi gibi kilit konulara odaklanmaktadır. Bu raporda aşağıdaki önemli adımlar için protokoller açıklanmaktadır: elektriksel stimülasyon ve elektroensefalogramı okumak için hipokampal derinlik elektrotlarına sahip kulaklıklar yapmak; kulaklığı farenin kafatasına güvenli bir şekilde yapıştırmak için ameliyat, böylece düşmez; ve darbenin süresi, trenin sıklığı, trenin süresi ve enjekte edilen akım miktarı gibi elektrik çıra protokolünün önemli ayrıntıları. Çıra protokolü, çoğu VGAT-Cre faresinde güvenilir bir şekilde epilepsiye yol açması ve yeni antiepileptojenik ilaçları test etmek için yeni bir model sağlaması bakımından sağlamdır.
Giriş
Epilepsi, önemli ekonomik ve beşeri yükleri olan majör bir nörolojik hastalıktır. NINDS, epilepsili 3 milyon Amerikalı olduğunu tahmin ediyor. Bu hastaların yaklaşık 0,6 milyonunda temporal lob epilepsisi (TLE) vardır1. Ne yazık ki, TLE'nin tıbbi tedavisi hastaların üçte birinde etkisizlik, ilaç direnci gelişimi veya yan etkilere karşı toleranssızlık nedeniyle başarısız olmaktadır2. Açıkçası, Amerikan Epilepsi Derneği Temel Bilim Komitesi, Preklinik Epilepsi İlaç Keşfi için Uluslararası Epilepsiye Karşı Birlik Çalışma Grubu ve Ulusal Danışma Nörolojik Bozukluklar ve İnme Konseyi 3,4 tarafından paylaşılan bir sonuç olan TLE için yeni tedaviler geliştirmeye önemli bir ihtiyaç vardır.
Temporal lob epilepsisinin mevcut hayvan modelleri, uzun süreli status epileptikusu indüklemek için kemokonvülzanlar (örneğin, kainat, pilokarpin) veya uzun süreli elektriksel stimülasyon kullanır 5,6,7. İşlem sırasında birçok hayvan ölür (sıçanlarda% 10-30, farelerde% 90'a kadar8). Hayatta kalan ve epilepsi geliştiren hayvanlar, beyin boyunca yaygın nöronal ölüm gösterir 9,10. Bu ölüm, mikroglia, astrositler ve sızan monositlerin aktivasyonu ile başlayan bir dizi yanıtı tetikler. Nöronal yanıtlar arasında devre reorganizasyonu (örneğin, yosunlu lif filizlenmesi), devrelere düzgün bir şekilde entegre olamayan yeni nöronların doğumu (örneğin, ektopik granül hücreleri) ve hipereksitabiliteye yol açan içsel değişiklikler (örneğin, Na + kanallarının yukarı regülasyonu) bulunur. Önemli nöronal ölümü olmayan bir epilepsi modeli, yeni antiepileptik ilaçların araştırılmasını kolaylaştıracaktır.
Epilepsinin GABA hipotezini test ederken, VGAT-Cre farelerinin hafif bir elektriksel çıra protokolü ile tedavi edilmesinin spontan motor ve elektrografik nöbetlere yol açtığı keşfedilmiştir11. Genel olarak, kemirgenlerin elektriksel çıralanması, epilepsiyi tanımlayan spontan nöbetlere yol açmaz, ancak aşırı çıra11 vakalarında olabilir. VGAT-Cre fareleri, özellikle GABAerjik inhibitör nöronlarda eksprese edilen veziküler GABA taşıyıcı (VGAT) geninin kontrolü altında Cre rekombinazını eksprese eder. Cre yerleştirilmesinin mRNA ve protein seviyelerinde VGAT ekspresyonunu bozduğu, böylece hipokampusta GABAerjik sinaptik iletimi bozduğu bulundu. Yakılmış VGAT-Cre farelerinin epileptogenezde rol oynayan mekanizmaları incelemek ve yeni terapötikleri taramak için yararlı olabileceği sonucuna varılmıştır11. Bu rapor, modelin oluşturulmasında kullanılan yöntemleri ayrıntılı olarak sağlar.
Protokol
Hayvan kullanımı ARRIVE12 yönergelerini izledi ve Virginia Üniversitesi Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylandı.
1. İki bipolar elektrotlu kulaklıklar yapmak (Şekil 1)
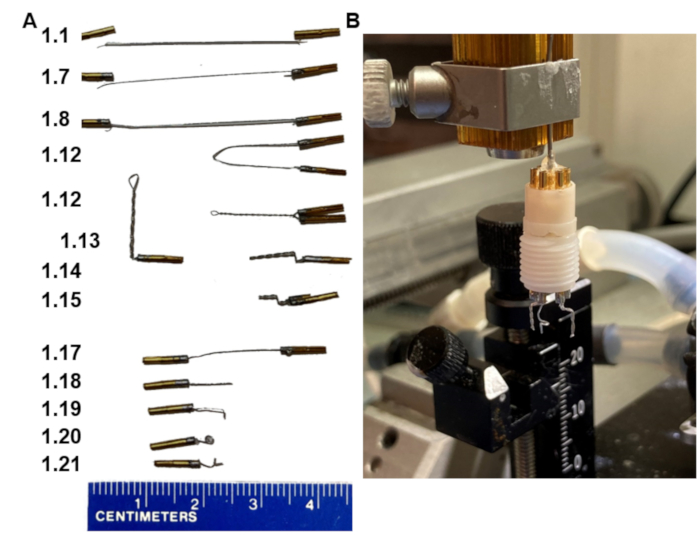
Şekil 1: EEG kulaklık üretiminde temel adımlar. (A) Elektrotların protokoldeki çeşitli adımlarda görünmesi (sol eşleşme adımındaki sayılar). (B) Stereotaksik çerçeveye uyan ev yapımı bir tutucuya monte edilmiş nihai ürünün resmi. Tutucunun, kulaklık kaidesine uyan bir yaka pimi tertibatı ile bittiğini unutmayın. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- 3,5 cm paslanmaz politetrafloroetilen kaplı paslanmaz çelik tel kesin.
- İzolasyon katının yaklaşık 1 mm'sini her iki uçtaki telden çıkarın. Telin çok fazla sıyrılmasını sağlamayın.
- Pimin alt kısmı aşağı bakacak şekilde daha uzun bir yarığa sahip olan bir mengene tutucuya iki pim yerleştirin.
- Telin soyulmuş uçlarına ve pimlerin üst kısımlarına akı uygulayın.
- Telin soyulmuş kısmını, kaplamak için yeterli lehimle kalın.
- Yanlara taşmadan pimin üstüne minimum miktarda lehim ekleyin.
- Telin soyulmuş uçlarının bir ucunu, lehim eritirken izin verdiği kadar derin bir pime yerleştirin.
NOT: Telin çıkabileceği bir yan delik vardır - telin pimden çıkmasına izin vermeyin. Soyulmuş telin tümü pim içinde kalmalıdır. - İkinci pim için 1.6-1.7 arasındaki adımları tekrarlayın, şimdi telin diğer soyulmuş uçlarıyla.
- Pimlerin ayarlanması için 30 sn bekletin, mengene tutucusundan çıkarın ve ardından tel ile pimler arasındaki bağlantının güçlü olduğundan ve tuttuğundan emin olmak için üzerlerine çekin.
- Pimleri soğuk suda durulayın ve sonra kurutun.
- Bir ohmmetre kullanarak pim 1 ve pim 2 arasındaki iletkenliği doğrulayın.
- Telin uçlarındaki pimleri bir araya getirin; Onları paralel ve yakın tutun. Bir hemostatı telin merkezine kelepçeleyin. Ardından, hemostatı döndürün, böylece tel kendi etrafında oldukça sıkı bir şekilde bükülür. Hemostatı çıkarın.
- Pimlerin 2 mm altındaki bükülmüş tel üzerine bir forseps kelepçeleyin ve teli 90°'de bükün.
- Aynı teli forsepslerin üzerine tekrar 90 ° geri itin ve ilkinden 1 mm daha fazla kıvrım oluşturun.
- Bükülmüş teli küçük keskin makasla 3,5 mm'de virajın altında 45°'lik bir açıyla kesin.
- Her kulaklık için bu bipolar (çift pimli bükümlü) elektrotlardan ikisini hazırlayın (isteğe bağlı, ikincisi birincisiyle ilgili elektrik sorunları durumunda yedeklemedir).
- Her iki ucunda lehimlenmiş pimler bulunan bir teli ikiye bölerek tek bir referans elektrodu hazırlayın (adım 1.1-1.17, Şekil 1A).
- Teli 7 mm'de kesin.
- Ucu ucun 1 mm altına bükün.
- Ardından, telin bükülmüş 1 mm ucunu forseps ile örtün ve küçük bir halka (1 mm çapında) oluşturmak için teli forsepslerin etrafında sıkıca döndürün.
- Tel ucunun tekrar dışa bakmasını sağlamak için ilmeği telin düz kısmına dik olarak bükün.
- İki bipolar elektrodu ve tek referans elektrodunu, bipolar elektrotlar aralarında 6 mm mesafe olacak şekilde yan yana olacak ve referans elektrodu orta dış deliğe yerleştirilecek şekilde altı pimli kaideye monte edin (Şekil 1B).
NOT: Alternatif bir yöntem, elektrotları implante etmek, yerlerine çimentolamak ve daha sonra pimlerini kaideye yerleştirmektir.
2. Stereotaksik elektrot implantasyonu
- Ameliyattan önce tüm cerrahi aletleri ve altı pimli elektrot düzeneğini otoklavlayarak sterilize edin. Ameliyat sırasında steril bir cerrahi alan bulundurulmalı ve steril cerrahi eldivenler kullanılmalıdır. Steril örtüler (örneğin, Press n' Seal) cerrahi alan dışında hayvanı örtmek için tavsiye edilir.
- Sütten kesildikten 4 hafta sonra ameliyatlar için 8 haftalık VGAT-Cre fareleri (yaşa uygun, hem erkek hem de dişi) kullanın. Ameliyat sonrası kilo kaybının ölçülmesine izin vermek için ameliyattan önce hayvanın ağırlığını kaydedin.
- Sertifikalı bir izofluran buharlaştırıcı veya hassas bir şırınga pompası, entegre dijital buharlaştırıcı ve geri beslemeli ısı yastığı ile donatılmış düşük akışlı bir anestezi sistemi kullanın.
NOT: Düşük akışlı sistemler, anesteziyi, hayvanın büyüklüğüyle orantılı düşük akış hızlarında bir indüksiyon odasına veya stereotaksik çerçevedeki bir burun konisinden geçirebilir (70 mL / dak, havadaki izofluran konsantrasyonu indüksiyon için% 4 ve ameliyat için% 2'dir). Daha az anestezi kullanmak sadece ameliyatlar sırasında hayvana fayda sağlamakla kalmaz, aynı zamanda laboratuvar personelinin izoflurana maruz kalma riskini de azaltır. - Anestezi uygulanan hayvanı, ameliyat sırasında sıcak tutmak için 37 ° C'ye ısıtılmış ısıtılmış bir ped üzerine yerleştirin. Geri besleme kontrollü bir sıcaklık sistemi kullanıyorsanız, hafifçe yağlanmış sıcaklık probunu ameliyat sırasında sıcaklık izleme için hayvanın rektumuna yerleştirin.
- Kulak çubuklarını kulaklara ve ön üst dişleri kesici uca yavaşça yerleştirerek hayvanı stereotaksik çerçeveye monte edin. Doğru anestezi uygulaması için burun konisini burnun üzerine yerleştirin. Başın düzleştirilmiş ve ortalanmış olduğundan ve hafifçe incelendiğinde hareket ettirilemediğinden emin olun.
- Hidrasyon için deri altından 0.5 mL normosol enjekte edin.
- Kornea kurumasını önlemek için oküler kayganlaştırıcı uygulayın.
- Bir arka bacak parmağını sıkıştırdıktan sonra yoksunluk refleksinin yokluğu ile anestezi derinliğini izleyin ve daha sonra ameliyat sırasında izofluran% 1.5 -% 2.0'a düşürün.
- Kesme makineleri (tıraş) veya tüy dökücü krem kopararak veya kullanarak cerrahi bölgedeki ve çevresindeki saçları çıkarın ve cildi iyotla bitirerek üç döngü dönüşümlü iyot ve etanol uygulamasıyla dezenfekte edin. Saçların cerrahi bölgeden uzaklaştırılması, yalnızca o yerde anesteziyi sürdürmenin yolları varsa önerilir. Gerekirse, saçları başın hemen çevresindeki bölgeden çıkarmak için alkole batırılmış pamuklu uç aplikatörleri kullanın. Deri altından 0.05 mL lokal analjezik bupivakain (% 0.25) enjekte edin.
- Bir neşter kullanarak kafatası üzerinde bir kesi yapın ve ardından cildin bir kısmını keskin cerrahi makasla keserek kafatasını açığa çıkarın. Cildi bir kenara iterek, pamuklu çubuk kullanarak, kafatasını görüşü engelleyen tüm kaslardan ve altta yatan dokulardan temizleyin.
NOT: Kazara kanamayı durdurmak için, kanama bölgesine durana kadar steril bir pamuklu çubukla basınç uygulayın. - Kafatası dikişlerini ve hem bregma hem de lambda'yı görünür hale getirmek için steril pamuklu çubuklar kullanarak kafatasını hidrojen peroksit ile temizleyin.
- Kafatasını iyice kurutun ve ardından aplikatörünü kullanarak bir damla kendinden aşındırıcı diş yapıştırıcısı uygulayın. Kafatasına fırçalayın, 60 saniye bekleyin ve 40 saniye boyunca diş UV ışığı ile tedavi edin. Parlak bir yüzey, yapıştırıcının kafatası ile etkili bir şekilde çapraz bağlandığını gösterir.
NOT: Bu adım, kulaklığın güvenli bir şekilde takılması için kritik öneme sahiptir. - Hipokampal derinlik elektrotlarının implantasyonu için iki çapak deliğini iki taraflı olarak delmek üzere 0,031" matkap ucu (0,79 mm) kullanın (yaklaşık 5.000 rpm). Lambdanın arkasındaki beyinciğin üzerindeki referans elektrodu için fazladan bir çapak deliği açın.
NOT: Delme yaparken, matkabı yavaşça indirmeye ve beyne delmekten kaçınmaya özen gösterin. - Elektrotların koordinatları aşağıdaki gibidir (mm cinsinden bregma'dan): 3 mm posterior, 3 mm lateral ve 3 mm derinlikte hipokampal elektrotlar; ve 6 mm posterior, 0 mm lateral ve 0 mm derinlikte (subdural) serebellar referans elektrodu.
- Doğruluğu artırmak için, stereotaksik olarak monte edilmiş bir matkap kullanın, bregma'ya dokunurken stereotaksik manipülatör X / Y eksenini sıfırlayın - bu, koordinatlar için referans noktasıdır.
- Tüm elektrotları altı pimli kaideye yerleştirerek bir kulaklık takın ve pimlerin kaidenin içine kadar itildiğinden emin olun. Kaideyi stereotaksik bir çerçeve üzerinde elektrot tutucuya monte edin (Şekil 1B).
- Elektrotları ilgili çapak deliklerinin üzerine hizalayın. Stereotaksik olarak sağ ve sol hipokampusa bükülmüş bipolar paslanmaz çelik tel elektrotları implante edin ve kulaklığı yavaşça indirerek ve elektrotları çapak deliklerine yönlendirerek beyincik içine referans elektrodu yerleştirin.
- Hipokampal büküm elektrodu deliğin hemen üzerindeyken, Z eksenini sıfırlayın ve yavaşça -3.0 mm'ye düşürün.
- Kafatası yüzeyini ve elektrotları diş çimentosu ile örtün ve kafatası yüzeyi ile kaidenin tabanı arasındaki boşluğu doldurun. Cilt kenarları diş çimentosuna bitişik olacaktır, böylece altta yatan doku açıkta kalmayacaktır. Çimentonun kurumasını ve sertleşmesini bekleyin. Daha sonra elektrot tutucuyu stereotaksik koldan ayırın ve tutucuyu kaideden çıkarın.
- Analjezi için 0.1 mL ketoprofen (1 mg / mL, SC) ve hidrasyon için ikinci bir doz 0.5 mL normosol (SC) enjekte edin ve hayvanı stereotaksik çerçeveden çıkarın.
- 37 ° C'ye önceden ısıtılmış bir izotermal pedi, kağıt havluyla kaplı boş bir vivaryum kafesinin içine yerleştirin. Tamamen uyanık olduğunda, hayvanı yatak takımları ve yumuşak yiyeceklerle temiz bir kafese yerleştirin ve vivaryuma geri koyun. Hayvanlar, birbirlerinin kulaklıklarını çiğnemeyi önlemek için bu noktadan itibaren tek başlarına barındırılır. Kulaklıkların sıkışmasını önlemek için tel çubuk hazneleri kullanılmaz ve bunun yerine, su şişeleri kafes üstlerinin alt tarafına bağlanır ve yataklarda chow bulunur.
- Ameliyattan sonra 72 saat boyunca hayvana biraz yumuşak yiyecek verin ve kilo kaybı ve vücut kondisyon skorunu izleyin. Susuz kalmış hayvanlara, susuz bırakılırsa deri altından 0.5 mL normosol uygulanabilir (kilo kaybı, artmış cilt turgoru, batık gözler). Ketoprofen, ameliyattan sonraki 2 gün boyunca günde bir kez deri altından verilebilir (yerel IACUC kılavuzlarına göre analjezi rejimini takip edin). EEG kayıt sistemine aktarılmadan önce hayvanların kafeslerinde 4-7 gün boyunca tamamen iyileşmelerine izin verin.
3. Elektrik çıra protokolü
- Fare kafasındaki ve komütatördeki soketlere uyan esnek bir kablo kullanarak fareleri EEG kayıt sistemine bağlayın ( Malzeme Tablosu listesine bakın). Aşağıdaki elektriksel stimülasyon protokolüne devam etmeden önce hayvanların bir gün boyunca alışmasına izin verin. Genel sağlıklarını ve alışmalarını günlük olarak izleyin ve% 25'i aşan hastalık, sıkıntı ve / veya sürekli vücut ağırlığı kaybı belirtileri olduğunda bunları sistemden çıkarın
- Her iki ucu da uyarıcı elektrottan sabit akım stimülatörünün çıkışına bağlayın.
NOT: Bu elektrotları EEG kaydediciden ve uyarıcıdan uzaklaştıran bir devre kartına sahip olmak çok yararlıdır. - Stimülatörü 2 s tren süresi boyunca 50 Hz'de 1 ms darbe verecek şekilde ayarlayın.
- Stimülatörün çıkışını 20 mikroampere (μA) ayarlayın ve 1. darbeyi iletin.
- EEG'yi, elektriksel stimülasyon darbesinden daha uzun süre dayanan yüksek frekanslı sivri uçların deşarjından sonra karakteristik bir şekilde izleyin.
- Deşarj gözlenmezse, bir deşarj sonrası tetiklenene kadar enjekte edilen akım miktarını 20 μA'lık artışlarla artırın. Gerekli akım miktarı Deşarj Sonrası Eşiğidir (ADT).
- Tipik ADT'ler 20-50 μA'dır. 200 μA'ya yükseldikten sonra bile deşarj gözlenmezse, elektrik bağlantılarında ve kulaklık kablolarında yüksek hassasiyetli ohmmetre ile sorun giderme gerekir. Sorun uyarıcı elektrottaysa, diğer derinlik elektrotlarıyla uyarmayı deneyin.
- Hayvanlar, o fare için ADT değerinin 1.5 katı olan bir akım kullanılarak günde 2x veya 6x uyarılarak yakılır.
- Durumun değişmesinden düşme ile bilateral tonik-klonik nöbetlere yükselen stimülasyona davranışsal tepkiyi izleyin. Değiştirilmiş bir Racine sınıf sistemi kullanarak puan11. Uyarılmış ölümcül tonik nöbetlerden kaçınmak için, ardışık uyaranlar modifiye edilmiş Racine skoru 6'ya (koşma ve atlama) kadar nöbetlerin şiddetini ve uzunluğunu arttırmaya yol açarsa çıra duraklatılmalıdır
Sonuçlar
Hayvan
Model başlangıçta karışık bir arka plan üzerinde VGAT-Cre fareleri (Slc32a1tm2 (cre)Lowl / J)13 kullanılarak geliştirilmiştir. Bununla birlikte, C57BL / 6J ile konjenik olan VGAT-Cre suşuna da uygulanmıştır. Suşlar arasında gelişen epilepside fark gözlenmemiştir. Her iki suş da veziküler GABA taşıyıcı promotörünün kontrolü altında Cre rekombinazını eksprese eder. Bu fareler, Vgat genindeki durdurma kodonundan sonra bir ...
Tartışmalar
Bu raporda, farelerin elektriksel çıralarının epilepsiye yol açtığı bir protokol açıklanmaktadır. Uyarıcı elektrot hipokampusa yerleştirildiğinden, bu hastalarda temporal lob epilepsisini (TLE) modelleyen fokal limbik bir epilepsidir. Bu protokoldeki kritik bir adım, Vgat genine bir IRES-Cre rekombinaz kasetinin yerleştirilmesi nedeniyle, bozulmuş inhibitör GABA akımları11'i gösteren VGAT-Cre farelerini kullanmaktır. C57BL / 6, bu protokolle tutuşturulduktan sonra ...
Açıklamalar
Yazarların açıklayacak hiçbir çatışması yoktur.
Teşekkürler
Yazarlar, bu protokol hakkındaki yararlı tartışmalar için John Williamson'a teşekkür eder. Bu çalışma NIH / NINDS hibesi NS112549 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 16 Channel Extracellular Differential AC Amplifier (115V/60Hz) | AD Instruments | AM3500-115-60 | Alternate EEG amplifier |
| 363/CP PLUG COLLAR, PINS SLEEVE | P1 Technologies | 363SLEEVPIN0NL | For electrode holder |
| Cable, 363-363 5CM - 100CM W/MESH 6TCM | P1 Technologies | 363363XXXXCM004 | mouse-to-commutator cable |
| CCTV cameras Qcwox HD Sony IR LED | Sony | QC-SP316 | |
| Commutator SL6C/SB (single brush) | P1 Technologies | 8BSL6CSBC0MT | formerly Plastics One, Inc. |
| Current amplifier | A-M Systems | Model 2100 | |
| Dental cement | Stoelting | 51459 | |
| Drill bits, #75, OD 0.310" LOC 130 PT | Kyocera | 105-0210.310 | |
| E363/0 SOCKET CONTACT SKEWED | P1 Technologies | 8IE3630XXXXE | pins for connector |
| iBond Self Etch glue | Kulzer | CE0197 | |
| MS363 PEDESTAL 2298 6 PIN WHITE | P1 Technologies | 8K000229801F | EEG headset connector |
| Ohmeter | Simpson | 260 | High sensitivity |
| PowerLab 16/35 and LabChart Pro | AD Instruments | PL3516/P | Alternate EEG software |
| SomnoSuite | Kent Scientific Corp. | SS-01 | anesthesia unit & RightTemp monitoring |
| Stereotactic drill and micromotor kit | Foredom Electric Co. | K.1070 | |
| Stereotactic frame | David Kopf Instruments | Model 940 | |
| Teflon-coated wire for depth electrode, OD 0.008' | A-M Systems | 791400 | |
| VGAT-Cre mice on congenic C57BL/6J background | The Jackson Laboratory | 000664 |
Referanslar
- Lekoubou, A., Bishu, K. G., Ovbiagele, B. Nationwide trends in medical expenditures among adults with epilepsy: 2003-2014. Journal of the Neurological Sciences. 384, 113-120 (2018).
- Hauser, W. A., Hesdorffer, D. C. Epilepsy: Frequency, Causes, and Consequences. Epilepsy Foundation of America. , (1990).
- Galanopoulou, A. S., et al. Identification of new epilepsy treatments: issues in preclinical methodology. Epilepsia. 53 (3), 571-582 (2012).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Buckmaster, P. S. Laboratory animal models of temporal lobe epilepsy. Comparative Medicine. 54 (5), 473-485 (2004).
- Levesque, M., Avoli, M., Bernard, C. Animal models of temporal lobe epilepsy following systemic chemoconvulsant administration. Journal of Neuroscience Methods. 260, 45-52 (2016).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Wang, L., Liu, Y. H., Huang, Y. G., Chen, L. W. Time-course of neuronal death in the mouse pilocarpine model of chronic epilepsy using Fluoro-Jade C staining. Brain Research. 1241, 157-167 (2008).
- Dey, D., et al. A potassium leak channel silences hyperactive neurons and ameliorates status epilepticus. Epilepsia. 55 (2), 203-213 (2014).
- Straub, J., et al. Characterization of kindled VGAT-Cre mice as a new animal model of temporal lobe epilepsy. Epilepsia. 61 (10), 11 (2020).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biology. 8 (6), 1000412 (2010).
- Vong, L., et al. Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron. 71 (1), 142-154 (2011).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, (2016).
- Lothman, E. W., Bertram, E. H., Bekenstein, J. W., Perlin, J. B. Self-sustaining limbic status epilepticus induced by 'continuous' hippocampal stimulation: electrographic and behavioral characteristics. Epilepsy Research. 3 (2), 107-119 (1989).
- Lothman, E. W., Williamson, J. M. Influence of electrical stimulus parameters on afterdischarge thresholds in the rat hippocampus. Epilepsy Research. 13 (3), 205-213 (1992).
- Lewczuk, E., et al. Electroencephalography and behavior patterns during experimental status epilepticus. Epilepsia. 59 (2), 369-380 (2018).
- Wenker, I. C., et al. Postictal death is associated with tonic phase apnea in a mouse model of sudden unexpected death in epilepsy. Annals of Neurology. 89 (5), 1023-1035 (2021).
- Morimoto, K., Fahnestock, M., Racine, R. J. Kindling and status epilepticus models of epilepsy: rewiring the brain. Progress in Neurobiology. 73 (1), 1-60 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır