JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
측두엽 간질에 대한 모델을 생성하기 위해 전기적으로 점화되는 VGAT-Cre 마우스를 위한 전극의 준비 및 이식
요약
이 보고서는 형질전환 VGAT-Cre 마우스의 전기적 점화를 기반으로 측두엽 간질 모델을 생성하는 방법을 설명합니다. 점화된 VGAT-Cre 마우스는 간질의 원인을 파악하고 새로운 치료법을 스크리닝하는 데 유용할 수 있습니다.
초록
VGAT-Cre 마우스의 전기 점화가 자발적인 모터 및 전기 발작을 유발한다는 것이 발견되었습니다. 최근 논문은 점화 후 자발적인 재발 발작 (SRS)을 발생시키는 데 독특한 VGAT-Cre 마우스가 어떻게 사용되었는지에 초점을 맞추 었으며 VGAT 유전자에 Cre를 삽입하는 메커니즘이 발현을 방해하고 GABAergic 톤을 감소 시켰습니다. 현재 연구는 이러한 관찰을 더 큰 생쥐 코호트로 확장하여 SRS가 점화 후 지속되는 기간과 동물의 성별 및 연령의 영향과 같은 주요 문제에 초점을 맞춥니다. 이 보고서는 다음과 같은 주요 단계에 대한 프로토콜을 설명합니다 : 전기 자극 및 뇌파도 읽기를위한 해마 깊이 전극이있는 헤드셋 만들기; 헤드셋이 떨어지지 않도록 마우스의 두개골에 단단히 고정하는 수술; 펄스 지속 시간, 열차 주파수, 열차 지속 시간 및 주입 전류량과 같은 전기 점화 프로토콜의 주요 세부 정보. 점화 프로토콜은 대부분의 VGAT-Cre 마우스에서 간질을 안정적으로 유발한다는 점에서 강력하여 새로운 항간질제를 테스트할 수 있는 새로운 모델을 제공합니다.
서문
간질은 상당한 경제적, 인간적 부담을 안고 있는 주요 신경 장애입니다. NINDS는 간질을 앓고 있는 미국인이 300만 명에 달하는 것으로 추정합니다. 이 환자 중 약 60만 명이 측두엽 간질(TLE)을 앓고 있습니다1. 안타깝게도 TLE의 의학적 치료는 환자의 1/3에서 효과가 없거나 약물 내성이 발생하거나 부작용에 대한 불내성으로 인해 실패합니다2. 분명히, TLE에 대한 새로운 치료법을 개발할 필요가 있으며, 이는 미국 간질 학회 기초 과학 위원회(American Epilepsy Society Basic Science Committee), 전임상 간질 약물 발견을 위한 국제 간질 퇴치 실무 그룹(International League Against Epilepsy Working Group for Preclinical Epilepsy Drug Discovery) 및 국가 자문 신경 장애 및 뇌졸중 위원회(National Advisory Neurological Disorders and Stroke Council) 3,4가 공유하는 결론입니다.
측두엽 간질의 현재 동물 모델은 화학경련제(예: kainate, pilocarpine) 또는 장기간 전기 자극을 사용하여 오래 지속되는 간질 상태를 유도한다 5,6,7. 많은 동물들이 시술 중에 사망합니다 (쥐에서 10 % -30 %, 쥐에서 최대 90 %8). 생존하고 간질이 발생하는 동물은 뇌 전체에 걸쳐 광범위한 신경 세포 사멸을 보입니다 9,10. 이 죽음은 미세아교세포, 성상교세포 및 침윤성 단핵구의 활성화로 시작하여 일련의 반응을 유발합니다. 뉴런 반응에는 회로 재구성(예: 이끼 낀 섬유 발아), 회로에 제대로 통합되지 않는 새로운 뉴런의 탄생(예: 이소성 과립 세포) 및 과흥분성으로 이어지는 내재적 변화(예: Na+ 채널의 상향 조절)가 포함됩니다. 심각한 신경 세포 사멸이 없는 간질 모델은 새로운 항간질제에 대한 검색을 용이하게 할 것입니다.
간질에 대한 GABA 가설을 시험하는 동안, VGAT-Cre 마우스를 약한 전기 점화 프로토콜로 치료하면 자발적인 운동 및 전기 발작이 일어난다는 것이 발견되었다11. 일반적으로 설치류의 전기적 점화는 간질을 정의하는 자발적인 발작으로 이어지지는 않지만, 과도하게 점화되는 경우에는 가능할 수 있다11. VGAT-Cre 마우스는 GABAergic 억제 뉴런에서 특이적으로 발현되는 소포성 GABA 수송체(VGAT) 유전자의 제어 하에 Cre 재조합효소를 발현합니다. Cre의 삽입은 mRNA 및 단백질 수준에서 VGAT의 발현을 방해하여 해마에서 GABAergic 시냅스 전달을 손상시키는 것으로 밝혀졌습니다. 점화된 VGAT-Cre 마우스는 간질 생성과 관련된 메커니즘을 연구하고 새로운 치료제를 스크리닝하는 데 유용할 수 있다고 결론지었다11. 현재 보고서는 모델 생성에 사용되는 방법을 자세히 제공합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
동물 사용은 ARRIVE12 지침을 따랐으며 버지니아 대학의 동물 관리 및 사용위원회의 승인을 받았습니다.
1. 두 개의 양극 전극이 있는 헤드셋 만들기(그림 1)
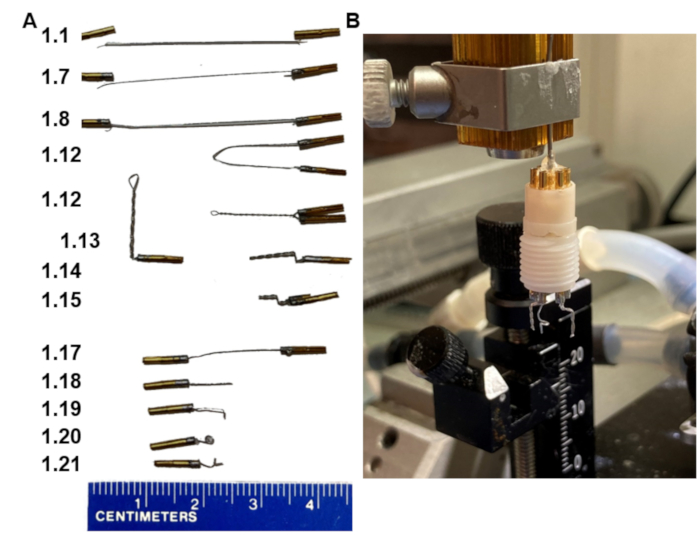
그림 1: EEG 헤드셋 제작의 주요 단계. (A) 프로토콜의 다양한 단계에서 전극의 모양(왼쪽 일치 단계의 숫자). (B) 정위 프레임에 맞는 수제 홀더에 장착 된 최종 제품의 사진. 홀더는 헤드셋 받침대에 맞는 칼라 핀 어셈블리로 끝납니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 3.5cm의 스테인리스 폴리테트라플루오로에틸렌 코팅 스테인리스 스틸 와이어를 자릅니다.
- 양쪽 끝의 전선에서 절연 코팅을 약 1mm 벗겨냅니다. 와이어를 너무 많이 벗기지 마십시오.
- 더 긴 슬릿이 있는 핀의 바닥 부분이 아래를 향하도록 바이스 홀더에 두 개의 핀을 놓습니다.
- 와이어의 벗겨진 끝과 핀 상단에 플럭스를 적용합니다.
- 와이어의 벗겨진 부분을 코팅하기에 충분한 땜납으로 주석 처리합니다.
- 측면에 넘치지 않고 핀 상단에 최소한의 땜납을 추가하십시오.
- 땜납이 녹는 동안 와이어의 벗겨진 끝의 한쪽 끝을 가능한 한 깊이 핀에 넣습니다.
알림: 와이어가 나올 수 있는 측면 구멍이 있습니다 - 와이어가 핀에서 나오지 않도록 하십시오. 벗겨진 모든 와이어는 핀 안에 있어야 합니다. - 두 번째 핀에 대해 1.6-1.7단계를 반복하고 이제 와이어의 다른 벗겨진 끝을 사용합니다.
- 핀을 고정할 때까지 30초 동안 그대로 두고 바이스 홀더에서 핀을 제거한 다음 핀을 당겨 와이어와 핀 사이의 연결이 강하고 고정되는지 확인합니다.
- 핀을 찬물로 헹구고 말리십시오.
- 저항계를 사용하여 핀 1과 핀 2 사이의 컨덕턴스를 확인합니다.
- 와이어 끝에 있는 핀을 함께 가져옵니다. 그것들을 평행하게 잡고 닫습니다. 지혈제를 와이어 중앙에 고정합니다. 그런 다음 지혈기를 돌려서 와이어가 상당히 단단히 꼬이도록 합니다. 지혈제를 제거하십시오.
- Clamp 핀에서 2mm 아래 꼬인 와이어에 집게를 끼우고 와이어를 90°로 구부립니다.
- 동일한 와이어를 집게 위로 다시 90° 뒤로 밀어 첫 번째에서 1mm 더 구부립니다.
- 꼬인 와이어를 작고 날카로운 가위로 45mm에서 굽힘 아래 3.5° 각도로 자릅니다.
- 각 헤드셋에 대해 이러한 양극성(이중 핀 꼬임) 전극 중 두 개를 준비합니다(선택 사항, 두 번째는 첫 번째 전기적 문제가 있는 경우 백업).
- 양쪽 끝에 납땜된 핀이 있는 와이어를 두 개로 절단하여 하나의 단일 기준 전극을 준비합니다(단계 1.1-1.17, 그림 1A).
- 와이어를 7mm로 자릅니다.
- 끝을 끝 아래 1mm 구부립니다.
- 그런 다음 구부러진 와이어 1mm 끝을 집게로 덮고 집게 주위로 와이어를 단단히 돌려 작은 고리(직경 1mm)를 만듭니다.
- 와이어의 직선 부분에 수직으로 루프를 구부려 와이어 팁이 다시 바깥쪽을 향하도록 합니다.
- 두 개의 바이폴라 전극과 단일 기준 전극을 6핀 받침대에 조립하여 바이폴라 전극이 6mm 간격으로 나란히 있고 기준 전극이 중간 외부 구멍에 배치되도록 합니다(그림 1B).
알림: 다른 방법은 전극을 이식하고 제자리에 시멘트를 바른 다음 받침대에 핀을 삽입하는 것입니다.
2. 정위 전극 주입
- 수술 전에 모든 수술 도구와 6핀 전극 어셈블리를 고압증기멸균으로 소독하십시오. 수술 중에는 멸균 수술 부위를 유지해야 하며 멸균 수술용 장갑을 사용해야 합니다. 멸균 커튼(예: Press n' Seal)은 수술 부위를 제외하고 동물을 덮는 것이 좋습니다.
- 이유 후 4주 후에 수술을 위해 8주령의 VGAT-Cre 마우스(연령 일치, 수컷과 암컷 모두)를 사용합니다. 수술 후 체중 감소를 측정할 수 있도록 수술 전에 동물의 체중을 기록합니다.
- 인증된 이소플루란 기화기 또는 정밀 주사기 펌프, 통합 디지털 기화기 및 피드백 열 패드가 장착된 저유량 마취 시스템을 사용하십시오.
참고: 저유량 시스템은 동물의 크기에 비례하는 낮은 유속으로 유도 챔버 또는 정위 프레임의 노즈 콘을 통해 마취를 전달할 수 있습니다(70mL/분, 공기 중 이소플루란 농도는 유도의 경우 4%, 수술의 경우 2%). 마취를 줄이면 수술 중 동물에게 도움이 될 뿐만 아니라 실험실 직원이 이소플루란에 노출될 위험도 줄어듭니다. - 수술 중에 따뜻하게 유지하기 위해 37°C로 예열된 가열된 패드에 마취된 동물을 놓습니다. 피드백 제어 온도 시스템을 사용하는 경우 수술 중 온도 모니터링을 위해 가볍게 윤활된 온도 프로브를 동물의 직장에 삽입하십시오.
- 귀 바를 귀에 부드럽게 넣고 앞니를 앞니 바에 부드럽게 넣어 동물을 정위 프레임에 장착하십시오. 적절한 마취 전달을 위해 코 위에 노즈 콘을 놓습니다. 헤드가 수평을 이루고 중앙에 있고 약간 조사할 때 움직일 수 없는지 확인하십시오.
- 수화를 위해 0.5mL의 노르모솔을 피하 주사합니다.
- 각막 건조를 방지하기 위해 안구 윤활제를 바르십시오.
- 뒷다리 발가락을 꼬집은 후 금단 반사가 없어 마취 깊이를 모니터링 한 다음 수술 중 이소 플루 란을 1.5 % -2.0 %로 줄입니다.
- 가위(면도) 또는 제모 크림을 뽑거나 사용하여 수술 부위와 주변의 머리카락을 제거하고 요오드와 에탄올을 번갈아 가며 3회 주기로 피부를 소독하고 요오드로 마무리합니다. 수술 부위에서 머리카락을 제거하는 것은 해당 위치에서 마취를 유지할 수 있는 수단이 있는 경우에만 권장됩니다. 필요한 경우 알코올에 적신 화장솜 어플리케이터를 사용하여 머리 주변 부위의 털을 제거합니다. 국소 진통제 부피바카인(0.25%) 0.05mL를 피하 주사한다.
- 메스를 사용하여 두개골을 절개 한 다음 날카로운 수술 용 가위로 피부 일부를 잘라내어 두개골을 노출시킵니다. 면봉을 사용하여 피부를 옆으로 밀고 시야를 방해하는 모든 근육과 밑에있는 조직에서 두개골을 닦아냅니다.
알림: 우발적인 출혈을 멈추려면 멸균 면봉으로 출혈 부위가 멈출 때까지 압력을 가하십시오. - 멸균 면봉을 사용하여 과산화수소로 두개골을 청소하여 두개골 봉합사와 브레그마와 람다를 모두 볼 수 있도록 합니다.
- 두개골을 완전히 건조시킨 다음 어플리케이터를 사용하여 자체 에칭 치과용 접착제 한 방울을 바릅니다. 두개골에 솔질하고 60초 동안 기다렸다가 치과용 자외선으로 40초 동안 치료합니다. 광택 표면은 접착제가 두개골과 효과적으로 가교되었음을 나타냅니다.
참고: 이 단계는 헤드셋을 안전하게 부착하는 데 중요합니다. - 0.031" 드릴 비트(0.79mm)를 사용하여 해마 깊이 전극(약 5,000rpm)을 이식하기 위해 두 개의 버 구멍을 양측으로 뚫습니다. 람다 뒤의 소뇌 위에 기준 전극을 위한 버 구멍을 하나 더 뚫습니다.
알림: 드릴링할 때 드릴을 천천히 내리고 뇌에 구멍을 뚫지 않도록 주의하십시오. - 전극의 좌표는 다음과 같습니다 (브레그마에서 mm 단위) : 후방 3mm, 측면 3mm 및 깊이 3mm의 해마 전극; 및 후방 6mm, 측면 0mm, 깊이 0mm(경막하)의 소뇌 기준 전극.
- 정확도를 높이려면 정밀하게 장착된 드릴을 사용하고 브레그마를 만질 때 정체 조작기 X/Y 축을 영점 조정하십시오 - 이것은 좌표의 기준점입니다.
- 6핀 받침대에 모든 전극을 삽입하여 헤드셋을 조립하고 핀이 받침대 안으로 완전히 밀어 넣어졌는지 확인합니다. 받침대를 정위 프레임의 전극 홀더에 장착합니다(그림 1B).
- 해당 버 구멍 위에 전극을 맞춥니다. 헤드셋을 천천히 내리고 전극을 버 구멍으로 안내하여 좌우 해마와 기준 전극에 꼬인 양극성 스테인리스 스틸 와이어 전극을 소뇌에 정위 이식합니다.
- 해마 트위스트 전극이 구멍 바로 위에 있으면 Z 축을 영점으로 만들고 천천히 -3.0mm로 내립니다.
- 두개골 표면과 전극을 치과 용 시멘트로 덮고 두개골 표면과 받침대 바닥 사이의 공간을 채 웁니다. 피부 가장자리는 치과용 시멘트에 인접하여 밑에 있는 조직이 노출된 상태로 유지되지 않습니다. 시멘트가 마르고 굳을 때까지 기다리십시오. 그런 다음 전극 홀더를 정위 암에서 분리하고 받침대에서 홀더를 제거합니다.
- 진통을 위해 0.1mL의 케토프로펜(1mg/mL, SC)을 주사하고 수분 공급을 위해 0.5mL의 노르모솔(SC)의 두 번째 용량을 주입하고 정위 프레임에서 동물을 제거합니다.
- 37°C로 예열된 등온 패드를 종이 타월로 덮인 빈 동물 사육장 안에 넣습니다. 완전히 깨어 나면 침구와 부드러운 음식이있는 깨끗한 새장에 동물을 넣고 동물 사육장으로 되돌려 보냅니다. 이 시점부터 동물들은 서로의 헤드셋을 씹는 것을 방지하기 위해 단독으로 수용됩니다. 와이어 바 호퍼는 헤드셋이 끼는 것을 방지하기 위해 사용되지 않으며 대신 물병이 케이지 상단의 아래쪽에 묶여 있고 차우가 침구에 있습니다.
- 수술 후 72 시간 동안 동물에게 부드러운 음식을 먹이고 체중 감소 및 신체 상태 점수를 모니터링하십시오. 탈수 된 동물은 탈수 된 경우 0.5 mL의 노르 모솔을 피하 투여 할 수 있습니다 (체중 감소, 피부 팽창 증가, 눈의 침몰). 케토프로펜은 수술 후 2일 더 하루에 한 번 피하 투여할 수 있습니다(현지 IACUC 지침에 따라 진통 요법을 따르십시오). 동물이 EEG 기록 시스템으로 옮기기 전에 4-7일 동안 새장에서 완전히 회복되도록 합니다.
3. 전기 점화 프로토콜
- 마우스 헤드와 정류자의 소켓에 맞는 유연한 케이블을 사용하여 마우스를 EEG 기록 시스템에 연결합니다( 재료 표 목록 참조). 아래의 전기 자극 프로토콜을 진행하기 전에 동물이 하루 동안 적응하도록 하십시오. 매일 전반적인 건강 및 순응을 모니터링하고 질병, 고통 및/또는 25%를 초과하는 지속적인 체중 감소의 징후가 있는 경우 시스템에서 제거하십시오.
- 자극 전극의 두 리드를 정전류 자극기의 출력에 연결합니다.
알림: 이러한 전극을 EEG 기록기에서 자극기로 전환하는 회로 기판이 있으면 매우 유용합니다. - 2초 동안 50Hz에서 1ms 펄스를 전달하도록 자극기를 설정합니다.
- 자극기의 출력을 20μA로 설정하고 1차 펄스를 전달합니다.
- 전기 자극 펄스보다 오래 지속되는 고주파 스파이크의 방전 후 특성에 대해 EEG를 모니터링합니다.
- 방전이 관찰되지 않으면 방전 후 트리거될 때까지 주입되는 전류의 양을 20μA 단위로 늘립니다. 필요한 전류의 양은 방전 후 임계값(ADT)입니다.
- 일반적인 ADT는 20-50μA입니다. 200μA로 증가한 후에도 방전이 관찰되지 않으면 고감도 저항계를 사용하여 전기 연결 및 헤드셋 배선 문제를 해결해야 합니다. 자극 전극에 문제가 있는 경우 다른 깊이 전극으로 자극을 시도하십시오.
- 동물은 해당 마우스의 ADT 값의 1.5배인 전류를 사용하여 하루에 2배 또는 6배를 자극하여 불을 붙입니다.
- 상태의 변화에서 떨어지는 양측 긴장 간대 발작으로 상승하는 자극에 대한 행동 반응을 모니터링하십시오. 수정된 라신 클래스 시스템을 사용하여 점수매기기 11. 치명적인 긴장성 발작을 피하기 위해, 연속적인 자극이 발작의 심각성과 발작 기간을 최대 6점(달리기 및 점프)까지 증가시키는 경우 점화를 일시 중지해야 합니다
Access restricted. Please log in or start a trial to view this content.
결과
마리
이 모델은 원래 혼합 배경에서 VGAT-Cre 마우스(Slc32a1tm2(cre)Lowl/J)13 를 사용하여 개발되었습니다. 그러나 C57BL/6J와 유사한 VGAT-Cre 균주에도 적용되었습니다. 균주 간에 발생하는 간질에서는 차이가 관찰되지 않았습니다. 두 균주 모두 소포 GABA 수송체 프로모터의 제어 하에 Cre 재조합효소를 발현합니다. 이들 마우스는 Vgat 유전자에서 코돈을 정지시...
Access restricted. Please log in or start a trial to view this content.
토론
이 보고서는 생쥐의 전기 점화가 간질을 유발하는 프로토콜을 설명합니다. 자극 전극이 해마에 위치하기 때문에 이것은 환자의 측두엽 간질(TLE)을 모델링하는 국소 변연계 간질입니다. 이 프로토콜의 중요한 단계는 VGAT-Cre 마우스를 사용하는 것인데, Vgat 유전자에 IRES-Cre 재조합 효소 카세트가 삽입되어 손상된 억제성 GABA 전류를 나타낸다11. C57BL/6은 이 프로토콜로 발을 붙...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 갈등이 없습니다.
감사의 말
저자는 이 프로토콜에 대한 유용한 토론을 해준 John Williamson에게 감사를 표합니다. 이 작업은 NIH/NINDS 보조금 NS112549의 지원을 받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 16 Channel Extracellular Differential AC Amplifier (115V/60Hz) | AD Instruments | AM3500-115-60 | Alternate EEG amplifier |
| 363/CP PLUG COLLAR, PINS SLEEVE | P1 Technologies | 363SLEEVPIN0NL | For electrode holder |
| Cable, 363-363 5CM - 100CM W/MESH 6TCM | P1 Technologies | 363363XXXXCM004 | mouse-to-commutator cable |
| CCTV cameras Qcwox HD Sony IR LED | Sony | QC-SP316 | |
| Commutator SL6C/SB (single brush) | P1 Technologies | 8BSL6CSBC0MT | formerly Plastics One, Inc. |
| Current amplifier | A-M Systems | Model 2100 | |
| Dental cement | Stoelting | 51459 | |
| Drill bits, #75, OD 0.310" LOC 130 PT | Kyocera | 105-0210.310 | |
| E363/0 SOCKET CONTACT SKEWED | P1 Technologies | 8IE3630XXXXE | pins for connector |
| iBond Self Etch glue | Kulzer | CE0197 | |
| MS363 PEDESTAL 2298 6 PIN WHITE | P1 Technologies | 8K000229801F | EEG headset connector |
| Ohmeter | Simpson | 260 | High sensitivity |
| PowerLab 16/35 and LabChart Pro | AD Instruments | PL3516/P | Alternate EEG software |
| SomnoSuite | Kent Scientific Corp. | SS-01 | anesthesia unit & RightTemp monitoring |
| Stereotactic drill and micromotor kit | Foredom Electric Co. | K.1070 | |
| Stereotactic frame | David Kopf Instruments | Model 940 | |
| Teflon-coated wire for depth electrode, OD 0.008' | A-M Systems | 791400 | |
| VGAT-Cre mice on congenic C57BL/6J background | The Jackson Laboratory | 000664 |
참고문헌
- Lekoubou, A., Bishu, K. G., Ovbiagele, B. Nationwide trends in medical expenditures among adults with epilepsy: 2003-2014. Journal of the Neurological Sciences. 384, 113-120 (2018).
- Hauser, W. A., Hesdorffer, D. C. Epilepsy: Frequency, Causes, and Consequences. Epilepsy Foundation of America. , (1990).
- Galanopoulou, A. S., et al. Identification of new epilepsy treatments: issues in preclinical methodology. Epilepsia. 53 (3), 571-582 (2012).
- Kehne, J. H., Klein, B. D., Raeissi, S., Sharma, S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochemical Research. 42 (7), 1894-1903 (2017).
- Buckmaster, P. S. Laboratory animal models of temporal lobe epilepsy. Comparative Medicine. 54 (5), 473-485 (2004).
- Levesque, M., Avoli, M., Bernard, C. Animal models of temporal lobe epilepsy following systemic chemoconvulsant administration. Journal of Neuroscience Methods. 260, 45-52 (2016).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Wang, L., Liu, Y. H., Huang, Y. G., Chen, L. W. Time-course of neuronal death in the mouse pilocarpine model of chronic epilepsy using Fluoro-Jade C staining. Brain Research. 1241, 157-167 (2008).
- Dey, D., et al. A potassium leak channel silences hyperactive neurons and ameliorates status epilepticus. Epilepsia. 55 (2), 203-213 (2014).
- Straub, J., et al. Characterization of kindled VGAT-Cre mice as a new animal model of temporal lobe epilepsy. Epilepsia. 61 (10), 11(2020).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biology. 8 (6), 1000412(2010).
- Vong, L., et al. Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons. Neuron. 71 (1), 142-154 (2011).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, (2016).
- Lothman, E. W., Bertram, E. H., Bekenstein, J. W., Perlin, J. B. Self-sustaining limbic status epilepticus induced by 'continuous' hippocampal stimulation: electrographic and behavioral characteristics. Epilepsy Research. 3 (2), 107-119 (1989).
- Lothman, E. W., Williamson, J. M. Influence of electrical stimulus parameters on afterdischarge thresholds in the rat hippocampus. Epilepsy Research. 13 (3), 205-213 (1992).
- Lewczuk, E., et al. Electroencephalography and behavior patterns during experimental status epilepticus. Epilepsia. 59 (2), 369-380 (2018).
- Wenker, I. C., et al. Postictal death is associated with tonic phase apnea in a mouse model of sudden unexpected death in epilepsy. Annals of Neurology. 89 (5), 1023-1035 (2021).
- Morimoto, K., Fahnestock, M., Racine, R. J. Kindling and status epilepticus models of epilepsy: rewiring the brain. Progress in Neurobiology. 73 (1), 1-60 (2004).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유