Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Efecto del ácido hialurónico 35 kDa en un modelo in vitro de lesión prematura del intestino delgado y curación utilizando monocapas derivadas de enteroides
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un método para establecer y realizar un ensayo de herida por rasguño en monocapas bidimensionales (2D) derivadas de enteroides tridimensionales (3D) aislados del íleon de primates no humanos.
Resumen
Los ensayos de heridas por rasguño in vitro se utilizan comúnmente para investigar los mecanismos y características de la curación epitelial en una variedad de tipos de tejidos. Aquí, describimos un protocolo para generar una monocapa bidimensional (2D) a partir de enteroides de primates no humanos tridimensionales (3D) derivados de criptas intestinales del íleon terminal. Estas monocapas derivadas de enteroides se utilizaron en un ensayo in vitro de herida por rasguño para probar la capacidad del hialuronano 35 kDa (HA35), un imitador de HA de la leche humana, para promover la migración y proliferación celular a lo largo del borde de la herida epitelial. Después de que las monocapas se cultivaron hasta la confluencia, se rayaron manualmente y se trataron con HA35 (50 μg / ml, 100 μg / ml, 200 μg / ml) o control (PBS). La migración celular y la proliferación en la brecha se obtuvieron imágenes utilizando un microscopio de luz transmitida equipado para imágenes de células vivas. El cierre de la herida se cuantificó como porcentaje de cicatrización de heridas utilizando el complemento Wound Healing Size en ImageJ. El área de rasguño y la tasa de migración celular y el porcentaje de cierre de la herida se midieron durante 24 h. HA35 in vitro acelera la cicatrización de heridas en monocapas enteroides del intestino delgado, probablemente a través de una combinación de proliferación celular en el borde de la herida y migración al área de la herida. Estos métodos pueden usarse potencialmente como modelo para explorar la regeneración intestinal en el intestino delgado humano prematuro.
Introducción
La enterocolitis necrosante (ECN) es una de las urgencias gastrointestinales más frecuentes en lactantes prematuros1. La enfermedad se caracteriza por una inflamación intestinal severa que puede deteriorarse rápidamente a necrosis intestinal, sepsis y potencialmente la muerte. Aunque la etiología no está clara, la evidencia sugiere que la ECN es multifactorial y el resultado de una compleja interacción de alimentación, colonización bacteriana anormal y epitelio intestinal inmaduro 2,3. Los lactantes prematuros tienen mayor permeabilidad intestinal, colonización bacteriana anormal y baja capacidad regenerativa de enterocitos4,5, lo que aumenta el riesgo de disfunción de la barrera intestinal, translocación bacteriana y desarrollo de NEC. Por lo tanto, identificar estrategias o intervenciones para acelerar la maduración epitelial intestinal y promover la regeneración o curación del epitelio intestinal es fundamental para prevenir esta enfermedad mortal.
Los estudios han demostrado que la leche materna (HM) protege contra la ECN en lactantes prematuros 6,7,8,9,10,11. Tanto los estudios en humanos como en animales han demostrado que la fórmula de base bovina aumenta la permeabilidad intestinal y es directamente tóxica para las células epitelialesintestinales 2,12. Aunque no está completamente dilucidado, la evidencia sugiere que los efectos protectores de HM están mediados por componentes bioactivos como lactoferrina, inmunoglobulina A (IgA) y oligosacáridos HM13. HM también es rico en hialuronano (HA), un glicosaminoglicano no sulfatado único con ácido D-glucurónico repetitivo y N-acetil-D-glucosamina disacáridos14,15. Es importante destacar que hemos demostrado que el HA oral de 35 kDa (HA35), un imitador de HM HA, atenúa la gravedad de la lesión intestinal, previene la translocación bacteriana y disminuye la mortalidad en un modelo murino de lesión intestinal similar a NEC16,17.
Aquí, los efectos de HA35 en la curación intestinal y la regeneración in vitro se investigan más a fondo. Actualmente, el ensayo in vitro más utilizado para heridas intestinales y reparación es un ensayo de herida por rasguño realizado en monocapas de células de cáncer colorrectal (CCR). La relevancia fisiológica de tal modelo para el intestino del lactante prematuro es limitada, ya que la reparación de heridas de las células del CCR depende en gran medida de la naturaleza altamente proliferativa de las células cancerosas en lugar de los procesos de reparación impulsados por células madre18. Para superar esta limitación, aquí se describe el establecimiento de un modelo de herida por rasguño enteroide 2D, incluido el procedimiento de aislamiento y mantenimiento de enteroides intestinales delgados derivados de células madre primarias de primates prematuros no humanos (NHP). Dado que la ECN prematura se informa con mayor frecuencia en el intestino delgado distal, el uso de organoides de células epiteliales primarias en un modelo de daño y reparación intestinal proporciona un modelo in vitro más fisiológicamente traducible en comparación con los modelos existentes que utilizan monocapas colorrectales tradicionales18,19.
Protocolo
Todos los procedimientos con animales en este estudio fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales del Centro de Ciencias de la Salud de la Universidad de Oklahoma. Después de la aprobación institucional, se obtuvieron muestras fetales de conveniencia del intestino delgado de un primate no humano prematuro (NHP, 90% gestación, babuino oliva, Papio anubis) después de la eutanasia para un estudio separado (Protocolo # 101523-16-039-I)20.
1. Establecimiento de enteroides intestinales 3D de primates no humanos prematuros
- Preparación de los medios
NOTA: Los medios se pueden preparar hasta 1 semana antes del aislamiento de la cripta siguiendo la técnica aséptica estándar. La penicilina/estreptomicina (concentración final del 1%) se puede utilizar en lugar de los antibióticos de amplio espectro para las células primarias si se desea.- Prepare el medio de crecimiento de organoides humanos + Y-27632 (HOGMY) mezclando 50 mL de medio de crecimiento de organoides medio basal humano con 50 mL de suplemento de organoide (Tabla de materiales). Añadir 200 μL de los antibióticos de amplio espectro (concentración final 100 μg/ml) (tabla de materiales) e Y-27632 (a una concentración final de 10 μM). Caliente en la mesa de trabajo a temperatura ambiente.
- Prepare los medios de crecimiento de organoides humanos (HOGM) mezclando 50 ml de medio basal humano medio de crecimiento organoide con 50 ml de suplemento organoide. Añadir 200 μL de los antibióticos de amplio espectro (100 μg/ml). Caliente en la mesa de trabajo a temperatura ambiente.
NOTA: HOGM se utilizará cuando se cambie de medio más allá de los primeros 2-3 días posteriores a la aprobación. - Enfríe 100 ml de 1x solución salina tamponada con fosfato (PBS) sin calcio ni magnesio hasta que esté helada.
- Prepare 50 ml de tampón de lavado combinando 1x PBS sin calcio ni magnesio con albúmina sérica bovina (BSA) al 0,1%. Enfríe hasta que esté helado.
- Prepare el tampón de lavado DMEM-F12 agregando 1 ml de antibióticos de amplio espectro (100 μg / ml) a 500 ml de DMEM / F12 (Medio de águila modificada de Dulbecco/mezcla de jamón nutriente F12 + 15 mM HEPES tampón). Manténgalo helado.
- Aislamiento y chapado de criptas
NOTA: El hidrogel a base de matriz extracelular (ECM) debe permanecer en el hielo durante todo el procedimiento. Este procedimiento supone suficiente tejido para poblar seis domos de hidrogel basados en ECM. Si se cosecha una densidad diferente de criptas, el número de la cúpula debe modificarse en consecuencia.- Descongele 150 μL de extracto de membrana basal (BME) reducido (TFG) con factor de crecimiento reducido (TFG) durante la noche en el hielo a 2-8 °C.
- Incubar una placa de poliestireno tratado con cultivo de tejidos de fondo plano de 24 pocillos en una incubadora a 37 °C y 5% deCO2 durante un mínimo de 30 minutos antes de su uso.
- Después de la eutanasia NHP y la recolección de tejidos, enjuague el segmento de íleon de residuos con una punta de pipeta de 1,000 μL usando PBS 1x helado en una placa de Petri desechable.
NOTA: El tejido fresco debe cosecharse rápidamente y mantenerse helado para cosechar enteroides sanos. - Corte el íleon longitudinalmente a lo largo de todo el intestino y lávese con PBS 3x helado. Picar el tejido en pequeños fragmentos (aproximadamente 2 mm de longitud) con tijeras estériles sobre un tubo cónico de 50 ml que contiene 15 ml de PBS helado, comenzando desde la porción del segmento ileal más cercana al tubo.
- Use una pipeta serológica de 10 ml para interrumpir las criptas pipeteando hacia arriba y hacia abajo 5-10x. Deje que los segmentos de tejido se asienten en el fondo del tubo, luego retire el sobrenadante y reemplácelo con PBS fresco y helado. Repita este proceso un mínimo de 7x-10x hasta que el sobrenadante esté limpio y libre de residuos.
- Una vez claro, retire el sobrenadante y vuelva a suspender las criptas en 25 ml de reactivo de disociación celular. Coloque el tubo en una plataforma oscilante a 20 rpm durante 15 minutos a temperatura ambiente.
- Retire el tubo del balancín, deje que las células se asienten durante aproximadamente 30 s a 1 min, y retire el sobrenadante. Agregue 10 ml de tampón de lavado helado. Pipetear hacia arriba y hacia abajo con una pipeta p1000 para disociar aún más en criptas individuales.
- Filtre el tejido a través de un filtro celular de 70 μm en un nuevo tubo cónico de 50 ml. Enjuague el tubo cónico original de 50 ml con 10 ml de tampón de lavado helado y filtre a través del filtro de 70 μm para asegurarse de que todas las criptas se hayan retirado del tubo original. Repita este lavado de pañuelos de papel para un total de 4x enjuagues.
- Centrifugar el filtrado a 300 x g durante 5 min a 4 °C y retirar el sobrenadante. Añadir 600 μL de HOGMY e interrumpir el pellet pipeteando hacia arriba y hacia abajo con una pipeta de 200 μL. Coloque el tubo sobre hielo hasta que la solución se enfríe como el hielo.
NOTA: Si la solución no está helada, la cúpula no mantendrá la estructura adecuada cuando esté plateada. Evite introducir burbujas al pipetear domos de hidrogel a base de ECM, ya que las burbujas evitarán la adherencia adecuada al fondo de la placa. - Añadir 600 μL de hidrogel helado a base de ECM para suspender el pellet celular y mezclar bien con una pipeta de 200 μL.
- Retire la placa de 24 pocillos de la incubadora y colóquela en un calentador de placas a 37 °C. Pipetear 50 μL de mezcla de hidrogel helada a base de HOGMY/ECM en el centro de 24 pocillos de una placa de cultivo de 24 pocillos (50 μL por domo).
- Una vez plateadas, deje que las cúpulas se asienten en un calentador de placas a 37 ° C durante 1 minuto para permitir la adherencia a la parte inferior de la placa. Invierta cuidadosamente la placa, asegúrese de que no se haya acumulado condensación en la parte inferior de la placa y coloque la placa invertida en la incubadora a 37 °C y 5% deCO2.
- Después de 15 minutos, gire la placa hacia arriba y pipete 750 μL de HOGMY a temperatura ambiente en cada pocillo.
NOTA: Pipetea los medios lentamente sobre la pared lateral de los pocillos, teniendo cuidado de no interrumpir la cúpula de hidrogel basada en ECM 3D recién formada. - Una vez que todos los pocillos se hayan llenado con medios, coloque la placa en la incubadora y cambie el medio cada 3 días con 750 μL de HOGM. Paso enteroides cada 7-10 días.
- Evacuación enteroide intestinal
NOTA: El siguiente protocolo es para una placa de cultivo de 24 pocillos que contiene enteroides NHP a una velocidad de división de 1:2.- Retire los medios enteroides de cada pocillo, teniendo cuidado de no interrumpir la cúpula ECM que contiene enteroides, agregue 500 μL de reactivo de disociación de células heladas a cada pocillo con una pipeta de 1.000 μL e incube a temperatura ambiente durante 1 minuto.
- Interrumpa manualmente el ECM pipeteando hacia arriba y hacia abajo 8-12x. Transfiera el contenido de 12 pocillos a un tubo cónico de 15 ml.
- Una vez que se haya recogido toda la solución de la placa de cultivo de 24 pocillos, agregue 250 μL de reactivo de interrupción celular a cada pocillo para asegurarse de que todos los enteroides NHP se hayan eliminado de cada pocillo, agregando este último enjuague a los tubos cónicos de 15 ml existentes.
- Colóquelo en una plataforma oscilante a 40 rpm durante 15 min a temperatura ambiente (20 °C). Alternativamente, agite manualmente los tubos durante 15 minutos a temperatura ambiente.
- Después de 15 min, centrifugar a 300 x g durante 5 min a 4 °C. Retire el sobrenadante de los tubos de 15 ml hasta que solo quede el pellet.
- Agregue 8 ml de DMEM helado + antibióticos de amplio espectro a un tubo cónico de 15 ml, asegurándose de que el pellet esté suficientemente interrumpido. Centrifugar a 300 x g durante 5 min a 4 °C y desechar el sobrenadante.
- Añadir 600 μL de HOGMY e interrumpir el pellet pipeteando hacia arriba y hacia abajo con una pipeta de 1.000 μL. Coloque el tubo sobre hielo hasta que la solución se enfríe como el hielo. Una vez que la solución esté helada, añadir 600 μL de ECM helada para suspender el pellet de la célula y mezclar bien con una pipeta de 1.000 μL. Repita los pasos 1.3.2.-1.3.7. para los 12 pozos restantes.
- Para los pasos restantes, consulte los pasos 1.2.11.-1.2.16.
2. Establecimiento de monocapa enteroide y ensayo de herida por rasguño
- Preparación de medios y tratamiento
- Enfríe 5 ml de PBS sin calcio o magnesio hasta que esté helado.
- Prepare el tampón de lavado DMEM-F12 agregando 1 ml de antibióticos de amplio espectro (100 μg / ml) a 500 ml de DMEM / F12 (Medio de águila modificada de Dulbecco/mezcla de jamón nutriente F12 + 15 mM HEPES tampón). Mantener el hielo frío.
- Prepare 100 ml de HOGMY, como se describe en el paso 1.1.1., y caliéntelo en la mesa de trabajo a temperatura ambiente.
- Calentar 25 ml de ácido tripsina-etilendiaminotetraacético (EDTA) al 0,25% en un baño maría a 37 °C.
- Preparar concentraciones de 50 μg/mL, 100 μg/mL y 200 μg/mL de HA35 para el tratamiento celular, utilizando PBS estéril sin calcio o magnesio como disolvente. La dilución final de HA35 utilizará HOMGY como disolvente.
NOTA: La preparación de HA35 puede requerir varias diluciones, ya que HA35 a menudo sale de la solución a una concentración superior a 5 mg / ml.
- Formación de monocapa enteroide
NOTA: El siguiente procedimiento proporciona volúmenes suficientes para la generación de una placa de 24 pocillos de monocapas enteroides. Ajuste los volúmenes para el número deseado de monocapas.- Descongele 96 μL de hidrogel BME (libre de rojo de fenol) a base de ECM durante la noche en hielo a 2-8 °C. Diluir el hidrogel a base de ECM en PBS helado sin calcio ni magnesio en una proporción de 1:50. Cubra cada pocillo de una placa de cultivo de tejido de 24 pocillos con 200 μL de hidrogel diluido a base de ECM helado.
- Incubar la placa recubierta de hidrogel a base de ECM durante un mínimo de 1 h a 37 °C y 5% deCO2. Aspirar los medios de la placa de cultivo de 24 pocillos que contiene los enteroides 3D destinados a monocapas y reemplazarlos con 500 μL de reactivo/pocillo de disociación celular.
- Interrumpa manualmente los domos de hidrogel basados en ECM pipeteando hacia arriba y hacia abajo 8x-12x y transfiera el contenido de 12 pocillos a un tubo cónico de 15 ml.
- Lave los 12 pocillos vacíos con 250 μL de reactivo de disociación celular para asegurarse de que se hayan eliminado todos los enteroides y transfiera el contenido a un tubo cónico de 15 ml. Repita el paso 2.2.5. y paso 2.2.6. para los 12 pocillos restantes utilizando un segundo tubo cónico de 15 ml.
- Centrifugar los tubos cónicos a 300 x g durante 5 min a 4 °C y desechar el sobrenadante. Agregue 10 ml de tampón de lavado DMEM-F12 helado a 15 ml de tubos cónicos y suspenda los gránulos enteroides invirtiendo los tubos. Centrifugar a 300 x g durante 5 min a 4 °C.
- Retirar el sobrenadante y resuspender los gránulos celulares en 12 mL de tripsina-EDTA a 37 °C. Coloque los tubos en un baño de agua a 37 °C durante 10 minutos o hasta que las células parezcan solubles. Agregue 3 ml de tampón de lavado DMEM-F12 a cada tubo para diluir la tripsina-EDTA, mezcle invirtiendo los tubos y colóquelos en hielo.
- Filtre los enteroides disociados a través de un filtro de células de malla de 37 μM, recogiendo el contenido en tubos cónicos limpios de 15 ml. Centrifugar los tubos a 300 x g durante 5 min a 4 °C.
- Mientras las células se peletizan en la centrífuga, retire la placa recubierta de hidrogel a base de ECM de la incubadora y aspire cualquier exceso de solución de hidrogel a base de ECM sin rayar la superficie recubierta ni dejar que la placa se seque completamente.
- Retire el sobrenadante de los tubos cónicos y resuspenda los gránulos celulares con 6 ml de HOMGY. Agregue 500 μL de la suspensión combinada de células HOMGY de 12 ml en cada pocillo de la placa de 24 pocillos recubierta con hidrogel a base de ECM a una densidad de siembra de aproximadamente 3 x 105 células/pocillo. Agite la placa con una tapa para asegurar una distribución uniforme de las células dentro de los pocillos.
- Incubar la placa a 37 °C y 5% deCO2, intercambiando medios HOMGY cada 2 días hasta que las monocapas alcancen >90% de confluencia.
- Tratamiento monocapa y ensayo de heridas por rasguño
- Una vez que las monocapas alcancen >90% de confluencia, aspire los medios para eliminar las células que no se adhieran. Tratar las células con 500 μL de HA35 (50 μg/mL, 100 μg/mL, 200 μg/mL) o PBS, disueltos en HOMGY, durante 24 h.
- Después de 24 h, retire el medio, teniendo cuidado de no interrumpir la superficie de la monocapa. Usando una punta de pipeta de 200 μL, haga un rasguño lineal en todo el diámetro de la superficie de la monocapa en cada pocillo, teniendo cuidado de no dejar que las monocapas se sequen.
- Lave las monocapas rayadas 1x con 500 μL de 1x PBS. Añadir 500 μL de HA35 (50 μg/ml, 100 μg/ml, 200 μg/ml) o PBS disuelto en HOMGY y transferir la placa al instrumento de análisis de células vivas (tabla de materiales) dentro de una incubadora de 37 °C y 5% deCO2 .
- En el icono Schedule (Programación ) en el software de análisis de células vivas (Tabla de materiales), haga clic en el icono Launch Add New Vessel Wizard (Iniciar agregar nuevo buque) y configure la frecuencia de escaneo para escanear según un cronograma. Cree un nuevo recipiente de pozo completo en Tipo de escaneo, especifique la configuración de escaneo (es decir, Fase para canales de imagen y 4x para Objetivo) y haga clic en Siguiente.
- Seleccione el fabricante de la placa y el número de catálogo de la lista proporcionada. En el icono Programación , elija el símbolo más donde se colocará la placa dentro del instrumento de análisis de células vivas. Seleccione el patrón de escaneo deseado y, a continuación, cree un mapa de placas seleccionando "+" en la página Diseño de placa. Seleccione Aplazar análisis hasta más tarde y, a continuación, establezca el Programa de escaneo para cada 4 h durante 24 h y verifique la configuración de adquisición en la página Resumen del asistente de buques . Finalmente, seleccione Agregar a programación.
- Una vez completado el ensayo 24, en el icono Ver, haga doble clic en Nombre del buque y exporte imágenes y películas. Seleccione pozos y una serie de imágenes para mostrar y exportar como JPEG. Analice las imágenes para el porcentaje de cicatrización de heridas utilizando el complemento Wound Healing Size para ImageJ21, según el paso 2.4. abajo.
- Análisis de heridas por arañazos
- Abra el software ImageJ. Cargue las imágenes del ensayo de la herida por rasguño (. TIFF o .JPG).
- Seleccione Imagen > Tipo > 8 bits para cambiar la imagen de RGB de 24 bits a 8 bits. Instale el complemento Wound Healing Size seleccionando Plugins > Macros > Install > Wound Healing Size Plugin.
- Gire la imagen para que el rasguño sea vertical e inicialice el complemento Wound Healing Size Tool.
- Seleccione los parámetros del complemento en el cuadro de diálogo para que se ajusten mejor a la herida por arañazo. Establezca el valor de los parámetros para las opciones de tamaño de cicatrización de heridas de la siguiente manera: Radio de ventana de varianza en 20, Valor de umbral en 100 y Porcentaje de píxeles saturados en 0,001, y elija Sí para Establecer escala global. Finalice la selección haciendo clic en el botón Aceptar. Verifique si el área seleccionada es el área de la herida. Los parámetros anteriores pueden requerir estandarización de laboratorio a laboratorio.
- Repita los pasos 2.4.2.-2.4.4. para los puntos de tiempo restantes para cada rasguño.
- Calcule el porcentaje de cicatrización de heridas en el área de rasguño de células migratorias o proliferantes durante 24 h de la siguiente manera:
% de cicatrización de heridas =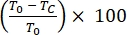
donde T 0 = % Área en el momento 0 h y Tc = % Área a las 0 h, 4 h, 12 h o 24 h.
Resultados
Los efectos de la AH en la reparación de tejidos y la cicatrización de heridas en diversos tejidos y órganos están bien documentados; sin embargo, actualmente se desconocen los efectos específicos del AH con un peso molecular de 35 kDa sobre la cicatrización y regeneración fetal o neonatal del intestino delgado. Para probar la capacidad de HA35 para promover la cicatrización de heridas en un modelo del intestino delgado fetal o neonatal, generamos enteroides intestinales 3D a partir de tejido ileal NHP y disociam...
Discusión
El tracto gastrointestinal de un recién nacido prematuro está bajo presión regenerativa continua por exposiciones repetidas a insultos ambientales asociados con disbiosis, metabolitos y toxinas bacterianas inflamatorias, e hipoxia intermitente23,24. Desafortunadamente, el epitelio intestinal del recién nacido prematuro es incapaz de establecer rápidamente la integridad funcional23, lo que resulta en disfunción de barrera, aumento de ...
Divulgaciones
Los autores no tienen nada que revelar ni conflictos de intereses.
Agradecimientos
Este contenido es responsabilidad exclusiva de los autores y no representa necesariamente los puntos de vista oficiales de los Institutos Nacionales de Salud. HC es apoyado por la subvención P20GM134973 de los Institutos Nacionales de Salud. KB cuenta con el apoyo de una subvención de Children's Hospital Foundation (CHF) y Presbyterian Health Foundation (PHF). Los servicios de imágenes de células vivas proporcionados por el núcleo de Genómica Funcional del Cáncer fueron apoyados en parte por la Subvención P20GM103639 del Instituto Nacional de Ciencias Médicas Generales y la Subvención P30CA225520 del Instituto Nacional del Cáncer del Instituto Nacional del Cáncer, otorgada al Centro de Ciencias de la Salud Stephenson del Centro de Cáncer Stephenson de la Universidad de Oklahoma.
Materiales
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipet | Fisher Scientific | 13-675-49 | |
| 100x21mm Dish, Nunclon Delta | ThermoFisher Scientific | 172931 | |
| 15 mL Conical tube | VWR | 89039-666 | |
| 24-Well, TC-Treated, Flat Bottom Plate | Corning | 3524 | |
| 37 µM Reversible Cell Strainer | STEMCELL Technologies | 27215 | |
| 50 mL Conical tube | VWR | 89039-658 | |
| 70 µm Sterile Cell Strainers | Fisher Scientific | FB22-363-548 | |
| Albumin, Bovine (BSA) | VWR | 0332-100G | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | |
| Dulbecco's Modified Eagle's Medium/Nutrient Ham's Mixture F-12 (DMEM-F12) with 15 mM HEPES buffer | STEMCELL Technologies | 36254 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | |
| ImageJ | NIH | imagej.nih.gov/ij/ | |
| Incucyte S3 Live-Cell Analysis Instrument | Sartorius | 4647 | |
| Incucyte Scratch Wound Analysis Software Module | Sartorius | 9600-0012 | |
| IntestiCult Organoid Growth Medium (Human) | STEMCELL Technologies | 06010 | This is HOGMY, but without the Y-27632 or antibiotics. Also used as base for HOGM, but then only missing the antibiotics. |
| Lipopolysaccharides from Escherichia coli O111:B4, purified by gel filtration chromatography | Millipore Sigma | L3012-10MG | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, Phenol Red-Free | Corning | 356231 | |
| Nunc MicroWell 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | ThermoFisher Scientific | 136101 | |
| PBS (Phosphate-Buffered Saline), 1X [-] Calcium, Magnesium, pH 7.4 | Corning | 21-040-CM | |
| Primocin | Invivogen | ant-pm-1 | This is broad-spectrum antibiotics |
| Sodium Hyaluronate, Research Grade, HA20K | Lifecore Biomedical | HA20K-1 | |
| TC20 Automated Cell Counter | Company: Bio-Rad | 1450102 | |
| Trypsin-EDTA 1X, 0.25% Trypsin | Fisher Scientific | MT25053CI | |
| Y-27632 | STEMCELL Technologies | 72302 |
Referencias
- Lemons, J. A., et al. Very low birth weight outcomes of the National Institute of Child Health and Human Development Neonatal Research Network, January 1995 through December 1996. Pediatrics. 107 (1), 1 (2001).
- Burge, K., Vieira, F., Eckert, J., Chaaban, H. Lipid composition, digestion, and absorption differences among neonatal feeding strategies: Potential implications for intestinal inflammation in preterm infants. Nutrients. 13 (2), 550 (2021).
- Duffy, L. C. Interactions mediating bacterial translocation in the immature intestine. The Journal of Nutrition. 130, 432-436 (2000).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: An immature innate immune response. PLoS One. 6 (3), 17776 (2011).
- Nanthakumar, N. N., Fusunyan, R. D., Sanderson, I., Walker, W. A. Inflammation in the developing human intestine: A possible pathophysiologic contribution to necrotizing enterocolitis. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 6043-6048 (2000).
- He, Y., Lawlor, N. T., Newburg, D. S. Human milk components modulate toll-like receptor-mediated inflammation. Advances in Nutrition. 7 (1), 102-111 (2016).
- Walker, W. A., Iyengar, R. S. Breast milk, microbiota, and intestinal immune homeostasis. Pediatric Research. 77 (1-2), 220-228 (2015).
- Westerbeek, E. A., vanden Berg, A., Lafeber, H. N., Fetter, W. P., van Elburg, R. M. The effect of enteral supplementation of a prebiotic mixture of non-human milk galacto-, fructo- and acidic oligosaccharides on intestinal permeability in preterm infants. British Journal of Nutrition. 105 (2), 268-274 (2011).
- vanden Berg, A., et al. The effect of glutamine-enriched enteral nutrition on intestinal permeability in very-low-birth-weight infants: A randomized controlled trial. Journal of Parenteral and Enteral Nutrition. 30 (5), 408-414 (2006).
- Foster, J. P., Seth, R., Cole, M. J. Oral immunoglobulin for preventing necrotizing enterocolitis in preterm and low birth weight neonates. The Cochrane Database of Systematic Reviews. 4 (4), (2016).
- Maffei, D., Schanler, R. J. Human milk is the feeding strategy to prevent necrotizing enterocolitis. Seminars in Perinatology. 41 (1), 36-40 (2017).
- Patel, A. L., Kim, J. H. Human milk and necrotizing enterocolitis. Seminars in Pediatric Surgery. 27 (1), 34-38 (2018).
- Nolan, L. S., Parks, O. B., Good, M. A review of the immunomodulating components of maternal breast milk and protection against necrotizing enterocolitis. Nutrients. 12 (1), 14 (2019).
- Hill, D. R., et al. Human milk hyaluronan enhances innate defense of the intestinal epithelium. Journal of Biological Chemistry. 288 (40), 29090-29104 (2013).
- Burge, K., Bergner, E., Gunasekaran, A., Eckert, J., Chaaban, H. The role of glycosaminoglycans in protection from neonatal necrotizing enterocolitis: A narrative review. Nutrients. 12 (2), 546 (2020).
- Chaaban, H., et al. Acceleration of small intestine development and remodeling of the microbiome following hyaluronan 35 kDa treatment in neonatal mice. Nutrients. 13 (6), 2030 (2021).
- Gunasekaran, A., et al. Hyaluronan 35 kDa enhances epithelial barrier function and protects against the development of murine necrotizing enterocolitis. Pediatric Research. 87 (7), 1177-1184 (2020).
- Montenegro-Miranda, P. S., et al. A novel organoid model of damage and repair identifies HNF4α as a critical regulator of intestinal epithelial regeneration. Cellular and Molecular Gastroenterology and Hepatology. 10 (2), 209-223 (2020).
- Lee, C., Hong, S. N., Kim, E. R., Chang, D. K., Kim, Y. H. Epithelial regeneration ability of Crohn's disease assessed using patient-derived intestinal organoids. International Journal of Molecular Sciences. 22 (11), 6013 (2021).
- Gurung, S., et al. Maternal Zika virus (ZIKV) infection following vaginal inoculation with ZIKV-infected semen in timed-pregnant olive baboons. Journal of Virology. 94 (11), 00058 (2020).
- Suarez-Arnedo, A., et al. An image J plugin for the high throughput image analysis of in vitro scratch wound healing assays. PLoS One. 15 (7), 0232565 (2020).
- Kobelt, D., Walther, W., Stein, U. S. Real-time cell migration monitoring to analyze drug synergism in the scratch assay using the IncuCyte system. Methods in Molecular Biology. 2294, 133-142 (2021).
- de Jong, J. C. W., Ijssennagger, N., van Mil, S. W. C. Breast milk nutrients driving intestinal epithelial layer maturation via Wnt and Notch signaling: Implications for necrotizing enterocolitis. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1867 (11), 166229 (2021).
- Yu, Y., et al. Erythropoietin protects epithelial cells from excessive autophagy and apoptosis in experimental neonatal necrotizing enterocolitis. PLoS One. 8 (7), 69620 (2013).
- Kessler, S. P., et al. Multifunctional role of 35 kilodalton hyaluronan in promoting defense of the intestinal epithelium. The Journal of Histochemistry and Cytochemistry. 66 (4), 273-287 (2018).
- Fraser, J. R. E., Laurent, T. C., Laurent, U. B. G. Hyaluronan: Its nature, distribution, functions and turnover. Journal of Internal Medicine. 242 (1), 27-33 (1997).
- Kim, Y., et al. Hyaluronan 35kDa treatment protects mice from Citrobacter rodentium infection and induces epithelial tight junction protein ZO-1 in vivo. Matrix Biology. 62, 28-39 (2017).
- Prehm, P., Schumacher, U. Inhibition of hyaluronan export from human fibroblasts by inhibitors of multidrug resistance transporters. Biochemical Pharmacology. 68 (7), 1401-1410 (2004).
- Stenson, W. F., Ciorba, M. A. Nonmicrobial activation of TLRs controls intestinal growth, wound repair, and radioprotection. Frontiers in Immunology. 11 (3591), 617510 (2021).
- Riehl, T. E., Ee, X., Stenson, W. F. Hyaluronic acid regulates normal intestinal and colonic growth in mice. American Journal of Physiology-Gastrointestinal and Liver Physiology. 303 (3), 377-388 (2012).
- Riehl, T. E., Santhanam, S., Foster, L., Ciorba, M., Stenson, W. F. CD44 and TLR4 mediate hyaluronic acid regulation of Lgr5+ stem cell proliferation, crypt fission, and intestinal growth in postnatal and adult mice. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309 (11), 874-887 (2015).
- Hill, D. R., Kessler, S. P., Rho, H. K., Cowman, M. K., de la Motte, C. A. Specific-sized hyaluronan fragments promote expression of human beta-defensin 2 in intestinal epithelium. Journal of Biological Chemistry. 287 (36), 30610-30624 (2012).
- Fernando, E. H., Gordon, M. H., Beck, P. L., MacNaughton, W. K. Inhibition of intestinal epithelial wound healing through protease-activated receptor-2 activation in Caco2 cells. Journal of Pharmacology and Experimental Therapeutics. 367 (2), 382-392 (2018).
- Nyegaard, S., Christensen, B., Rasmussen, J. T. An optimized method for accurate quantification of cell migration using human small intestine cells. Metabolic Engineering Communications. 3, 76-83 (2016).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Singh, A., Poling, H. M., Spence, J. R., Wells, J. M., Helmrath, M. A. Gastrointestinal organoids: a next-generation tool for modeling human development. American Journal of Physiology-Gastrointestinal and Liver Physiology. 319 (3), 375-381 (2020).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Experimental Biology and Medicine. 239 (9), 1124-1134 (2014).
- Foulke-Abel, J., et al. Human enteroids as a model of upper small intestinal ion transport physiology and pathophysiology. Gastroenterology. 150 (3), 638-649 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados