Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hyaluronik Asit 35 kDa'nın Enteroid Kaynaklı Tek Katmanlı Erken İnce Bağırsak Hasarı ve İyileşmesinin In Vitro Modeline Etkisi
Bu Makalede
Özet
Bu protokol, insan dışı primat ileumundan izole edilen üç boyutlu (3B) enteroidlerden türetilen iki boyutlu (2B) tek katmanlı tabakalar üzerinde bir çizik yara testi oluşturmak ve gerçekleştirmek için bir yöntem açıklamaktadır.
Özet
In vitro çizik yara testleri, çeşitli doku tiplerinde epitel iyileşmesinin mekanizmalarını ve özelliklerini araştırmak için yaygın olarak kullanılmaktadır. Burada, terminal ileumun bağırsak kriptlerinden türetilen üç boyutlu (3B) insan dışı primat enteroidlerinden iki boyutlu (2B) bir tek katman oluşturmak için bir protokol açıklıyoruz. Bu enteroid türevi monokatmanlar daha sonra, bir insan sütü HA taklidi olan hyaluronan 35 kDa'nın (HA35) epitel yara kenarı boyunca hücre göçünü ve proliferasyonunu teşvik etme yeteneğini test etmek için in vitro çizik yara testinde kullanıldı. Tek katmanlar akıcılığa yükseltildikten sonra, manuel olarak çizildi ve HA35 (50 μg / mL, 100 μg / mL, 200 μg / mL) veya kontrol (PBS) ile muamele edildi. Hücre göçü ve boşluğa proliferasyon, canlı hücre görüntüleme için donatılmış bir iletilmiş ışık mikroskobu kullanılarak görüntülendi. Yara kapanması, ImageJ'deki Yara İyileştirme Boyutu Eklentisi kullanılarak yara iyileşmesinin yüzdesi olarak ölçüldü. HA35 in vitro , ince bağırsak enteroid tek katmanlarında, muhtemelen yara kenarındaki hücre proliferasyonu ve yara bölgesine göçün bir kombinasyonu yoluyla, yara iyileşmesini hızlandırır. Bu yöntemler potansiyel olarak erken insan ince bağırsağında bağırsak yenilenmesini keşfetmek için bir model olarak kullanılabilir.
Giriş
Nekrotizan enterokolit (NEC) preterm bebeklerde en sık görülen gastrointestinal acillerden biridir1. Hastalık, bağırsak nekrozu, sepsis ve potansiyel olarak ölüme hızla bozulabilen şiddetli bağırsak iltihabı ile karakterizedir. Etiyolojisi belirsiz olmasına rağmen, kanıtlar NEC'nin multifaktöriyel olduğunu ve beslenmenin karmaşık bir etkileşiminin, anormal bakteriyel kolonizasyonun ve olgunlaşmamış bir bağırsak epitelinin sonucu olduğunu düşündürmektedir 2,3. Preterm bebeklerde bağırsak geçirgenliği, anormal bakteriyel kolonizasyon ve düşük enterosit rejeneratif kapasitesi4,5 artmış, intestinal bariyer disfonksiyonu, bakteriyel translokasyon ve NEC gelişimi riskini arttırmıştır. Bu nedenle, bağırsak epitel olgunlaşmasını hızlandırmak ve bağırsak epitelinin yenilenmesini veya iyileşmesini teşvik etmek için stratejilerin veya müdahalelerin belirlenmesi, bu ölümcül hastalığın önlenmesinde kritik öneme sahiptir.
Çalışmalar, insan sütünün (HM) preterm bebeklerde NEC'ye karşı koruyucu olduğunu göstermiştir 6,7,8,9,10,11. Hem insan hem de hayvan çalışmaları, sığır bazlı formülün bağırsak geçirgenliğini arttırdığını ve bağırsak epitel hücreleri için doğrudan toksik olduğunu göstermiştir 2,12. Tam olarak aydınlatılamamasına rağmen, kanıtlar HM'nin koruyucu etkilerinin laktoferrin, immünoglobulin A (IgA) ve HM oligosakkaritler13 gibi biyoaktif bileşenler aracılığıyla aracılık ettiğini göstermektedir. HM ayrıca, tekrarlayan D-glukuronik asit ve N-asetil-D-glukozamin disakkaritleri14,15 ile benzersiz bir sülfatlanmamış glikozaminoglikan olan hyaluronan (HA) bakımından da zengindir. Önemli olarak, bir HM HA taklidi olan oral 35 kDa HA'nın (HA35), bağırsak hasarının şiddetini azalttığını, bakteriyel translokasyonu önlediğini ve murin NEC benzeri bir bağırsak hasarı modelinde mortaliteyi azalttığını gösterdik16,17.
Burada, HA35'in bağırsak iyileşmesi ve in vitro rejenerasyonu üzerindeki etkileri daha ayrıntılı olarak araştırılmıştır. Günümüzde bağırsak yaralanması ve onarımı için en yaygın kullanılan in vitro tahlil, kolorektal kanser (KRK) hücre tek katmanlarında yapılan bir çizik yara testidir. Böyle bir modelin preterm bebek bağırsağı ile fizyolojik ilgisi sınırlıdır, çünkü CRC hücrelerinin yara onarımı, kök hücre güdümlü onarım süreçlerinden ziyade kanser hücrelerinin yüksek derecede proliferatif doğasına dayanır18. Bu sınırlamanın üstesinden gelmek için, birincil kök hücre kaynaklı ince bağırsak enteroidlerinin preterm insan olmayan primatlardan (NHP) izole edilmesi ve sürdürülmesi prosedürü de dahil olmak üzere bir 2D enteroid çizik yara modelinin kurulması burada açıklanmaktadır. Preterm NEC'nin en sık distal ince bağırsakta bildirildiği göz önüne alındığında, primer epitel hücreli organoidlerin bağırsak hasarı ve onarımı modelinde kullanılması, geleneksel kolorektal monokatmanları kullanan mevcut modellere kıyasla daha fizyolojik olarak çevrilebilir bir in vitro model sağlar18,19.
Protokol
Bu çalışmadaki tüm hayvan prosedürleri, Oklahoma Üniversitesi Sağlık Bilimleri Merkezi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır. Kurumsal onayı takiben, ayrı bir çalışma için ötenaziyi takiben, preterm insan dışı primattan (NHP,% 90 gebelik, zeytin babunu, Papio anubis) fetal ince bağırsak kolaylık örnekleri alındı (Protokol # 101523-16-039-I)20.
1. Preterm insan dışı primat 3D intestinal enteroidlerin kurulması
- Medya hazırlama
NOT: Medya, standart aseptik tekniği izleyerek kript izolasyonundan 1 hafta öncesine kadar hazırlanabilir. İstenirse primer hücreler için geniş spektrumlu antibiyotiklerin yerine penisilin/streptomisin (son konsantrasyon %1) kullanılabilir.- 50 mL organoid büyüme ortamı insan bazal ortamını 50 mL organoid takviyesi ile karıştırarak insan organoid büyüme ortamı + Y-27632 (HOGMY) hazırlayın (Malzeme Tablosu). Geniş spektrumlu antibiyotiklerin 200 μL'sini (son konsantrasyon 100 μg / mL) (Malzeme Tablosu) ve Y-27632'yi (10 μM'lik bir nihai konsantrasyona) ekleyin. Tezgahta oda sıcaklığına kadar ısıtın.
- 50 mL organoid büyüme ortamı insan bazal ortamını 50 mL organoid takviyesi ile karıştırarak insan organoid büyüme ortamını (HOGM) hazırlayın. Geniş spektrumlu antibiyotiklerden 200 μL (100 μg / mL) ekleyin. Tezgahta oda sıcaklığına kadar ısıtın.
NOT: HOGM, geçişten sonraki ilk 2-3 günden sonraki ortam değiştirilirken kullanılacaktır. - 100 mL 1x fosfat tamponlu salin (PBS) buz gibi soğuyana kadar kalsiyum veya magnezyum olmadan soğutun.
- Kalsiyum veya magnezyum içermeyen 1x PBS'yi% 0.1 sığır serum albümini (BSA) ile birleştirerek 50 mL yıkama tamponu hazırlayın. Buz soğuyuncaya kadar soğutun.
- DMEM-F12 yıkama tamponunu, 500 mL DMEM / F12'ye (Dulbecco'nun Modifiye Kartalın Orta / Besin Ham Karışımı F12 + 15 mM HEPES tamponu) 1 mL geniş spektrumlu antibiyotik (100 μg / mL) ekleyerek hazırlayın. Buz gibi soğuk tutun.
- Kript izolasyonu ve kaplaması
NOT: Hücre dışı matriks (ECM) bazlı hidrojel, tüm prosedür boyunca buz üzerinde kalmalıdır. Bu prosedür, altı ECM bazlı hidrojel kubbeyi doldurmak için yeterli doku varsayar. Farklı bir kript yoğunluğu toplanırsa, kubbe numarası buna göre değiştirilmelidir.- 150 μL büyüme faktörü azaltılmış (GFR) bazal membran ekstraktı (BME) (fenol kırmızısız) 2-8 ° C'de buz üzerinde gece boyunca çözülür.
- 24 kuyulu, düz tabanlı, doku kültürü ile muamele edilmiş bir polistiren plakayı bir inkübatörde 37 ° C'de ve% 5 CO2'de kullanımdan önce en az 30 dakika boyunca inkübe edin.
- NHP ötenazi ve doku toplamayı takiben, tek kullanımlık bir Petri kabında buz gibi soğuk 1x PBS kullanarak enkazın ileum segmentini 1.000 μL pipet ucu ile yıkayın.
NOT: Sağlıklı enteroidleri hasat etmek için taze doku hızlı bir şekilde toplanmalı ve buz gibi soğuk tutulmalıdır. - İleomu tüm bağırsak boyunca uzunlamasına kesin ve buz gibi soğuk PBS 3x ile yıkayın. Dokuyu, ileal segmentin tüpe en yakın kısmından başlayarak, 15 mL buz gibi soğuk PBS içeren 50 mL konik bir tüp üzerinde steril makasla küçük parçalar halinde (yaklaşık 2 mm uzunluğunda) kesin.
- 5-10x yukarı ve aşağı pipet yaparak kriptleri bozmak için 10 mL'lik bir serolojik pipet kullanın. Doku segmentlerinin tüpün dibine yerleşmesine izin verin, ardından süpernatantı çıkarın ve taze, buz gibi soğuk PBS ile değiştirin. Süpernatant temizlenene ve döküntülerden arındırılana kadar bu işlemi en az 7x-10x tekrarlayın.
- Temizlendikten sonra, süpernatantı çıkarın ve kriptleri 25 mL hücre ayrışma reaktifinde yeniden askıya alın. Tüpü oda sıcaklığında 15 dakika boyunca 20 rpm'de sallanan bir platforma yerleştirin.
- Tüpü rocker'dan çıkarın, hücrelerin yaklaşık 30 s ila 1 dakika boyunca yerleşmesine izin verin ve süpernatanı çıkarın. 10 mL buz gibi soğuk yıkama tamponu ekleyin. Pipetleri p1000 pipetle yukarı ve aşağı indirerek tek kriptlerde daha fazla ayrışın.
- Dokuyu 70 μm'lik bir hücre süzgecinden yeni bir 50 mL konik tüpe filtreleyin. Orijinal 50 mL konik tüpü 10 mL buz gibi soğuk yıkama tamponu ile durulayın ve tüm kriptlerin orijinal tüpten çıkarıldığından emin olmak için 70 μm süzgeçten süzün. Bu doku yıkamasını toplam 4x durulama için tekrarlayın.
- Filtratı 300 x g'de 4 ° C'de 5 dakika boyunca santrifüj edin ve süpernatanı çıkarın. 600 μL HOGMY ekleyin ve 200 μL'lik bir pipetle yukarı ve aşağı pipetle pipetle peleti bozun. Çözelti buz gibi soğuyana kadar tüpü buz üzerine yerleştirin.
NOT: Çözelti buz gibi soğuk değilse, kubbe kaplandığında uygun yapıyı korumaz. ECM bazlı hidrojel kubbeleri pipetlerken kabarcıklar sokmaktan kaçının, çünkü kabarcıklar plaka tabanına düzgün yapışmayı önleyecektir. - Hücre peletini askıya almak için 600 μL buz gibi soğuk ECM bazlı hidrojel ekleyin ve 200 μL'lik bir pipetle iyice karıştırın.
- 24 delikli plakayı inkübatörden çıkarın ve 37 ° C'lik bir plaka ısıtıcısına yerleştirin. Pipet, 24 kuyucuklu bir kültür plakasının 24 kuyucuğunun ortasına 50 μL buz gibi soğuk HOGMY / ECM bazlı hidrojel karışımı (kubbe başına 50 μL).
- Kaplandıktan sonra, plakanın dibine yapışmasını sağlamak için kubbelerin 37 ° C'lik bir plaka ısıtıcısına 1 dakika boyunca oturmasına izin verin. Plakayı dikkatlice ters çevirin, plakanın dibinde yoğuşma birikmediğinden emin olun ve ters çevrilmiş plakayı inkübatöre 37 ° C ve% 5 CO2'ye yerleştirin.
- 15 dakika sonra plakayı sağdan yukarı doğru çevirin ve 750 μL oda sıcaklığında HOGMY pipetini her bir kuyucuğa yerleştirin.
NOT: Pipet ortamını yavaşça kuyucukların yan duvarına yerleştirin ve yeni oluşan 3D ECM bazlı hidrojel kubbeyi bozmamaya dikkat edin. - Tüm kuyucuklar medya ile doldurulduktan sonra, plakayı inkübatöre yerleştirin ve medyayı her 3 günde bir 750 μL HOGM ile değiştirin. Pasaj enteroidleri her 7-10 günde bir.
- Bağırsak enteroid pasajı
NOT: Aşağıdaki protokol, NHP enteroidlerini 1: 2 bölünmüş hızda içeren bir 24 delikli kültür plakası içindir.- Enteroid içeren ECM kubbesini bozmamaya dikkat ederek enteroid medyayı her bir kuyucuktan çıkarın, 1.000 μL'lik bir pipet kullanarak her bir kuyucuğa 500 μL buz gibi soğuk hücre ayrışma reaktifi ekleyin ve 1 dakika boyunca oda sıcaklığında inkübe edin.
- 8-12x yukarı ve aşağı pipet yaparak ECM'yi manuel olarak bozun. 12 kuyucuğun içeriğini 15 mL'lik bir konik tüpe aktarın.
- Tüm çözelti 24 delikli kültür plakasından toplandıktan sonra, tüm NHP enteroidlerinin her bir kuyucuktan çıkarıldığından emin olmak için her bir kuyucuğa 250 μL hücre bozma reaktifi ekleyin ve bu son durulamayı mevcut 15 mL konik tüplere ekleyin.
- Oda sıcaklığında (20 ° C) 15 dakika boyunca 40 rpm'de sallanan bir platforma yerleştirin. Alternatif olarak, tüpleri oda sıcaklığında 15 dakika boyunca manuel olarak çalkalayın.
- 15 dakika sonra, 4 ° C'de 5 dakika boyunca 300 x g'de santrifüj. Süpernatantı 15 mL tüplerden sadece pelet kalana kadar çıkarın.
- Bir 15 mL konik tüpe 8 mL buz gibi soğuk DMEM + geniş spektrumlu antibiyotik ekleyerek peletin yeterince bozulduğundan emin olun. 4 °C'de 5 dakika boyunca 300 x g'de santrifüj yapın ve süpernatanı atın.
- 600 μL HOGMY ekleyin ve 1.000 μL'lik bir pipetle yukarı ve aşağı pipetle pipetleyerek peleti bozun. Çözelti buz gibi soğuyana kadar tüpü buz üzerine yerleştirin. Çözelti buz gibi soğuk olduğunda, hücre peletini askıya almak için 600 μL buz gibi soğuk ECM ekleyin ve 1.000 μL'lik bir pipetle iyice karıştırın. 1.3.2.-1.3.7 arasındaki adımları yineleyin. kalan 12 kuyu için.
- Kalan adımlar için 1.2.11.-1.2.16 numaralı adımlara bakın.
2. Enteroid tek katmanlı ve çizik yara tahlilinin kurulması
- Medya ve tedavi hazırlığı
- 5 mL PBS'yi buz gibi soğuğa kadar kalsiyum veya magnezyum olmadan soğutun.
- DMEM-F12 yıkama tamponunu, 500 mL DMEM / F12'ye (Dulbecco'nun Modifiye Kartalın Orta / Besin Ham Karışımı F12 + 15 mM HEPES tamponu) 1 mL geniş spektrumlu antibiyotik (100 μg / mL) ekleyerek hazırlayın. Buz gibi soğuk tutun.
- Adım 1.1.1.1.'de açıklandığı gibi 100 mL HOGMY hazırlayın ve tezgahın üzerinde oda sıcaklığına ısıtın.
- 37 °C su banyosunda ılık 25 mL% 0.25 Tripsin-etilendiamintetraasetik asit (EDTA).
- Çözücü olarak kalsiyum veya magnezyum içermeyen steril PBS kullanarak hücre tedavisi için 50 μg / mL, 100 μg / mL ve 200 μg / mL HA35 konsantrasyonları hazırlayın. HA35'in son seyreltilmesinde çözücü olarak HOMGY kullanılacaktır.
NOT: HA35 preparatı birkaç seyreltme gerektirebilir, çünkü HA35 genellikle çözeltiden 5 mg / mL'den daha yüksek bir konsantrasyonda ortaya çıkar.
- Enteroid tek katmanlı oluşum
NOT: Aşağıdaki prosedür, 24 delikli enteroid tek katmanlı bir plakanın oluşturulması için yeterli hacimleri sağlar. İstediğiniz sayıda tek katman için ses seviyelerini ayarlayın.- ECM bazlı hidrojel BME'nin (fenol kırmızısı içermeyen) 96 μL'sini 2-8 ° C'de buz üzerinde gece boyunca çözün. ECM bazlı hidrojeli buz gibi soğuk PBS'de kalsiyum veya magnezyum olmadan 1:50 oranında seyreltin. 24 kuyucuklu bir doku kültürü plakasının her bir kuyusunu 200 μL buz gibi soğuk seyreltilmiş ECM bazlı hidrojel ile kaplayın.
- ECM bazlı hidrojel kaplı plakayı 37 °C'de en az 1 saat ve %5 CO2'de inkübe edin. Tek katmanlara yönelik 3D enteroidleri içeren 24 delikli kültür plakasından ortamları aspire edin ve 500 μL hücre ayrışma reaktifi / kuyusu ile değiştirin.
- ECM bazlı hidrojel kubbeleri 8x-12x yukarı ve aşağı pipetleyerek manuel olarak bozun ve 12 kuyucuğun içeriğini 15 mL'lik konik bir tüpe aktarın.
- Tüm enteroidlerin çıkarıldığından emin olmak için 12 boş kuyucuğu 250 μL hücre ayrışma reaktifi ile yıkayın ve içeriği 15 mL'lik bir konik tüpe aktarın. 2.2.5 adımını yineleyin. ve adım 2.2.6. ikinci bir 15 mL konik tüp kullanarak kalan 12 kuyu için.
- Konik tüpleri 300 x g'de 4 ° C'de 5 dakika boyunca santrifüj edin ve süpernatanı atın. 15 mL konik tüplere 10 mL buz gibi soğuk DMEM-F12 yıkama tamponu ekleyin ve tüpleri ters çevirerek enteroid peletleri askıya alın. 4 °C'de 5 dakika boyunca 300 x g'de santrifüj.
- Süpernatantı çıkarın ve hücre peletlerini 12 mL'lik 37 °C Tripsin-EDTA'da yeniden askıya alın. Tüpleri 10 dakika boyunca veya hücreler çözünür görünene kadar 37 ° C'lik bir su banyosuna yerleştirin. Tripsin-EDTA'yı seyreltmek için her tüpe 3 mL DMEM-F12 yıkama tamponu ekleyin, tüpleri ters çevirerek karıştırın ve buzun üzerine yerleştirin.
- Ayrışmış enteroidleri 37 μM ağ hücre süzgecinden filtreleyin ve içeriği temiz 15 mL konik tüpler halinde toplayın. Tüpleri 4 °C'de 5 dakika boyunca 300 x g'de santrifüj yapın.
- Hücreler santrifüjde peletlenirken, ECM bazlı hidrojel kaplı plakayı inkübatörden çıkarın ve kaplanmış yüzeyi çizmeden veya plakanın tamamen kurumasına izin vermeden fazla ECM bazlı hidrojel çözeltisini aspire edin.
- Süpernatantı konik tüplerden çıkarın ve hücre peletlerini 6 mL HOMGY ile yeniden askıya alın. ECM bazlı hidrojel ile kaplanmış 24 delikli plakanın her bir kuyucuğuna, kabaca 3 x 10 5 hücreli / kuyucuklu bir tohumlama yoğunluğunda kombine 12 mL HOMGY hücre süspansiyonunun500 μL'sini ekleyin. Kuyucuklar içindeki hücrelerin eşit dağılımını sağlamak için plakayı bir kapakla döndürün.
- Plakayı 37 °C ve %5 CO 2'de inkübe edin, tek katmanlar %>90 akıcılığa ulaşana kadar her2 günde bir HOMGY ortamını değiştirin.
- Tek katmanlı tedavi ve çizik yara tahlili
- Tek katmanlar% >90 akıcılığa ulaştığında, yapışamayan hücreleri çıkarmak için ortamı aspire edin. Hücreleri 24 saat boyunca HOMGY'de çözünmüş 500 μL HA35 (50 μg / mL, 100 μg / mL, 200 μg / mL) veya PBS ile tedavi edin.
- 24 saat sonra, tek katmanın yüzeyini bozmamaya dikkat ederek ortamı çıkarın. 200 μL'lik bir pipet ucu kullanarak, tek katmanların kurumasına izin vermemeye dikkat ederek her bir kuyucuktaki tek katmanın tam yüzey çapı boyunca doğrusal bir çizik yapın.
- Çizilmiş tek katmanlı 1x'i 500 μL 1x PBS ile yıkayın. HOMGY'de çözünmüş 500 μL HA35 (50 μg/mL, 100 μg/mL, 200 μg/mL) veya PBS ekleyin ve plakayı 37 °C ve %5 CO2 inkübatöründe canlı hücre analiz cihazına (Malzeme Tablosu) aktarın.
- Canlı hücre analiz yazılımındaki (Malzeme Tablosu) Program simgesinin altında, Yeni Gemi Ekleme Sihirbazını Başlat simgesine tıklayın ve tarama sıklığını bir programa göre tarama yapacak şekilde ayarlayın. Tarama Türü altında yeni bir Tam Kuyu kabı oluşturun, tarama ayarlarını belirtin (örneğin, Görüntü Kanalları için Faz ve Hedef için 4x) ve İleri'ye tıklayın.
- Sağlanan listeden plaka üreticisini ve katalog numarasını seçin. Zamanlama simgesinin altında, plakanın canlı hücre analiz aracına yerleştirileceği artı sembolünü seçin. İstediğiniz Tarama Desenini seçin ve ardından Plaka Düzeni sayfasında "+" işaretini seçerek bir plaka haritası oluşturun. Analizi Daha Sonra Ertele'yi seçin ve ardından 24 saat boyunca her 4 saatte bir Tarama Zamanlaması'nı ayarlayın ve Gemi Sihirbazı Özeti sayfası altında alma ayarlarını doğrulayın. Son olarak, Programa Ekle'yi seçin.
- 24 tahlil tamamlandıktan sonra, Görünüm simgesinin altında, Gemi Adı'na çift tıklayın ve görüntüleri ve filmleri dışa aktarın. JPEG olarak görüntülemek ve dışa aktarmak için kuyucukları ve bir dizi görüntüyü seçin. Adım 2.4'e göre ImageJ21 için Yara İyileştirme Boyutu Eklentisi'ni kullanarak yüzde yara iyileşmesi için görüntüleri analiz edin. aşağıda.
- Çizik yara analizi
- ImageJ yazılımını açın. Çizik yara tahlili görüntülerini yükleyin (. TIFF veya .JPG).
- Görüntü > Görüntüyü 24 bit RGB'den 8 bit'e değiştirmek için > 8 bit yazın'ı seçin. Yara İyileştirme Boyutu Eklentisini , Eklentiler > Makrolar'ı seçerek > > Yara İyileştirme Boyutu Eklentisi Yükle'yi yükleyin.
- Çizik dikey olacak şekilde görüntüyü döndürün ve Yara İyileştirme Boyutu Aracı eklentisini başlatın.
- Kazıma yarasına en iyi şekilde uyması için iletişim kutusundaki eklenti parametrelerini seçin. Yara iyileşmesi boyutu seçenekleri için parametrelerin değerini şu şekilde ayarlayın: Varyans Penceresi Yarıçapı 20'de, Eşik değeri 100'de ve Doymuş Piksellerin Yüzdesi 0,001'de ve Ölçeği Genel Ayarla için Evet'i seçin. Tamam düğmesine tıklayarak seçimi tamamlayın. Seçilen alanın yara bölgesi olup olmadığını doğrulayın. Yukarıdaki parametreler laboratuvardan laboratuvara standardizasyon gerektirebilir.
- 2.4.2.-2.4.4 arasındaki adımları yineleyin. her çizik için kalan zaman noktaları için.
- 24 saat boyunca göç eden veya çoğalan hücrelerin çizik alanı yara iyileşmesi yüzdesini aşağıdaki gibi hesaplayın:
% Yara İyileşmesi =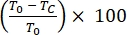
burada T 0 = % Alan 0 saat ve Tc = % Alan 0 saat, 4 saat, 12 saat veya 24 saatte.
Sonuçlar
HA'nın çeşitli doku ve organlarda doku onarımı ve yara iyileşmesi üzerindeki etkileri iyi belgelenmiştir; Bununla birlikte, moleküler ağırlığı 35 kDa'lık olan HA'nın fetal veya yenidoğan ince bağırsak iyileşmesi ve rejenerasyonu üzerindeki spesifik etkileri şu anda bilinmemektedir. HA35'in fetal veya yenidoğan ince bağırsağının bir modelinde yara iyileşmesini destekleme yeteneğini test etmek için, NHP ileal dokusundan 3D bağırsak enteroidleri ürettik ve 2D enteroid türevi tek katmanlar ...
Tartışmalar
Preterm bir bebeğin gastrointestinal sistemi, dysbiosis, inflamatuar bakteriyel metabolitler ve toksinler ve aralıklı hipoksi23,24 ile ilişkili çevresel hakaretlere tekrar tekrar maruz kalmaktan kaynaklanan sürekli rejeneratif baskı altındadır. Ne yazık ki, preterm bebeğin bağırsak epiteli, fonksiyonel bütünlüğü hızlı bir şekilde oluşturamamaktadır23, bariyer disfonksiyonu, artmış bağırsak geçirgenliği ve ciddi...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri ve çıkar çatışmaları yoktur.
Teşekkürler
Bu içerik yalnızca yazarların sorumluluğundadır ve Ulusal Sağlık Enstitüleri'nin resmi görüşlerini temsil etmek zorunda değildir. HC, Ulusal Sağlık Enstitüleri'nden P20GM134973 hibesi ile desteklenmektedir. KB, Çocuk Hastanesi Vakfı (CHF) ve Presbiteryen Sağlık Vakfı (PHF) hibesi ile desteklenmektedir. Kanser Fonksiyonel Genomik çekirdeği tarafından sağlanan canlı hücre görüntüleme hizmetleri kısmen Oklahoma Üniversitesi Sağlık Bilimleri Merkezi Stephenson Kanser Merkezi'ne verilen Ulusal Genel Tıp Bilimleri Enstitüsü Hibe P20GM103639 ve Ulusal Sağlık Enstitüleri Ulusal Kanser Enstitüsü Hibe P30CA225520 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipet | Fisher Scientific | 13-675-49 | |
| 100x21mm Dish, Nunclon Delta | ThermoFisher Scientific | 172931 | |
| 15 mL Conical tube | VWR | 89039-666 | |
| 24-Well, TC-Treated, Flat Bottom Plate | Corning | 3524 | |
| 37 µM Reversible Cell Strainer | STEMCELL Technologies | 27215 | |
| 50 mL Conical tube | VWR | 89039-658 | |
| 70 µm Sterile Cell Strainers | Fisher Scientific | FB22-363-548 | |
| Albumin, Bovine (BSA) | VWR | 0332-100G | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | |
| Dulbecco's Modified Eagle's Medium/Nutrient Ham's Mixture F-12 (DMEM-F12) with 15 mM HEPES buffer | STEMCELL Technologies | 36254 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | |
| ImageJ | NIH | imagej.nih.gov/ij/ | |
| Incucyte S3 Live-Cell Analysis Instrument | Sartorius | 4647 | |
| Incucyte Scratch Wound Analysis Software Module | Sartorius | 9600-0012 | |
| IntestiCult Organoid Growth Medium (Human) | STEMCELL Technologies | 06010 | This is HOGMY, but without the Y-27632 or antibiotics. Also used as base for HOGM, but then only missing the antibiotics. |
| Lipopolysaccharides from Escherichia coli O111:B4, purified by gel filtration chromatography | Millipore Sigma | L3012-10MG | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, Phenol Red-Free | Corning | 356231 | |
| Nunc MicroWell 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | ThermoFisher Scientific | 136101 | |
| PBS (Phosphate-Buffered Saline), 1X [-] Calcium, Magnesium, pH 7.4 | Corning | 21-040-CM | |
| Primocin | Invivogen | ant-pm-1 | This is broad-spectrum antibiotics |
| Sodium Hyaluronate, Research Grade, HA20K | Lifecore Biomedical | HA20K-1 | |
| TC20 Automated Cell Counter | Company: Bio-Rad | 1450102 | |
| Trypsin-EDTA 1X, 0.25% Trypsin | Fisher Scientific | MT25053CI | |
| Y-27632 | STEMCELL Technologies | 72302 |
Referanslar
- Lemons, J. A., et al. Very low birth weight outcomes of the National Institute of Child Health and Human Development Neonatal Research Network, January 1995 through December 1996. Pediatrics. 107 (1), 1 (2001).
- Burge, K., Vieira, F., Eckert, J., Chaaban, H. Lipid composition, digestion, and absorption differences among neonatal feeding strategies: Potential implications for intestinal inflammation in preterm infants. Nutrients. 13 (2), 550 (2021).
- Duffy, L. C. Interactions mediating bacterial translocation in the immature intestine. The Journal of Nutrition. 130, 432-436 (2000).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: An immature innate immune response. PLoS One. 6 (3), 17776 (2011).
- Nanthakumar, N. N., Fusunyan, R. D., Sanderson, I., Walker, W. A. Inflammation in the developing human intestine: A possible pathophysiologic contribution to necrotizing enterocolitis. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 6043-6048 (2000).
- He, Y., Lawlor, N. T., Newburg, D. S. Human milk components modulate toll-like receptor-mediated inflammation. Advances in Nutrition. 7 (1), 102-111 (2016).
- Walker, W. A., Iyengar, R. S. Breast milk, microbiota, and intestinal immune homeostasis. Pediatric Research. 77 (1-2), 220-228 (2015).
- Westerbeek, E. A., vanden Berg, A., Lafeber, H. N., Fetter, W. P., van Elburg, R. M. The effect of enteral supplementation of a prebiotic mixture of non-human milk galacto-, fructo- and acidic oligosaccharides on intestinal permeability in preterm infants. British Journal of Nutrition. 105 (2), 268-274 (2011).
- vanden Berg, A., et al. The effect of glutamine-enriched enteral nutrition on intestinal permeability in very-low-birth-weight infants: A randomized controlled trial. Journal of Parenteral and Enteral Nutrition. 30 (5), 408-414 (2006).
- Foster, J. P., Seth, R., Cole, M. J. Oral immunoglobulin for preventing necrotizing enterocolitis in preterm and low birth weight neonates. The Cochrane Database of Systematic Reviews. 4 (4), (2016).
- Maffei, D., Schanler, R. J. Human milk is the feeding strategy to prevent necrotizing enterocolitis. Seminars in Perinatology. 41 (1), 36-40 (2017).
- Patel, A. L., Kim, J. H. Human milk and necrotizing enterocolitis. Seminars in Pediatric Surgery. 27 (1), 34-38 (2018).
- Nolan, L. S., Parks, O. B., Good, M. A review of the immunomodulating components of maternal breast milk and protection against necrotizing enterocolitis. Nutrients. 12 (1), 14 (2019).
- Hill, D. R., et al. Human milk hyaluronan enhances innate defense of the intestinal epithelium. Journal of Biological Chemistry. 288 (40), 29090-29104 (2013).
- Burge, K., Bergner, E., Gunasekaran, A., Eckert, J., Chaaban, H. The role of glycosaminoglycans in protection from neonatal necrotizing enterocolitis: A narrative review. Nutrients. 12 (2), 546 (2020).
- Chaaban, H., et al. Acceleration of small intestine development and remodeling of the microbiome following hyaluronan 35 kDa treatment in neonatal mice. Nutrients. 13 (6), 2030 (2021).
- Gunasekaran, A., et al. Hyaluronan 35 kDa enhances epithelial barrier function and protects against the development of murine necrotizing enterocolitis. Pediatric Research. 87 (7), 1177-1184 (2020).
- Montenegro-Miranda, P. S., et al. A novel organoid model of damage and repair identifies HNF4α as a critical regulator of intestinal epithelial regeneration. Cellular and Molecular Gastroenterology and Hepatology. 10 (2), 209-223 (2020).
- Lee, C., Hong, S. N., Kim, E. R., Chang, D. K., Kim, Y. H. Epithelial regeneration ability of Crohn's disease assessed using patient-derived intestinal organoids. International Journal of Molecular Sciences. 22 (11), 6013 (2021).
- Gurung, S., et al. Maternal Zika virus (ZIKV) infection following vaginal inoculation with ZIKV-infected semen in timed-pregnant olive baboons. Journal of Virology. 94 (11), 00058 (2020).
- Suarez-Arnedo, A., et al. An image J plugin for the high throughput image analysis of in vitro scratch wound healing assays. PLoS One. 15 (7), 0232565 (2020).
- Kobelt, D., Walther, W., Stein, U. S. Real-time cell migration monitoring to analyze drug synergism in the scratch assay using the IncuCyte system. Methods in Molecular Biology. 2294, 133-142 (2021).
- de Jong, J. C. W., Ijssennagger, N., van Mil, S. W. C. Breast milk nutrients driving intestinal epithelial layer maturation via Wnt and Notch signaling: Implications for necrotizing enterocolitis. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1867 (11), 166229 (2021).
- Yu, Y., et al. Erythropoietin protects epithelial cells from excessive autophagy and apoptosis in experimental neonatal necrotizing enterocolitis. PLoS One. 8 (7), 69620 (2013).
- Kessler, S. P., et al. Multifunctional role of 35 kilodalton hyaluronan in promoting defense of the intestinal epithelium. The Journal of Histochemistry and Cytochemistry. 66 (4), 273-287 (2018).
- Fraser, J. R. E., Laurent, T. C., Laurent, U. B. G. Hyaluronan: Its nature, distribution, functions and turnover. Journal of Internal Medicine. 242 (1), 27-33 (1997).
- Kim, Y., et al. Hyaluronan 35kDa treatment protects mice from Citrobacter rodentium infection and induces epithelial tight junction protein ZO-1 in vivo. Matrix Biology. 62, 28-39 (2017).
- Prehm, P., Schumacher, U. Inhibition of hyaluronan export from human fibroblasts by inhibitors of multidrug resistance transporters. Biochemical Pharmacology. 68 (7), 1401-1410 (2004).
- Stenson, W. F., Ciorba, M. A. Nonmicrobial activation of TLRs controls intestinal growth, wound repair, and radioprotection. Frontiers in Immunology. 11 (3591), 617510 (2021).
- Riehl, T. E., Ee, X., Stenson, W. F. Hyaluronic acid regulates normal intestinal and colonic growth in mice. American Journal of Physiology-Gastrointestinal and Liver Physiology. 303 (3), 377-388 (2012).
- Riehl, T. E., Santhanam, S., Foster, L., Ciorba, M., Stenson, W. F. CD44 and TLR4 mediate hyaluronic acid regulation of Lgr5+ stem cell proliferation, crypt fission, and intestinal growth in postnatal and adult mice. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309 (11), 874-887 (2015).
- Hill, D. R., Kessler, S. P., Rho, H. K., Cowman, M. K., de la Motte, C. A. Specific-sized hyaluronan fragments promote expression of human beta-defensin 2 in intestinal epithelium. Journal of Biological Chemistry. 287 (36), 30610-30624 (2012).
- Fernando, E. H., Gordon, M. H., Beck, P. L., MacNaughton, W. K. Inhibition of intestinal epithelial wound healing through protease-activated receptor-2 activation in Caco2 cells. Journal of Pharmacology and Experimental Therapeutics. 367 (2), 382-392 (2018).
- Nyegaard, S., Christensen, B., Rasmussen, J. T. An optimized method for accurate quantification of cell migration using human small intestine cells. Metabolic Engineering Communications. 3, 76-83 (2016).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Singh, A., Poling, H. M., Spence, J. R., Wells, J. M., Helmrath, M. A. Gastrointestinal organoids: a next-generation tool for modeling human development. American Journal of Physiology-Gastrointestinal and Liver Physiology. 319 (3), 375-381 (2020).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Experimental Biology and Medicine. 239 (9), 1124-1134 (2014).
- Foulke-Abel, J., et al. Human enteroids as a model of upper small intestinal ion transport physiology and pathophysiology. Gastroenterology. 150 (3), 638-649 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır