É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Efeito do ácido hialurônico 35 kDa em um modelo in vitro de lesão e cicatrização do intestino delgado prematuro usando monocamadas derivadas de enteróides
Neste Artigo
Resumo
Este protocolo descreve um método para estabelecer e executar um ensaio de arranhão em monocamadas bidimensionais (2D) derivadas de enteróides tridimensionais (3D) isolados de íleo de primatas não humanos.
Resumo
Ensaios de feridas de arranhões in vitro são comumente usados para investigar os mecanismos e características da cicatrização epitelial em uma variedade de tipos de tecidos. Aqui, descrevemos um protocolo para gerar uma monocamada bidimensional (2D) a partir de enteroides de primatas não humanos tridimensionais (3D) derivados de criptas intestinais do íleo terminal. Essas monocamadas derivadas de enteroides foram então utilizadas em um ensaio de arranhão in vitro para testar a capacidade do hialuronano 35 kDa (HA35), um HA de leite humano, para promover a migração e proliferação celular ao longo da borda da ferida epitelial. Após o cultivo das monocamadas até a confluência, elas foram raspadas manualmente e tratadas com HA35 (50 μg/mL, 100 μg/mL, 200 μg/mL) ou controle (PBS). A migração celular e a proliferação para a lacuna foram fotografadas usando um microscópio de luz transmitida equipado para imagens de células vivas. O fechamento da ferida foi quantificado como porcentagem de cicatrização de feridas usando o Wound Healing Size Plugin no ImageJ. A área de arranhão e a taxa de migração celular e a porcentagem de fechamento da ferida foram medidas ao longo de 24 h. O HA35 in vitro acelera a cicatrização de feridas em monocamadas enteroides do intestino delgado, provavelmente através de uma combinação de proliferação celular na borda da ferida e migração para a área da ferida. Esses métodos podem potencialmente ser usados como um modelo para explorar a regeneração intestinal no intestino delgado humano prematuro.
Introdução
A enterocolite necrosante (NEC) é uma das emergências gastrointestinais mais comuns em prematuros1. A doença é caracterizada por inflamação intestinal grave que pode se deteriorar rapidamente para necrose intestinal, sepse e potencialmente morte. Embora a etiologia não seja clara, as evidências sugerem que a NEC é multifatorial e o resultado de uma complexa interação de alimentação, colonização bacteriana anormal e epitélio intestinal imaturo 2,3. Prematuros apresentam aumento da permeabilidade intestinal, colonização bacteriana anormal e baixa capacidade regenerativa de enterócitos4,5, aumentando o risco de disfunção da barreira intestinal, translocação bacteriana e desenvolvimento de NEC. Portanto, identificar estratégias ou intervenções para acelerar a maturação epitelial intestinal e promover a regeneração ou cicatrização do epitélio intestinal é fundamental na prevenção dessa doença mortal.
Estudos têm demonstrado que o leite humano (HM) é protetor contra a NEC em prematuros 6,7,8,9,10,11. Estudos em humanos e animais mostraram que a fórmula à base de bovinos aumenta a permeabilidade intestinal e é diretamente tóxica para as células epiteliais intestinais 2,12. Embora não totalmente elucidada, as evidências sugerem que os efeitos protetores da HM são mediados por componentes bioativos, como lactoferrina, imunoglobulina A (IgA) e oligossacarídeos HM13. O HM também é rico em hialuronano (AH), um glicosaminoglicano exclusivamente não sulfatado com repetição de ácido D-glucurônico e dissacarídeos N-acetil-D-glucosamina14,15. É importante ressaltar que mostramos que o 35 kDa HA oral (HA35), um HM HA mímica, atenua a gravidade da lesão intestinal, previne a translocação bacteriana e diminui a mortalidade em um modelo de lesão intestinal murina semelhante ao NEC16,17.
Aqui, os efeitos do HA35 na cicatrização e regeneração intestinal in vitro são investigados mais adiante. Atualmente, o ensaio in vitro mais utilizado para feridas intestinais e reparo é um ensaio de arranhão realizado em monocamadas celulares de câncer colorretal (CCR). A relevância fisiológica de tal modelo para o intestino infantil prematuro é limitada, uma vez que o reparo de feridas de células CRC depende fortemente da natureza altamente proliferativa das células cancerígenas, em vez de processos de reparo orientados por células-tronco18. Para superar essa limitação, o estabelecimento de um modelo de arranhão enteróide 2D, incluindo o procedimento de isolamento e manutenção de enteroides intestinais delgados derivados de células-tronco primárias de primatas não humanos (PNH) prematuros, é descrito aqui. Dado que a NEC pré-termo é mais frequentemente relatada no intestino delgado distal, o uso de organoides primários de células epiteliais em um modelo de dano e reparo intestinal fornece um modelo in vitro mais fisiologicamente traduzível em comparação com os modelos existentes que utilizam monocamadas colorretais tradicionais18,19.
Protocolo
Todos os procedimentos em animais neste estudo foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais do Centro de Ciências da Saúde da Universidade de Oklahoma. Após aprovação institucional, amostras de conveniência fetal do intestino delgado de um primata não humano prematuro (PNH, gestação de 90%, babuíno-oliva, Papio anubis) foram obtidas após eutanásia para um estudo separado (Protocolo nº 101523-16-039-I)20.
1. Estabelecimento de enteróides intestinais 3D de primatas não humanos prematuros
- Preparação para a mídia
NOTA: A mídia pode ser preparada até 1 semana antes do isolamento da cripta seguindo a técnica asséptica padrão. A penicilina/estreptomicina (concentração final de 1%) pode ser usada no lugar dos antibióticos de amplo espectro para células primárias, se desejado.- Preparar meios de crescimento organoides humanos + Y-27632 (HOGMY) misturando 50 mL de meio de crescimento organoide meio basal humano com 50 mL de suplemento organoide (Tabela de Materiais). Adicionar 200 μL dos antibióticos de amplo espectro (concentração final de 100 μg/mL) (Tabela de Materiais) e Y-27632 (a uma concentração final de 10 μM). Aqueça na bancada até a temperatura ambiente.
- Preparar meios de crescimento organoides humanos (HOGM) misturando 50 mL de meio de crescimento organoide meio basal humano com 50 mL de suplemento organoide. Adicionar 200 μL dos antibióticos de amplo espectro (100 μg/mL). Aqueça na bancada até a temperatura ambiente.
NOTA: O HOGM será usado ao mudar de mídia além dos primeiros 2-3 dias após a passagem. - Refrigerar 100 mL de 1x solução salina tamponada com fosfato (PBS) sem cálcio ou magnésio até ficar gelado.
- Preparar 50 mL de tampão de lavagem combinando 1x PBS sem cálcio ou magnésio com albumina sérica bovina (BSA) a 0,1%. Esfrie até gelar.
- Prepare o tampão de lavagem DMEM-F12 adicionando 1 mL dos antibióticos de amplo espectro (100 μg/mL) a 500 mL de DMEM/F12 (Dulbecco's Modified Eagle's Medium/Nutrient Ham's Mix F12 + 15 mM HEPES buffer). Mantenha-o gelado.
- Isolamento e revestimento de criptas
NOTA: O hidrogel à base de matriz extracelular (ECM) deve permanecer no gelo durante todo o procedimento. Este procedimento pressupõe tecido suficiente para preencher seis cúpulas de hidrogel à base de ECM. Se uma densidade diferente de criptas for colhida, o número da cúpula deve ser alterado de acordo.- Descongelar 150 μL de extracto de membrana basal (BME) (isento de vermelho de fenol) reduzido ao fator de crescimento (TFG) durante a noite sobre o gelo a 2-8 °C.
- Incubar uma placa de poliestireno tratada com cultura de tecidos de 24 poços, de fundo plano, numa incubadora a 37 °C e 5% de CO2 durante um mínimo de 30 minutos antes da utilização.
- Após a eutanásia NHP e a coleta de tecidos, lave o segmento de íleo dos detritos com uma ponta de pipeta de 1.000 μL usando PBS 1x gelado em uma placa de Petri descartável.
NOTA: O tecido fresco deve ser colhido rapidamente e mantido gelado para colher enteróides saudáveis. - Corte o íleo longitudinalmente ao longo de todo o intestino e lave com PBS 3x gelado. Pice o tecido em pequenos fragmentos (aproximadamente 2 mm de comprimento) com tesouras estéreis sobre um tubo cônico de 50 mL contendo 15 mL de PBS gelado, a partir da porção do segmento ileal mais próxima do tubo.
- Use uma pipeta sorológica de 10 mL para interromper as criptas pipetando para cima e para baixo 5-10x. Deixe os segmentos de tecido se depositarem no fundo do tubo, remova o sobrenadante e substitua-o por PBS fresco e gelado. Repita este processo um mínimo de 7x-10x até que o sobrenadante esteja limpo e livre de detritos.
- Uma vez limpo, remova o sobrenadante e ressuspenda as criptas em 25 mL de reagente de dissociação celular. Coloque o tubo sobre uma plataforma de balanço a 20 rpm durante 15 minutos à temperatura ambiente.
- Remova o tubo do balancim, deixe as células se acomodarem por aproximadamente 30 s a 1 min e remova o sobrenadante. Adicione 10 mL de tampão de lavagem gelado. Pipeta para cima e para baixo com uma pipeta p1000 para dissociar ainda mais em criptas únicas.
- Filtre o tecido através de um filtro de células de 70 μm em um novo tubo cônico de 50 mL. Lave o tubo cônico original de 50 mL com 10 mL de tampão de lavagem gelada e filtre através do filtro de 70 μm para garantir que todas as criptas foram removidas do tubo original. Repita esta lavagem de lenço de papel para um total de 4x enxaguamentos.
- Centrifugar o filtrado a 300 x g durante 5 min a 4 °C e remover o sobrenadante. Adicione 600 μL de HOGMY e interrompa o pellet pipetando para cima e para baixo com uma pipeta de 200 μL. Coloque o tubo no gelo até que a solução fique gelada.
NOTA: Se a solução não estiver gelada, a cúpula não manterá a estrutura adequada quando chapeada. Evite a introdução de bolhas ao pipetar cúpulas de hidrogel à base de ECM, pois as bolhas impedirão a aderência adequada ao fundo da placa. - Adicione 600 μL de hidrogel gelado à base de ECM para suspender o pellet celular e misture bem com uma pipeta de 200 μL.
- Retire a placa de 24 poços da incubadora e coloque-a sobre um aquecedor de placas a 37 °C. Pipetar 50 μL de mistura gelada de hidrogel à base de HOGMY/ECM para o centro de 24 poços de uma placa de cultura de 24 poços (50 μL por cúpula).
- Uma vez chapeadas, deixe as cúpulas assentarem numa placa de 37 °C mais quente durante 1 min para permitir a aderência ao fundo da placa. Inverta cuidadosamente a placa, certifique-se de que não se acumulou condensação no fundo da placa e coloque a placa invertida na incubadora a 37 °C e 5% de CO2.
- Após 15 min, vire a placa do lado direito para cima e pipete 750 μL de HOGMY à temperatura ambiente em cada poço.
NOTA: Pipeta de mídia lentamente na parede lateral dos poços, tomando cuidado para não interromper a recém-formada cúpula de hidrogel à base de ECM 3D. - Uma vez que todos os poços tenham sido preenchidos com meios, coloque a placa na incubadora e troque o meio a cada 3 dias com 750 μL de HOGM. Enteróides de passagem a cada 7-10 dias.
- Passagem enteróide intestinal
NOTA: O protocolo a seguir é para uma placa de cultura de 24 poços contendo enteróides NHP a uma taxa de divisão de 1:2.- Remova o meio enteróide de cada poço, tomando cuidado para não interromper a cúpula de ECM contendo enteróides, adicione 500 μL de reagente de dissociação celular gelado a cada poço usando uma pipeta de 1.000 μL e incube à temperatura ambiente por 1 min.
- Interrompa manualmente o ECM pipetando para cima e para baixo 8-12x. Transfira o conteúdo de 12 poços para um tubo cônico de 15 mL.
- Uma vez que toda a solução tenha sido coletada da placa de cultura de 24 poços, adicione 250 μL de reagente de ruptura celular a cada poço para garantir que todos os enteróides NHP tenham sido removidos de cada poço, adicionando este último enxágue aos tubos cônicos de 15 mL existentes.
- Colocar sobre uma plataforma de balanço a 40 rpm durante 15 min à temperatura ambiente (20 °C). Alternativamente, agite manualmente os tubos por 15 minutos à temperatura ambiente.
- Após 15 min, centrifugar a 300 x g durante 5 min a 4 °C. Retire o sobrenadante dos tubos de 15 mL até que apenas o pellet permaneça.
- Adicione 8 mL de DMEM gelado + antibióticos de amplo espectro a um tubo cônico de 15 mL, certificando-se de que o pellet esteja suficientemente interrompido. Centrifugar a 300 x g durante 5 min a 4 °C e eliminar o sobrenadante.
- Adicione 600 μL de HOGMY e interrompa o pellet pipetando para cima e para baixo com uma pipeta de 1.000 μL. Coloque o tubo no gelo até que a solução fique gelada. Quando a solução estiver gelada, adicione 600 μL de ECM gelado para suspender o pellet celular e misture bem com uma pipeta de 1.000 μL. Repita as etapas 1.3.2.-1.3.7. para os restantes 12 poços.
- Para as etapas restantes, consulte as etapas 1.2.11.-1.2.16.
2. Estabelecimento de monocamada enteróide e ensaio de ferida de arranhão
- Preparação de meios e tratamentos
- Arrefecer 5 ml de PBS sem cálcio ou magnésio até gelar.
- Prepare o tampão de lavagem DMEM-F12 adicionando 1 mL dos antibióticos de amplo espectro (100 μg/mL) a 500 mL de DMEM/F12 (Dulbecco's Modified Eagle's Medium/Nutrient Ham's Mix F12 + 15 mM HEPES buffer). Mantenha gelado.
- Preparar 100 ml de HOGMY, conforme descrito no passo 1.1.1., e aquecê-lo na bancada até à temperatura ambiente.
- Aquecer 25 ml de ácido tripsina-etilenodiaminotetracético (EDTA) a 0,25% em banho-maria a 37 °C.
- Preparar concentrações de 50 μg/mL, 100 μg/mL e 200 μg/mL de HA35 para tratamento celular, utilizando PBS estéril sem cálcio ou magnésio como solvente. A diluição final do HA35 utilizará HOMGY como solvente.
NOTA: A preparação de HA35 pode requerer várias diluições, uma vez que o HA35 geralmente sai da solução a uma concentração superior a 5 mg/mL.
- Formação de monocamada enteróide
NOTA: O procedimento a seguir fornece volumes suficientes para a geração de uma placa de 24 poços de monocamadas enteróides. Ajuste os volumes para o número desejado de monocamadas.- Descongelar 96 μL de hidrogel BME (sem fenol vermelho) à base de ECM durante a noite no gelo a 2-8 °C. Diluir hidrogel à base de ECM em PBS gelado sem cálcio ou magnésio na proporção de 1:50. Revestir cada poço de uma placa de cultura de tecidos de 24 poços com 200 μL de hidrogel à base de ECM diluído a frio.
- Incubar a placa revestida de hidrogel à base de ECM durante um mínimo de 1 h a 37 °C e 5% de CO2. Aspirar meios da placa de cultura de 24 poços contendo os enteróides 3D destinados a monocamadas e substituir por 500 μL de reagente/poço de dissociação celular.
- Interrompa manualmente as cúpulas de hidrogel à base de ECM pipetando para cima e para baixo 8x-12x e transfira o conteúdo de 12 poços para um tubo cônico de 15 mL.
- Lave os 12 poços vazios com 250 μL de reagente de dissociação celular para garantir que todos os enteróides foram removidos e transfira o conteúdo para um tubo cônico de 15 mL. Repita a etapa 2.2.5. e passo 2.2.6. para os 12 poços restantes usando um segundo tubo cônico de 15 mL.
- Centrifugar os tubos cónicos a 300 x g durante 5 min a 4 °C e eliminar o sobrenadante. Adicione 10 mL de tampão de lavagem DMEM-F12 gelado a tubos cônicos de 15 mL e suspenda os pellets enteróides invertendo os tubos. Centrífuga a 300 x g durante 5 min a 4 °C.
- Remova o sobrenadante e ressuspenda os pellets celulares em 12 mL de tripsina-EDTA a 37 °C. Colocar os tubos em banho-maria a 37 °C durante 10 minutos ou até que as células pareçam solúveis. Adicione 3 mL de tampão de lavagem DMEM-F12 a cada tubo para diluir a tripsina-EDTA, misture invertendo os tubos e coloque no gelo.
- Filtrar os enteróides dissociados através de um filtro de células de malha de 37 μM, recolhendo o conteúdo em tubos cónicos limpos de 15 ml. Centrifugar os tubos a 300 x g durante 5 min a 4 °C.
- Enquanto as células estão peletizando na centrífuga, remova a placa revestida de hidrogel à base de ECM da incubadora e aspire qualquer solução de hidrogel à base de ECM em excesso sem arranhar a superfície revestida ou deixar a placa secar completamente.
- Remova o sobrenadante dos tubos cônicos e ressuspenda os pellets celulares com 6 mL de HOMGY. Adicionar 500 μL da suspensão combinada de 12 ml de células HOMGY em cada poço da placa de 24 poços revestida com hidrogel à base de ECM a uma densidade de semeadura de aproximadamente 3 x 105 células/poço. Gire a placa com uma tampa para garantir uma distribuição uniforme das células dentro dos poços.
- Incubar a placa a 37 °C e 5% de CO 2, trocando meios HOMGY a cada2 dias até que as monocamadas atinjam >90% de confluência.
- Tratamento monocamada e ensaio de arranhões
- Uma vez que as monocamadas atinjam >90% de confluência, aspirar o meio para remover quaisquer células que não se liguem. Tratar as células com 500 μL de HA35 (50 μg/mL, 100 μg/mL, 200 μg/mL) ou PBS, dissolvidas em HOMGY, por 24 h.
- Após 24 h, remova o meio, tomando cuidado para não interromper a superfície da monocamada. Usando uma ponta de pipeta de 200 μL, faça um arranhão linear em todo o diâmetro da superfície da monocamada em cada poço, tomando cuidado para não deixar as monocamadas secarem.
- Lave as monocamadas riscadas 1x com 500 μL de 1x PBS. Adicionar 500 μL de HA35 (50 μg/mL, 100 μg/mL, 200 μg/mL) ou PBS dissolvido em HOMGY e transferir a placa para o instrumento de análise de células vivas (Tabela de Materiais) dentro de uma incubadora de 37 °C e 5% de CO2 .
- No ícone Agendar no software de análise de células vivas (Tabela de Materiais), clique no ícone Iniciar Assistente para Adicionar Nova Embarcação e defina a frequência de varredura para digitalizar de acordo com uma programação. Crie uma nova embarcação de Poço Inteiro em Tipo de Digitalização, especifique as configurações de digitalização (ou seja, Fase para Canais de Imagem e 4x para Objetivo) e clique em Avançar.
- Selecione o fabricante da placa e o número de catálogo na lista fornecida. No ícone Agendamento , escolha o símbolo de adição onde a placa será colocada dentro do instrumento de análise de células vivas. Selecione o Padrão de digitalização desejado e, em seguida, crie um mapa de placa selecionando "+" na página Layout de placa. Selecione Adiar análise para mais tarde e, em seguida, defina a programação de varredura para cada 4 horas por 24 horas e verifique as configurações de aquisição na página Resumo do Assistente de embarcação . Por fim, selecione Adicionar à programação.
- Quando o ensaio 24 estiver concluído, no ícone Exibir, clique duas vezes em Nome da embarcação e exporte imagens e filmes. Selecione poços e uma série de imagens para exibir e exportar como um JPEG. Analise imagens para obter a porcentagem de cicatrização de feridas usando o plug-in Wound Healing Size para ImageJ21, de acordo com a etapa 2.4. abaixo.
- Análise de arranhões
- Abra o software ImageJ. Carregue as imagens do ensaio de arranhões (. TIFF ou .JPG).
- Selecione Imagem > Tipo > 8 bits para alterar a imagem de RGB de 24 bits para 8 bits. Instale o Plug-in de Tamanho de Cicatrização de Feridas selecionando Plug-ins > Macros > Instalar > Plug-in de Tamanho de Cicatrização de Feridas.
- Gire a imagem para que o rascunho fique vertical e inicialize o plug-in Wound Healing Size Tool.
- Selecione os parâmetros do plug-in na caixa de diálogo para melhor se ajustar à ferida do arranhão. Defina o valor dos parâmetros para as opções de tamanho de cicatrização de feridas da seguinte maneira: Raio da janela de variância em 20, Valor limite em 100 e Porcentagem de pixels saturados em 0,001 e escolha Sim para Definir escala global. Finalize a seleção clicando no botão OK . Verifique se a área selecionada é a área da ferida. Os parâmetros acima podem exigir padronização de laboratório para laboratório.
- Repita as etapas 2.4.2.-2.4.4. para os pontos de tempo restantes para cada arranhão.
- Calcule a porcentagem de cicatrização de feridas na área de arranhões de células migratórias ou proliferantes ao longo de 24 horas da seguinte forma:
% Cicatrização de Feridas =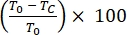
onde T 0 = % Área no tempo 0 h e Tc = % Área em 0 h, 4 h, 12 h ou 24 h.
Resultados
Os efeitos do AH no reparo tecidual e cicatrização de feridas em vários tecidos e órgãos estão bem documentados; no entanto, os efeitos específicos do AH com um peso molecular de 35 kDa na cicatrização e regeneração do intestino delgado fetal ou neonatal são atualmente desconhecidos. Para testar a capacidade do HA35 de promover a cicatrização de feridas em um modelo do intestino delgado fetal ou neonatal, geramos enteroides intestinais 3D a partir do tecido ileal NHP e dissociamos ainda mais esse tecido em ...
Discussão
O trato gastrointestinal de um prematuro está sob pressão regenerativa contínua de exposições repetidas a insultos ambientais associados à disbiose, metabólitos e toxinas bacterianas inflamatórias e hipóxia intermitente23,24. Infelizmente, o epitélio intestinal do prematuro é incapaz de estabelecer rapidamente a integridade funcional23, resultando em disfunção de barreira, aumento da permeabilidade intestinal e, em casos grave...
Divulgações
Os autores não têm nada a divulgar e nenhum conflito de interesses.
Agradecimentos
Este conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais dos Institutos Nacionais de Saúde. HC é apoiado pela concessão P20GM134973 dos Institutos Nacionais de Saúde. A KB é apoiada por uma doação da Children's Hospital Foundation (CHF) e da Presbyterian Health Foundation (PHF). Os serviços de imagem de células vivas fornecidos pelo núcleo de Genômica Funcional do Câncer foram apoiados em parte pelo National Institute of General Medical Sciences Grant P20GM103639 e pelo National Cancer Institute Grant P30CA225520 dos Institutos Nacionais de Saúde, concedido ao Centro de Ciências da Saúde Stephenson da Universidade de Oklahoma.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipet | Fisher Scientific | 13-675-49 | |
| 100x21mm Dish, Nunclon Delta | ThermoFisher Scientific | 172931 | |
| 15 mL Conical tube | VWR | 89039-666 | |
| 24-Well, TC-Treated, Flat Bottom Plate | Corning | 3524 | |
| 37 µM Reversible Cell Strainer | STEMCELL Technologies | 27215 | |
| 50 mL Conical tube | VWR | 89039-658 | |
| 70 µm Sterile Cell Strainers | Fisher Scientific | FB22-363-548 | |
| Albumin, Bovine (BSA) | VWR | 0332-100G | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | |
| Dulbecco's Modified Eagle's Medium/Nutrient Ham's Mixture F-12 (DMEM-F12) with 15 mM HEPES buffer | STEMCELL Technologies | 36254 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | |
| ImageJ | NIH | imagej.nih.gov/ij/ | |
| Incucyte S3 Live-Cell Analysis Instrument | Sartorius | 4647 | |
| Incucyte Scratch Wound Analysis Software Module | Sartorius | 9600-0012 | |
| IntestiCult Organoid Growth Medium (Human) | STEMCELL Technologies | 06010 | This is HOGMY, but without the Y-27632 or antibiotics. Also used as base for HOGM, but then only missing the antibiotics. |
| Lipopolysaccharides from Escherichia coli O111:B4, purified by gel filtration chromatography | Millipore Sigma | L3012-10MG | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, Phenol Red-Free | Corning | 356231 | |
| Nunc MicroWell 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | ThermoFisher Scientific | 136101 | |
| PBS (Phosphate-Buffered Saline), 1X [-] Calcium, Magnesium, pH 7.4 | Corning | 21-040-CM | |
| Primocin | Invivogen | ant-pm-1 | This is broad-spectrum antibiotics |
| Sodium Hyaluronate, Research Grade, HA20K | Lifecore Biomedical | HA20K-1 | |
| TC20 Automated Cell Counter | Company: Bio-Rad | 1450102 | |
| Trypsin-EDTA 1X, 0.25% Trypsin | Fisher Scientific | MT25053CI | |
| Y-27632 | STEMCELL Technologies | 72302 |
Referências
- Lemons, J. A., et al. Very low birth weight outcomes of the National Institute of Child Health and Human Development Neonatal Research Network, January 1995 through December 1996. Pediatrics. 107 (1), 1 (2001).
- Burge, K., Vieira, F., Eckert, J., Chaaban, H. Lipid composition, digestion, and absorption differences among neonatal feeding strategies: Potential implications for intestinal inflammation in preterm infants. Nutrients. 13 (2), 550 (2021).
- Duffy, L. C. Interactions mediating bacterial translocation in the immature intestine. The Journal of Nutrition. 130, 432-436 (2000).
- Nanthakumar, N., et al. The mechanism of excessive intestinal inflammation in necrotizing enterocolitis: An immature innate immune response. PLoS One. 6 (3), 17776 (2011).
- Nanthakumar, N. N., Fusunyan, R. D., Sanderson, I., Walker, W. A. Inflammation in the developing human intestine: A possible pathophysiologic contribution to necrotizing enterocolitis. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 6043-6048 (2000).
- He, Y., Lawlor, N. T., Newburg, D. S. Human milk components modulate toll-like receptor-mediated inflammation. Advances in Nutrition. 7 (1), 102-111 (2016).
- Walker, W. A., Iyengar, R. S. Breast milk, microbiota, and intestinal immune homeostasis. Pediatric Research. 77 (1-2), 220-228 (2015).
- Westerbeek, E. A., vanden Berg, A., Lafeber, H. N., Fetter, W. P., van Elburg, R. M. The effect of enteral supplementation of a prebiotic mixture of non-human milk galacto-, fructo- and acidic oligosaccharides on intestinal permeability in preterm infants. British Journal of Nutrition. 105 (2), 268-274 (2011).
- vanden Berg, A., et al. The effect of glutamine-enriched enteral nutrition on intestinal permeability in very-low-birth-weight infants: A randomized controlled trial. Journal of Parenteral and Enteral Nutrition. 30 (5), 408-414 (2006).
- Foster, J. P., Seth, R., Cole, M. J. Oral immunoglobulin for preventing necrotizing enterocolitis in preterm and low birth weight neonates. The Cochrane Database of Systematic Reviews. 4 (4), (2016).
- Maffei, D., Schanler, R. J. Human milk is the feeding strategy to prevent necrotizing enterocolitis. Seminars in Perinatology. 41 (1), 36-40 (2017).
- Patel, A. L., Kim, J. H. Human milk and necrotizing enterocolitis. Seminars in Pediatric Surgery. 27 (1), 34-38 (2018).
- Nolan, L. S., Parks, O. B., Good, M. A review of the immunomodulating components of maternal breast milk and protection against necrotizing enterocolitis. Nutrients. 12 (1), 14 (2019).
- Hill, D. R., et al. Human milk hyaluronan enhances innate defense of the intestinal epithelium. Journal of Biological Chemistry. 288 (40), 29090-29104 (2013).
- Burge, K., Bergner, E., Gunasekaran, A., Eckert, J., Chaaban, H. The role of glycosaminoglycans in protection from neonatal necrotizing enterocolitis: A narrative review. Nutrients. 12 (2), 546 (2020).
- Chaaban, H., et al. Acceleration of small intestine development and remodeling of the microbiome following hyaluronan 35 kDa treatment in neonatal mice. Nutrients. 13 (6), 2030 (2021).
- Gunasekaran, A., et al. Hyaluronan 35 kDa enhances epithelial barrier function and protects against the development of murine necrotizing enterocolitis. Pediatric Research. 87 (7), 1177-1184 (2020).
- Montenegro-Miranda, P. S., et al. A novel organoid model of damage and repair identifies HNF4α as a critical regulator of intestinal epithelial regeneration. Cellular and Molecular Gastroenterology and Hepatology. 10 (2), 209-223 (2020).
- Lee, C., Hong, S. N., Kim, E. R., Chang, D. K., Kim, Y. H. Epithelial regeneration ability of Crohn's disease assessed using patient-derived intestinal organoids. International Journal of Molecular Sciences. 22 (11), 6013 (2021).
- Gurung, S., et al. Maternal Zika virus (ZIKV) infection following vaginal inoculation with ZIKV-infected semen in timed-pregnant olive baboons. Journal of Virology. 94 (11), 00058 (2020).
- Suarez-Arnedo, A., et al. An image J plugin for the high throughput image analysis of in vitro scratch wound healing assays. PLoS One. 15 (7), 0232565 (2020).
- Kobelt, D., Walther, W., Stein, U. S. Real-time cell migration monitoring to analyze drug synergism in the scratch assay using the IncuCyte system. Methods in Molecular Biology. 2294, 133-142 (2021).
- de Jong, J. C. W., Ijssennagger, N., van Mil, S. W. C. Breast milk nutrients driving intestinal epithelial layer maturation via Wnt and Notch signaling: Implications for necrotizing enterocolitis. Biochimica et Biophysica Acta - Molecular Basis of Disease. 1867 (11), 166229 (2021).
- Yu, Y., et al. Erythropoietin protects epithelial cells from excessive autophagy and apoptosis in experimental neonatal necrotizing enterocolitis. PLoS One. 8 (7), 69620 (2013).
- Kessler, S. P., et al. Multifunctional role of 35 kilodalton hyaluronan in promoting defense of the intestinal epithelium. The Journal of Histochemistry and Cytochemistry. 66 (4), 273-287 (2018).
- Fraser, J. R. E., Laurent, T. C., Laurent, U. B. G. Hyaluronan: Its nature, distribution, functions and turnover. Journal of Internal Medicine. 242 (1), 27-33 (1997).
- Kim, Y., et al. Hyaluronan 35kDa treatment protects mice from Citrobacter rodentium infection and induces epithelial tight junction protein ZO-1 in vivo. Matrix Biology. 62, 28-39 (2017).
- Prehm, P., Schumacher, U. Inhibition of hyaluronan export from human fibroblasts by inhibitors of multidrug resistance transporters. Biochemical Pharmacology. 68 (7), 1401-1410 (2004).
- Stenson, W. F., Ciorba, M. A. Nonmicrobial activation of TLRs controls intestinal growth, wound repair, and radioprotection. Frontiers in Immunology. 11 (3591), 617510 (2021).
- Riehl, T. E., Ee, X., Stenson, W. F. Hyaluronic acid regulates normal intestinal and colonic growth in mice. American Journal of Physiology-Gastrointestinal and Liver Physiology. 303 (3), 377-388 (2012).
- Riehl, T. E., Santhanam, S., Foster, L., Ciorba, M., Stenson, W. F. CD44 and TLR4 mediate hyaluronic acid regulation of Lgr5+ stem cell proliferation, crypt fission, and intestinal growth in postnatal and adult mice. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309 (11), 874-887 (2015).
- Hill, D. R., Kessler, S. P., Rho, H. K., Cowman, M. K., de la Motte, C. A. Specific-sized hyaluronan fragments promote expression of human beta-defensin 2 in intestinal epithelium. Journal of Biological Chemistry. 287 (36), 30610-30624 (2012).
- Fernando, E. H., Gordon, M. H., Beck, P. L., MacNaughton, W. K. Inhibition of intestinal epithelial wound healing through protease-activated receptor-2 activation in Caco2 cells. Journal of Pharmacology and Experimental Therapeutics. 367 (2), 382-392 (2018).
- Nyegaard, S., Christensen, B., Rasmussen, J. T. An optimized method for accurate quantification of cell migration using human small intestine cells. Metabolic Engineering Communications. 3, 76-83 (2016).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Singh, A., Poling, H. M., Spence, J. R., Wells, J. M., Helmrath, M. A. Gastrointestinal organoids: a next-generation tool for modeling human development. American Journal of Physiology-Gastrointestinal and Liver Physiology. 319 (3), 375-381 (2020).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Experimental Biology and Medicine. 239 (9), 1124-1134 (2014).
- Foulke-Abel, J., et al. Human enteroids as a model of upper small intestinal ion transport physiology and pathophysiology. Gastroenterology. 150 (3), 638-649 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados