Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Transformación inducida por mediadores fosfolípidos en cultivos tridimensionales
En este artículo
Resumen
El presente protocolo describe la creación de cultivos 3D "en la parte superior " de una línea celular epitelial de mama no transformada, MCF10A, que se ha modificado para estudiar la transformación inducida por el factor activador plaquetario (PAF). La inmunofluorescencia se ha utilizado para evaluar la transformación y se discute en detalle.
Resumen
Se han desarrollado varios modelos para estudiar el cáncer, como modelos de roedores y líneas celulares establecidas. Los estudios que utilizan estos modelos han proporcionado información valiosa sobre la carcinogénesis. Las líneas celulares han proporcionado una comprensión de la desregulación de la señalización molecular asociada con la tumorigénesis de mama, mientras que los modelos de roedores se utilizan ampliamente para estudiar las características celulares y moleculares del cáncer de mama in vivo. El establecimiento de cultivos 3D de células epiteliales y cancerosas de mama ayuda a cerrar la brecha entre los modelos in vivo e in vitro al imitar las condiciones in vivo in vitro. Este modelo se puede utilizar para comprender la desregulación de eventos complejos de señalización molecular y las características celulares durante la carcinogénesis mamaria. Aquí, se modifica un sistema de cultivo 3D para estudiar una transformación inducida por un mediador fosfolípido (factor activador plaquetario, PAF). Los inmunomoduladores y otras moléculas secretadas juegan un papel importante en la iniciación y progresión del tumor en la mama. En el presente estudio, los cultivos acinares 3D de células epiteliales mamarias se exponen a características de transformación exhibidas por PAF, como pérdida de polaridad y características celulares alteradas. Este sistema de cultivo 3D ayudará a arrojar luz sobre las perturbaciones genéticas y / o epigenéticas inducidas por varias entidades de moléculas pequeñas en el microambiente tumoral. Además, este sistema también proporcionará una plataforma para la identificación de genes nuevos y conocidos que pueden estar involucrados en el proceso de transformación.
Introducción
Una miríada de modelos están disponibles para estudiar la progresión del cáncer, cada uno de ellos es único y representa un subtipo de esta compleja enfermedad. Cada modelo proporciona información única y valiosa sobre la biología del cáncer y ha mejorado los medios para imitar la condición real de la enfermedad. Las líneas celulares establecidas cultivadas como una monocapa han proporcionado información valiosa sobre procesos vitales in vitro, como la proliferación, la invasividad, la migración y la apoptosis1. Aunque el cultivo celular bidimensional (2D) ha sido la herramienta tradicional para investigar la respuesta de las células de mamíferos a varias perturbaciones ambientales, la extrapolación de estos hallazgos para predecir las respuestas a nivel tisular no parece lo suficientemente convincente. La principal limitación de los cultivos 2D es que el microambiente creado difiere en gran medida del tejido mamario en sí2. El cultivo 2D carece de la interacción de las células con la matriz extracelular, que es vital para el crecimiento de cualquier tejido. Además, las fuerzas de tracción experimentadas por la célula en cultivos monocapa dificultan la polaridad de esas células, alterando así la señalización celular y el comportamiento 3,4,5. Los sistemas de cultivo tridimensionales (3D) han abierto una nueva vía en el campo de la investigación del cáncer con su capacidad para imitar las condiciones in vivo in vitro. Muchas señales microambientales cruciales que se pierden en el cultivo celular 2D podrían restablecerse utilizando cultivos 3D de matriz extracelular rica en laminina (lrECM)6.
Diversos estudios han identificado la importancia del microambiente tumoral en la carcinogénesis 7,8. Los factores asociados a la inflamación son una parte importante del microambiente. El factor activador plaquetario (PAF) es un mediador fosfolípido secretado por varias células inmunes que media múltiples respuestas inmunes 9,10. Los altos niveles de PAF son secretados por diferentes líneas celulares de cáncer de mama y están asociados con una mayor proliferación11. Estudios de nuestro laboratorio han demostrado que la presencia prolongada de PAF en cultivos acinares conduce a la transformación de las células epiteliales de mama12. PAF activa el receptor PAF (PAFR), activando el eje de señalización PI3K/Akt13. También se informa que el FAP está asociado con EMT, invasión y metástasis14.
El presente protocolo demuestra un sistema modelo para estudiar la transformación inducida por PAF, utilizando cultivos 3D de células epiteliales de mama, como ha sido descrito previamente por Chakravarty et al.12. Las células epiteliales mamarias cultivadas en la matriz extracelular (cultivos 3D) tienden a formar esferoides polarizados con crecimiento detenido. Estos son llamados acinos y se asemejan mucho a los acinos del tejido mamario, la unidad funcional más pequeña de la glándula mamaria, in vivo15. Estos esferoides (Figura 1A, B) consisten en una monocapa de células epiteliales polarizadas estrechamente empaquetadas que rodean una luz hueca y están unidas a la membrana basal (Figura 1C). Este proceso de morfogénesis ha sido bien descrito en la literatura16. Cuando se siembran en lrECM, las células se dividen y diferencian para formar un grupo de células, que luego se polarizan desde el día 4 en adelante. Para el día 8, los acinos consisten en un grupo de células polarizadas que están en contacto directo con la matriz extracelular y un grupo de células no polarizadas encerradas dentro de las células polarizadas externas, sin contacto con la matriz. Se sabe que estas células no polarizadas sufren apoptosis en el día 12 de cultivo, formando una luz hueca. Para el día 16, se forman estructuras con crecimiento detenido16.
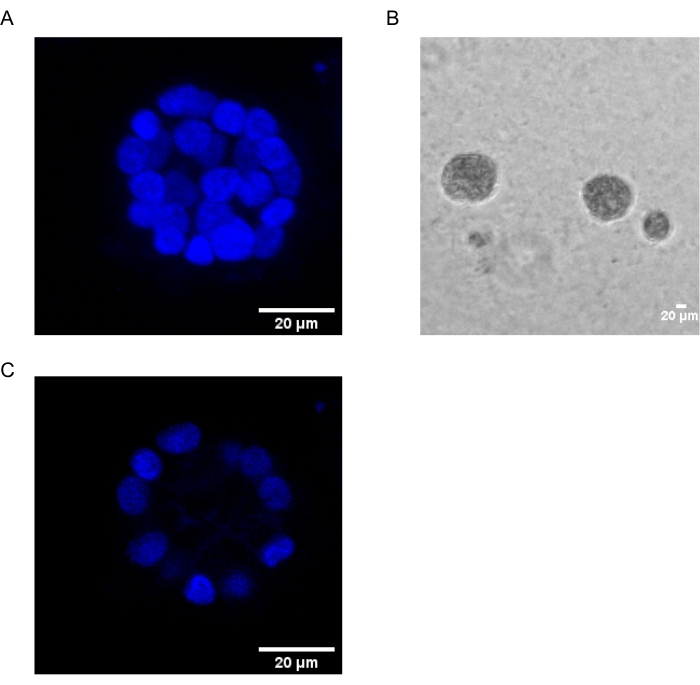
Figura 1: Núcleos de células en acinos teñidos con una tinción nuclear . (A) Construcción 3D de los acinos. (B) Imagen de contraste de fase de acinos MCF10A cultivados en Matrigel durante 20 días. (C) La sección central muestra la presencia de un lumen hueco. Barra de escala = 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
A diferencia de los cultivos 2D, los cultivos acinares ayudan a distinguir las células normales y transformadas a través de cambios morfológicos aparentes. Las células epiteliales mamarias no transformadas forman acinos con una luz hueca, imitando los acinos normales de la mama humana. Estos esferoides, tras la transformación, muestran una morfología alterada caracterizada por una pérdida importante de polaridad (una de las características del cáncer), ausencia de una luz o interrupción de la luz hueca (debido a la evasión de la apoptosis) que puede ser inducida debido a la desregulación de varios genes17,18,19,20 . Estas transformaciones se pueden estudiar utilizando técnicas de uso común como la inmunofluorescencia. Por lo tanto, el modelo de cultivo celular 3D puede funcionar como un método simple para investigar el proceso de morfogénesis acinar mamaria y carcinogénesis mamaria. El establecimiento de un sistema de cultivo 3D para comprender el efecto de un mediador fosfolípido, PAF, ayudará en la detección preclínica de fármacos de alto rendimiento.
Este trabajo ha adaptado el protocolo de cultivo 3D 'on top'16,21 para estudiar la transformación inducida por PAF 22. Los cambios fenotípicos inducidos por la exposición de los acinos al mediador fosfolípido se estudiaron mediante inmunofluorescencia. En el estudio se utilizaron varios marcadores de polaridad y transición epitelial-mesenquimal (EMT)12,16. La Tabla 1 menciona su localización normal y su fenotipo esperado tras la transformación.
| Anticuerpos | Marcas | Localización normal | Fenotipo transformado |
| α6-Integrina | Basolateral | Basal con tinción lateral débil | Fuerte tinción lateral / apical |
| β-Catenin | Unión célula-célula | Basolateral | Localización anormal / nuclear o citoplasmática |
| Vimentina | Emt | Presencia ausente / débil | Regulación positiva |
Tabla 1: Marcadores utilizados en el estudio. Diferentes marcadores utilizados con su localización en presencia y ausencia de tratamiento con FAP.
Este método se puede utilizar mejor para estudiar / detectar medicamentos plausibles y genes objetivo para varios subtipos de cáncer de mama. Esto puede proporcionar datos de respuesta a medicamentos más cercanos al escenario in vivo , ayudando a un desarrollo de medicamentos más rápido y confiable. Además, este sistema se puede utilizar para estudiar la señalización molecular asociada con la respuesta a los medicamentos y la resistencia a los medicamentos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Siembra de células MCF10A en lrECM
- Mantener las células MCF10A (células epiteliales mamarias adherentes) en el medio de crecimiento. Pasar las células cada 4 días.
NOTA: Composición del medio de crecimiento: DMEM de glucosa alta sin piruvato de sodio que contiene suero de caballo (5%), insulina (10 μg/ml), hidrocortisona (0,5 μg/ml), factor de crecimiento epidérmico, EGF (20 ng/ml), de la toxina del cólera (100 ng/ml) y penicilina-estreptomicina (100 unidades/ml) (ver Tabla de materiales). - Descongelar lrECM (ver Tabla de materiales) en hielo 20 minutos antes del inicio del experimento. El día de siembra de las células generalmente se considera Día 0.
- Para tripsinizar las células, aspirar el medio y lavar con 2 ml de PBS. Añadir 900 μL de tripsina-EDTA al 0,05% e incubar a 37 °C durante ~15 min o hasta que las células estén completamente tripsinizadas.
- Prepare un lecho de lrECM en ocho pocillos de un portaobjetos de vidrio con cámara (consulte la Tabla de materiales).
- Cuando las células estén tripsinizantes, cubra cada pocillo con 60 μL de lrECM y colóquelo en una incubadora deCO2 a 37 °C durante un máximo de 15 min.
- Prepare la suspensión celular siguiendo los pasos a continuación.
- Después del desplazamiento completo de las células, añadir 5 ml de medio de resuspensión para calmar la actividad de la tripsina y hacer girar las células a 112 x g durante 10 min a 25 °C.
NOTA: Composición del medio de resuspensión: DMEM de glucosa alta sin piruvato de sodio, suplementado con suero de caballo (20%) y penicilina-estreptomicina (100 unidades/mL). - Aspirar el medio gastado y volver a suspender las células en 2 ml de medio de ensayo. Mezcle bien la suspensión para asegurar la formación de una suspensión de una sola célula.
NOTA: Composición del medio de ensayo: DMEM de glucosa alta sin piruvato de sodio, suplementado con suero de caballo (2%), hidrocortisona (0,5 μg/ml), toxina del cólera (100 ng/ml), insulina (10 μg/ml) y penicilina-estreptomicina (100 unidades/ml). - Cuente las células usando un hemocitómetro y calcule el volumen de suspensión celular necesario para sembrar 6 x 103 células en cada pocillo.
NOTA: En general, se prefiere incluir un pozo adicional en el cálculo para tener en cuenta cualquier error de pipeteo. - De acuerdo con el número de pocillos requeridos, diluya la suspensión celular en medio de superposición.
NOTA: La composición del medio de superposición para un solo pocillo es la siguiente: 400 μL de medio de ensayo, 8 μL de lrECM (2% final) y 0,02 μL de 100 μg/ml de EGF (5 ng/ml final).
- Después del desplazamiento completo de las células, añadir 5 ml de medio de resuspensión para calmar la actividad de la tripsina y hacer girar las células a 112 x g durante 10 min a 25 °C.
- Realizar siembra de las celdas.
- Añadir 400 μL de la suspensión de células diluidas a los lechos lrECM preparados (paso 1.4), asegurándose cuidadosamente de no alterar el lecho lrECM. Incubar a 37 °C en una incubadora humidificada deCO2 al 5%.
2. Tratamiento PAF
- Añadir PAF 3 h después de la siembra de las células. Prepare un stock de 100 μM de PAF en PBS y agregue el volumen requerido de 0.2 μL en cada pocillo (que corresponde a 200 nM).
- Agregue la misma concentración de PAF durante cada cambio de medios.
3. Realimentación con medios frescos
- Reponga las células con medio fresco cada 4 días (es decir, día 4, día 8, día 12 y día 16).
4. Estudio de inmunofluorescencia para detectar cambios fenotípicos inducidos por la exposición prolongada a PAF
- Después de 20 días de cultivo, pipetear cuidadosamente el medio de cada pocillo y lavar los pocillos con 400 μL de PBS precalentado.
- Fijar las estructuras acinares añadiendo 400 μL de paraformaldehído al 4% (recién preparado diluyendo paraformaldehído al 16% en 1x PBS) e incubando durante 20 min a temperatura ambiente.
- Enjuague los pocillos una vez con PBS helado y permeabilice con PBS que contenga 0,5% de Triton X-100 durante 10 min a 4 °C.
- Después de 10 minutos, inmediatamente pero con cuidado pipetear la solución Triton-X 100 y enjuagar con 400 μL de PBS-glicina (recién preparada añadiendo una pizca de glicina en 1x PBS). Esto se repite tres veces durante 15 minutos cada una.
- Añadir 400 μL de la solución bloqueante primaria que comprende 10% de suero de cabra (ver Tabla de materiales) en tampón de inmunofluorescencia (IF) e incubar a temperatura ambiente durante 60 min.
NOTA: Composición del tampón IF: 0,05% de azida de sodio, 0,1% de BSA, 0,2% de Triton-X 100 y 0,05% de Tween (20 en 1 PBS). - Retirar la solución bloqueante primaria, añadir 200 μL de anticuerpo bloqueador secundario al 2% (F(ab')2 fragmento de anticuerpo criado en cabra contra antígeno de ratón, ver Tabla de materiales) preparado en solución bloqueante primaria, y dejar actuar durante 45-60 min a temperatura ambiente.
- Prepare el anticuerpo primario (ver Tabla de materiales) en una solución de anticuerpos de bloqueo secundario al 2% en una dilución 1:100. Después de retirar la solución de bloqueo secundario, añadir el anticuerpo recién preparado e incubar durante la noche a 4 °C.
- El paso anterior puede provocar la licuefacción de la membrana basal. Antes de continuar con el experimento, espere hasta que el portaobjetos alcance la temperatura ambiente. Pipetear cuidadosamente la solución de anticuerpos primarios y lavarla tres veces con 400 μL de tampón IF.
- Durante el último lavado con tampón IF, prepare una dilución 1:200 del anticuerpo secundario conjugado con fluoróforos (ver Tabla de materiales) en la solución bloqueante primaria. Incubar los portaobjetos en la solución de anticuerpos secundarios durante 40-60 min a temperatura ambiente.
- Enjuague los portaobjetos con 400 μL de tampón IF durante 20 minutos, seguido de dos lavados con PBS durante 10 minutos cada uno.
- Contrarrestar la tinción de los núcleos con PBS que contiene 0,5 ng/ml de tinción nuclear (ver Tabla de materiales) durante 5-6 min a temperatura ambiente. Lave los portaobjetos tres veces con 400 μL de PBS para eliminar el exceso de manchas.
- Pipetear cuidadosamente todo el PBS y asegurar la eliminación de la solución residual. Agregue una gota de reactivo de montaje (consulte la Tabla de materiales) en cada pocillo y déjelo reposar a temperatura ambiente durante la noche.
- Guarde las diapositivas a temperatura ambiente y obtenga imágenes de las diapositivas lo antes posible.
- Imagen con un aumento de 40x o 63x en un microscopio confocal (consulte la Tabla de materiales), tomando secciones Z ópticas de 0,6 mm de tamaño de paso (NA = 1,4).
- Abra las imágenes adquiridas con un software de procesamiento de imágenes (consulte la Tabla de materiales). Demostrar las diferencias morfológicas utilizando proyecciones 3D.
NOTA: La sección Z óptica más central se puede utilizar mejor para mostrar diferencias en la localización de los marcadores de polaridad. Estos se pueden cuantificar manualmente para representar el porcentaje de esferoides que muestran ese patrón de tinción específico. - Para ilustrar las diferencias en la expresión de proteínas, realice un análisis semicuantitativo midiendo el valor gris medio o calculando la fluorescencia celular total corregida (CTCF)23. Representar los datos como diagramas de violín o puntos.
Access restricted. Please log in or start a trial to view this content.
Resultados
Las células MCF10A, tras la exposición al tratamiento con PAF, forman estructuras acinares con fenotipos muy distintos. Se encontró que la α6-integrina estaba mal localizada con más tinción apical. Algunos acinos también mostraron tinción discontinua (Figura 2A). Ambos fenotipos indican la pérdida de polaridad basal, como lo demuestra la literatura24,25. Informes anteriores indican el controvertido papel de la α6-integrina ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Los modelos establecidos basados en líneas celulares se utilizan ampliamente para estudiar el proceso de carcinogénesis. Los cultivos monocapa de células continúan proporcionando información sobre las diversas vías de señalización molecular que median los cambios característicos en las células cancerosas32. Los estudios sobre el papel de oncogenes bien conocidos como Ras, Myc y p53 mutado se informaron por primera vez utilizando cultivos monocapa como sistema modelo33,3...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores declaran no tener posibles conflictos de intereses.
Agradecimientos
Agradecemos al IISER Pune Microscopy Facility por el acceso a equipos e infraestructura y el apoyo para los experimentos. Este estudio fue apoyado por una subvención del Departamento de Biotecnología (DBT), el Gobierno de la India (BT / PR8699 / MED / 30 / 1018 / 2013), la Junta de Investigación de Ciencia e Ingeniería (SERB), el Gobierno de la India (EMR / 2016 / 001974) y en parte por IISER, Pune Core financiamiento. A. K. fue financiado por la beca CSIR-SRF, L.A. fue financiado a través de la beca DST-INSPIRE, V.C fue financiado por DBT (BT / PR8699 / MED / 30 / 1018 / 2013).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
Referencias
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O'Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938(2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287(2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688(2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12(2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543(2020).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados