È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Trasformazione indotta dal mediatore dei fosfolipidi in colture tridimensionali
In questo articolo
Riepilogo
Il presente protocollo descrive la messa a punto di colture 3D "on top " di una linea cellulare epiteliale mammaria non trasformata, MCF10A, che è stata modificata per studiare la trasformazione indotta dal fattore attivante piastrinico (PAF). L'immunofluorescenza è stata utilizzata per valutare la trasformazione ed è discussa in dettaglio.
Abstract
Diversi modelli sono stati sviluppati per studiare il cancro, come modelli di roditori e linee cellulari stabilite. Informazioni preziose sulla carcinogenesi sono state fornite da studi che utilizzano questi modelli. Le linee cellulari hanno fornito una comprensione della deregolazione della segnalazione molecolare associata alla tumorigenesi mammaria, mentre i modelli di roditori sono ampiamente utilizzati per studiare le caratteristiche cellulari e molecolari del cancro al seno in vivo. La creazione di colture 3D di cellule epiteliali e cancerose del seno aiuta a colmare il divario tra modelli in vivo e in vitro imitando le condizioni in vivo in vitro. Questo modello può essere utilizzato per comprendere la deregolazione di eventi di segnalazione molecolare complessi e le caratteristiche cellulari durante la carcinogenesi mammaria. Qui, un sistema di coltura 3D viene modificato per studiare una trasformazione indotta dal mediatore fosfolipidico (Fattore di attivazione piastrinica, PAF). Gli immunomodulatori e altre molecole secrete svolgono un ruolo importante nell'inizio e nella progressione del tumore nel seno. Nel presente studio, le colture acinose 3D di cellule epiteliali mammarie sono esposte a caratteristiche di trasformazione PAF come perdita di polarità e caratteristiche cellulari alterate. Questo sistema di coltura 3D aiuterà a far luce sulle perturbazioni genetiche e / o epigenetiche indotte da varie entità di piccole molecole nel microambiente tumorale. Inoltre, questo sistema fornirà anche una piattaforma per l'identificazione di geni nuovi e noti che potrebbero essere coinvolti nel processo di trasformazione.
Introduzione
Una miriade di modelli sono disponibili per studiare la progressione del cancro, ognuno dei quali è unico e rappresenta un sottotipo di questa complessa malattia. Ogni modello fornisce informazioni uniche e preziose sulla biologia del cancro e ha migliorato i mezzi per imitare la condizione reale della malattia. Le linee cellulari consolidate cresciute come monostrato hanno fornito preziose informazioni sui processi vitali in vitro, come proliferazione, invasività, migrazione e apoptosi1. Sebbene la coltura cellulare bidimensionale (2D) sia stata lo strumento tradizionale per studiare la risposta delle cellule di mammifero a diverse perturbazioni ambientali, l'estrapolazione di questi risultati per prevedere le risposte a livello tissutale non sembra sufficientemente convincente. La principale limitazione delle colture 2D è che il microambiente creato differisce in gran parte da quello del tessuto mammario stesso2. La coltura 2D manca dell'interazione delle cellule con la matrice extracellulare, che è vitale per la crescita di qualsiasi tessuto. Inoltre, le forze di trazione sperimentate dalla cellula in colture monostrato ostacolano la polarità di queste cellule, alterando così la segnalazione e il comportamento cellulare 3,4,5. I sistemi di coltura tridimensionali (3D) hanno aperto una nuova strada nel campo della ricerca sul cancro con la loro capacità di imitare le condizioni in vivo in vitro. Molti segnali microambientali cruciali che vengono persi nella coltura cellulare 2D potrebbero essere ristabiliti utilizzando colture 3D di matrice extracellulare ricca di laminina (lrECM)6.
Diversi studi hanno identificato l'importanza del microambiente tumorale nella carcinogenesi 7,8. I fattori associati all'infiammazione sono una parte importante del microambiente. Il fattore attivante piastrinico (PAF) è un mediatore fosfolipidico secreto da varie cellule immunitarie che media le risposte immunitarie multiple 9,10. Alti livelli di PAF sono secreti da diverse linee cellulari di cancro al seno e sono associati a una maggiore proliferazione11. Studi del nostro laboratorio hanno dimostrato che la presenza prolungata di PAF nelle colture acinose porta alla trasformazione delle cellule epiteliali mammarie12. PAF attiva il recettore PAF (PAFR), attivando l'asse di segnalazione PI3K/Akt13. PAFR è anche segnalato per essere associato a EMT, invasione e metastasi14.
Il presente protocollo dimostra un sistema modello per studiare la trasformazione indotta da PAF, utilizzando colture 3D di cellule epiteliali mammarie, come è stato precedentemente descritto da Chakravarty et al.12. Le cellule epiteliali mammarie cresciute sulla matrice extracellulare (colture 3D) tendono a formare sferoidi polarizzati arrestati dalla crescita. Questi sono chiamati acini e assomigliano molto agli acini del tessuto mammario, la più piccola unità funzionale della ghiandola mammaria, in vivo15. Questi sferoidi (Figura 1A,B) sono costituiti da un monostrato di cellule epiteliali polarizzate strettamente imballate che circondano un lume cavo e attaccate alla membrana basale (Figura 1C). Questo processo di morfogenesi è stato ben descritto in letteratura16. Quando seminano su lrECM, le cellule subiscono divisione e differenziazione per formare un gruppo di cellule, che poi si polarizzano dal giorno 4 in poi. Al giorno 8, gli acini sono costituiti da un gruppo di cellule polarizzate che sono in contatto diretto con la matrice extracellulare e un gruppo di cellule non polarizzate racchiuse all'interno delle cellule polarizzate esterne, senza contatto con la matrice. Queste cellule non polarizzate sono note per andare incontro ad apoptosi entro il giorno 12 della coltura, formando un lume cavo. Entro il giorno 16, le strutture in arresto della crescita si formano16.
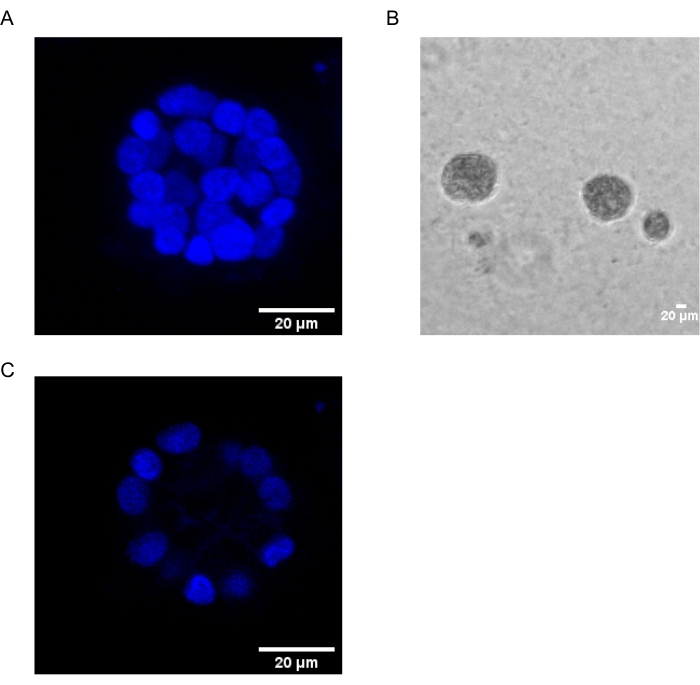
Figura 1: Nuclei di cellule in acini colorati con una colorazione nucleare . (A) Costruzione 3D degli acini. (B) Immagine a contrasto di fase di MCF10A acini coltivati su Matrigel per 20 giorni. (C) La sezione più centrale mostra la presenza di un lume cavo. Barra di scala = 20 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
A differenza delle colture 2D, le colture di acinosi aiutano a distinguere le cellule normali e trasformate attraverso apparenti cambiamenti morfologici. Le cellule epiteliali mammarie non trasformate formano acini con un lume cavo, imitando i normali acini del seno umano. Questi sferoidi, dopo la trasformazione, mostrano una morfologia perturbata caratterizzata da una grave perdita di polarità (uno dei segni distintivi del cancro), assenza di un lume o rottura del lume cavo (a causa dell'evasione dell'apoptosi) che può essere indotta a causa della deregolazione di vari geni17,18,19,20 . Queste trasformazioni possono essere studiate utilizzando tecniche comunemente usate come l'immunofluorescenza. Pertanto, il modello di coltura cellulare 3D può funzionare come un metodo semplice per studiare il processo di morfogenesi acinogenesi del seno e la carcinogenesi del seno. Stabilire un sistema di coltura 3D per comprendere l'effetto di un mediatore dei fosfolipidi, PAF, aiuterà nello screening preclinico dei farmaci ad alto rendimento.
Questo lavoro ha adattato il protocollo di coltura 3D "on top"16,21 per studiare la trasformazione indotta da PAF 22. I cambiamenti fenotipici indotti dall'esposizione degli acini al mediatore fosfolipidico sono stati studiati utilizzando l'immunofluorescenza. Nello studio sono stati utilizzati vari marcatori di polarità ed epiteliale-transizione mesenchimale (EMT)12,16. La Tabella 1 menziona la loro normale localizzazione e il loro fenotipo atteso dopo la trasformazione.
| Anticorpi | Marchi | Localizzazione normale | Fenotipo trasformato |
| α6-integrina | Basolaterale | Basali con debole macchia laterale | Forte macchia laterale / apicale |
| β-catenina | Giunzione cellula-cellula | Basolaterale | Localizzazione anomala / nucleare o citoplasmatica |
| Vimentino | Emt | Presenza assente / debole | Up-regulation |
Tabella 1: Marcatori utilizzati nello studio. Diversi marcatori utilizzati con la loro localizzazione in presenza e assenza di trattamento PAF.
Questo metodo può essere utilizzato al meglio per studiare / selezionare farmaci plausibili e geni bersaglio per vari sottotipi di cancro al seno. Ciò può fornire dati di risposta ai farmaci più vicini allo scenario in vivo , contribuendo a uno sviluppo più rapido e affidabile del farmaco. Inoltre, questo sistema può essere utilizzato per studiare la segnalazione molecolare associata alla risposta ai farmaci e alla resistenza ai farmaci.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Semina di celle MCF10A in lrECM
- Mantenere le cellule MCF10A (cellule epiteliali mammarie aderenti) nel mezzo di crescita. Passare le celle ogni 4 giorni.
NOTA: Composizione del terreno di crescita: DMEM ad alto contenuto di glucosio senza piruvato di sodio contenente siero di cavallo (5%), insulina (10 μg/mL), idrocortisone (0,5 μg/ml), fattore di crescita epidermico, EGF (20 ng/ml), tossina del colera (100 ng/mL) e penicillina-streptomicina (100 unità/ml) (vedere Tabella dei materiali). - Scongelare lrECM (vedi Tabella dei materiali) sul ghiaccio 20 minuti prima dell'inizio dell'esperimento. Il giorno della semina delle cellule è generalmente considerato il giorno 0.
- Per tripsinizzare le cellule, aspirare il mezzo e lavare con 2 ml di PBS. Aggiungere 900 μL di tripsina-EDTA allo 0,05% e incubare a 37 °C per ~15 minuti o fino a quando le cellule sono completamente tripsinzzate.
- Preparare un letto di lrECM in otto pozzetti di un vetrino di copertura camerato (vedi Tabella dei materiali).
- Quando le cellule sono tripsinizzatrici, rivestire ogni pozzetto con 60 μL di lrECM e metterlo in un incubatore di CO2 a 37 °C per un massimo di 15 minuti.
- Preparare la sospensione cellulare seguendo i passaggi seguenti.
- Dopo il completo spostamento delle cellule, aggiungere 5 ml di terreno di risospensione per estinguere l'attività della tripsina e ruotare le cellule a 112 x g per 10 minuti a 25 °C.
NOTA: Composizione del mezzo di risospensione: DMEM ad alto contenuto di glucosio senza piruvato di sodio, integrato con siero di cavallo (20%) e penicillina-streptomicina (100 unità/ml). - Aspirare il mezzo esaurito e risospendere le cellule in 2 ml di terreno di analisi. Mescolare bene la sospensione per garantire la formazione di una sospensione a cella singola.
NOTA: Composizione del terreno di analisi: DMEM ad alto contenuto di glucosio senza piruvato di sodio, integrato con siero di cavallo (2%), idrocortisone (0,5 μg/ml), tossina del colera (100 ng/ml), insulina (10 μg/ml) e penicillina-streptomicina (100 unità/ml). - Contare le cellule utilizzando un emocitometro e calcolare il volume di sospensione cellulare necessaria per seminare 6 x 103 cellule in ciascun pozzetto.
NOTA: in genere si preferisce includere un pozzetto aggiuntivo nel calcolo per tenere conto di eventuali errori di pipettaggio. - In base al numero di pozzetti richiesti, diluire la sospensione cellulare in mezzo di sovrapposizione.
NOTA: La composizione del mezzo di sovrapposizione per un singolo pozzetto è la seguente: 400 μL di mezzo di analisi, 8 μL di lrECM (2% finale) e 0,02 μL di 100 μg/mL di EGF (5 ng/mL finale).
- Dopo il completo spostamento delle cellule, aggiungere 5 ml di terreno di risospensione per estinguere l'attività della tripsina e ruotare le cellule a 112 x g per 10 minuti a 25 °C.
- Eseguire la semina delle cellule.
- Aggiungere 400 μL della sospensione cellulare diluita ai letti lrECM preparati (fase 1.4), assicurandosi accuratamente di non disturbare il letto lrECM. Incubare a 37 °C in un incubatore umidificato al 5% di CO2 .
2. Trattamento PAF
- Aggiungere PAF 3 h seguendo la semina delle cellule. Preparare una riserva di 100 μM di PAF in PBS e aggiungere il volume richiesto di 0,2 μL in ciascun pozzetto (che corrisponde a 200 nM).
- Aggiungi la stessa concentrazione di PAF durante ogni cambio di supporto.
3. Rialimentazione con terreni freschi
- Ricostituire le cellule con terreno fresco ogni 4 giorni (cioè Giorno 4, Giorno 8, Giorno 12 e Giorno 16).
4. Studio di immunofluorescenza per rilevare i cambiamenti fenotipici indotti dall'esposizione prolungata alla PAF
- Dopo 20 giorni di coltivazione, estrarre accuratamente il terreno da ciascun pozzetto e lavare i pozzetti con 400 μL di PBS preriscaldato.
- Fissare le strutture acinose aggiungendo 400 μL di paraformaldeide al 4% (preparata al momento diluendo il 16% di paraformaldeide in 1x PBS) e incubando per 20 minuti a temperatura ambiente.
- Risciacquare i pozzetti una volta con PBS ghiacciato e permeabilizzare con PBS contenente lo 0,5% di Triton X-100 per 10 minuti a 4 °C.
- Dopo 10 minuti, pipettare immediatamente ma accuratamente la soluzione di Triton-X 100 e risciacquare con 400 μL di PBS-glicina (preparata al momento aggiungendo un pizzico di glicina in 1x PBS). Questo viene ripetuto tre volte per 15 minuti ciascuno.
- Aggiungere 400 μL della soluzione bloccante primaria contenente il 10% di siero di capra (vedere tabella dei materiali) in tampone di immunofluorescenza (IF) e incubare a temperatura ambiente per 60 minuti.
NOTA: Composizione del tampone IF: 0,05% azoturo di sodio, 0,1% BSA, 0,2% Triton-X 100 e 0,05% Tween (20 in 1 PBS). - Rimuovere la soluzione bloccante primaria, aggiungere 200 μL di anticorpo bloccante secondario al 2% (frammento F(ab')2 di anticorpo generato in capra contro l'antigene del topo, vedere Tabella dei materiali) preparato in soluzione bloccante primaria e lasciare agire per 45-60 minuti a temperatura ambiente.
- Preparare l'anticorpo primario (vedere Tabella dei materiali) in una soluzione di anticorpi bloccanti secondari al 2% in una diluizione 1:100. Dopo aver rimosso la soluzione bloccante secondaria, aggiungere l'anticorpo appena preparato e incubare per una notte a 4 °C.
- Il passaggio precedente può provocare la liquefazione della membrana basale. Prima di procedere con l'esperimento, attendere che il vetrino raggiunga la temperatura ambiente. Pipettare accuratamente la soluzione di anticorpi primari e lavarla tre volte con 400 μL di tampone IF.
- Durante l'ultimo lavaggio con tampone IF, preparare una diluizione 1:200 dell'anticorpo secondario coniugato con fluorofori (vedere Tabella dei materiali) nella soluzione bloccante primaria. Incubare i vetrini nella soluzione anticorpale secondaria per 40-60 minuti a temperatura ambiente.
- Risciacquare i vetrini con 400 μL di tampone IF per 20 minuti, seguiti da due lavaggi con PBS per 10 minuti ciascuno.
- Controcolorare i nuclei con PBS contenente 0,5 ng/mL di colorazione nucleare (vedi Tabella dei materiali) per 5-6 minuti a temperatura ambiente. Lavare i vetrini tre volte con 400 μL di PBS per rimuovere le macchie in eccesso.
- Pipettare accuratamente l'intero PBS e assicurarsi di rimuovere la soluzione residua. Aggiungere una goccia di reagente di montaggio (vedere Tabella dei materiali) in ciascun pozzetto e lasciarlo riposare a temperatura ambiente durante la notte.
- Conservare le diapositive a temperatura ambiente e visualizzare le diapositive il prima possibile.
- Immagine con ingrandimento 40x o 63x su un microscopio confocale (vedi Tabella dei materiali), prendendo sezioni ottiche Z di dimensioni di passo di 0,6 mm (NA = 1,4).
- Aprire le immagini acquisite con un software di elaborazione delle immagini (vedi Tabella dei materiali). Dimostrare le differenze morfologiche utilizzando proiezioni 3D.
NOTA: la sezione Z ottica più centrale può essere utilizzata al meglio per mostrare le differenze nella localizzazione dei marcatori di polarità. Questi possono essere quantificati manualmente per rappresentare la percentuale di sferoidi che mostrano quel modello di colorazione specifico. - Per illustrare le differenze nell'espressione delle proteine, eseguire un'analisi semi-quantitativa che misura il valore medio di grigio o calcola la fluorescenza cellulare totale corretta (CTCF)23. Rappresentare i dati come violino o diagramma a punti.
Access restricted. Please log in or start a trial to view this content.
Risultati
Le cellule MCF10A, dopo esposizione al trattamento con PAF, formano strutture acinose con fenotipi molto distinti. L'α6-integrina è risultata essere localizzata in modo errato con una colorazione più apicale. Alcuni acini hanno anche mostrato colorazioni discontinue (Figura 2A). Entrambi questi fenotipi indicano la perdita di polarità basale, come evidenziato dalla letteratura24,25. Rapporti precedenti indicano il ruolo controver...
Access restricted. Please log in or start a trial to view this content.
Discussione
I modelli basati su linee cellulari consolidate sono ampiamente utilizzati per studiare il processo di cancerogenesi. Le colture monostrato di cellule continuano a fornire informazioni sulle varie vie di segnalazione molecolare che mediano i cambiamenti caratteristici nelle cellule tumorali32. Studi sul ruolo di oncogeni ben noti come Ras, Myc e p53 mutati sono stati riportati per la prima volta utilizzando colture monostrato come sistema modello33,34,35,36
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non dichiarano potenziali conflitti di interesse.
Riconoscimenti
Ringraziamo l'IISER Pune Microscopy Facility per l'accesso alle attrezzature e alle infrastrutture e il supporto per gli esperimenti. Questo studio è stato sostenuto da una sovvenzione del Dipartimento di Biotecnologia (DBT), Govt. of India (BT / PR8699 / MED / 30/1018 / 2013), Science and Engineering Research Board (SERB), Govt. of India (EMR / 2016 / 001974) e in parte da IISER, finanziamento Pune Core. A. K. è stato finanziato dalla borsa di studio CSIR-SRF, L.A. è stato finanziato dalla borsa di studio DST-INSPIRE, V.C. è stato finanziato da DBT (BT / PR8699 / MED / 30/1018/2013).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
Riferimenti
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O'Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938(2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287(2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688(2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12(2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543(2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon