Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Üç Boyutlu Kültürlerde Fosfolipid Aracısı İndüklenmiş Transformasyon
Bu Makalede
Özet
Mevcut protokol, Trombosit Aktive Edici Faktör (PAF) kaynaklı transformasyonu incelemek için modifiye edilmiş, dönüştürülmemiş bir meme epitel hücre hattı olan MCF10A'nın 3D 'üstte' kültürlerinin kurulmasını açıklamaktadır. İmmüno-floresan transformasyonu değerlendirmek için kullanılmış ve ayrıntılı olarak tartışılmıştır.
Özet
Kemirgen modelleri ve yerleşik hücre hatları gibi kanseri incelemek için çeşitli modeller geliştirilmiştir. Karsinogenez ile ilgili değerli bilgiler bu modelleri kullanan çalışmalarla sağlanmıştır. Hücre hatları, meme tümörigenezi ile ilişkili moleküler sinyalleşmenin serbestleştirilmesinin anlaşılmasını sağlarken, kemirgen modelleri, meme kanserinin in vivo hücresel ve moleküler özelliklerini incelemek için yaygın olarak kullanılmaktadır. Meme epitel ve kanserli hücrelerin 3D kültürlerinin oluşturulması, in vivo ve in vitro modeller arasındaki boşluğu in vitro olarak in vivo koşulları taklit ederek köprülemeye yardımcı olur. Bu model, meme kanserogenezi sırasında karmaşık moleküler sinyal olaylarının ve hücresel özelliklerin serbestleştirilmesini anlamak için kullanılabilir. Burada, fosfolipid meditor kaynaklı (Trombosit Aktive Edici Faktör, PAF) bir dönüşümü incelemek için bir 3D kültür sistemi modifiye edilmiştir. İmmünomodülatörler ve diğer salgılanan moleküller memede tümör başlangıcında ve ilerlemesinde önemli rol oynar. Bu çalışmada, meme epitel hücrelerinin 3D asinar kültürleri, polarite kaybı ve değişmiş hücresel özellikler gibi PAF transformasyon özelliklerine maruz bırakılmıştır. Bu 3B kültür sistemi, tümör mikro ortamındaki çeşitli küçük moleküllü varlıklar tarafından indüklenen genetik ve / veya epigenetik pertürbasyonlara ışık tutmaya yardımcı olacaktır. Ek olarak, bu sistem aynı zamanda dönüşüm sürecine dahil olabilecek yeni ve bilinen genlerin tanımlanması için bir platform sağlayacaktır.
Giriş
Kanserin ilerlemesini incelemek için sayısız model mevcuttur, bunların her biri benzersizdir ve bu karmaşık hastalığın bir alt tipini temsil etmektedir. Her model, kanser biyolojisine benzersiz ve değerli bilgiler sağlar ve gerçek hastalık durumunu taklit etme araçlarını geliştirmiştir. Tek katmanlı olarak yetiştirilen yerleşik hücre hatları, proliferasyon, invazivlik, göç ve apoptoz1 gibi in vitro hayati süreçler hakkında değerli bilgiler sağlamıştır. İki boyutlu (2D) hücre kültürü, memeli hücrelerinin çeşitli çevresel karışıklıklara tepkisini araştırmak için geleneksel bir araç olmasına rağmen, doku düzeyindeki yanıtları tahmin etmek için bu bulguların ekstrapolasyonu yeterince ikna edici görünmemektedir. 2D kültürlerin en büyük sınırlaması, yaratılan mikro çevrenin meme dokusunun kendisinden büyük ölçüde farklı olmasıdır2. 2D kültür, hücrelerin herhangi bir dokunun büyümesi için hayati önem taşıyan hücre dışı matris ile etkileşiminden yoksundur. Ayrıca, tek katmanlı kültürlerde hücrenin yaşadığı gerilme kuvvetleri, bu hücrelerin polaritesini engeller, böylece hücre sinyalini ve davranışını değiştirir 3,4,5. Üç boyutlu (3D) kültür sistemleri, in vivo koşulları in vitro olarak taklit etme yetenekleriyle kanser araştırmaları alanında yeni bir yol açmıştır. 2B hücre kültüründe kaybolan birçok önemli mikroçevresel ipucu, laminin bakımından zengin hücre dışı matrisin (lrECM)6 3B kültürleri kullanılarak yeniden oluşturulabilir.
Çeşitli çalışmalar karsinogenezde tümör mikroçevresinin önemini belirlemiştir 7,8. Enflamasyonla ilişkili faktörler mikro çevrenin önemli bir parçasıdır. Trombosit Aktive Edici Faktör (PAF), çeşitli immün hücreler tarafından salgılanan ve çoklu immün yanıtlara aracılık eden bir fosfolipid mediatörüdür 9,10. Yüksek PAF seviyeleri farklı meme kanseri hücre hatları tarafından salgılanır ve artmış proliferasyon ile ilişkilidir11. Laboratuvarımızdan yapılan çalışmalar, asiner kültürlerde PAF'ın uzun süreli varlığının meme epitel hücrelerinin transformasyonuna yol açtığını göstermiştir12. PAF, PAF reseptörünü (PAFR) aktive ederek PI3K/Akt sinyal ekseni13'ü aktive eder. PAFR'nin ayrıca EMT, invazyon ve metastaz14 ile ilişkili olduğu bildirilmiştir.
Mevcut protokol, daha önce Chakravarty ve ark.12 tarafından tanımlandığı gibi, meme epitel hücrelerinin 3D kültürlerini kullanarak, PAF kaynaklı transformasyonu incelemek için bir model sistemi göstermektedir. Hücre dışı matriste (3D kültürler) yetiştirilen meme epitel hücreleri, polarize büyüme ile tutuklanan sferoidler oluşturma eğilimindedir. Bunlara acini denir ve meme bezinin en küçük fonksiyonel birimi olan meme dokusunun akinisine in vivo 15'e çok benzer. Bu sferoidler (Şekil 1A,B), içi boş bir lümeni çevreleyen ve bazal membrana tutturulmuş, sıkıca paketlenmiş polarize epitel hücrelerinden oluşan bir tek katmandan oluşur (Şekil 1C). Bu morfogenez süreci literatür16'da iyi tanımlanmıştır. LrECM üzerine tohumlandığında, hücreler bir hücre kümesi oluşturmak için bölünme ve farklılaşmaya uğrar ve daha sonra 4. Gün'den itibaren polarize olurlar. 8. Günde, acini, hücre dışı matrisle doğrudan temas halinde olan bir grup polarize hücreden ve dış polarize hücrelerin içine kapatılmış, matrise temas etmeyen polarize edilmemiş bir hücre kümesinden oluşur. Bu polarize olmayan hücrelerin, kültürün 12. Gününe kadar apoptoza uğradığı ve içi boş bir lümen oluşturduğu bilinmektedir. 16. Gün'e gelindiğinde, büyümeyi durduran yapılar16.
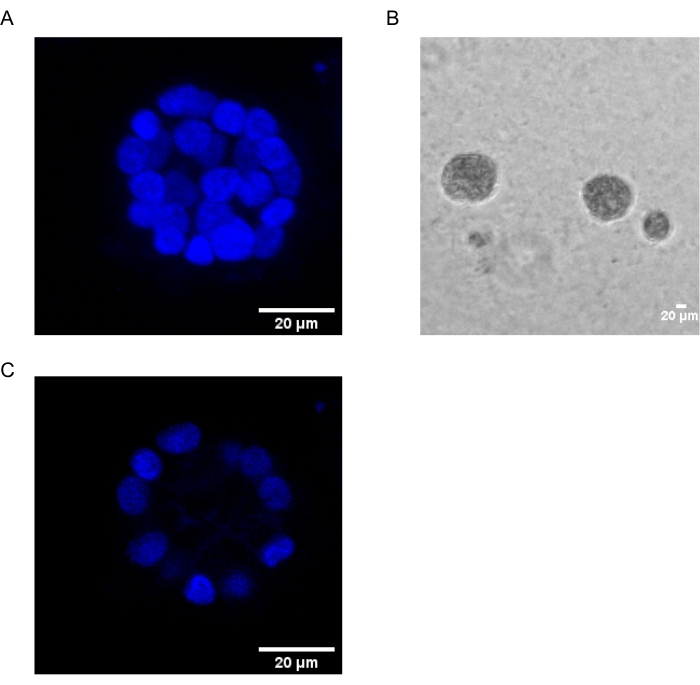
Şekil 1: Acini'deki hücrelerin çekirdekleri nükleer bir leke ile boyanmıştır . (A) Acini'nin 3D yapısı. (B) Matrigel'de 20 gün boyunca yetiştirilen MCF10A acini'nin Faz Kontrastı görüntüsü. (C) En ortadaki bölüm içi boş bir lümenin varlığını gösterir. Ölçek çubuğu = 20 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2D kültürlerin aksine, acinar kültürler normal ve dönüştürülmüş hücreleri görünür morfoloji değişiklikleri yoluyla ayırt etmeye yardımcı olur. Transforme olmayan meme epitel hücreleri, normal insan meme acinisini taklit eden içi boş bir lümen ile acini oluşturur. Bu sferoidler, transformasyon üzerine, çeşitli genlerin deregülasyonuna bağlı olarak indüklenebilecek büyük bir polarite kaybı (kanserin ayırt edici özelliklerinden biri), bir lümen yokluğu veya içi boş lümenin bozulması (apoptozun kaçması nedeniyle) ile karakterize bozulmuş bir morfoloji göstermektedir17,18,19,20 . Bu dönüşümler, immünofloresan gibi yaygın olarak kullanılan teknikler kullanılarak incelenebilir. Böylece, 3D hücre kültürü modeli, meme asinar morfogenezi ve meme kanserogenezi sürecini araştırmak için basit bir yöntem olarak işlev görebilir. Bir fosfolipit mediyatörü olan PAF'ın etkisini anlamak için bir 3D kültür sistemi kurmak, yüksek verimli preklinik ilaç taramasına yardımcı olacaktır.
Bu çalışma, PAF 22 tarafından indüklenen dönüşümü incelemek için 3D 'üstte' kültür protokolü 16,21'i uyarladı. Acının fosfolipid mediatöre maruz kalmasıyla indüklenen fenotipik değişiklikler immünofloresan kullanılarak incelendi. Çalışmada çeşitli polarite ve epitelyal-mezenkimal geçiş (EMT) belirteçleri 12,16 kullanıldı. Tablo 1'de normal lokalizasyonlarından ve transformasyon üzerine beklenen fenotiplerinden bahsedilmektedir.
| Antikor | Işaret | Normal lokalizasyon | Dönüştürülmüş fenotip |
| α6-İntegrin | Basolateral | Zayıf yanal lekeli bazal | Güçlü yanal / apikal leke |
| β-Katenin | Hücre-hücre bağlantısı | Basolateral | Anormal / nükleer veya sitoplazmik lokalizasyon |
| Arjantin | Emt | Eksik / zayıf mevcudiyet | Yukarı düzenleme |
Tablo 1: Çalışmada kullanılan belirteçler. PAF tedavisinin varlığında ve yokluğunda lokalizasyonları ile kullanılan farklı belirteçler.
Bu yöntem, makul ilaçları incelemek / taramak ve çeşitli meme kanseri alt tipleri için genleri hedeflemek için en iyi şekilde kullanılabilir. Bu, in vivo senaryoya daha yakın bir ilaç yanıt verisi sağlayarak daha hızlı ve daha güvenilir ilaç geliştirilmesine yardımcı olabilir. Ayrıca, bu sistem ilaç yanıtı ve ilaç direnci ile ilişkili moleküler sinyalizasyonu incelemek için kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. MCF10A hücrelerinin lrECM'de tohumlanması
- MCF10A hücrelerini (yapışkan meme epitel hücreleri) büyüme ortamında tutun. Hücreleri her 4 günde bir geçirin.
NOT: Büyüme ortamının bileşimi: at serumu (% 5), insülin (10 μg / mL), hidrokortizon (0.5 μg / mL), epidermal büyüme faktörü, EGF (20 ng / mL), kolera toksini (100 ng / mL) ve penisilin-streptomisin (100 birim / mL) içeren sodyum piruvat içermeyen yüksek glikozlu DMEM (bkz. - Deneyin başlamasından 20 dakika önce buz üzerinde lrECM'yi (bkz. Hücrelerin tohumlandığı gün genellikle 0. Gün olarak kabul edilir.
- Hücreleri tripsinize etmek için, ortamı aspire edin ve 2 mL PBS ile yıkayın. 900 μL% 0.05 Tripsin-EDTA ekleyin ve ~ 15 dakika boyunca veya hücreler tamamen tripsinize olana kadar 37 ° C'de inkübe edin.
- Odacıklı bir kapak camı slaytının sekiz kuyucuğunda bir lrECM yatağı hazırlayın (bkz.
- Hücreler tripsinizasyon yaparken, her bir kuyucuğu 60 μL lrECM ile kaplayın ve maksimum 15 dakika boyunca 37 °C CO2 inkübatöre yerleştirin.
- Aşağıdaki adımları izleyerek hücre süspansiyonunu hazırlayın.
- Hücrelerin tamamen yerinden çıkmasını takiben, tripsin aktivitesini söndürmek için 5 mL yeniden süspansiyon ortamı ekleyin ve hücreleri 25 ° C'de 10 dakika boyunca 112 x g'de döndürün.
NOT: Yeniden süspansiyon ortamının bileşimi: at serumu (% 20) ve penisilin-streptomisin (100 ünite / mL) ile desteklenmiş sodyum piruvat içermeyen yüksek glikozlu DMEM. - Harcanan ortamı aspire edin ve hücreleri 2 mL tahlil ortamında yeniden askıya alın. Tek hücreli bir süspansiyonun oluşumunu sağlamak için süspansiyonu iyice karıştırın.
NOT: Tahlil ortamının bileşimi: at serumu (% 2), hidrokortizon (0.5 μg / mL), kolera toksini (100 ng / mL), insülin (10 μg / mL) ve penisilin-streptomisin (100 ünite / mL) ile desteklenmiş sodyum piruvat içermeyen yüksek glikozlu DMEM. - Bir hemositometre kullanarak hücreleri sayın ve her bir kuyucukta 6 x 103 hücreyi tohumlamak için gereken hücre süspansiyonunun hacmini hesaplayın.
NOT: Herhangi bir pipetleme hatasını hesaba katmak için genellikle hesaplamaya fazladan bir kuyu eklemek tercih edilir. - Gerekli kuyu sayısına göre, hücre süspansiyonunu kaplama ortamında seyreltin.
NOT: Tek bir kuyucuk için bindirme ortamı bileşimi aşağıdaki gibidir: 400 μL tahlil ortamı, 8 μL lrECM (%2 nihai) ve 0,02 μL 100 μg/mL EGF (5 ng/mL nihai).
- Hücrelerin tamamen yerinden çıkmasını takiben, tripsin aktivitesini söndürmek için 5 mL yeniden süspansiyon ortamı ekleyin ve hücreleri 25 ° C'de 10 dakika boyunca 112 x g'de döndürün.
- Hücrelerin tohumlamasını gerçekleştirin.
- Hazırlanan lrECM yataklarına 400 μL seyreltilmiş hücre süspansiyonu ekleyin (adım 1.4), lrECM yatağını rahatsız etmediğinizden emin olun. Nemlendirilmiş %5 CO2 inkübatörde 37 °C'de inkübe edin.
2. PAF tedavisi
- Hücrelerin tohumlanmasını takiben PAF 3 saat ekleyin. PBS'de 100 μM'lik bir PAF stoğu hazırlayın ve her bir kuyucuğa gerekli 0,2 μL hacmini ekleyin (200 nM'ye karşılık gelir).
- Her ortam değişikliği sırasında aynı PAF konsantrasyonunu ekleyin.
3. Taze medya ile yeniden besleme
- Hücreleri her 4 günde bir taze ortamla doldurun (yani, Gün 4, Gün 8, Gün 12 ve Gün 16).
4. Uzun süreli PAF maruziyetinin neden olduğu fenotipik değişiklikleri tespit etmek için immünofloresan çalışması
- 20 günlük kültürlemeden sonra, ortamı her bir kuyucuktan dikkatlice pipetleyin ve kuyucukları 400 μL önceden ısıtılmış PBS ile yıkayın.
- Asinar yapıları, 400 μL% 4 paraformaldehit ekleyerek (1x PBS'de% 16 paraformaldehit seyreltilerek taze hazırlanmış) ve oda sıcaklığında 20 dakika boyunca inkübe ederek sabitleyin.
- Kuyucukları buz gibi soğuk PBS ile bir kez durulayın ve 4 ° C'de 10 dakika boyunca% 0,5 Triton X-100 içeren PBS ile geçirgenleştirin.
- 10 dakika sonra, Triton-X 100 çözeltisini hemen ama dikkatlice pipetleyin ve 400 μL PBS-glisin ile durulayın (1x PBS'ye bir tutam glisin eklenerek taze hazırlanmış). Bu, her biri 15 dakika boyunca üç kez tekrarlanır.
- İmmünofloresan (IF) tamponunda %10 keçi serumu içeren birincil blokaj çözeltisinden 400 μL (bakınız Malzeme Tablosu) ekleyin ve oda sıcaklığında 60 dakika inkübe edin.
NOT: IF tamponunun bileşimi: %0,05 sodyum azid, %0,1 BSA, %0,2 Triton-X 100 ve %0,05 Ara (1 PBS'de 20). - Birincil blokaj çözeltisini çıkarın, birincil blokaj çözeltisinde hazırlanan 200 μL% 2 ikincil bloke edici antikor (fare antijenine karşı keçide yetiştirilen F(ab')2 antikor parçası) ekleyin ve oda sıcaklığında 45-60 dakika bekletin.
- Birincil antikoru ( bakınız Malzeme Tablosu) %2 sekonder bloke edici antikor çözeltisi içinde 1:100 seyreltmede hazırlayın. İkincil blokaj çözeltisini çıkardıktan sonra, taze hazırlanmış antikoru ekleyin ve gece boyunca 4 ° C'de inkübe edin.
- Önceki adım, bazal membranın sıvılaşmasını sağlayabilir. Deneye devam etmeden önce, slayt oda sıcaklığına ulaşana kadar bekleyin. Birincil antikor çözeltisini dikkatlice pipetleyin ve 400 μL IF tamponu ile üç kez yıkayın.
- IF tamponu ile son yıkama sırasında, birincil blokaj çözeltisinde florofor konjuge sekonjuge sekonder antikorun 1:200 seyreltilmesini hazırlayın (bakınız Malzeme Tablosu). İkincil antikor çözeltisindeki slaytları oda sıcaklığında 40-60 dakika boyunca inkübe edin.
- Slaytları 400 μL IF tamponu ile 20 dakika boyunca durulayın, ardından her biri 10 dakika boyunca PBS ile iki yıkama yapın.
- Çekirdekleri 0,5 ng/mL nükleer leke içeren PBS ile oda sıcaklığında 5-6 dakika boyunca karşı boyayın (bakınız Malzeme Tablosu). Fazla lekeyi çıkarmak için slaytları 400 μL PBS ile üç kez yıkayın.
- Tüm PBS'yi dikkatlice pipetle çıkarın ve artık çözeltinin çıkarılmasını sağlayın. Her bir oyuğa bir damla montaj reaktifi ekleyin ( Malzeme Tablosuna bakınız) ve gece boyunca oda sıcaklığında durmasını sağlayın.
- Slaytları oda sıcaklığında saklayın ve slaytları mümkün olan en kısa sürede görüntüleyin.
- Konfokal mikroskopta 40x veya 63x büyütme altında görüntü (bakınız Malzeme Tablosu), 0,6 mm adım boyutunda optik Z-kesitleri alarak (NA = 1,4).
- Elde edilen görüntüleri bir görüntü işleme yazılımıyla açın (bkz. 3B projeksiyonları kullanarak morfolojik farklılıkları gösterin.
NOT: En ortadaki optik Z bölümü, polarite işaretleyicilerinin lokalizasyonundaki farklılıkları göstermek için en iyi şekilde kullanılabilir. Bunlar, spesifik boyama modelini gösteren sferoidlerin yüzdesini temsil etmek için manuel olarak ölçülebilir. - Proteinlerin ekspresyonundaki farklılıkları göstermek için, ortalama gri değeri ölçen veya düzeltilmiş toplam hücre floresansını (CTCF) hesaplayan yarı kantitatif bir analiz yapın 23. Verileri keman veya nokta grafikleri olarak temsil edin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
MCF10A hücreleri, PAF tedavisine maruz kaldıktan sonra, çok farklı fenotiplere sahip asinar yapılar oluşturur. α6-integrinin daha apikal boyama ile yanlış lokalize olduğu bulundu. Birkaç acini de süreksiz boyama gösterdi (Şekil 2A). Her iki fenotip, literatür24,25'ten de kanıtlandığı gibi, bazal polarite kaybını göstermektedir. Daha önceki raporlar, α6-integrinin kanser metastazındaki tartışmalı rolünü g...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Yerleşik hücre hattı tabanlı modeller, karsinogenez sürecini incelemek için yaygın olarak kullanılmaktadır. Hücrelerin tek katmanlı kültürleri, kanser hücrelerindeki karakteristik değişikliklere aracılık eden çeşitli moleküler sinyal yolları hakkında fikir vermeye devam etmektedir32. Ras, Myc ve mutasyona uğramış p53 gibi iyi bilinen onkogenlerin rolü üzerine yapılan çalışmalar ilk olarak 33,34,35,36 model sistemi...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar potansiyel çıkar çatışması olmadığını beyan ederler.
Teşekkürler
IISER Pune Mikroskopi Tesisi'ne ekipman ve altyapıya erişim ve deneylere destek için teşekkür ederiz. Bu çalışma, Biyoteknoloji Bölümü (DBT), Hindistan Hükümeti (BT/PR8699/MED/30/1018/2013), Bilim ve Mühendislik Araştırma Kurulu (SERB), Hindistan Hükümeti (EMR / 2016 / 001974) ve kısmen IISER, Pune Core fonu tarafından desteklenmiştir. A.K. CSIR-SIR bursu tarafından, L.A. DST-INSPIRE bursu tarafından, V.C DBT (BT / PR8699 / MED / 30/1018 / 2013) tarafından finanse edildi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
Referanslar
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O'Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938(2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287(2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688(2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12(2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543(2020).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır