Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Phospholipid-Mediator-induzierte Transformation in dreidimensionalen Kulturen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt den Aufbau von 3D-On-Top-Kulturen einer nicht transformierten Brustepithelzelllinie, MCF10A, die modifiziert wurde, um die durch den Thrombozytenaktivierungsfaktor (PAF) induzierte Transformation zu untersuchen. Immunfluoreszenz wurde verwendet, um die Transformation zu bewerten und wird ausführlich diskutiert.
Zusammenfassung
Mehrere Modelle wurden entwickelt, um Krebs zu untersuchen, wie Nagetiermodelle und etablierte Zelllinien. Studien mit diesen Modellen lieferten wertvolle Einblicke in die Karzinogenese. Zelllinien haben ein Verständnis für die Deregulation der molekularen Signalübertragung im Zusammenhang mit der Brusttumorgenese geliefert, während Nagetiermodelle häufig verwendet werden, um zelluläre und molekulare Eigenschaften von Brustkrebs in vivo zu untersuchen. Die Etablierung von 3D-Kulturen von Brustepithel- und Krebszellen hilft, die Lücke zwischen In-vivo- und In-vitro-Modellen zu schließen, indem die In-vivo-Bedingungen in vitro nachgeahmt werden. Dieses Modell kann verwendet werden, um die Deregulation komplexer molekularer Signalereignisse und die zellulären Eigenschaften während der Brustkarzinogenese zu verstehen. Hier wird ein 3D-Kultursystem modifiziert, um eine Phospholipid-Mediator-induzierte (Platelet Activating Factor, PAF) Transformation zu untersuchen. Immunmodulatoren und andere sezernierte Moleküle spielen eine wichtige Rolle bei der Tumorinitiierung und -progression in der Brust. In der vorliegenden Studie werden 3D-Azinuskulturen von Brustepithelzellen PAF-Transformationsmerkmalen wie Polaritätsverlust und veränderten zellulären Eigenschaften ausgesetzt. Dieses 3D-Kultursystem wird dazu beitragen, genetische und / oder epigenetische Störungen zu beleuchten, die durch verschiedene niedermolekulare Einheiten in der Tumormikroumgebung induziert werden. Darüber hinaus wird dieses System auch eine Plattform für die Identifizierung neuer sowie bekannter Gene bieten, die am Transformationsprozess beteiligt sein könnten.
Einleitung
Eine Vielzahl von Modellen steht zur Verfügung, um das Fortschreiten von Krebs zu untersuchen, von denen jedes einzigartig ist und einen Subtyp dieser komplexen Krankheit darstellt. Jedes Modell bietet einzigartige und wertvolle Einblicke in die Krebsbiologie und hat die Mittel verbessert, um den tatsächlichen Krankheitszustand nachzuahmen. Etablierte Zelllinien, die als Monoschicht gezüchtet wurden, haben wertvolle Einblicke in lebenswichtige Prozesse in vitro wie Proliferation, Invasivität, Migration und Apoptosegeliefert 1. Obwohl die zweidimensionale (2D) Zellkultur das traditionelle Werkzeug war, um die Reaktion von Säugetierzellen auf mehrere Umweltstörungen zu untersuchen, scheint die Extrapolation dieser Ergebnisse zur Vorhersage von Reaktionen auf Gewebeebene nicht überzeugend genug zu sein. Die Haupteinschränkung der 2D-Kulturen besteht darin, dass sich die erzeugte Mikroumgebung stark von der des Brustgewebes selbst unterscheidet2. Der 2D-Kultur fehlt die Interaktion der Zellen mit der extrazellulären Matrix, die für das Wachstum jedes Gewebes unerlässlich ist. Auch Zugkräfte, denen die Zelle in Monoschichtkulturen ausgesetzt ist, behindern die Polarität dieser Zellen und verändern so die Zellsignalisierung unddas Verhalten 3,4,5. Dreidimensionale (3D) Kultursysteme haben mit ihrer Fähigkeit, die in vivo Bedingungen in vitro nachzuahmen, einen neuen Weg im Bereich der Krebsforschung eröffnet. Viele wichtige Hinweise auf die Mikroumgebung, die in der 2D-Zellkultur verloren gehen, könnten mithilfe von 3D-Kulturen der lamininreichen extrazellulären Matrix (lrECM) wiederhergestellt werden6.
Verschiedene Studien haben die Bedeutung der Tumormikroumgebung bei der Karzinogenese identifiziert 7,8. Entzündungsassoziierte Faktoren sind ein wichtiger Teil der Mikroumgebung. Der Thrombozytenaktivierungsfaktor (PAF) ist ein von verschiedenen Immunzellen sezernierter Phospholipidmediator, der mehrere Immunantworten vermittelt 9,10. Hohe PAF-Spiegel werden von verschiedenen Brustkrebszelllinien sezerniert und sind mit einer erhöhten Proliferation assoziiert11. Studien aus unserem Labor haben gezeigt, dass die längere Anwesenheit von PAF in Azinuskulturen zur Transformation von Brustepithelzellen führt12. PAF aktiviert den PAF-Rezeptor (PAFR) und aktiviert die PI3K/Akt-Signalachse13. Es wird auch berichtet, dass PAFR mit EMT, Invasion und Metastasierung assoziiert ist14.
Das vorliegende Protokoll zeigt ein Modellsystem zur Untersuchung der PAF-induzierten Transformation unter Verwendung von 3D-Kulturen von Brustepithelzellen, wie sie zuvor von Chakravarty et al.12 beschrieben wurde. Die Brustepithelzellen, die auf der extrazellulären Matrix (3D-Kulturen) wachsen, neigen dazu, polarisierte wachstumshemmende Sphäroide zu bilden. Diese werden Acini genannt und ähneln stark den Acini des Brustgewebes, der kleinsten funktionellen Einheit der Brustdrüse, in vivo15. Diese Sphäroide (Abbildung 1A,B) bestehen aus einer Monoschicht dicht gepackter polarisierter Epithelzellen, die ein hohles Lumen umgeben und an der Basalmembran befestigt sind (Abbildung 1C). Dieser Prozess der Morphogenese wurde in Literatur16 gut beschrieben. Wenn sie auf lrECM ausgesät werden, durchlaufen die Zellen eine Teilung und Differenzierung, um einen Zellhaufen zu bilden, der dann ab Tag 4 polarisiert. Am Tag 8 bestehen die Acini aus einer Gruppe polarisierter Zellen, die in direktem Kontakt mit der extrazellulären Matrix stehen, und einem Cluster von unpolarisierten Zellen, die in den äußeren polarisierten Zellen eingeschlossen sind, ohne Kontakt zur Matrix. Es ist bekannt, dass diese unpolarisierten Zellen am 12. Tag der Kultur Apoptose durchlaufen und ein hohles Lumen bilden. Am Tag 16 bilden sich wachstumshemmende Strukturen16.
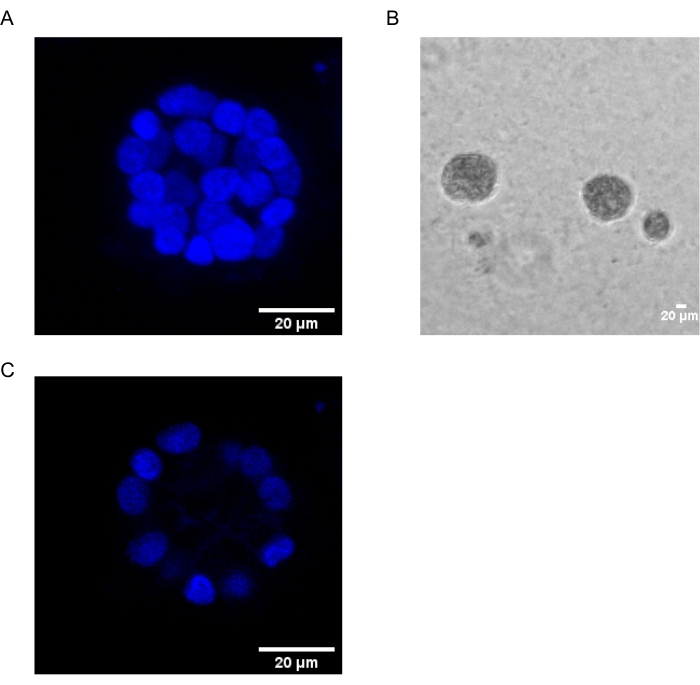
Abbildung 1: Zellkerne in Acini, die mit einer Kernfärbung gefärbt sind . (A) 3D-Konstruktion der Acini. (B) Phasenkontrastbild von MCF10A acini, das 20 Tage lang auf Matrigel gezüchtet wurde. (C) Der mittlere Abschnitt zeigt das Vorhandensein eines hohlen Lumens. Maßstabsbalken = 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Im Gegensatz zu 2D-Kulturen helfen Azinuskulturen bei der Unterscheidung normaler und transformierter Zellen durch offensichtliche Morphologieänderungen. Nicht transformierte Brustepithelzellen bilden Acini mit einem hohlen Lumen, das die normalen menschlichen Brustacini nachahmt. Diese Sphäroide zeigen bei der Transformation eine gestörte Morphologie, die durch einen starken Polaritätsverlust (eines der Kennzeichen von Krebs), das Fehlen eines Lumens oder eine Störung des Hohllumens (aufgrund der Umgehung der Apoptose) gekennzeichnet ist, die aufgrund einer Deregulation verschiedener Gene induziert werden kann17,18,19,20 . Diese Transformationen können mit häufig verwendeten Techniken wie Immunfluoreszenz untersucht werden. Somit kann das 3D-Zellkulturmodell als einfache Methode dienen, um den Prozess der Brust-Azinus-Morphogenese und Brustkarzinogenese zu untersuchen. Die Einrichtung eines 3D-Kultursystems, um die Wirkung eines Phospholipidmediators, PAF, zu verstehen, wird das präklinische Arzneimittelscreening mit hohem Durchsatz unterstützen.
Diese Arbeit hat das 3D-On-Top-Kulturprotokoll16,21 für die Untersuchung der durch PAF 22 induzierten Transformation angepasst. Die phänotypischen Veränderungen, die durch die Exposition der Acini gegenüber dem Phospholipidmediator induziert wurden, wurden mittels Immunfluoreszenz untersucht. In der Studie wurden verschiedene Polaritäts- und epitheliale zu mesenchymale Übergangsmarker (EMT)12,16 verwendet. Tabelle 1 erwähnt ihre normale Lokalisation und ihren erwarteten Phänotyp bei der Transformation.
| Antikörper | Zeichen | Normale Lokalisierung | Transformierter Phänotyp |
| α6-Integrin | Basolateral | Basal mit schwacher lateraler Färbung | Starker lateraler / apikaler Fleck |
| β-Catenin | Zell-Zell-Übergang | Basolateral | Abnorme / nukleäre oder zytoplasmatische Lokalisation |
| Vimentin | Emt | Fehlende / schwache Präsenz | Hochregulierung |
Tabelle 1: In der Studie verwendete Marker. Verschiedene Marker, die mit ihrer Lokalisation in Gegenwart und Abwesenheit einer PAF-Behandlung verwendet werden.
Diese Methode kann am besten verwendet werden, um plausible Medikamente und Zielgene für verschiedene Brustkrebs-Subtypen zu untersuchen / zu screenen. Dies kann Daten zur Arzneimittelreaktion liefern, die näher am In-vivo-Szenario liegen, was zu einer schnelleren und zuverlässigeren Arzneimittelentwicklung beiträgt. Dieses System kann auch verwendet werden, um die molekulare Signalübertragung zu untersuchen, die mit Arzneimittelreaktion und Arzneimittelresistenz verbunden ist.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Aussaat von MCF10A-Zellen in lrECM
- Halten Sie MCF10A-Zellen (adhärente Brustepithelzellen) im Wachstumsmedium. Durchgang der Zellen alle 4 Tage.
HINWEIS: Zusammensetzung des Wachstumsmediums: DMEM mit hohem Glukosegehalt ohne Natriumpyruvat mit Pferdeserum (5%), Insulin (10 μg/ml), Hydrocortison (0,5 μg/ml), epidermaler Wachstumsfaktor, EGF (20 ng/ml), Choleratoxin (100 ng/ml) und Penicillin-Streptomycin (100 Einheiten/ml) (siehe Materialtabelle). - Auftauen von lrECM (siehe Materialtabelle) auf Eis 20 min vor Beginn des Experiments. Der Tag der Aussaat der Zellen wird im Allgemeinen als Tag 0 betrachtet.
- Um die Zellen zu trypsinisieren, saugen Sie das Medium ab und waschen Sie es mit 2 ml PBS. Fügen Sie 900 μL 0,05% Trypsin-EDTA hinzu und inkubieren Sie bei 37 °C für ~15 min oder bis die Zellen vollständig trypsinisiert sind.
- Bereiten Sie ein Bett aus lrECM in acht Vertiefungen eines Kammerdeckglasobjektträgers vor (siehe Materialtabelle).
- Wenn die Zellen trypsinisieren, beschichten Sie jede Vertiefung mit 60 μL lrECM und legen Sie sie für maximal 15 min in einen 37 °C CO2-Inkubator.
- Bereiten Sie die Zellsuspension gemäß den folgenden Schritten vor.
- Nach der vollständigen Entfernung der Zellen werden 5 ml Resuspensionsmedium hinzugefügt, um die Trypsinaktivität zu löschen, und die Zellen bei 112 x g für 10 min bei 25 °C drehen.
HINWEIS: Zusammensetzung des Resuspensionsmediums: DMEM mit hohem Glukosegehalt ohne Natriumpyruvat, ergänzt mit Pferdeserum (20%) und Penicillin-Streptomycin (100 Einheiten / ml). - Saugen Sie das verbrauchte Medium ab und suspendieren Sie die Zellen in 2 ml Assay-Medium. Mischen Sie die Suspension gut, um die Bildung einer einzelligen Suspension sicherzustellen.
HINWEIS: Zusammensetzung des Assaymediums: DMEM mit hohem Glukosegehalt ohne Natriumpyruvat, ergänzt mit Pferdeserum (2%), Hydrocortison (0,5 μg / ml), Choleratoxin (100 ng / ml), Insulin (10 μg / ml) und Penicillin-Streptomycin (100 Einheiten / ml). - Zählen Sie die Zellen mit einem Hämozytometer und berechnen Sie das Volumen der Zellsuspension, die benötigt wird, um 6 x 103 Zellen in jeder Vertiefung zu säen.
HINWEIS: Es wird im Allgemeinen bevorzugt, eine zusätzliche Vertiefung in die Berechnung einzubeziehen, um etwaige Pipettierfehler zu berücksichtigen. - Je nach Anzahl der erforderlichen Vertiefungen die Zellsuspension in Overlay-Medium verdünnen.
HINWEIS: Die Zusammensetzung des Overlay-Mediums für eine einzelne Vertiefung ist wie folgt: 400 μL Assaymedium, 8 μL lrECM (2% endgültig) und 0,02 μL 100 μg/ml EGF (5 ng/ml endgültig).
- Nach der vollständigen Entfernung der Zellen werden 5 ml Resuspensionsmedium hinzugefügt, um die Trypsinaktivität zu löschen, und die Zellen bei 112 x g für 10 min bei 25 °C drehen.
- Führen Sie das Seeding der Zellen durch.
- 400 μL der verdünnten Zellsuspension in die vorbereiteten lrECM-Betten geben (Schritt 1.4), wobei darauf zu achten ist, dass das lrECM-Bett nicht gestört wird. Inkubieren bei 37 °C in einem befeuchteten 5%CO2-Inkubator .
2. PAF-Behandlung
- Fügen Sie PAF 3 h nach der Aussaat der Zellen hinzu. Bereiten Sie einen PAF-Vorrat von 100 μM in PBS vor und fügen Sie das erforderliche Volumen von 0,2 μL in jede Vertiefung hinzu (was 200 nM entspricht).
- Fügen Sie bei jedem Medienwechsel die gleiche PAF-Konzentration hinzu.
3. Nachfütterung mit frischen Medien
- Füllen Sie die Zellen alle 4 Tage mit frischem Medium auf (dh Tag 4, Tag 8, Tag 12 und Tag 16).
4. Immunfluoreszenzstudie zum Nachweis phänotypischer Veränderungen, die durch längere PAF-Exposition induziert werden
- Nach 20 Tagen Kultivierung pipetten Sie das Medium vorsichtig aus jeder Vertiefung heraus und waschen Sie die Vertiefungen mit 400 μL vorgewärmtem PBS.
- Fixieren Sie die acinarus Strukturen durch Zugabe von 400 μL 4% Paraformaldehyd (frisch zubereitet durch Verdünnen von 16% Paraformaldehyd in 1x PBS) und Inkubation für 20 min bei Raumtemperatur.
- Die Vertiefungen einmal mit eiskaltem PBS abspülen und mit PBS mit 0,5% Triton X-100 für 10 min bei 4 °C permeabilisieren.
- Nach 10 min sofort aber vorsichtig die Triton-X 100 Lösung pipetten und mit 400 μL PBS-Glycin abspülen (frisch zubereitet durch Zugabe einer Prise Glycin in 1x PBS). Dies wird dreimal für jeweils 15 Minuten wiederholt.
- 400 μL der primären Blockierungslösung, bestehend aus 10% Ziegenserum (siehe Materialtabelle), in Immunfluoreszenzpuffer (IF) zugeben und bei Raumtemperatur 60 min inkubieren.
HINWEIS: Zusammensetzung des IF-Puffers: 0,05% Natriumazid, 0,1% BSA, 0,2% Triton-X 100 und 0,05% Tween (20 in 1 PBS). - Entfernen Sie die primäre Blockierungslösung, fügen Sie 200 μL 2% sekundär blockierenden Antikörper (F(ab')2 Fragment des in Ziege gegen Mausantigen erhöhten Antikörpers, siehe Tabelle der Materialien) in primärer Blockierungslösung hinzu und lassen Sie es 45-60 min bei Raumtemperatur.
- Bereiten Sie den primären Antikörper (siehe Materialtabelle) in 2%iger sekundär blockierender Antikörperlösung in einer Verdünnung von 1:100 vor. Nach dem Entfernen der sekundären Blockierungslösung den frisch zubereiteten Antikörper zugeben und über Nacht bei 4 °C inkubieren.
- Der vorherige Schritt kann eine Verflüssigung der Basalmembran hervorrufen. Bevor Sie mit dem Experiment fortfahren, warten Sie, bis der Objektträger Raumtemperatur erreicht hat. Die primäre Antikörperlösung vorsichtig pipetten und dreimal mit 400 μL ZF-Puffer waschen.
- Während der letzten Wäsche mit IF-Puffer wird eine 1:200-Verdünnung des fluorophorkonjugierten sekundären Antikörpers (siehe Materialtabelle) in der primären Blockierungslösung hergestellt. Inkubieren Sie die Objektträger in der sekundären Antikörperlösung für 40-60 min bei Raumtemperatur.
- Spülen Sie die Objektträger mit 400 μL ZF-Puffer für 20 min, gefolgt von zwei Waschgängen mit PBS für jeweils 10 min.
- Die Kerne mit PBS, das 0,5 ng/ml Kernfärbung enthält (siehe Materialtabelle), 5-6 min bei Raumtemperatur gegenfärben. Waschen Sie die Objektträger dreimal mit 400 μL PBS, um überschüssigen Fleck zu entfernen.
- Pipette vorsichtig das gesamte PBS heraus und stelle sicher, dass die Restlösung entfernt wird. Fügen Sie einen Tropfen Montagereagenz (siehe Materialtabelle) in jede Vertiefung und lassen Sie sie über Nacht bei Raumtemperatur stehen.
- Lagern Sie die Dias bei Raumtemperatur und machen Sie so schnell wie möglich ein Bild von den Dias.
- Aufnahme unter 40- oder 63-facher Vergrößerung auf einem konfokalen Mikroskop (siehe Materialtabelle) mit optischen Z-Schnitten von 0,6 mm Schrittweite (NA = 1,4).
- Öffnen Sie die aufgenommenen Bilder mit einer Bildbearbeitungssoftware (siehe Materialtabelle). Demonstrieren Sie die morphologischen Unterschiede anhand von 3D-Projektionen.
HINWEIS: Der mittlere optische Z-Schnitt kann am besten verwendet werden, um Unterschiede in der Lokalisierung von Polaritätsmarkern zu zeigen. Diese können manuell quantifiziert werden, um den Prozentsatz der Sphäroide darzustellen, die dieses spezifische Färbemuster aufweisen. - Um Unterschiede in der Expression von Proteinen zu veranschaulichen, führen Sie eine semiquantitative Analyse durch, die den mittleren Grauwert misst oder die korrigierte Gesamtzellfluoreszenz (CTCF) berechnet23. Stellen Sie die Daten als Violin- oder Punktdiagramme dar.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
MCF10A-Zellen bilden nach Exposition gegenüber PAF-Behandlung Azinusstrukturen mit sehr unterschiedlichen Phänotypen. Es wurde festgestellt, dass α6-Integrin mit apikaler Färbung fehllokalisiert war. Einige Acini zeigten auch diskontinuierliche Färbungen (Abbildung 2A). Beide Phänotypen weisen auf den Verlust der basalen Polarität hin, wie aus der Literatur24,25 hervorgeht. Frühere Berichte weisen auf die umstrittene Rolle vo...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Etablierte Zelllinien-basierte Modelle werden häufig verwendet, um den Prozess der Karzinogenese zu untersuchen. Monoschichtkulturen von Zellen liefern weiterhin Einblicke in die verschiedenen molekularen Signalwege, die charakteristische Veränderungen in Krebszellen vermitteln32. Studien zur Rolle bekannter Onkogene wie Ras, Myc und mutiertem p53 wurden erstmals unter Verwendung von Monoschichtkulturen als Modellsystem33,34,35,36
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären keine potenziellen Interessenkonflikte.
Danksagungen
Wir danken der IISER Pune Microscopy Facility für den Zugang zu Ausrüstung und Infrastruktur und die Unterstützung der Experimente. Diese Studie wurde durch einen Zuschuss des Department of Biotechnology (DBT), der indischen Regierung (BT / PR8699 / MED / 30 / 1018 / 2013), des Science and Engineering Research Board (SERB), der indischen Regierung (EMR / 2016 / 001974) und teilweise durch IISER, Pune Core-Finanzierung unterstützt. A. K. wurde durch das CSIR-SRF-Stipendium finanziert, L.A. wurde durch das DST-INSPIRE-Stipendium finanziert, V.C. wurde durch DBT finanziert (BT/PR8699/MED/30/1018/2013).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
Referenzen
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O'Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938(2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287(2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688(2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12(2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543(2020).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten