Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imitación del método de rodillo de Ding en lesiones musculares inducidas por Notexin en ratas
En este artículo
Resumen
Este protocolo describe un dispositivo simple que imita el método de rollo de Ding, establece un modelo de lesión muscular esquelética en ratas y utiliza la tinción de hematoxilina-eosina para observar la patología del tejido dañado y el ensayo de inmunoabsorción ligado a enzimas para detectar cambios en los marcadores de daño sérico.
Resumen
El método del rollo de Ding es una de las manipulaciones más utilizadas en las clínicas de masaje tradicional chino (Tuina) y una de las manipulaciones contemporáneas de Tuina más influyentes en China. Se basa en el método tradicional de enrollado comúnmente utilizado en el género zen de un dedo y se denomina método de rollo de Ding. Debido a sus efectos antiinflamatorios y promotores de la circulación sanguínea, el método de rodadura de Ding tiene efectos terapéuticos sólidos sobre la miopatía. Debido a la gran área de fuerza aplicada a la piel humana, el método de balanceo de Ding es difícil de realizar en animales de experimentación con áreas de piel pequeñas, como ratas y conejos. Además, la fuerza de Tuina aplicada al cuerpo humano difiere de la aplicada a animales de experimentación, por lo que puede suceder que la fuerza sea demasiado alta o demasiado baja para lograr el efecto terapéutico de Tuina durante el experimento. Este experimento tiene como objetivo crear un masajeador simple adecuado para ratas basado en los parámetros de manipulación de balanceo de Ding (fuerza, frecuencia, duración de Tuina). El dispositivo puede estandarizar la manipulación en experimentos con animales y reducir la variación en la fuerza de Tuina aplicada a diferentes animales debido a factores subjetivos. Se estableció un modelo de lesión muscular esquelética inducida por notexina en ratas, y se utilizaron marcadores de lesión plasmática creatina quinasa (CK) y proteína de unión a ácidos grasos 3 (FABP3) para evaluar el efecto terapéutico de Tuina sobre la lesión muscular esquelética. Los resultados mostraron que este masajeador Tuina podía reducir los niveles de expresión de CK y FABP3 y ralentizar el grado de lesión del músculo esquelético. Por lo tanto, el masajeador Tuina descrito aquí, imitando el método del rollo de Ding, contribuye a estandarizar la manipulación de Tuina en la investigación experimental y es de gran ayuda para la investigación posterior sobre el mecanismo molecular de Tuina para la miopatía.
Introducción
Las lesiones musculares son lesiones traumáticas comunes en la vida clínica y diaria, causadas por golpes externos (contusiones) o sobreesfuerzo crónico de las fibras musculares (distensiones), etc., que dan lugar a disfunción muscular y dolor, afectando incluso gravemente a la calidad de vida del paciente1. Iniciar la rehabilitación lo antes posible después de una lesión por esfuerzo agudo es la clave para reducir el tiempo de retorno al deporte2 y para reducir el dolor 3,4. En la medicina occidental moderna, los primeros auxilios clínicos para las lesiones musculares siguen los principios de reposo, hielo, compresión y elevación (RICE) para detener el sangrado dañino en el tejido muscular5 y los medicamentos antiinflamatorios no esteroideos para aliviar el dolor6. El descubrimiento de nuevas terapias como los exosomas7 y la ingeniería tisular8 se convirtieron en posibles estrategias de tratamiento para las enfermedades del músculo esquelético, compensando las deficiencias de los tratamientos farmacológicos anteriores. Sin embargo, también puede aumentar el costo del tratamiento para los pacientes, poniéndolos bajo una tremenda presión financiera9. Por lo tanto, se recomiendan terapias alternativas y complementarias para el tratamiento de problemas musculoesqueléticos10. Tuina se usa ampliamente clínicamente en China como un método médico tradicional y es popular entre los pacientes por su eficacia y menos efectos secundarios. La terapia Tuina para los trastornos musculoesqueléticos puede aliviar el dolor y mejorar la función11,12,13. El Sr. Ding Jifeng, un famoso practicante de Shanghai Tuina, fundó el método de rollode Ding 14. Es una técnica única de laminación y trituración con una gran área de fuerza, una fuerza uniforme y suave, y una penetración intensa.
Los diferentes modelos animales se basan en diferentes etiologías. Tienen ventajas y desventajas, y la selección de modelos animales correctos y apropiados es de gran importancia para los experimentos básicos, lo que ayuda a comprender las vías de señalización celular y molecular de la regeneración y reparación después de una lesión del músculo esquelético para desarrollar nuevas terapias para tratar el tratamiento de las enfermedades del músculo esquelético. Los modelos de lesión muscular inducidos químicamente son ampliamente utilizados, con inyecciones de músculo esquelético que causan necrosis miofibral y producen áreas regeneradas que pueden regenerarse efectivamente en 2 semanas15. Tanto la notexina como la bupivacaína pueden causar daño muscular. Sin embargo, la notexina puede causar un daño miotóxico más grave al músculo esquelético que la bupivacaína, y la recuperación funcional natural es relativamente más lenta16. El moldeo por inyección intramuscular de fármacos no solo lleva menos tiempo, sino que también tiene efectos controlados y extensión del daño muscular esquelético. Este control cuantificable hace que el moldeo exitoso sea menos difícil15,17.
La respuesta inflamatoria es una respuesta biológica esencial que ha sido ampliamente estudiada en el contexto de la miopatía18,19. En las primeras etapas de la lesión del músculo esquelético, la necrosis miofibrosa altera la homeostasis muscular local, y muchas células inflamatorias se infiltran en el sitio de la lesión, secretando muchas citocinas proinflamatorias19. La creatina quinasa (CK) es un biomarcador sérico tradicional para evaluar la lesión del músculo esquelético. Sin embargo, carece de especificidad tisular20 y sensibilidad21, lo que limita su capacidad para evaluar el alcance del daño muscular inducido por fármacos e informar indirectamente el grado de recuperación muscular después de la lesión. Nuevos biomarcadores, incluida la proteína de unión a ácidos grasos 3 (FABP3), han demostrado recientemente una especificidad tisular y una sensibilidad relativamente altas en modelos de lesiones musculares esqueléticas en roedores. FABP3 es una familia de proteínas de unión que se expresan principalmente en las células del músculo cardíaco y esquelético e implicadas en el metabolismo, el transporte y la señalización de los ácidos grasos22. Por lo tanto, elegimos una combinación de dos biomarcadores, CK y FABP3, para evaluar el alcance del daño muscular esquelético inducido por notexina y la recuperación después del tratamiento.
En roedores, los músculos son poco profundos y el área de la piel es pequeña, lo que también determina que los diversos parámetros del masaje en roedores no serán los mismos que en los humanos, como en la terapia con animales, el masajista debe tratarlos con menos fuerza utilizando el método de rollo de Ding, y puede no ser propicio para la operación de esta técnica debido al pequeño tamaño del área lesionada, lo que, en última instancia, puede conducir a una reducción de la eficacia del masaje. Por lo tanto, el experimento utilizó el masajeador rodante de fabricación propia, que se ajusta a las características del método de rodillo de Ding, para intervenir y evaluar el efecto terapéutico del modelo de lesión muscular esquelética inducida por notexina en ratas, lo que ayuda a estandarizar los parámetros de Tuina en estudios con animales de experimentación con el fin de investigar profundamente el mecanismo molecular de acción de Tuina. un método de tratamiento de la medicina tradicional china, sobre las enfermedades musculoesqueléticas.
Protocolo
Los procedimientos que involucran animales han sido aprobados por el Comité de Cuidado y Uso Institucional de la Universidad de Medicina China de Hunan.
1. Montaje del masajeador rodante
- Seleccione un masajeador que conste de un rodillo de goma, un soporte para horquillas, un resorte, un deflector de límite, una férula de ajuste, un tornillo y un mango acrílico (Figura 1). Asegúrese de que el rodillo de goma mida 3 cm de largo y 1,6 cm de diámetro, el resorte mida 3 cm de largo y 0,9 cm de diámetro, el deflector de límite sea de 3 cm de largo y 2 cm de ancho, y el mango mida 12 cm de largo y 0,9 cm de diámetro.
- Control de fuerza: De acuerdo con los resultados de la literatura23, se encontró que la presión descendente del método de balanceo de Ding es de aproximadamente el 10% del peso corporal, por lo que la presión aplicada durante el diseño del balanceo hacia adelante es de aproximadamente el 10% del peso corporal de la rata (0.2-0.3 N). Pruebe que la presión máxima del masajeador en el controlador de pesaje sea de aproximadamente 0,3 N ajustando el ángulo del deflector límite. Este requisito de presión satisface las necesidades de la rata.
- Asegúrese de que la presión mínima sea de aproximadamente 0,08 N cuando retroceda (Figura 2). Asegúrese de que la presión esté exactamente en conformidad con el requisito del método de balanceo de Ding de que la relación de las fuerzas hacia adelante y hacia atrás sea de 3:1.
- Antes del tratamiento, pídale al operador que trabaje con el software del metrónomo para controlar la frecuencia de laminación a 140 rollos / min y practique esto más de 3 veces en el experimento previo para asegurarse de que la operación esté estandarizada.
2. Establecimiento de un modelo de lesión músculo esquelética en ratas
- Divida al azar 24 ratas macho Sprague-Dawley (con un peso de 200 a 250 g) en tres grupos de ocho ratas cada uno, incluyendo control (C), notexina (NTX) y notexina con Tuina (NTX + Tuina), y aliméntelos con una dieta estándar. Mantener en un ciclo de 12 h de luz/12 h de oscuridad, alojar a 20-25 °C y 50%-70% de humedad.
- Anestesiar con pentobarbital sódico al 1% (40 mg/kg) mediante inyección intraperitoneal y luego eliminar el vello del miembro inferior derecho con crema depilatoria. Después de quitar el pelaje, limpie la crema residual con solución salina. Confirme la anestesia adecuada mediante la respuesta de pellizco de los dedos de los pies. Aplique ungüento oftálmico para hidratar los ojos mientras el animal está bajo anestesia. Proporcionar soporte térmico durante todo el procedimiento.
- Alternar la desinfección de la piel de la extremidad inferior derecha con una solución desinfectante de yodóforo y alcohol al 75% antes de la inyección. Toque un hisopo de algodón empapado en solución desinfectante de yodóforo en el centro de la piel de la extremidad inferior y aplíquelo con movimientos circulares hacia afuera. Repita con un hisopo de algodón empapado en etanol.
- Establecer modelos de lesión músculo esquelética según el método de referencia24. Inyecte notexina en una sola pierna (para evitar la doble inyección de notexina). Extraer 200 μL de solución de notexina (solución de notexina de 10 μg/mL preparada añadiendo 100 μg de notexina a 10 ml de solución salina normal en un tubo de centrífuga de 15 mL) en una jeringa de 1 ml con una aguja de 30G e inyectar la solución de notexina por vía intramuscular en el músculo gastrocnemio para producir lesión muscular.
- Inyecte la notexina lentamente y espere 3 segundos antes de sacar la aguja (para que se inyecte por completo).
PRECAUCIÓN: Notexin es un producto químico tóxico que requiere un lavado inmediato con abundante agua al entrar en contacto con una herida abierta y atención médica inmediata si es necesario. - Inyectar a las ratas del grupo control 200 μL de solución salina. Traslada a las ratas anestesiadas a jaulas vacías con ropa de cama limpia. Tenga cuidado de quitar el acolchado alrededor de la nariz y la boca de las ratas para mantener su respiración despejada. Observe visualmente el color del tejido y la frecuencia respiratoria al final de la inyección hasta que las ratas recuperen la conciencia suficiente.
- Regrese a las ratas a la jaula doméstica y, por lo general, críalas durante 24 horas.
3. Terapia Tuina
- Coloque una rata SD en posición prona con la cabeza cubierta con un paño negro en la plataforma experimental desinfectada con alcohol al 75% para exponer el músculo gastrocnemio. No cubra demasiado apretado.
- Uso del masajeador Tuina para el grupo NTX+Tuina: Sostenga el masajeador y coloque el rodillo sobre el músculo gastrocnemio de la rata y ruede hacia adelante hasta que el resorte haga contacto con el deflector de límite. A continuación, retraiga la fuerza y vuelva a su posición original, con lo que se alterna el movimiento (Figura 3).
- Haga rodar el masajeador a una velocidad de 140 rollos por minuto y realice cada operación durante 3 minutos. Realiza los masajes una vez por la mañana y otra por la tarde durante 3 días consecutivos.
- Regrese las ratas a la jaula de la casa después de cada tratamiento y ayune durante 8 h después del último tratamiento.
4. Recolección de sangre y tejidos de ratas después del experimento
- De acuerdo con los requisitos del comité de ética de la experimentación animal pertinente, anestesiar a las ratas mediante inyección intraperitoneal de pentobarbital sódico al 1% (40 mg/kg, inyección intraperitoneal). Confirme la anestesia adecuada mediante la respuesta de pellizco de los dedos de los pies. Eutanasia de ratas mediante sangría de la aorta abdominal después de la extracción de sangre.
- Alternar la desinfección de la piel con una solución desinfectante de yodóforo y alcohol al 75% antes de la inyección. Toque un hisopo de algodón empapado en povidona yodada en el centro de la piel abdominal y aplíquelo con movimientos circulares hacia afuera. Repita con un hisopo de algodón empapado en etanol. Repita la desinfección 3 veces.
- Pídale al asistente que use dos hemostáticos para levantar la piel en el medio del abdomen. Como operador, use un bisturí para cortar la piel abdominal y los músculos desde el rafe hasta la sínfisis púbica.
- Después de abrir la cavidad abdominal, separe el intestino con bolas de algodón estériles para exponer la aorta abdominal en la pared abdominal posterior.
- Localice la aorta abdominal, tome 5 ml de sangre de rata en tubos de extracción de sangre y obtenga el plasma en 1,5 microtubos centrifugando a 3000 x g durante 10 min después de reposar sangre durante 1 h. Almacenar plasma a -80 °C.
- Abra la piel con unas tijeras quirúrgicas a lo largo de la abertura abdominal inferior hacia la cara lateral de la extremidad inferior derecha, exponiendo los músculos de las extremidades inferiores, y después de separar cuidadosamente la fascia con fórceps, corte el bisturí para eliminar el músculo gastrocnemio intacto.
- Lave el músculo gastrocnemio con solución salina estéril para eliminar el pelo y la sangre adheridos.
- Coloque el músculo gastrocnemio extirpado en un tubo de centrífuga de 15 ml que contenga un 4% de paraformaldehído.
5. Detección de los niveles plasmáticos de CK y FABP 3 mediante ELISA
- Calcule y determine el número de placas preenvueltas necesarias para un experimento. Retire las placas necesarias, colóquelas en el marco de 96 pocillos, vuelva a colocar las microplacas restantes en la bolsa de papel de aluminio para sellarlas y guárdelas a 4 °C.
- Equilibre los kits y las muestras a temperatura ambiente (25-28 °C) durante 120 min, equilibre completamente a temperatura ambiente.
NOTA: El equilibrio del kit y la muestra es crítico y debe equilibrarse con el tiempo suficiente. - Establezca pocillos estándar, de muestra y en blanco. Agregue 50 μL de patrón CK o FABP3 a diferentes concentraciones (100, 50, 25, 12.5, 6.25, 0 ng/mL) a los pocillos estándar. Repita cada patrón una vez, ocupando un total de 12 pozos.
- Llene los pocillos de muestra con 40 μL de diluyente de muestra (0,8 g de NaCl, 0,02 gde KH 2 PO 4, 0,29 g de Na 2 HPO 4 12H2O,0,02 g de KCl, 0,01 g de NaN3en 100 mL de agua bidestilada, pH7,4), seguido de 10 μL de la muestra a analizar. Repita cada muestra una vez, ocupando 48 pocillos en total.
- A excepción de los pocillos en blanco ubicados dos pocillos detrás del último pocillo de muestra, agregue 100 μL de anticuerpo anti-CK humano marcado con HRP o FABP3 (anticuerpo marcado con enzimas) a cada pocillo estándar y de muestra.
- Sellar los pocillos con film sellador e incubar en un baño de agua o termostato a 37 °C durante 60 min.
- Deseche el líquido, seque el plato con papel absorbente, llene cada pocillo con líquido de lavado, déjelo actuar durante 20 segundos, sacuda el líquido de lavado, seque el papel secante y repita el lavado del plato 5 veces (o use un lavaplatos).
- Añadir 50 μL de solución de cromógeno A (20 mg de tetrametilbencidina 10 mL de etanol en 100 mL de agua bidestilada) y 50 μL de solución de cromógeno B (0,1 M/L de ácido cítrico, 0,2 M/L de tampón dihidrógeno fosfato de sodio, pH 5,0-5,4) a cada pocillo. Mantener alejado de la luz durante 15 minutos a 37 °C.
- Para pocillos estándar, pocillos de muestra y pocillos en blanco, agregue 50 μL de solución de terminación a cada pocillo y mida el valor de densidad óptica de cada pocillo a 450 nm en 15 minutos.
6. Análisis histológico de la lesión muscular gastrocnemio inducida por notexina en ratas
- Preparar secciones de parafina de 5 μm de espesor teñidas con hematoxilina y eosina para un examen microscópico ligero como se describe enel punto 25.
7. Procesamiento de imágenes y análisis de datos
- Lea y analice las imágenes capturadas por el sistema de imágenes con software de análisis. Mueva el campo de visión de la imagen seleccionada al centro de la pantalla con el mouse, haga clic en 40x y, a continuación, haga clic en Tomar instantánea.
- Registre los valores de OD del ELISA en una hoja de cálculo y calcule los niveles de CK y FABP3 de rata en las muestras utilizando la curva estándar.
- Utilice software de análisis estadístico para los análisis estadísticos. Exprese las mediciones como media ± desviación estándar (
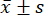 ), y analice las comparaciones entre los grupos mediante ANOVA de un factor, con la prueba LSD cuando la varianza fue uniforme, y el método Tamhane T2 cuando la varianza no fue uniforme. La diferencia se consideró estadísticamente significativa con un valor de p menor a 0,05.
), y analice las comparaciones entre los grupos mediante ANOVA de un factor, con la prueba LSD cuando la varianza fue uniforme, y el método Tamhane T2 cuando la varianza no fue uniforme. La diferencia se consideró estadísticamente significativa con un valor de p menor a 0,05.
Resultados
Con el fin de observar las propiedades morfológicas del músculo esquelético de rata después de la lesión, el músculo gastrocnemio se tiñó con hematoxilina y eosina, y las imágenes teñidas se leyeron con un software de análisis como se describe en el protocolo para 8 ratas por grupo. En ratas con lesión muscular gastrocnemia inducida por notexina (grupo NTX), muchas células musculares estaban rotas, atróficas, necróticas y dispuestas irregularmente. También hubo una alta infiltración de neutrófilos y lin...
Discusión
Aquí, describimos un protocolo para el tratamiento de Tuina de la lesión muscular esquelética en ratas y luego analizamos el grado de lesión muscular esquelética después del tratamiento para verificar la efectividad del método. En particular, los modelos de lesión del músculo esquelético de rata, que incluyen, entre otros, la inducción de fármacos (notexina, bupivacaína)16, la contusióncontusa 26, el aplastamiento27 y la isquemia-reperf...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación contó con el apoyo de subvenciones de la Fundación Nacional de Ciencias Naturales de China (Subvención n.º 82174521), Proyecto de Innovación para Estudiantes de Posgrado de la Universidad de Medicina China de Hunan (2022CX109)
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | JIANGXI FENGLIN | 20220521 | |
| 1.5 microtubes | Servicebio | EP-150X-J | |
| 15 mL centrifuge tube | Servicebio | EP-1501-J | |
| 30G needle | CONPUVON | 220318 | |
| 5 mL blood collection tube | Servicebio | QX0023 | |
| Acrylic handle | Guangdong Guangxingwang Plastic Materials Co., Ltd | 65643645 | |
| Adjustment splint | CREROMEM | 20220729 | |
| Cotton Swab | INOHV | 22080215 | |
| Enzyme-labeled Instrument | Rayto | RT-6100 | |
| Ethanol | INOHV | 211106 | |
| Fork holder | Yongkang Kangzhe Health Technology Co., Ltd | JL001 | |
| Hair removal cream | Veet, France | LOTC190922002 | |
| Hematoxylin dyeing solution set | Wuhan Google Biotech | G1005 | |
| Imaging system | Nikon, Japan | Nikon DS-U3 | |
| IODOPHOR disfecting solution | Hale&Hearty | 20221205 | |
| Light microscope | Nikon, Japan | Nikon Eclipse E100 | |
| Limit baffle | CREROMEM | 20220724 | |
| Notexin | Latoxan S.A.S. | L8104-100UG | |
| Pentobarbital sodium | Merck KGaA | P3761 | |
| Rat creatine kinase (CK) ELISA kit | LunChangShuoBiotech | YD-35237 | |
| Rat fatty acid-binding protein 3 (FABP3) ELISA kit | LunChangShuoBiotech | YD-35730 | |
| Rubber roller | Hebei Mgkui Chemical Technology Co.,Ltd | 202207 | |
| Screw | Weiyan Hardware | B05Z122 | |
| Sprague Dawley rats | Hunan Slake Kingda Laboratory Animal Co. | SYXK2019-0009 | |
| Spring | Bingzhang Hardware | TH001 | |
| Surgical blade | Covetrus | #23 | |
| Weigh controller | Iyoys | HY-XSQ |
Referencias
- Lempainen, L., et al. Management of anterior thigh injuries in soccer players: practical guide. BMC Sports Science, Medicine and Rehabilitation. 14 (1), 41 (2022).
- Bayer, M. L., Mackey, A., Magnusson, S. P., Krogsgaard, M. R., Kjær, M. Treatment of acute muscle injuries (in Danish). Ugeskrift for Laeger. 181 (8), V11180753 (2019).
- Serner, A., et al. Progression of Strength, Flexibility, and Palpation Pain During Rehabilitation of Athletes with Acute Adductor Injuries: A Prospective Cohort Study. The Journal of Orthopaedic and Sports Physical Therapy. 51 (3), 126-134 (2021).
- Gozubuyuk, O. B., Koksal, C., Tasdemir, E. N. Rehabilitation of a patient with bilateral rectus abdominis full thickness tear sustained in recreational strength training: a case report. Physiotherapy Theory and Practice. 38 (13), 3216-3225 (2022).
- Hotfiel, T., et al. Current Conservative Treatment and Management Strategies of Skeletal Muscle Injuries. Zeitschrift für Orthopädie und Unfallchirurgie. 154 (3), 245-253 (2016).
- de Sire, A., et al. Pharmacological Treatment for Acute Traumatic Musculoskeletal Pain in Athletes. Medicina. 57 (11), 1208 (2021).
- Connor, D. E., et al. Therapeutic potential of exosomes in rotator cuff tendon healing. Journal of Bone and Mineral Metabolism. 37 (5), 759-767 (2019).
- Martins, A. L. L., Giorno, L. P., Santos, A. R. Tissue Engineering Applied to Skeletal Muscle: Strategies and Perspectives. Bioengineering. 9 (12), 744 (2022).
- Horgan, D., et al. Clouds across the new dawn for clinical, diagnostic and biological data: accelerating the development, delivery and uptake of personalized medicine. Diagnosis. , (2023).
- Urits, I., et al. A Comprehensive Review of Alternative Therapies for the Management of Chronic Pain Patients: Acupuncture, Tai Chi, Osteopathic Manipulative Medicine, and Chiropractic Care. Advances in Therapy. 38 (1), 76-89 (2021).
- Lee, N. W., et al. Chuna (or Tuina) Manual Therapy for Musculoskeletal Disorders: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Evidence-based Complementary and Alternative Medicine: eCAM. 2017, 8218139 (2017).
- Xie, J., Deng, D. X., Chen, Y., Peng, L. Progress in the intervention of massage techniques on skeletal muscle injury. Hunan Journal of Traditional Chinese Medicine. 34 (04), 199-201 (2018).
- Yuan, Y., Zhang, H., Zhang, G. H., Xue, X. N. Research progress on microstructure changes and rehabilitation treatment of exercise-induced skeletal muscle injury. Massage and Rehabilitation Medicine. 14 (6), 29-33 (2023).
- Zhao, Y. The Establishment of Famous Tuina Master Ding Jifeng and Wei Fa - Commemorating the 100th Anniversary of Mr. Ding Jifeng's Birthday. Traditional Chinese Medicine Culture. 9 (6), 18-21 (2014).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PloS one. 11 (1), e0147198 (2016).
- Plant, D. R., Colarossi, F. E., Lynch, G. S. Notexin causes greater myotoxic damage and slower functional repair in mouse skeletal muscles than bupivacaine. Muscle & Nerve. 34 (5), 577-585 (2006).
- Tierney, M. T., Sacco, A. Inducing and Evaluating Skeletal Muscle Injury by Notexin and Barium Chloride. Methods in Molecular Biology. 1460, 53-60 (2016).
- Torres-Ruiz, J., Alcalá-Carmona, B., Alejandre-Aguilar, R., Gómez-Martín, D. Inflammatory myopathies and beyond: The dual role of neutrophils in muscle damage and regeneration. Frontiers in Immunology. 14, 1113214 (2023).
- Tu, H., Li, Y. L. Inflammation balance in skeletal muscle damage and repair. Frontiers in Immunology. 14, 1133355 (2023).
- Castro, C., Gourley, M. Diagnosis and treatment of inflammatory myopathy: issues and management. Therapeutic Advances in Musculoskeletal Disease. 4 (2), 111-120 (2012).
- Dabby, R., et al. Asymptomatic or minimally symptomatic hyperCKemia: histopathologic correlates. The Israel Medical Association Journal: IMAJ. 8 (2), 110-113 (2006).
- Khodabukus, A., et al. Tissue-Engineered Human Myobundle System as a Platform for Evaluation of Skeletal Muscle Injury Biomarkers. Toxicological Sciences. 176 (1), 124-136 (2020).
- Zhou, X. W., Jin, W. D., Zhu, L., Liu, X. H., Zhou, B. H. Experimental observation on the influence of different frequency, intensity and action time of Ding rolling manipulation on hemodynamics. Shanghai Journal of Traditional Chinese Medicine. (06), 42-44 (1998).
- Pablos, A., et al. Protective Effects of Foam Rolling against Inflammation and Notexin Induced Muscle Damage in Rats. International Journal of Medical Sciences. 17 (1), 71-81 (2017).
- Wisner, L., Larsen, B., Maguire, A. Enhancing Tumor Content through Tumor Macrodissection. Journal of Visualized Experiments: JoVE. (180), e62961 (2022).
- Deng, P., et al. Contusion concomitant with ischemia injury aggravates skeletal muscle necrosis and hinders muscle functional recovery. Experimental Biology and Medicine. 247 (17), 1577-1590 (2022).
- Dobek, G. L., Fulkerson, N. D., Nicholas, J., Schneider, B. S. Mouse model of muscle crush injury of the legs. Comparative Medicine. 63 (3), 227-232 (2013).
- Armstrong, D. M., et al. Sildenafil citrate protects skeletal muscle of ischemia-reperfusion injury: immunohistochemical study in rat model. Acta Cirúrgica Brasileira. 28 (4), 282-287 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados