Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imitation de la méthode de roulis de Ding sur les lésions musculaires induites par la notexine chez le rat
Dans cet article
Résumé
Ce protocole décrit un dispositif simple qui imite la méthode de roulis de Ding, établit un modèle de lésion des muscles squelettiques chez le rat et utilise la coloration à l’hématoxyline-éosine pour observer la pathologie des tissus endommagés et un test immuno-enzymatique pour détecter les changements dans les marqueurs de dommages sériques.
Résumé
La méthode du rouleau de Ding est l’une des manipulations les plus couramment utilisées dans les cliniques de massage traditionnel chinois (Tuina) et l’une des manipulations contemporaines de Tuina les plus influentes en Chine. Il est basé sur la méthode de roulement traditionnelle couramment utilisée dans le genre zen à un doigt et nommé méthode de roulement de Ding. En raison de ses effets anti-inflammatoires et favorisant la circulation sanguine, la méthode de roulement de Ding a des effets thérapeutiques solides sur la myopathie. En raison de la grande surface de force appliquée à la peau humaine, la méthode de roulage de Ding est difficile à exécuter sur des animaux de laboratoire avec de petites surfaces cutanées, tels que les rats et les lapins. De plus, la force du Tuina appliquée sur le corps humain diffère de celle appliquée aux animaux de laboratoire, il peut donc arriver que la force soit trop élevée ou trop faible pour obtenir l’effet thérapeutique du Tuina pendant l’expérience. Cette expérience vise à créer un masseur simple adapté aux rats en se basant sur les paramètres de manipulation du roulement de Ding (force, fréquence, durée du Tuina). L’appareil peut standardiser la manipulation dans les expériences animales et réduire la variation de la force Tuina appliquée à différents animaux en raison de facteurs subjectifs. Un modèle de lésion des muscles squelettiques induite par la notexine chez le rat a été établi, et les marqueurs plasmatiques de lésions de la créatine kinase (CK) et de la protéine de liaison aux acides gras 3 (FABP3) ont été utilisés pour évaluer l’effet thérapeutique du Tuina sur les lésions des muscles squelettiques. Les résultats ont montré que ce masseur Tuina pouvait réduire les niveaux d’expression de CK et de FABP3 et ralentir le degré de lésion des muscles squelettiques. Par conséquent, le masseur Tuina décrit ici, imitant la méthode du rouleau de Ding, contribue à standardiser la manipulation du Tuina dans la recherche expérimentale et est d’une grande aide pour les recherches ultérieures sur le mécanisme moléculaire du Tuina pour la myopathie.
Introduction
Les lésions musculaires sont des blessures traumatiques courantes dans la vie clinique et quotidienne, causées par des coups externes (contusions) ou une surcharge chronique des fibres musculaires (foulures), etc., entraînant un dysfonctionnement musculaire et des douleurs, affectant même gravement la qualité de vie du patient1. Commencer la rééducation le plus tôt possible après une microtraumatisme aiguë est la clé pour réduire le temps nécessaire à la reprise du sport2 et pour réduire la douleur 3,4. Dans la médecine occidentale moderne, les premiers soins cliniques pour les blessures musculaires suivent les principes du repos, de la glace, de la compression et de l’élévation (RICE) pour arrêter les saignements nuisibles dans le tissu musculaire5 et des anti-inflammatoires non stéroïdiens pour soulager la douleur6. La découverte de nouvelles thérapies telles que les exosomes7 et l’ingénierie tissulaire8 sont devenues des stratégies de traitement potentielles pour les maladies des muscles squelettiques, compensant les lacunes des traitements pharmacologiques précédents. Cependant, elle peut également augmenter le coût du traitement pour les patients, ce qui les soumet à une pression financière énorme9. Par conséquent, les thérapies alternatives et complémentaires sont recommandées pour traiter les problèmes musculo-squelettiques10. Le Tuina est largement utilisé cliniquement en Chine comme méthode médicale traditionnelle et est populaire parmi les patients pour son efficacité et ses effets secondaires. La thérapie Tuina pour les troubles musculo-squelettiques peut soulager la douleur et améliorer la fonction11,12,13. M. Ding Jifeng, un célèbre pratiquant de Tuina de Shanghai, a fondé la méthode de roulementde Ding 14. Il s’agit d’une technique unique de roulage et d’écrasement avec une grande surface de force, une force uniforme et douce et une pénétration intense.
Différents modèles animaux sont basés sur des étiologies différentes. Ils ont des avantages et des inconvénients, et la sélection de modèles animaux corrects et appropriés est d’une grande importance pour les expériences fondamentales, ce qui aide à comprendre les voies de signalisation cellulaires et moléculaires de la régénération et de la réparation après une lésion des muscles squelettiques afin de développer de nouvelles thérapies pour traiter le traitement des maladies des muscles squelettiques. Les modèles de lésions musculaires induits chimiquement sont largement utilisés, avec des injections de muscle squelettique provoquant une nécrose des myofibres et produisant des zones régénérées qui peuvent se régénérer efficacement en 2 semaines15. La notexine et la bupivacaïne peuvent causer des lésions musculaires. Cependant, la notexine peut causer des dommages myotoxiques plus graves aux muscles squelettiques que la bupivacaïne, et la récupération fonctionnelle naturelle est relativement plus lente16. Le moulage par injection intramusculaire prend non seulement moins de temps, mais a également des effets contrôlés et l’étendue des dommages aux muscles squelettiques. Ce contrôle quantifiable rend le moulage réussi moins difficile15,17.
La réponse inflammatoire est une réponse biologique essentielle qui a été largement étudiée dans le contexte de la myopathie18,19. Dans les premiers stades de la lésion des muscles squelettiques, la nécrose des myofibres perturbe l’homéostasie musculaire locale et de nombreuses cellules inflammatoires s’infiltrent dans le site de la lésion, sécrétant de nombreuses cytokines pro-inflammatoires19. La créatine kinase (CK) est un biomarqueur sérique traditionnel pour évaluer les lésions musculaires squelettiques. Cependant, il manque de spécificité tissulaire20 et de sensibilité21, ce qui limite sa capacité à évaluer l’étendue des lésions musculaires induites par le médicament et à signaler indirectement l’étendue de la récupération musculaire après une blessure. De nouveaux biomarqueurs, dont la protéine de liaison aux acides gras 3 (FABP3), ont récemment montré une spécificité et une sensibilité tissulaires relativement élevées dans des modèles de lésions musculaires squelettiques chez les rongeurs. FABP3 est une famille de protéines de liaison exprimées principalement dans les cellules musculaires cardiaques et squelettiques et impliquées dans le métabolisme, le transport et la signalisation des acides gras22. Par conséquent, nous avons choisi une combinaison de deux biomarqueurs, CK et FABP3, pour évaluer l’étendue des lésions des muscles squelettiques induites par la notexine et la récupération après le traitement.
Chez les rongeurs, les muscles sont peu profonds et la zone de la peau est petite, ce qui détermine également que les différents paramètres de massage chez les rongeurs ne seront pas les mêmes que chez l’homme, comme en zoothérapie, le massothérapeute doit les traiter avec moins de force en utilisant la méthode du rouleau de Ding, et peut ne pas être propice au fonctionnement de cette technique en raison de la petite taille de la zone blessée, ce qui peut finalement entraîner une réduction de l’efficacité du massage. Par conséquent, l’expérience a utilisé le masseur roulant fabriqué en interne, qui est conforme aux caractéristiques de la méthode de roulement de Ding, pour intervenir et évaluer l’effet thérapeutique du modèle de lésion des muscles squelettiques induit par la notexine chez le rat, ce qui aide à normaliser les paramètres de Tuina dans les études expérimentales sur les animaux afin d’étudier en profondeur le mécanisme moléculaire d’action du Tuina. une méthode de traitement de la médecine traditionnelle chinoise, sur les maladies musculo-squelettiques.
Protocole
Les procédures impliquant des animaux ont été approuvées par le Comité institutionnel de soins et d’utilisation de l’Université de médecine chinoise du Hunan.
1. Montage du masseur roulant
- Choisissez un appareil de massage composé d’un rouleau en caoutchouc, d’un porte-fourche, d’un ressort, d’un déflecteur de limite, d’une attelle de réglage, d’une vis et d’une poignée en acrylique (Figure 1). Assurez-vous que le rouleau en caoutchouc mesure 3 cm de long et 1,6 cm de diamètre, que le ressort mesure 3 cm de long et 0,9 cm de diamètre, que le déflecteur de limite mesure 3 cm de long et 2 cm de large et que la poignée mesure 12 cm de long et 0,9 cm de diamètre.
- Contrôle de la force : Selon les résultats de la littérature23, la pression vers le bas de la méthode de roulis de Ding s’est avérée être d’environ 10 % du poids corporel, de sorte que la pression appliquée lors de la conception du roulement vers l’avant est d’environ 10 % du poids corporel du rat (0,2-0,3 N). Testez la pression maximale du masseur sur le contrôleur de pesage pour qu’elle soit d’environ 0,3 N en ajustant l’angle du déflecteur de limite. Cette exigence de pression répond aux besoins du rat.
- Assurez-vous que la pression minimale est d’environ 0,08 N lorsque vous reculez (Figure 2). Assurez-vous que la pression est précisément conforme à l’exigence de la méthode de roulis de Ding selon laquelle le rapport des forces avant et arrière est de 3 :1.
- Avant le traitement, demandez à l’opérateur de travailler avec le logiciel métronome pour contrôler la fréquence de roulement à 140 rouleaux/min et pratiquez-le plus de 3 fois dans la pré-expérience pour vous assurer que l’opération est standardisée.
2. Etablissement d’un modèle de lésion des muscles squelettiques chez le rat
- Divisez au hasard 24 rats mâles de Sprague-Dawley (pesant de 200 à 250 g) en trois groupes de huit rats chacun, y compris le témoin (C), la notexine (NTX) et la notexine avec Tuina (NTX + Tuina), et nourrissez-les avec un régime standard. Maintenir sur un cycle de lumière de 12 h / 12 h d’obscurité, maison à 20-25 °C et 50%-70% d’humidité.
- Anesthésier avec du pentobarbital sodique à 1 % (40 mg/kg) par injection intrapéritonéale, puis épiler le membre inférieur droit avec une crème dépilatoire. Après avoir retiré la fourrure, essuyez la crème résiduelle avec une solution saline. Confirmer l’anesthésie adéquate par une réponse de pincement des orteils. Appliquez une pommade ophtalmique pour hydrater les yeux pendant que l’animal est sous anesthésie. Fournir un soutien thermique tout au long de l’intervention.
- Désinfection alternée de la peau du membre inférieur droit avec une solution désinfectante iodophore et de l’alcool à 75% avant l’injection. Touchez un coton-tige imbibé d’une solution désinfectante iodophore au centre de la peau des membres inférieurs et appliquez dans un mouvement circulaire vers l’extérieur. Répétez l’opération avec un coton-tige imbibé d’éthanol.
- Établir des modèles de lésions des muscles squelettiques selon la méthode de référence24. Injecter la notexine dans une seule jambe (pour éviter une double injection de notexine). Prélever 200 μL de solution de notexine (solution de notexine de 10 μg/mL préparée en ajoutant 100 μg de notexine à 10 mL de solution saline normale dans un tube à centrifuger de 15 mL) dans une seringue de 1 mL munie d’une aiguille de 30 G et injecter la solution de notexine par voie intramusculaire dans le muscle gastrocnémien pour provoquer une lésion musculaire.
- Injectez lentement la notexine et attendez 3 s avant de retirer l’aiguille (pour l’injecter complètement).
ATTENTION : Notexin est un produit chimique toxique qui nécessite un rinçage immédiat avec beaucoup d’eau au contact d’une plaie ouverte et des soins médicaux rapides si nécessaire. - Injecter 200 μL de solution saline aux rats du groupe témoin. Déplacez les rats anesthésiés dans des cages vides avec une litière propre. Prenez soin d’enlever le rembourrage autour du nez et de la bouche des rats pour garder leur respiration claire. Observez visuellement la couleur des tissus et la fréquence respiratoire à la fin de l’injection jusqu’à ce que les rats retrouvent une conscience suffisante.
- Remettez les rats dans la cage d’origine et élevez-les généralement pendant 24 heures.
3. Thérapie Tuina
- Placez un rat SD en position couchée avec la tête recouverte d’un tissu noir sur la plate-forme expérimentale désinfectée avec de l’alcool à 75% pour exposer le muscle gastrocnémien. Ne couvrez pas trop fort.
- Utilisation du masseur Tuina pour le groupe NTX+Tuina : Tenez le masseur et placez le rouleau sur le muscle gastrocnémien du rat et roulez vers l’avant jusqu’à ce que le ressort entre en contact avec le déflecteur de limite. Ensuite, rétractez la force et revenez à sa position initiale, ce qui permet un mouvement alternatif (Figure 3).
- Faites rouler le masseur à une vitesse de 140 rouleaux par minute et effectuez chaque opération pendant 3 minutes. Effectuez les massages une fois le matin et une fois l’après-midi pendant 3 jours consécutifs.
- Remettez les rats dans la cage d’accueil après chaque traitement et jeûnez pendant 8 h après le dernier traitement.
4. Prélèvement de sang et de tissus sur des rats après l’expérience
- Selon les exigences du comité d’éthique de l’expérimentation animale compétent, anesthésier les rats par injection intrapéritonéale de pentobarbital sodique à 1 % (40 mg/kg, injection intrapéritonéale). Confirmer l’anesthésie adéquate par une réponse de pincement des orteils. Euthanasier les rats par saignée abdominale après le prélèvement sanguin.
- Alterner la désinfection de la peau avec une solution désinfectante à base d’iodophore et d’alcool à 75% avant l’injection. Touchez un coton-tige imbibé de povidone iodée au centre de la peau abdominale et appliquez dans un mouvement circulaire vers l’extérieur. Répétez l’opération avec un coton-tige imbibé d’éthanol. Répétez la désinfection 3 fois.
- Demandez à l’assistant d’utiliser deux hémostatiques pour soulever la peau au milieu de l’abdomen. En tant qu’opérateur, utilisez un scalpel pour couper la peau abdominale et les muscles, du raphé à la symphyse pubienne.
- Après avoir ouvert la cavité abdominale, séparez l’intestin avec des boules de coton stériles pour exposer l’aorte abdominale dans la paroi abdominale postérieure.
- Localisez l’aorte abdominale, prélevez 5 mL de sang de rat dans des tubes de prélèvement sanguin et obtenez le plasma dans 1,5 microtube en centrifugant à 3000 x g pendant 10 min après avoir laissé reposer le sang pendant 1 h. Conservez le plasma à -80 °C.
- Coupez la peau avec des ciseaux chirurgicaux le long de l’ouverture abdominale inférieure vers la face latérale du membre inférieur droit, exposant les muscles des membres inférieurs, et après avoir soigneusement séparé le fascia avec une pince, coupez le scalpel pour enlever le muscle gastrocnémien intact.
- Lavez le muscle gastrocnémien dans une solution saline stérile pour éliminer les poils et le sang adhérents.
- Placez le muscle gastrocnémien retiré dans un tube à centrifuger de 15 ml contenant 4 % de paraformaldéhyde.
5. Détection des taux plasmatiques de CK et de FABP 3 par ELISA
- Calculer et déterminer le nombre de plaques préemballées nécessaires pour une expérience. Retirez les plaques requises, placez-les dans le cadre à 96 puits, remettez les microplaques restantes dans le sac en papier d’aluminium pour le scellage et stockez-les à 4 °C.
- Équilibrer les kits et les échantillons à température ambiante (25-28 °C) pendant 120 min, complètement équilibrer à température ambiante.
REMARQUE : L’équilibrage de la trousse et de l’échantillon est essentiel et doit être équilibré suffisamment longtemps. - Définissez des puits standard, des puits d’échantillonnage et des puits vides. Ajouter 50 μL d’étalon CK ou FABP3 à différentes concentrations (100, 50, 25, 12,5, 6,25, 0 ng/mL) dans les puits étalons. Répétez chaque norme une fois, occupant un total de 12 puits.
- Remplir les puits d’échantillons avec 40 μL de diluant d’échantillon (0,8 g NaCl, 0,02 g KH 2 PO 4, 0,29 g Na 2 HPO 412H2O, 0,02 g KCl, 0,01 g NaN3dans 100 mL d’eau double distillée, pH7,4), suivi de 10 μL de l’échantillon à analyser. Répétez chaque échantillon une fois, en occupant 48 puits au total.
- À l’exception des puits à blanc situés à deux puits derrière le dernier puits d’échantillonnage, ajouter 100 μL d’anticorps anti-humain CK ou FABP3 marqué HRP (anticorps marqué par enzyme) à chaque étalon et à chaque puits d’échantillonnage.
- Sceller les puits avec un film d’étanchéité et incuber dans un bain-marie à 37 °C ou un thermostat pendant 60 min.
- Jetez le liquide, séchez-le en tapotant sur du papier absorbant, remplissez chaque puits de liquide de lavage, laissez agir pendant 20 s, secouez le liquide de lavage, séchez-le en tapotant sur du papier buvard et répétez le lavage de l’assiette 5 fois (ou utilisez une laveuse d’assiettes).
- Ajouter 50 μL de solution chromogène A (20 mg de tétraméthylbenzidine, 10 mL d’éthanol dans 100 mL d’eau distillée double) et 50 μL de solution chromogène B (0,1 M/L d’acide citrique, 0,2 M/L de tampon phosphate de dihydrogénophosphate de sodium, pH 5,0-5,4) dans chaque puits. Conserver à l’abri de la lumière pendant 15 min à 37 °C.
- Pour les puits standard, les puits d’échantillonnage et les puits vides, ajoutez 50 μL de solution de terminaison à chaque puits et mesurez la valeur de densité optique de chaque puits à 450 nm en 15 min.
6. Analyse histologique des lésions musculaires gastrocnémiennes induites par la notexine chez le rat
- Préparer des coupes de paraffine de 5 μm d’épaisseur colorées à l’hématoxyline et à l’éosine pour un examen au microscope optique tel que décrit aupoint 25.
7. Traitement d’images et analyse de données
- Lire et analyser les images capturées par le système d’imagerie à l’aide d’un logiciel d’analyse. Déplacez le champ de vision de l’image sélectionnée vers le centre de l’écran à l’aide de la souris, cliquez sur 40x, puis cliquez sur Prendre un instantané.
- Enregistrez les valeurs de DO du test ELISA dans une feuille de calcul et calculez les niveaux de CK et de FABP3 chez le rat dans les échantillons à l’aide de la courbe standard.
- Utiliser un logiciel d’analyse statistique pour les analyses statistiques. Exprimez les mesures sous forme de moyenne ±écart-type (
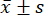 ) et analysez les comparaisons entre les groupes par ANOVA à un facteur, avec le test LSD lorsque la variance était uniforme, et la méthode Tamhane T2 lorsque la variance n’était pas uniforme. La différence a été considérée comme statistiquement significative à une valeur de p inférieure à 0,05.
) et analysez les comparaisons entre les groupes par ANOVA à un facteur, avec le test LSD lorsque la variance était uniforme, et la méthode Tamhane T2 lorsque la variance n’était pas uniforme. La différence a été considérée comme statistiquement significative à une valeur de p inférieure à 0,05.
Résultats
Afin d’observer les propriétés morphologiques du muscle squelettique du rat après une blessure, le muscle gastrocnémien a été coloré avec de l’hématoxyline et de l’éosine, et les images colorées ont été lues avec un logiciel d’analyse tel que décrit dans le protocole pour 8 rats par groupe. Chez les rats présentant une lésion du muscle gastrocnémien induite par la notexine (groupe NTX), de nombreuses cellules musculaires étaient rompues, atrophiques, nécrotiques et disposées de manière irrégu...
Discussion
Ici, nous avons décrit un protocole pour le traitement Tuina des lésions musculaires squelettiques chez le rat, puis analysé le degré de lésion des muscles squelettiques après le traitement pour vérifier l’efficacité de la méthode. Notamment, les modèles de lésions musculaires squelettiques chez le rat, y compris, mais sans s’y limiter, l’induction de médicaments (notexine, bupivacaïne)16, la contusion contondante 26, l’écrasement 27 et l’ischémie-reperfusion
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée par des subventions de la Fondation nationale des sciences naturelles de Chine (subvention n° 82174521), Projet d’innovation pour les étudiants diplômés de l’Université de médecine chinoise du Hunan (2022CX109)
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | JIANGXI FENGLIN | 20220521 | |
| 1.5 microtubes | Servicebio | EP-150X-J | |
| 15 mL centrifuge tube | Servicebio | EP-1501-J | |
| 30G needle | CONPUVON | 220318 | |
| 5 mL blood collection tube | Servicebio | QX0023 | |
| Acrylic handle | Guangdong Guangxingwang Plastic Materials Co., Ltd | 65643645 | |
| Adjustment splint | CREROMEM | 20220729 | |
| Cotton Swab | INOHV | 22080215 | |
| Enzyme-labeled Instrument | Rayto | RT-6100 | |
| Ethanol | INOHV | 211106 | |
| Fork holder | Yongkang Kangzhe Health Technology Co., Ltd | JL001 | |
| Hair removal cream | Veet, France | LOTC190922002 | |
| Hematoxylin dyeing solution set | Wuhan Google Biotech | G1005 | |
| Imaging system | Nikon, Japan | Nikon DS-U3 | |
| IODOPHOR disfecting solution | Hale&Hearty | 20221205 | |
| Light microscope | Nikon, Japan | Nikon Eclipse E100 | |
| Limit baffle | CREROMEM | 20220724 | |
| Notexin | Latoxan S.A.S. | L8104-100UG | |
| Pentobarbital sodium | Merck KGaA | P3761 | |
| Rat creatine kinase (CK) ELISA kit | LunChangShuoBiotech | YD-35237 | |
| Rat fatty acid-binding protein 3 (FABP3) ELISA kit | LunChangShuoBiotech | YD-35730 | |
| Rubber roller | Hebei Mgkui Chemical Technology Co.,Ltd | 202207 | |
| Screw | Weiyan Hardware | B05Z122 | |
| Sprague Dawley rats | Hunan Slake Kingda Laboratory Animal Co. | SYXK2019-0009 | |
| Spring | Bingzhang Hardware | TH001 | |
| Surgical blade | Covetrus | #23 | |
| Weigh controller | Iyoys | HY-XSQ |
Références
- Lempainen, L., et al. Management of anterior thigh injuries in soccer players: practical guide. BMC Sports Science, Medicine and Rehabilitation. 14 (1), 41 (2022).
- Bayer, M. L., Mackey, A., Magnusson, S. P., Krogsgaard, M. R., Kjær, M. Treatment of acute muscle injuries (in Danish). Ugeskrift for Laeger. 181 (8), V11180753 (2019).
- Serner, A., et al. Progression of Strength, Flexibility, and Palpation Pain During Rehabilitation of Athletes with Acute Adductor Injuries: A Prospective Cohort Study. The Journal of Orthopaedic and Sports Physical Therapy. 51 (3), 126-134 (2021).
- Gozubuyuk, O. B., Koksal, C., Tasdemir, E. N. Rehabilitation of a patient with bilateral rectus abdominis full thickness tear sustained in recreational strength training: a case report. Physiotherapy Theory and Practice. 38 (13), 3216-3225 (2022).
- Hotfiel, T., et al. Current Conservative Treatment and Management Strategies of Skeletal Muscle Injuries. Zeitschrift für Orthopädie und Unfallchirurgie. 154 (3), 245-253 (2016).
- de Sire, A., et al. Pharmacological Treatment for Acute Traumatic Musculoskeletal Pain in Athletes. Medicina. 57 (11), 1208 (2021).
- Connor, D. E., et al. Therapeutic potential of exosomes in rotator cuff tendon healing. Journal of Bone and Mineral Metabolism. 37 (5), 759-767 (2019).
- Martins, A. L. L., Giorno, L. P., Santos, A. R. Tissue Engineering Applied to Skeletal Muscle: Strategies and Perspectives. Bioengineering. 9 (12), 744 (2022).
- Horgan, D., et al. Clouds across the new dawn for clinical, diagnostic and biological data: accelerating the development, delivery and uptake of personalized medicine. Diagnosis. , (2023).
- Urits, I., et al. A Comprehensive Review of Alternative Therapies for the Management of Chronic Pain Patients: Acupuncture, Tai Chi, Osteopathic Manipulative Medicine, and Chiropractic Care. Advances in Therapy. 38 (1), 76-89 (2021).
- Lee, N. W., et al. Chuna (or Tuina) Manual Therapy for Musculoskeletal Disorders: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Evidence-based Complementary and Alternative Medicine: eCAM. 2017, 8218139 (2017).
- Xie, J., Deng, D. X., Chen, Y., Peng, L. Progress in the intervention of massage techniques on skeletal muscle injury. Hunan Journal of Traditional Chinese Medicine. 34 (04), 199-201 (2018).
- Yuan, Y., Zhang, H., Zhang, G. H., Xue, X. N. Research progress on microstructure changes and rehabilitation treatment of exercise-induced skeletal muscle injury. Massage and Rehabilitation Medicine. 14 (6), 29-33 (2023).
- Zhao, Y. The Establishment of Famous Tuina Master Ding Jifeng and Wei Fa - Commemorating the 100th Anniversary of Mr. Ding Jifeng's Birthday. Traditional Chinese Medicine Culture. 9 (6), 18-21 (2014).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PloS one. 11 (1), e0147198 (2016).
- Plant, D. R., Colarossi, F. E., Lynch, G. S. Notexin causes greater myotoxic damage and slower functional repair in mouse skeletal muscles than bupivacaine. Muscle & Nerve. 34 (5), 577-585 (2006).
- Tierney, M. T., Sacco, A. Inducing and Evaluating Skeletal Muscle Injury by Notexin and Barium Chloride. Methods in Molecular Biology. 1460, 53-60 (2016).
- Torres-Ruiz, J., Alcalá-Carmona, B., Alejandre-Aguilar, R., Gómez-Martín, D. Inflammatory myopathies and beyond: The dual role of neutrophils in muscle damage and regeneration. Frontiers in Immunology. 14, 1113214 (2023).
- Tu, H., Li, Y. L. Inflammation balance in skeletal muscle damage and repair. Frontiers in Immunology. 14, 1133355 (2023).
- Castro, C., Gourley, M. Diagnosis and treatment of inflammatory myopathy: issues and management. Therapeutic Advances in Musculoskeletal Disease. 4 (2), 111-120 (2012).
- Dabby, R., et al. Asymptomatic or minimally symptomatic hyperCKemia: histopathologic correlates. The Israel Medical Association Journal: IMAJ. 8 (2), 110-113 (2006).
- Khodabukus, A., et al. Tissue-Engineered Human Myobundle System as a Platform for Evaluation of Skeletal Muscle Injury Biomarkers. Toxicological Sciences. 176 (1), 124-136 (2020).
- Zhou, X. W., Jin, W. D., Zhu, L., Liu, X. H., Zhou, B. H. Experimental observation on the influence of different frequency, intensity and action time of Ding rolling manipulation on hemodynamics. Shanghai Journal of Traditional Chinese Medicine. (06), 42-44 (1998).
- Pablos, A., et al. Protective Effects of Foam Rolling against Inflammation and Notexin Induced Muscle Damage in Rats. International Journal of Medical Sciences. 17 (1), 71-81 (2017).
- Wisner, L., Larsen, B., Maguire, A. Enhancing Tumor Content through Tumor Macrodissection. Journal of Visualized Experiments: JoVE. (180), e62961 (2022).
- Deng, P., et al. Contusion concomitant with ischemia injury aggravates skeletal muscle necrosis and hinders muscle functional recovery. Experimental Biology and Medicine. 247 (17), 1577-1590 (2022).
- Dobek, G. L., Fulkerson, N. D., Nicholas, J., Schneider, B. S. Mouse model of muscle crush injury of the legs. Comparative Medicine. 63 (3), 227-232 (2013).
- Armstrong, D. M., et al. Sildenafil citrate protects skeletal muscle of ischemia-reperfusion injury: immunohistochemical study in rat model. Acta Cirúrgica Brasileira. 28 (4), 282-287 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon