Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Имитация метода Дина на мышечных повреждениях, индуцированных нотексином, у крыс
В этой статье
Резюме
Этот протокол описывает простое устройство, которое имитирует метод Дина, создает модель травмы скелетных мышц на крысах и использует окрашивание гематоксилин-эозином для наблюдения за патологией поврежденных тканей и иммуноферментный анализ для обнаружения изменений в маркерах повреждения сыворотки.
Аннотация
Метод ролла Дина является одной из наиболее часто используемых манипуляций в клиниках традиционного китайского массажа (Туйна) и одной из самых влиятельных современных манипуляций Туйна в Китае. Он основан на традиционном методе прокатки, обычно используемом в жанре однопальцевого дзен и названном методом ролла Дина. Благодаря своему противовоспалительному и стимулирующему кровообращение эффекту, роликовый метод Дина оказывает сильное терапевтическое воздействие на миопатию. Из-за большой площади силы, приложенной к человеческой коже, метод Дина трудно применить на экспериментальных животных с небольшими участками кожи, таких как крысы и кролики. Кроме того, сила Туины, применяемая к человеческому телу, отличается от силы, применяемой к экспериментальным животным, поэтому может случиться так, что сила будет слишком высокой или слишком низкой для достижения терапевтического эффекта Туины во время эксперимента. Этот эксперимент направлен на создание простого массажера, подходящего для крыс, на основе параметров манипуляций Дина (сила, частота, продолжительность Tuina). Устройство может стандартизировать манипуляции в экспериментах на животных и уменьшить вариации силы Туина, применяемой к разным животным из-за субъективных факторов. Была создана модель нотексин-индуцированного повреждения скелетных мышц на крысах, а маркеры плазменного повреждения креатинкиназы (КФК) и белка, связывающего жирные кислоты 3 (FABP3), были использованы для оценки терапевтического эффекта Туина при повреждении скелетных мышц. Результаты показали, что этот массажер Tuina может снизить уровни экспрессии CK и FABP3 и замедлить степень повреждения скелетных мышц. Таким образом, описанный здесь массажер Tuina, имитирующий метод Дина Дина, вносит свой вклад в стандартизацию манипуляций Tuina в экспериментальных исследованиях и является большим подспорьем для последующих исследований молекулярного механизма Tuina при миопатии.
Введение
Мышечные повреждения являются распространенными травматическими повреждениями в клинической и повседневной жизни, вызванными внешними ударами (ушибами) или хроническим перенапряжением мышечных волокон (растяжениями) и т.д., приводящими к мышечной дисфункции и боли, даже серьезно влияющим на качество жизни пациента1. Как можно более раннее начало реабилитации после острой травмы является ключом к сокращению времени возвращения к занятиям спортом2 и уменьшению боли 3,4. В современной западной медицине клиническая первая помощь при мышечных травмах следует принципам покоя, льда, сжатия и подъема (RICE) для остановки вредного кровотечения в мышечнуюткань 5 и нестероидных противовоспалительных препаратов для облегчения боли6. Открытие новых методов лечения, таких как экзосомы7 и тканевая инженерия8, стало потенциальными стратегиями лечения заболеваний скелетных мышц, компенсируя недостатки предыдущих фармакологических методов лечения. Однако это также может привести к увеличению стоимости лечения для пациентов, оказывая на них огромное финансовое давление9. Поэтому для лечения проблем опорно-двигательного аппарата рекомендуются альтернативные и дополнительные методы лечения10. Туйна широко используется клинически в Китае как традиционный медицинский метод и популярен среди пациентов благодаря своей эффективности и меньшему количеству побочных эффектов. Терапия Tuina при заболеваниях опорно-двигательного аппарата может облегчить боль и улучшить функцию11,12,13. Г-н Дин Цзифэн, известный шанхайский практик туйна, основал метод Дина14. Это уникальная техника прокатки и дробления с большой площадью силы, равномерным и щадящим усилием и интенсивным проникновением.
Различные модели животных основаны на разной этиологии. У них есть свои преимущества и недостатки, и выбор правильных и подходящих моделей животных имеет большое значение для базовых экспериментов, что помогает понять клеточные и молекулярные сигнальные пути регенерации и восстановления после травмы скелетных мышц для разработки новых методов лечения заболеваний скелетных мышц. Широко используются химически индуцированные модели мышечных повреждений, при этом инъекции скелетных мышц вызывают некроз миоволокон и создают регенерированные области, которые могут эффективно регенерироваться в течение 2недель15. Как нотексин, так и бупивакаин могут вызывать повреждение мышц. Тем не менее, нотексин может вызывать более серьезное миотоксическое повреждение скелетных мышц, чем бупивакаин, и естественное функциональное восстановление происходит относительно медленнее16. Внутримышечное литье препарата под давлением не только занимает меньше времени, но и имеет контролируемый эффект и степень повреждения скелетной мускулатуры. Этот количественный контроль делает успешное формование менее сложным15,17.
Воспалительная реакция является важной биологической реакцией, которая была широко изучена в контексте миопатии18,19. На ранних стадиях повреждения скелетных мышц некроз миоволокна нарушает локальный гомеостаз мышц, и многие воспалительные клетки проникают в место повреждения, секретируя множество провоспалительных цитокинов19. Креатинкиназа (КФК) является традиционным сывороточным биомаркером для оценки повреждений скелетных мышц. Однако ему не хватает тканевой специфичности20 и чувствительности21, что ограничивает его способность оценивать степень вызванного лекарственными препаратами повреждения мышц и косвенно сообщать о степени восстановления мышц после травмы. Новые биомаркеры, в том числе белок, связывающий жирные кислоты 3 (FABP3), недавно показали относительно высокую тканевую специфичность и чувствительность в моделях повреждений скелетных мышц у грызунов. FABP3 представляет собой семейство связывающих белков, экспрессируемых в основном в клетках сердца и скелетных мышц и участвующих в метаболизме жирных кислот, транспорте и передаче сигналов22. Поэтому мы выбрали комбинацию двух биомаркеров, CK и FABP3, для оценки степени индуцированного нотексином повреждения скелетных мышц и восстановления после лечения.
У грызунов мышцы неглубокие, а площадь кожи небольшая, что также обуславливает то, что различные параметры массажа у грызунов не будут такими же, как у людей, например, в анималотерапии, массажист должен обрабатывать их с меньшей силой, используя метод валика Дина, и может не способствовать работе этой техники из-за небольшого размера травмированного участка, что в конечном итоге может привести к снижению эффективности массажа. Таким образом, в эксперименте использовался роликовый массажер собственного производства, который соответствует характеристикам валкового метода Дина, чтобы вмешаться и оценить терапевтический эффект модели травмы скелетных мышц, индуцированной нотексином, у крыс, что помогает стандартизировать параметры Tuina в экспериментальных исследованиях на животных с целью глубокого изучения молекулярного механизма действия Tuina. метод лечения заболеваний опорно-двигательного аппарата традиционной китайской медицины.
протокол
Процедуры с участием животных были одобрены Комитетом по уходу и использованию в учреждениях Хунаньского университета китайской медицины.
1. Сборка роликового массажера
- Выберите массажер, состоящий из резинового валика, держателя вилки, пружины, ограничительной перегородки, регулировочной шины, винта и акриловой ручки (рисунок 1). Убедитесь, что резиновый валик имеет длину 3 см и диаметр 1,6 см, пружина — 3 см в длину и 0,9 см в диаметре, предельная перегородка — 3 см в длину и 2 см в ширину, а ручка — 12 см в длину и 0,9 см в диаметре.
- Контроль силы: Согласно литературным результатам23, было обнаружено, что метод Дина с перекатом вниз составляет около 10% от массы тела, поэтому давление, приложенное при проектировании перекатывания вперед, составляет около 10% от массы тела крысы (0,2-0,3 Н). Убедитесь, что максимальное давление массажера на весовом контроллере составляет около 0,3 Н, отрегулировав угол наклона ограничительной перегородки. Это требование к давлению отвечает потребностям крысы.
- Убедитесь, что минимальное давление составляет около 0,08 Н при откате назад (рисунок 2). Убедитесь, что давление точно соответствует требованию метода валков Дина, согласно которому соотношение прямых и обратных сил составляет 3:1.
- Перед процедурой попросите оператора поработать с программным обеспечением метронома, чтобы контролировать частоту вращения до 140 оборотов в минуту, и попрактиковаться в этом более 3 раз в предварительном эксперименте, чтобы убедиться, что операция стандартизирована.
2. Создание крысиной модели повреждения скелетной мускулатуры
- Случайным образом разделите 24 крыс-самца Спрэга-Доули (весом 200-250 г) на три группы по восемь крыс в каждой, включая контрольную (С), нотексин (NTX) и нотексин с Туиной (NTX + Tuina), и кормите их стандартной диетой. Выдерживать в цикле 12 часов света / 12 часов темноты в доме при температуре 20-25 °C и влажности 50%-70%.
- Обезболить 1% пентобарбиталом натрия (40 мг/кг) путем внутрибрюшинной инъекции, а затем удалить волосы с правой нижней конечности с помощью крема для эпиляции. После удаления меха протрите остатки крема с помощью физраствора. Подтвердите адекватную анестезию реакцией щипкового зажима пальца ноги. Наносите офтальмологическую мазь для увлажнения глаз, пока животное находится под наркозом. Обеспечьте тепловую поддержку на протяжении всей процедуры.
- Чередуйте дезинфекцию кожи правой нижней конечности дезинфицирующим раствором йодофора и 75% спиртом перед инъекцией. Приложите ватный тампон, смоченный в дезинфицирующем растворе йодофора, к центру кожи нижней конечности и приложите круговыми движениями наружу. Повторите то же самое с ватным тампоном, смоченным в этаноле.
- Создание моделей травм скелетных мышц в соответствии со ссылочным методом24. Вводите нотексин только в одну ногу (чтобы предотвратить двойную инъекцию нотексина). Наберите 200 мкл раствора нотексина (10 мкг/мл раствора нотексина, приготовленного путем добавления 100 мкг нотексина к 10 мл физиологического раствора в центрифужной пробирке объемом 15 мл) в шприц объемом 1 мл с иглой 30 г и введите раствор нотексина внутримышечно в икроножную мышцу до повреждения мышцы.
- Медленно вводите нотексин и подождите 3 с, прежде чем вытащить иглу (для полной инъекции).
ВНИМАНИЕ: Нотексин является токсичным химическим веществом, которое требует немедленного промывания большим количеством воды при контакте с открытой раной и немедленной медицинской помощи в случае необходимости. - Крысам контрольной группы вводят 200 мкл физиологического раствора. Переместите крыс под наркозом в пустые клетки с чистой подстилкой. Позаботьтесь о том, чтобы удалить прокладку вокруг носа и рта крыс, чтобы их дыхание было чистым. Визуально наблюдайте за цветом тканей и частотой дыхания в конце инъекции до тех пор, пока крысы не придут в сознание.
- Верните крыс в домашнюю клетку и, как правило, выращивайте их в течение 24 часов.
3. Туинатерапия
- Поместите крысу SD в положение лежа с головой, покрытой черной тканью, на экспериментальной платформе, продезинфицированной 75% спиртом, чтобы обнажить икроножную мышцу. Не накрывайте слишком плотно.
- Использование массажера Tuina для группы NTX+Tuina: Удерживая массажер, поместите валик на икроножную мышцу крысы и катите вперед до тех пор, пока пружина не коснется предельной перегородки. Затем втяните усилие и вернитесь в исходное положение, тем самым совершая возвратно-поступательное движение (рисунок 3).
- Вращайте массажер со скоростью 140 роликов в минуту, и выполняйте каждую операцию в течение 3 мин. Выполняйте массаж один раз утром и один раз днем в течение 3 дней подряд.
- Возвращайте крыс в домашнюю клетку после каждой обработки и голодайте в течение 8 часов после последней обработки.
4. Забор крови и тканей у крыс после эксперимента
- В соответствии с требованиями соответствующего комитета по этике экспериментов на животных, крыс обезболивают внутрибрюшинным введением 1% пентобарбитала натрия (40 мг/кг, внутрибрюшинная инъекция). Подтвердите адекватную анестезию реакцией щипкового зажима пальца ноги. Эвтаназия крыс путем кровопускания брюшной аорты после забора крови.
- Перед инъекцией чередуйте дезинфекцию кожи дезинфицирующим раствором йодофора и 75% спиртом. Прикоснитесь ватным тампоном, смоченным в повидон-йоде, к центру кожи живота и приложите круговыми движениями наружу. Повторите то же самое с ватным тампоном, смоченным в этаноле. Повторите дезинфекцию 3 раза.
- Попросите ассистента использовать два гемостата, чтобы приподнять кожу в середине живота. В качестве оператора используйте скальпель, чтобы разрезать кожу живота и мышцы от рафа до лобкового симфиза.
- После вскрытия брюшной полости отделите кишечник стерильными ватными шариками, чтобы обнажить брюшную аорту в задней брюшной стенке.
- Найдите брюшную аорту, возьмите 5 мл крысиной крови в пробирки для забора крови и получите плазму в 1,5 микропробирки путем центрифугирования при 3000 x g в течение 10 мин после стояния крови в течение 1 ч. Храните плазму при температуре -80 °C.
- Хирургическими ножницами разрезать кожу вдоль нижнего брюшного отверстия по направлению к латеральной стороне правой нижней конечности, обнажив мышцы нижних конечностей, и, осторожно отделив фасцию щипцами, разрезать скальпелем, чтобы удалить неповрежденную икроножную мышцу.
- Промойте икроножную мышцу в стерильном физиологическом растворе, чтобы удалить прилипшие волосы и кровь.
- Поместите удаленную икроножную мышцу в центрифужную пробирку объемом 15 мл, содержащую 4% параформальдегида.
5. Определение уровней КФК и FABP 3 в плазме крови методом ИФА
- Рассчитайте и определите количество предварительно обернутых пластин, необходимое для одного эксперимента. Снимите необходимые пластины, поместите их в раму на 96 лунок, поместите оставшиеся микропланшеты обратно в пакет из алюминиевой фольги для запечатывания и храните их при температуре 4 °C.
- Уравновешивают наборы и образцы при комнатной температуре (25-28 °C) в течение 120 мин, полностью уравновешивают до комнатной температуры.
ПРИМЕЧАНИЕ: Уравновешивание комплекта и образца имеет решающее значение и должно быть уравновешено в течение достаточного времени. - Установка стандартных, пробных и пустых лунок. Добавьте 50 мкл стандарта CK или FABP3 в различных концентрациях (100, 50, 25, 12,5, 6,25, 0 нг/мл) в стандартные лунки. Повторите каждый стандарт по одному разу, заняв в общей сложности 12 лунок.
- Лунки для образцов заполняют 40 мкл разбавителя образца (0,8 г NaCl, 0,02 г KH 2 PO 4, 0,29 г Na 2 HPO 412H2O, 0,02 г KCl, 0,01 г NaN3 в 100 мл воды двойной дистиллированной воды, pH 7,4), а затем 10 мкл испытуемого образца. Повторите каждую пробу один раз, заняв в общей сложности 48 лунок.
- За исключением пустых лунок, расположенных на две лунки позади последней лунки для образца, добавьте 100 мкл меченного HRP античеловеческого антитела к КФК или FABP3 (антитела, меченного ферментом) в каждую стандартную лунку и лунку для отбора проб.
- Загерметизируйте лунки герметизирующей пленкой и инкубируйте на водяной бане с температурой 37 °C или термостате в течение 60 минут.
- Слейте жидкость, промокните насухо на впитывающей бумаге, наполните каждую лунку промывочной жидкостью, оставьте на 20 с, стряхните моющую жидкость, промокните насухо промокательной бумагой и повторите мытье пластины 5 раз (или используйте шайбу для тарелок).
- Добавьте в каждую лунку 50 мкл раствора хромогена А (20 мг тетраметилбензидина, 10 мл этанола в 100 мл воды двойной дистилляции) и 50 мкл раствора хромогена В (0,1 М/л лимонной кислоты, 0,2 М/л буфера дигидрофосфата натрия, рН 5,0-5,4). Хранить вдали от света в течение 15 минут при температуре 37 °C.
- Для стандартных лунок, лунок для отбора проб и пустых лунок добавьте 50 мкл раствора для заделки в каждую лунку и измерьте значение оптической плотности каждой лунки при длине волны 450 нм в течение 15 минут.
6. Гистологический анализ нотексин-индуцированного повреждения икроножной мышцы у крыс
- Подготовьте парафиновые срезы толщиной 5 мкм, окрашенные гематоксилином и эозином, для легкого микроскопического исследования, как описано в25.
7. Обработка изображений и анализ данных
- Считывание и анализ изображений, полученных системой визуализации, с помощью аналитического программного обеспечения. Переместите выбранное поле зрения изображения в центр экрана с помощью мыши, щелкните 40x, а затем нажмите кнопку Сделать снимок.
- Запишите значения OD из ИФА в электронную таблицу и рассчитайте уровни CK и FABP3 крыс в образцах, используя стандартную кривую.
- Используйте программное обеспечение для статистического анализа для статистического анализа. Выразите измерения в виде среднего ± стандартного отклонения (
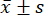 ) и проанализируйте сравнения между группами с помощью одностороннего метода ANOVA, с помощью теста LSD, когда дисперсия была однородной, и метода Tamhane T2, когда дисперсия была неоднородной. Разница считалась статистически значимой при p-значении менее 0,05.
) и проанализируйте сравнения между группами с помощью одностороннего метода ANOVA, с помощью теста LSD, когда дисперсия была однородной, и метода Tamhane T2, когда дисперсия была неоднородной. Разница считалась статистически значимой при p-значении менее 0,05.
Результаты
С целью наблюдения за морфологическими свойствами скелетной мускулатуры крыс после травмы икроножную мышцу окрашивали гематоксилином и эозином, а окрашенные изображения считывали с помощью аналитического программного обеспечения, как описано в протоколе для 8 крыс в группе. У крыс с ...
Обсуждение
В данной работе мы описали протокол лечения травмы скелетных мышц у крыс по методу Tuina, а затем проанализировали степень повреждения скелетных мышц после лечения, чтобы убедиться в эффективности метода. Примечательно, что модели повреждений скелетных мышц крыс, включая, помимо прочего,...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Исследование выполнено при поддержке грантов Национального фонда естественных наук Китая (грант No 82174521), Инновационный проект для аспирантов Хунаньского университета китайской медицины (2022CX109)
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | JIANGXI FENGLIN | 20220521 | |
| 1.5 microtubes | Servicebio | EP-150X-J | |
| 15 mL centrifuge tube | Servicebio | EP-1501-J | |
| 30G needle | CONPUVON | 220318 | |
| 5 mL blood collection tube | Servicebio | QX0023 | |
| Acrylic handle | Guangdong Guangxingwang Plastic Materials Co., Ltd | 65643645 | |
| Adjustment splint | CREROMEM | 20220729 | |
| Cotton Swab | INOHV | 22080215 | |
| Enzyme-labeled Instrument | Rayto | RT-6100 | |
| Ethanol | INOHV | 211106 | |
| Fork holder | Yongkang Kangzhe Health Technology Co., Ltd | JL001 | |
| Hair removal cream | Veet, France | LOTC190922002 | |
| Hematoxylin dyeing solution set | Wuhan Google Biotech | G1005 | |
| Imaging system | Nikon, Japan | Nikon DS-U3 | |
| IODOPHOR disfecting solution | Hale&Hearty | 20221205 | |
| Light microscope | Nikon, Japan | Nikon Eclipse E100 | |
| Limit baffle | CREROMEM | 20220724 | |
| Notexin | Latoxan S.A.S. | L8104-100UG | |
| Pentobarbital sodium | Merck KGaA | P3761 | |
| Rat creatine kinase (CK) ELISA kit | LunChangShuoBiotech | YD-35237 | |
| Rat fatty acid-binding protein 3 (FABP3) ELISA kit | LunChangShuoBiotech | YD-35730 | |
| Rubber roller | Hebei Mgkui Chemical Technology Co.,Ltd | 202207 | |
| Screw | Weiyan Hardware | B05Z122 | |
| Sprague Dawley rats | Hunan Slake Kingda Laboratory Animal Co. | SYXK2019-0009 | |
| Spring | Bingzhang Hardware | TH001 | |
| Surgical blade | Covetrus | #23 | |
| Weigh controller | Iyoys | HY-XSQ |
Ссылки
- Lempainen, L., et al. Management of anterior thigh injuries in soccer players: practical guide. BMC Sports Science, Medicine and Rehabilitation. 14 (1), 41 (2022).
- Bayer, M. L., Mackey, A., Magnusson, S. P., Krogsgaard, M. R., Kjær, M. Treatment of acute muscle injuries (in Danish). Ugeskrift for Laeger. 181 (8), V11180753 (2019).
- Serner, A., et al. Progression of Strength, Flexibility, and Palpation Pain During Rehabilitation of Athletes with Acute Adductor Injuries: A Prospective Cohort Study. The Journal of Orthopaedic and Sports Physical Therapy. 51 (3), 126-134 (2021).
- Gozubuyuk, O. B., Koksal, C., Tasdemir, E. N. Rehabilitation of a patient with bilateral rectus abdominis full thickness tear sustained in recreational strength training: a case report. Physiotherapy Theory and Practice. 38 (13), 3216-3225 (2022).
- Hotfiel, T., et al. Current Conservative Treatment and Management Strategies of Skeletal Muscle Injuries. Zeitschrift für Orthopädie und Unfallchirurgie. 154 (3), 245-253 (2016).
- de Sire, A., et al. Pharmacological Treatment for Acute Traumatic Musculoskeletal Pain in Athletes. Medicina. 57 (11), 1208 (2021).
- Connor, D. E., et al. Therapeutic potential of exosomes in rotator cuff tendon healing. Journal of Bone and Mineral Metabolism. 37 (5), 759-767 (2019).
- Martins, A. L. L., Giorno, L. P., Santos, A. R. Tissue Engineering Applied to Skeletal Muscle: Strategies and Perspectives. Bioengineering. 9 (12), 744 (2022).
- Horgan, D., et al. Clouds across the new dawn for clinical, diagnostic and biological data: accelerating the development, delivery and uptake of personalized medicine. Diagnosis. , (2023).
- Urits, I., et al. A Comprehensive Review of Alternative Therapies for the Management of Chronic Pain Patients: Acupuncture, Tai Chi, Osteopathic Manipulative Medicine, and Chiropractic Care. Advances in Therapy. 38 (1), 76-89 (2021).
- Lee, N. W., et al. Chuna (or Tuina) Manual Therapy for Musculoskeletal Disorders: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Evidence-based Complementary and Alternative Medicine: eCAM. 2017, 8218139 (2017).
- Xie, J., Deng, D. X., Chen, Y., Peng, L. Progress in the intervention of massage techniques on skeletal muscle injury. Hunan Journal of Traditional Chinese Medicine. 34 (04), 199-201 (2018).
- Yuan, Y., Zhang, H., Zhang, G. H., Xue, X. N. Research progress on microstructure changes and rehabilitation treatment of exercise-induced skeletal muscle injury. Massage and Rehabilitation Medicine. 14 (6), 29-33 (2023).
- Zhao, Y. The Establishment of Famous Tuina Master Ding Jifeng and Wei Fa - Commemorating the 100th Anniversary of Mr. Ding Jifeng's Birthday. Traditional Chinese Medicine Culture. 9 (6), 18-21 (2014).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PloS one. 11 (1), e0147198 (2016).
- Plant, D. R., Colarossi, F. E., Lynch, G. S. Notexin causes greater myotoxic damage and slower functional repair in mouse skeletal muscles than bupivacaine. Muscle & Nerve. 34 (5), 577-585 (2006).
- Tierney, M. T., Sacco, A. Inducing and Evaluating Skeletal Muscle Injury by Notexin and Barium Chloride. Methods in Molecular Biology. 1460, 53-60 (2016).
- Torres-Ruiz, J., Alcalá-Carmona, B., Alejandre-Aguilar, R., Gómez-Martín, D. Inflammatory myopathies and beyond: The dual role of neutrophils in muscle damage and regeneration. Frontiers in Immunology. 14, 1113214 (2023).
- Tu, H., Li, Y. L. Inflammation balance in skeletal muscle damage and repair. Frontiers in Immunology. 14, 1133355 (2023).
- Castro, C., Gourley, M. Diagnosis and treatment of inflammatory myopathy: issues and management. Therapeutic Advances in Musculoskeletal Disease. 4 (2), 111-120 (2012).
- Dabby, R., et al. Asymptomatic or minimally symptomatic hyperCKemia: histopathologic correlates. The Israel Medical Association Journal: IMAJ. 8 (2), 110-113 (2006).
- Khodabukus, A., et al. Tissue-Engineered Human Myobundle System as a Platform for Evaluation of Skeletal Muscle Injury Biomarkers. Toxicological Sciences. 176 (1), 124-136 (2020).
- Zhou, X. W., Jin, W. D., Zhu, L., Liu, X. H., Zhou, B. H. Experimental observation on the influence of different frequency, intensity and action time of Ding rolling manipulation on hemodynamics. Shanghai Journal of Traditional Chinese Medicine. (06), 42-44 (1998).
- Pablos, A., et al. Protective Effects of Foam Rolling against Inflammation and Notexin Induced Muscle Damage in Rats. International Journal of Medical Sciences. 17 (1), 71-81 (2017).
- Wisner, L., Larsen, B., Maguire, A. Enhancing Tumor Content through Tumor Macrodissection. Journal of Visualized Experiments: JoVE. (180), e62961 (2022).
- Deng, P., et al. Contusion concomitant with ischemia injury aggravates skeletal muscle necrosis and hinders muscle functional recovery. Experimental Biology and Medicine. 247 (17), 1577-1590 (2022).
- Dobek, G. L., Fulkerson, N. D., Nicholas, J., Schneider, B. S. Mouse model of muscle crush injury of the legs. Comparative Medicine. 63 (3), 227-232 (2013).
- Armstrong, D. M., et al. Sildenafil citrate protects skeletal muscle of ischemia-reperfusion injury: immunohistochemical study in rat model. Acta Cirúrgica Brasileira. 28 (4), 282-287 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены