JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐의 Notexin-Induced Muscle Injury에 대한 Ding의 롤 방법 모방
요약
이 프로토콜은 Ding의 롤 방법을 모방하고, 골격근 손상의 쥐 모델을 설정하고, 헤마톡실린-에오신 염색을 사용하여 손상된 조직의 병리를 관찰하고 효소 결합 면역 흡착 분석을 사용하여 혈청 손상 마커의 변화를 감지하는 간단한 장치를 설명합니다.
초록
Ding의 롤 방법은 중국 전통 마사지(Tuina) 클리닉에서 가장 일반적으로 사용되는 조작 중 하나이며 중국에서 가장 영향력 있는 현대 Tuina 조작 중 하나입니다. 그것은 한 손가락 선 장르에서 일반적으로 사용되는 전통적인 롤링 방법을 기반으로 하며 Ding의 롤 방법이라고 명명되었습니다. 항염증 및 혈액 순환 촉진 효과로 인해 Ding의 롤링 방법은 근육병증에 대한 건전한 치료 효과가 있습니다. 인간의 피부에 가해지는 힘의 영역이 넓기 때문에 Ding의 롤 방법은 쥐와 토끼와 같이 피부 면적이 작은 실험 동물에게 수행하기가 어렵습니다. 또한, 인체에 가해지는 투이나의 강도는 실험동물에게 가해지는 강도와 다르기 때문에 실험 중 투이나의 치료 효과를 얻기에는 강도가 너무 높거나 낮을 수 있습니다. 이 실험은 Ding의 롤링 조작 매개변수(강도, 빈도, Tuina 지속 시간)를 기반으로 쥐에게 적합한 간단한 마사지기를 만드는 것을 목표로 합니다. 이 장치는 동물 실험에서 조작을 표준화하고 주관적인 요인으로 인해 다른 동물에 적용되는 Tuina 힘의 변화를 줄일 수 있습니다. 노텍신에 의한 골격근 손상의 쥐 모델을 확립하고, 혈장 손상 마커인 크레아틴 키나아제(CK) 및 지방산 결합 단백질 3(FABP3)를 사용하여 골격근 손상에 대한 투이나의 치료 효과를 평가했습니다. 결과는 이 Tuina 마사지기가 CK 및 FABP3 발현 수준을 줄이고 골격근 손상 정도를 늦출 수 있음을 보여주었습니다. 따라서 여기에 설명된 Ding의 롤 방법을 모방한 Tuina 마사지기는 실험 연구에서 Tuina 조작을 표준화하는 데 기여하고 근육병증에 대한 Tuina의 분자 메커니즘에 대한 후속 연구에 큰 도움이 됩니다.
서문
근육 손상은 임상 및 일상 생활에서 흔히 발생하는 외상성 부상으로, 외부 타격(타박상) 또는 근섬유의 만성적인 과긴장(긴장) 등으로 인해 근육 기능 장애와 통증을 유발하고 환자의 삶의 질에 심각한 영향을 미치기도 합니다1. 급성 긴장 장애 후 가능한 한 빨리 재활을 시작하는 것이 스포츠 복귀 시간을 단축하는 열쇠입니다2 통증을 줄이는 열쇠 3,4. 현대 서양 의학에서 근육 손상에 대한 임상적 응급처치는 근육 조직으로의 유해한 출혈을 막기 위해 휴식, 얼음찜질, 압박 및 상승(RICE)의 원칙을 따르며5 통증을 완화하기 위해 비스테로이드성 항염증제6를 사용한다. 엑소좀(exosome)7 및 조직공학(tissue engineering)8과 같은 새로운 치료법의 발견은 골격근 질환에 대한 잠재적인 치료 전략이 되었으며, 기존 약리학적 치료법의 단점을 보완했습니다. 그러나 이는 환자의 치료 비용을 증가시켜 엄청난 재정적 압박을 가할 수 있다9. 따라서 근골격계 질환을 치료하기 위해 대체 및 보완 요법이 권장된다10. Tuina는 중국에서 전통 의학 방법으로 임상적으로 널리 사용되며 효능과 부작용이 적어 환자들 사이에서 인기가 있습니다. 근골격계 질환에 대한 투이나 요법은 통증을 완화하고 기능을 향상시킬 수 있다11,12,13. 상하이 투이나(Tuina)의 유명한 수련자인 딩지펑(Ding Jifeng) 씨는 딩의 롤 방법14를 창시했습니다. 넓은 힘 면적, 균일하고 부드러운 힘, 강렬한 침투력을 가진 독특한 압연 및 분쇄 기술입니다.
다른 동물 모델은 다른 병인을 기반으로합니다. 장점과 단점이 있으며, 정확하고 적절한 동물 모델을 선택하는 것은 골격근 손상 후 재생 및 복구의 세포 및 분자 신호 전달 경로를 이해하여 골격근 질환 치료를 위한 새로운 치료법을 개발하는 데 도움이 되는 기본 실험에 매우 중요합니다. 근육 손상의 화학적 유도 모델이 널리 사용되며, 골격근 주사는 근섬유 괴사를 유발하고 2주 이내에 효과적으로 재생될 수 있는 재생 부위를 생성한다15. 노텍신과 부피바카인은 모두 근육 손상을 일으킬 수 있습니다. 그러나 노텍신은 부피바카인보다 골격근에 더 심각한 근독성 손상을 일으킬 수 있으며, 자연적인 기능 회복은 상대적으로 느리다16. 약물 근육 사출 성형은 시간이 덜 걸릴 뿐만 아니라 골격근 손상의 효과와 정도를 제어합니다. 이 정량화 가능한 제어는 성공적인 성형을 덜 어렵게 만듭니다15,17.
염증 반응은 근병증의 맥락에서 광범위하게 연구된 필수적인 생물학적 반응이다18,19. 골격근 손상의 초기 단계에서 근섬유 괴사는 국소 근육 항상성을 방해하고 많은 염증 세포가 손상 부위에 침투하여 많은 전염증성 사이토카인을 분비한다19. 크레아틴 키나아제(CK)는 골격근 손상을 평가하기 위한 전통적인 혈청 바이오마커입니다. 그러나 조직 특이성(tissue specificity)20 및 민감도(sensitivity)21가 부족하여 약물에 의한 근육 손상의 정도를 평가하고 부상 후 근육 회복 정도를 간접적으로 보고하는 능력이 제한된다. 지방산 결합 단백질 3(FABP3)를 포함한 새로운 바이오마커는 최근 골격근 손상의 설치류 모델에서 상대적으로 높은 조직 특이성과 민감도를 보여주었습니다. FABP3는 주로 심장 및 골격근 세포에서 발현되는 결합 단백질군이며 지방산 대사, 수송 및 신호 전달에 관여합니다22. 따라서 노텍신으로 인한 골격근 손상 및 치료 후 회복 정도를 평가하기 위해 CK와 FABP3의 두 가지 바이오마커 조합을 선택했습니다.
설치류의 경우 근육이 얕고 피부 면적이 작기 때문에 설치류의 다양한 마사지 매개 변수가 동물 치료와 같이 인간과 동일하지 않을 것으로 판단되며, 마사지 치료사는 Ding의 롤 방법을 사용하여 적은 힘으로 치료해야하며 부상 부위의 크기가 작기 때문에이 기술의 작동에 도움이되지 않을 수 있습니다. 이는 궁극적으로 마사지의 효과를 감소시킬 수 있습니다. 따라서 실험은 Ding의 롤링 방법의 특성에 부합하는 자체 제작 롤링 마사지기를 활용하여 쥐에서 노텍신 유도 골격근 손상 모델의 치료 효과를 개입하고 평가하여 실험 동물 연구에서 Tuina의 매개 변수를 표준화하여 Tuina의 분자 작용 메커니즘을 심층적으로 조사하고, 근골격계 질환에 대한 한의학 치료 방법.
프로토콜
동물과 관련된 시술은 Hunan University of Chinese Medicine의 Institutional Care and Use Committee의 승인을 받았습니다.
1. 롤링 마사지기 조립
- 고무 롤러, 포크 홀더, 스프링, 리미트 배플, 조정 부목, 나사 및 아크릴 손잡이로 구성된 마사지기를 선택합니다(그림 1). 고무 롤러의 길이는 3cm, 직경은 1.6cm, 스프링은 길이 3cm, 직경은 0.9cm, 한계 배플은 길이 3cm, 너비는 2cm, 핸들은 길이 12cm, 직경 0.9cm인지 확인합니다.
- 힘 제어: 문헌 결과23에 따르면, 딩의 롤 방식 하향 압력은 체중의 약 10%인 것으로 밝혀졌으므로 전방 롤링 설계 시 가해지는 압력은 쥐 체중의 약 10%(0.2-0.3N)입니다. 한계 배플의 각도를 조정하여 계량 컨트롤러에서 마사지기의 최대 압력이 약 0.3N이 되도록 테스트합니다. 이 압력 요구 사항은 쥐의 요구를 충족시킵니다.
- 롤백할 때 최소 압력이 약 0.08N인지 확인합니다(그림 2). 압력이 전진력과 후진력의 비율이 3:1이라는 Ding의 롤 방식의 요구 사항을 정확하게 준수하는지 확인하십시오.
- 치료하기 전에 작업자에게 메트로놈 소프트웨어로 작업하여 롤링 주파수를 140롤/분으로 제어하고 사전 실험에서 이를 3회 이상 연습하여 작업이 표준화되었는지 확인하도록 요청합니다.
2. 골격근 손상의 쥐 모델 확립
- 24마리의 수컷 Sprague-Dawley 쥐(체중 200-250g)를 대조군(C), 노텍신(NTX), 노텍신과 투이나(NTX + Tuina)를 포함하여 각각 8마리의 쥐로 구성된 세 그룹으로 무작위로 나누고 표준 식단을 먹습니다. 12시간 조명/12시간 어둡게 유지하고 20-25°C 및 50%-70% 습도에서 보관하십시오.
- 복강내 주사로 펜토바르비탈나트륨 1%(40mg/kg)를 마취한 후 제모크림으로 우측 하지의 털을 제거한다. 털을 제거한 후 남은 크림을 식염수로 닦아냅니다. 발가락 꼬집기 반응으로 적절한 마취를 확인합니다. 동물이 마취 중인 동안 눈에 수분을 공급하기 위해 안과 연고를 바르십시오. 절차 전반에 걸쳐 열 지원을 제공합니다.
- 주사하기 전에 요오드포 소독액과 75% 알코올로 오른쪽 하지의 피부 소독을 번갈아 가며 합니다. 요오드포 소독액을 적신 면봉을 하지 피부 중앙에 대고 바깥쪽으로 원을 그리며 바릅니다. 에탄올을 적신 면봉으로 반복합니다.
- 참조 방법24에 따라 골격근 손상 모델을 설정합니다. 한쪽 다리에만 노텍신을 주사합니다(이중 노텍신 주입을 방지하기 위해). 노텍신 용액 200μL(15mL 원심분리 튜브에 생리식염수 10mL에 노텍신 100μg을 첨가하여 제조한 노텍신 용액 10μg/mL)를 30G 바늘로 1mL 주사기에 넣고 노텍신 용액을 비복근에 근육 주사하여 근육 손상을 일으킵니다.
- 노텍신을 천천히 주입하고 바늘을 빼내기 전에 3초 동안 기다립니다(완전히 주입됨).
주의 : Notexin은 열린 상처에 닿으면 즉시 다량의 물로 씻어내고 필요한 경우 즉시 의사의 조치를 취해야 하는 독성 화학 물질입니다. - 대조군의 쥐에게 200μL의 식염수를 주입합니다. 마취된 쥐를 깨끗한 침구가 있는 빈 우리로 옮깁니다. 쥐의 호흡을 맑게 유지하기 위해 쥐의 코와 입 주위의 패딩을 제거하도록 주의하십시오. 쥐가 충분한 의식을 회복할 때까지 주사가 끝날 때 조직 색상과 호흡수를 육안으로 관찰합니다.
- 쥐를 집 우리로 돌려보내고 일반적으로 24시간 동안 기르십시오.
3. 투이나 테라피
- 75% 알코올로 소독한 실험대에 검은색 천으로 머리를 덮고 엎드린 자세를 취한 SD 쥐를 놓아 비복근을 노출시킵니다. 너무 꽉 덮지 마십시오.
- NTX+Tuina 그룹용 Tuina 마사지기 사용: 마사지기를 잡고 롤러를 쥐의 비복근에 놓고 스프링이 한계 배플에 닿을 때까지 앞으로 굴립니다. 그런 다음 힘을 후퇴시키고 원래 위치로 돌아가 왕복 운동을 합니다(그림 3).
- 분당 140롤의 속도로 마사지기를 굴리고 각 작업을 3분 동안 수행합니다. 3일 연속으로 아침에 한 번, 오후에 한 번 마사지를 합니다.
- 각 처리 후 쥐를 홈 케이지로 되돌리고 마지막 처리 후 8시간 동안 금식합니다.
4. 실험 후 쥐의 혈액 및 조직 채취
- 관련 동물실험윤리위원회의 요구사항에 따라 1% 펜토바르비탈나트륨(40mg/kg, 복강내 주사)을 복강내 주사하여 쥐를 마취한다. 발가락 꼬집기 반응으로 적절한 마취를 확인합니다. 채혈 후 복부 대동맥 사혈로 쥐를 안락사시킨다.
- 주사하기 전에 요오드포 소독액과 75% 알코올로 피부 소독을 번갈아 가며 합니다. 포비돈 요오드를 적신 면봉을 복부 피부 중앙에 대고 바깥쪽으로 원을 그리며 바릅니다. 에탄올을 적신 면봉으로 반복합니다. 소독을 3회 반복합니다.
- 조수에게 두 개의 지혈제를 사용하여 복부 중앙의 피부를 들어 올리도록 요청합니다. 시술자로서 메스를 사용하여 복부 피부와 근육을 라페에서 치골 대칭까지 절단합니다.
- 복강을 연 후 멸균 면봉으로 장을 분리하여 후복벽의 복부 대동맥을 노출시킵니다.
- 복부 대동맥을 찾아 쥐 혈액 5mL를 채혈 튜브에 넣고 1시간 동안 혈액을 방치한 후 3000 x g 에서 10분 동안 원심분리하여 혈장을 1.5마이크로튜브로 얻습니다. 플라즈마는 -80 °C에서 보관합니다.
- 수술용 가위로 하복부 개구부를 따라 오른쪽 하지의 측면으로 피부를 절개하여 하지 근육을 노출시키고 집게로 근막을 조심스럽게 분리한 후 메스를 잘라 멀쩡한 비복근을 제거합니다.
- 비복근을 멸균 식염수로 씻어 달라붙은 모발과 피를 제거합니다.
- 제거한 비복근을 4% 파라포름알데히드가 함유된 15mL 원심분리 튜브에 넣습니다.
5. ELISA에 의한 혈장 CK 및 FABP 3 수준 검출
- 한 번의 실험에 필요한 사전 포장된 플레이트의 수를 계산하고 결정합니다. 필요한 플레이트를 제거하고 96웰 프레임에 넣고 나머지 마이크로플레이트를 알루미늄 호일 백에 다시 넣어 밀봉하고 4°C에서 보관합니다.
- 키트와 샘플을 실온(25-28°C)에서 120분 동안 평형을 이루고 실온과 완전히 평형을 이룹니다.
알림: 키트와 s의 평형ample는 매우 중요하며 충분한 시간 동안 평형을 유지해야 합니다. - 표준웰, 표본 및 블랭크 웰을 설정합니다. 표준 웰에 다양한 농도(100, 50, 25, 12.5, 6.25, 0ng/mL)의 CK 또는 FABP3 표준물질 50μL를 추가합니다. 각 표준을 한 번씩 반복하여 총 12개의 웰을 차지합니다.
- 샘플 웰에 40 μL의 샘플 희석액(0.8 g NaCl, 0.02 g KH 2 PO 4, 0.29 g Na 2 HPO 4 12H2O,0.02 g KCl, 0.01 g NaN3중 이중 증류수 100 mL, pH 7.4)을 채운 다음 테스트할 샘플 10 μL를 채웁니다. 각 샘플을 한 번씩 반복하여 총 48개의 웰을 차지합니다.
- 마지막 샘플 웰 뒤에 있는 두 개의 웰에 있는 블랭크 웰을 제외하고, 100μL의 HRP 표지 항인간 CK 또는 FABP3 항체(효소 표지 항체)를 각 표준물질 및 샘플 웰에 추가합니다.
- 밀봉 필름으로 웰을 밀봉하고 37°C 수조 또는 온도 조절기에서 60분 동안 배양합니다.
- 액체를 버리고 흡수성 종이에 두드려 말리고 각 웰에 세척액을 채우고 20초 동안 그대로 둔 다음 세척액을 털어내고 압지에 두드려 건조시킨 다음 접시를 5번 세척을 반복합니다(또는 접시 세척기 사용).
- 50μL의 발색원 용액 A(이중 증류수 100mL에 테트라메틸벤지딘 10mL 에탄올 20mg)와 50μL의 발색원 용액 B(0.1M/L 구연산, 0.2M/L 인산이수소 완충액, pH 5.0-5.4)를 각 웰에 추가합니다. 37 °C에서 15분 동안 빛을 피하십시오.
- 표준 웰, 샘플 웰 및 블랭크 웰의 경우 각 웰에 50μL의 종단 용액을 추가하고 15분 이내에 450nm에서 각 웰의 광학 밀도 값을 측정합니다.
6. 쥐의 notexin-induced gastrocnemius 근육 손상의 조직학적 분석
- 25에 설명된 대로 광학 현미경 검사를 위해 헤마톡실린 및 에오신으로 염색된 5μm 두께의 파라핀 절편을 준비합니다.
7. 이미지 처리 및 데이터 분석
- 분석 소프트웨어를 사용하여 이미징 시스템에서 캡처한 이미지를 읽고 분석합니다. 마우스로 선택한 이미지 시야를 화면 중앙으로 이동하고 40x를 클릭한 다음 스냅숏 찍기를 클릭합니다.
- ELISA의 OD 값을 스프레드시트에 기록하고 표준 곡선을 사용하여 샘플에서 쥐 CK 및 FABP3 수준을 계산합니다.
- 통계 분석을 위해 통계 분석 소프트웨어를 사용하십시오. 측정값을 평균 ± 표준편차(
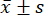 )로 표현하고, 분산이 균일할 때는 LSD 검정을, 분산이 균일하지 않은 경우 Tamhane T2 방법을 사용하여 일원분산분석으로 그룹 간 비교를 분석합니다. 차이는 0.05 미만의 p-값에서 통계적으로 유의한 것으로 간주되었습니다.
)로 표현하고, 분산이 균일할 때는 LSD 검정을, 분산이 균일하지 않은 경우 Tamhane T2 방법을 사용하여 일원분산분석으로 그룹 간 비교를 분석합니다. 차이는 0.05 미만의 p-값에서 통계적으로 유의한 것으로 간주되었습니다.
결과
손상 후 쥐 골격근의 형태학적 특성을 관찰하기 위해 비복근을 헤마톡실린과 에오신으로 염색하고 염색된 이미지를 그룹당 8마리의 쥐에 대한 프로토콜에 설명된 대로 분석 소프트웨어로 판독했습니다. 노텍신(NTX 그룹)에 의해 유발된 비복근 손상이 있는 쥐에서는 많은 근육 세포가 파열되고, 위축되고, 괴사하고, 불규칙하게 배열되었습니다. 또한 환부 주변에 호중구와 림프구가 많이 침투되어 ...
토론
여기서는 쥐의 골격근 손상에 대한 Tuina 치료 프로토콜을 설명한 후 치료 후 골격근 손상 정도를 분석하여 방법의 효과를 검증했습니다. 특히, 약물 유도(notexin, bupivacaine)16, 둔기 타박상(blunt contusion)26, 크러쉬(crush)27 및 허혈-재관류(ischemia-reperfusion)28를 포함하되 이에 국한되지 않는 쥐 골격근 손상 모델이 Tuina와 함께 개입할 수 있다.
공개
저자는 공개할 것이 없습니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단(보조금 번호 82174521), 후난 중의학 대학 대학원생을 위한 혁신 프로젝트(2022CX109)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | JIANGXI FENGLIN | 20220521 | |
| 1.5 microtubes | Servicebio | EP-150X-J | |
| 15 mL centrifuge tube | Servicebio | EP-1501-J | |
| 30G needle | CONPUVON | 220318 | |
| 5 mL blood collection tube | Servicebio | QX0023 | |
| Acrylic handle | Guangdong Guangxingwang Plastic Materials Co., Ltd | 65643645 | |
| Adjustment splint | CREROMEM | 20220729 | |
| Cotton Swab | INOHV | 22080215 | |
| Enzyme-labeled Instrument | Rayto | RT-6100 | |
| Ethanol | INOHV | 211106 | |
| Fork holder | Yongkang Kangzhe Health Technology Co., Ltd | JL001 | |
| Hair removal cream | Veet, France | LOTC190922002 | |
| Hematoxylin dyeing solution set | Wuhan Google Biotech | G1005 | |
| Imaging system | Nikon, Japan | Nikon DS-U3 | |
| IODOPHOR disfecting solution | Hale&Hearty | 20221205 | |
| Light microscope | Nikon, Japan | Nikon Eclipse E100 | |
| Limit baffle | CREROMEM | 20220724 | |
| Notexin | Latoxan S.A.S. | L8104-100UG | |
| Pentobarbital sodium | Merck KGaA | P3761 | |
| Rat creatine kinase (CK) ELISA kit | LunChangShuoBiotech | YD-35237 | |
| Rat fatty acid-binding protein 3 (FABP3) ELISA kit | LunChangShuoBiotech | YD-35730 | |
| Rubber roller | Hebei Mgkui Chemical Technology Co.,Ltd | 202207 | |
| Screw | Weiyan Hardware | B05Z122 | |
| Sprague Dawley rats | Hunan Slake Kingda Laboratory Animal Co. | SYXK2019-0009 | |
| Spring | Bingzhang Hardware | TH001 | |
| Surgical blade | Covetrus | #23 | |
| Weigh controller | Iyoys | HY-XSQ |
참고문헌
- Lempainen, L., et al. Management of anterior thigh injuries in soccer players: practical guide. BMC Sports Science, Medicine and Rehabilitation. 14 (1), 41 (2022).
- Bayer, M. L., Mackey, A., Magnusson, S. P., Krogsgaard, M. R., Kjær, M. Treatment of acute muscle injuries (in Danish). Ugeskrift for Laeger. 181 (8), V11180753 (2019).
- Serner, A., et al. Progression of Strength, Flexibility, and Palpation Pain During Rehabilitation of Athletes with Acute Adductor Injuries: A Prospective Cohort Study. The Journal of Orthopaedic and Sports Physical Therapy. 51 (3), 126-134 (2021).
- Gozubuyuk, O. B., Koksal, C., Tasdemir, E. N. Rehabilitation of a patient with bilateral rectus abdominis full thickness tear sustained in recreational strength training: a case report. Physiotherapy Theory and Practice. 38 (13), 3216-3225 (2022).
- Hotfiel, T., et al. Current Conservative Treatment and Management Strategies of Skeletal Muscle Injuries. Zeitschrift für Orthopädie und Unfallchirurgie. 154 (3), 245-253 (2016).
- de Sire, A., et al. Pharmacological Treatment for Acute Traumatic Musculoskeletal Pain in Athletes. Medicina. 57 (11), 1208 (2021).
- Connor, D. E., et al. Therapeutic potential of exosomes in rotator cuff tendon healing. Journal of Bone and Mineral Metabolism. 37 (5), 759-767 (2019).
- Martins, A. L. L., Giorno, L. P., Santos, A. R. Tissue Engineering Applied to Skeletal Muscle: Strategies and Perspectives. Bioengineering. 9 (12), 744 (2022).
- Horgan, D., et al. Clouds across the new dawn for clinical, diagnostic and biological data: accelerating the development, delivery and uptake of personalized medicine. Diagnosis. , (2023).
- Urits, I., et al. A Comprehensive Review of Alternative Therapies for the Management of Chronic Pain Patients: Acupuncture, Tai Chi, Osteopathic Manipulative Medicine, and Chiropractic Care. Advances in Therapy. 38 (1), 76-89 (2021).
- Lee, N. W., et al. Chuna (or Tuina) Manual Therapy for Musculoskeletal Disorders: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Evidence-based Complementary and Alternative Medicine: eCAM. 2017, 8218139 (2017).
- Xie, J., Deng, D. X., Chen, Y., Peng, L. Progress in the intervention of massage techniques on skeletal muscle injury. Hunan Journal of Traditional Chinese Medicine. 34 (04), 199-201 (2018).
- Yuan, Y., Zhang, H., Zhang, G. H., Xue, X. N. Research progress on microstructure changes and rehabilitation treatment of exercise-induced skeletal muscle injury. Massage and Rehabilitation Medicine. 14 (6), 29-33 (2023).
- Zhao, Y. The Establishment of Famous Tuina Master Ding Jifeng and Wei Fa - Commemorating the 100th Anniversary of Mr. Ding Jifeng's Birthday. Traditional Chinese Medicine Culture. 9 (6), 18-21 (2014).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PloS one. 11 (1), e0147198 (2016).
- Plant, D. R., Colarossi, F. E., Lynch, G. S. Notexin causes greater myotoxic damage and slower functional repair in mouse skeletal muscles than bupivacaine. Muscle & Nerve. 34 (5), 577-585 (2006).
- Tierney, M. T., Sacco, A. Inducing and Evaluating Skeletal Muscle Injury by Notexin and Barium Chloride. Methods in Molecular Biology. 1460, 53-60 (2016).
- Torres-Ruiz, J., Alcalá-Carmona, B., Alejandre-Aguilar, R., Gómez-Martín, D. Inflammatory myopathies and beyond: The dual role of neutrophils in muscle damage and regeneration. Frontiers in Immunology. 14, 1113214 (2023).
- Tu, H., Li, Y. L. Inflammation balance in skeletal muscle damage and repair. Frontiers in Immunology. 14, 1133355 (2023).
- Castro, C., Gourley, M. Diagnosis and treatment of inflammatory myopathy: issues and management. Therapeutic Advances in Musculoskeletal Disease. 4 (2), 111-120 (2012).
- Dabby, R., et al. Asymptomatic or minimally symptomatic hyperCKemia: histopathologic correlates. The Israel Medical Association Journal: IMAJ. 8 (2), 110-113 (2006).
- Khodabukus, A., et al. Tissue-Engineered Human Myobundle System as a Platform for Evaluation of Skeletal Muscle Injury Biomarkers. Toxicological Sciences. 176 (1), 124-136 (2020).
- Zhou, X. W., Jin, W. D., Zhu, L., Liu, X. H., Zhou, B. H. Experimental observation on the influence of different frequency, intensity and action time of Ding rolling manipulation on hemodynamics. Shanghai Journal of Traditional Chinese Medicine. (06), 42-44 (1998).
- Pablos, A., et al. Protective Effects of Foam Rolling against Inflammation and Notexin Induced Muscle Damage in Rats. International Journal of Medical Sciences. 17 (1), 71-81 (2017).
- Wisner, L., Larsen, B., Maguire, A. Enhancing Tumor Content through Tumor Macrodissection. Journal of Visualized Experiments: JoVE. (180), e62961 (2022).
- Deng, P., et al. Contusion concomitant with ischemia injury aggravates skeletal muscle necrosis and hinders muscle functional recovery. Experimental Biology and Medicine. 247 (17), 1577-1590 (2022).
- Dobek, G. L., Fulkerson, N. D., Nicholas, J., Schneider, B. S. Mouse model of muscle crush injury of the legs. Comparative Medicine. 63 (3), 227-232 (2013).
- Armstrong, D. M., et al. Sildenafil citrate protects skeletal muscle of ischemia-reperfusion injury: immunohistochemical study in rat model. Acta Cirúrgica Brasileira. 28 (4), 282-287 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유