È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imitazione del metodo di rotolamento di Ding sulla lesione muscolare indotta da Notexin nei ratti
In questo articolo
Riepilogo
Questo protocollo descrive un semplice dispositivo che imita il metodo del rullo di Ding, stabilisce un modello di ratto di lesione muscolare scheletrica e utilizza la colorazione ematossilina-eosina per osservare la patologia del tessuto danneggiato e il test di immunoassorbimento enzimatico per rilevare i cambiamenti nei marcatori di danno sierico.
Abstract
Il metodo del rotolo di Ding è una delle manipolazioni più comunemente usate nelle cliniche di massaggio tradizionale cinese (Tuina) e una delle manipolazioni Tuina contemporanee più influenti in Cina. Si basa sul tradizionale metodo di rotolamento comunemente usato nel genere Zen con un dito e chiamato metodo di rotolamento di Ding. Grazie ai suoi effetti antinfiammatori e di promozione della circolazione sanguigna, il metodo di rotolamento di Ding ha effetti terapeutici sulla miopatia. A causa dell'ampia area di forza applicata alla pelle umana, il metodo di rotolamento di Ding è difficile da eseguire su animali da esperimento con piccole aree cutanee, come ratti e conigli. Inoltre, la forza del Tuina applicata al corpo umano differisce da quella applicata agli animali da esperimento, quindi può accadere che la forza sia troppo alta o troppo bassa per ottenere l'effetto terapeutico del Tuina durante l'esperimento. Questo esperimento mira a creare un semplice massaggiatore adatto ai ratti basato sui parametri di manipolazione del rotolamento di Ding (forza, frequenza, durata del Tuina). Il dispositivo può standardizzare la manipolazione negli esperimenti sugli animali e ridurre la variazione della forza Tuina applicata a diversi animali a causa di fattori soggettivi. È stato stabilito un modello di ratto di lesione muscolare scheletrica indotta da notexina e sono stati utilizzati marcatori di lesione plasmatica creatinchinasi (CK) e proteina legante gli acidi grassi 3 (FABP3) per valutare l'effetto terapeutico di Tuina sulla lesione muscolare scheletrica. I risultati hanno mostrato che questo massaggiatore Tuina potrebbe ridurre i livelli di espressione di CK e FABP3 e rallentare il grado di lesione del muscolo scheletrico. Pertanto, il massaggiatore Tuina qui descritto, imitando il metodo del rullo di Ding, contribuisce a standardizzare la manipolazione Tuina nella ricerca sperimentale ed è di grande aiuto per le successive ricerche sul meccanismo molecolare del Tuina per la miopatia.
Introduzione
Le lesioni muscolari sono lesioni traumatiche comuni nella vita clinica e quotidiana, causate da colpi esterni (contusioni) o sovraccarico cronico delle fibre muscolari (stiramenti), ecc., con conseguente disfunzione muscolare e dolore, compromettendo anche seriamente la qualità di vita del paziente1. Iniziare la riabilitazione il prima possibile dopo una lesione da sforzo acuto è la chiave per ridurre il tempo di ritorno allo sport2 e per ridurre il dolore 3,4. Nella moderna medicina occidentale, il primo soccorso clinico per le lesioni muscolari segue i principi di riposo, ghiaccio, compressione ed elevazione (RICE) per fermare l'emorragia dannosa nel tessuto muscolare5 e farmaci antinfiammatori non steroidei per alleviare il dolore6. La scoperta di nuove terapie come gli esosomi7 e l'ingegneria tissutale8 sono diventate potenziali strategie di trattamento per le malattie del muscolo scheletrico, compensando le carenze dei precedenti trattamenti farmacologici. Tuttavia, può anche aumentare il costo del trattamento per i pazienti, sottoponendoli a un'enorme pressione finanziaria9. Pertanto, si raccomandano terapie alternative e complementari per il trattamento dei problemi muscoloscheletrici10. Tuina è ampiamente utilizzato clinicamente in Cina come metodo medico tradizionale ed è popolare tra i pazienti per la sua efficacia e per i minori effetti collaterali. La terapia Tuina per i disturbi muscoloscheletrici può alleviare il dolore e migliorare la funzione11,12,13. Il signor Ding Jifeng, un famoso praticante Tuina di Shanghai, ha fondato il metodo14 del rotolo di Ding. È una tecnica unica di rotolamento e frantumazione con un'ampia area di forza, una forza uniforme e delicata e un'intensa penetrazione.
Diversi modelli animali si basano su diverse eziologie. Hanno vantaggi e svantaggi e la selezione di modelli animali corretti e appropriati è di grande importanza per gli esperimenti di base, che aiutano a comprendere le vie di segnalazione cellulare e molecolare di rigenerazione e riparazione dopo una lesione del muscolo scheletrico per sviluppare nuove terapie per il trattamento delle malattie del muscolo scheletrico. I modelli di lesioni muscolari indotti chimicamente sono ampiamente utilizzati, con iniezioni di muscolo scheletrico che causano necrosi delle miofibre e producono aree rigenerate che possono rigenerarsi efficacemente entro 2 settimane15. Sia la notexina che la bupivacaina possono causare danni muscolari. Tuttavia, la notexina può causare danni miotossici più gravi al muscolo scheletrico rispetto alla bupivacaina e il recupero funzionale naturale è relativamente più lento16. Lo stampaggio a iniezione intramuscolare di farmaci non solo richiede meno tempo, ma ha anche effetti controllati e l'entità del danno muscolare scheletrico. Questo controllo quantificabile rende meno difficile il successo dello stampaggio15,17.
La risposta infiammatoria è una risposta biologica essenziale che è stata ampiamente studiata nel contesto della miopatia18,19. Nelle prime fasi della lesione muscolare scheletrica, la necrosi delle miofibre interrompe l'omeostasi muscolare locale e molte cellule infiammatorie si infiltrano nel sito della lesione, secernendo molte citochine pro-infiammatorie19. La creatinchinasi (CK) è un biomarcatore sierico tradizionale per la valutazione delle lesioni muscolari scheletriche. Tuttavia, manca di specificità tissutale20 e sensibilità21, il che limita la sua capacità di valutare l'entità del danno muscolare indotto da farmaci e di segnalare indirettamente l'entità del recupero muscolare dopo la lesione. Nuovi biomarcatori, tra cui la proteina legante gli acidi grassi 3 (FABP3), hanno recentemente mostrato una specificità e una sensibilità tissutale relativamente elevate nei modelli di roditori di lesioni muscolari scheletriche. FABP3 è una famiglia di proteine leganti espresse principalmente nelle cellule muscolari cardiache e scheletriche e implicate nel metabolismo, nel trasporto e nella segnalazione degli acidi grassi22. Pertanto, abbiamo scelto una combinazione di due biomarcatori, CK e FABP3, per valutare l'entità del danno muscolare scheletrico indotto da notexina e il recupero dopo il trattamento.
Nei roditori, i muscoli sono poco profondi e l'area della pelle è piccola, il che determina anche che i vari parametri del massaggio nei roditori non saranno gli stessi degli esseri umani, come nella terapia animale, il massaggiatore dovrebbe trattarli con meno forza usando il metodo del rotolo di Ding e potrebbe non essere favorevole al funzionamento di questa tecnica a causa delle piccole dimensioni dell'area ferita, che alla fine può portare a una riduzione dell'efficacia del massaggio. Pertanto, l'esperimento ha utilizzato il massaggiatore rotante realizzato internamente, conforme alle caratteristiche del metodo di rotolamento di Ding, per intervenire e valutare l'effetto terapeutico del modello di lesione muscolare scheletrica indotta da notexina nei ratti, che aiuta a standardizzare i parametri di Tuina negli studi sperimentali sugli animali al fine di indagare a fondo il meccanismo molecolare di azione di Tuina, un metodo di trattamento della medicina tradizionale cinese, sulle malattie muscoloscheletriche.
Protocollo
Le procedure che coinvolgono gli animali sono state approvate dal Comitato Istituzionale per la Cura e l'Uso presso l'Università di Medicina Cinese di Hunan.
1. Montaggio del massaggiatore rotante
- Selezionare un massaggiatore composto da un rullo di gomma, un supporto per forcella, una molla, un deflettore di limite, una stecca di regolazione, una vite e un'impugnatura in acrilico (Figura 1). Assicurarsi che il rullo di gomma misuri 3 cm di lunghezza e 1,6 cm di diametro, la molla misuri 3 cm di lunghezza e 0,9 cm di diametro, il deflettore di limite sia lungo 3 cm e largo 2 cm e l'impugnatura misuri 12 cm di lunghezza e 0,9 cm di diametro.
- Controllo della forza: secondo i risultati della letteratura23, la pressione verso il basso del metodo di rollio di Ding è risultata essere circa il 10% del peso corporeo, quindi la pressione applicata durante la progettazione del rotolamento in avanti è di circa il 10% del peso corporeo del ratto (0,2-0,3 N). Verificare che la pressione massima del massaggiatore sul controller di pesatura sia di circa 0,3 N regolando l'angolo del deflettore limite. Questo requisito di pressione soddisfa le esigenze del ratto.
- Assicurarsi che la pressione minima sia di circa 0,08 N durante il rollback (Figura 2). Assicurarsi che la pressione sia esattamente conforme al requisito del metodo di rollio di Ding che il rapporto tra le forze in avanti e all'indietro sia di 3:1.
- Prima del trattamento, chiedere all'operatore di lavorare con il software del metronomo per controllare la frequenza di rotolamento a 140 rotoli/min e di esercitarsi più di 3 volte nel pre-esperimento per garantire che l'operazione sia standardizzata.
2. Creazione di un modello di ratto di lesione del muscolo scheletrico
- Dividi in modo casuale 24 ratti maschi Sprague-Dawley (del peso di 200-250 g) in tre gruppi di otto ratti ciascuno, inclusi il controllo (C), la notexina (NTX) e la notexina con Tuina (NTX + Tuina) e nutri con una dieta standard. Mantenere un ciclo di 12 ore di luce/12 ore di buio, casa a 20-25 °C e 50%-70% di umidità.
- Anestetizzare con pentobarbital sodico all'1% (40 mg/kg) mediante iniezione intraperitoneale e quindi rimuovere i peli dall'arto inferiore destro con crema depilatoria. Dopo aver rimosso il pelo, strofinare la crema residua con soluzione fisiologica. Confermare l'anestesia adeguata con la risposta al pizzicamento delle dita dei piedi. Applicare un unguento oftalmico per idratare gli occhi mentre l'animale è sotto anestesia. Fornire supporto termico durante tutta la procedura.
- Disinfezione cutanea alternata per l'arto inferiore destro con soluzione disinfettante iodoforo e alcol al 75% prima dell'iniezione. Toccare un batuffolo di cotone imbevuto di soluzione disinfettante iodoforo al centro della pelle dell'arto inferiore e applicare con un movimento circolare verso l'esterno. Ripeti con un batuffolo di cotone imbevuto di etanolo.
- Stabilire modelli di lesione del muscolo scheletrico secondo il metododi riferimento 24. Iniettare notexin in una sola gamba (per evitare la doppia iniezione di notexina). Prelevare 200 μL di soluzione di notexina (soluzione di notexina da 10 μg/mL preparata aggiungendo 100 μg di notexina a 10 mL di soluzione fisiologica normale in una provetta da centrifuga da 15 mL) in una siringa da 1 mL con un ago da 30 G e iniettare la soluzione di notexina per via intramuscolare nel muscolo gastrocnemio per produrre lesioni muscolari.
- Inietti la notexina lentamente e attenda 3 s prima di estrarre l'ago (da iniettare completamente).
ATTENZIONE: Notexin è una sostanza chimica tossica che richiede un lavaggio immediato con abbondante acqua al contatto con una ferita aperta e una pronta assistenza medica se necessario. - Iniettare nei ratti del gruppo di controllo 200 μL di soluzione salina. Sposta i ratti anestetizzati in gabbie vuote con lettiera pulita. Fai attenzione a rimuovere l'imbottitura intorno al naso e alla bocca dei ratti per mantenere la loro respirazione libera. Osservare visivamente il colore dei tessuti e la frequenza respiratoria alla fine dell'iniezione fino a quando i ratti non riacquistano sufficiente coscienza.
- Riportare i ratti nella gabbia di casa e in genere allevarli per 24 ore.
3. Terapia Tuina
- Posizionare un ratto SD in posizione prona con la testa coperta da un panno nero sulla piattaforma sperimentale disinfettata con alcol al 75% per esporre il muscolo gastrocnemio. Non coprire troppo strettamente.
- Utilizzo del massaggiatore Tuina per il gruppo NTX+Tuina: Tenere il massaggiatore e posizionare il rullo sul muscolo gastrocnemio del ratto e rotolare in avanti fino a quando la molla non entra in contatto con il deflettore limite. Quindi ritrarre la forza e tornare alla sua posizione originale, alternando così il movimento (Figura 3).
- Ruotare il massaggiatore a una velocità di 140 rotoli al minuto ed eseguire ogni operazione per 3 minuti. Eseguire i massaggi una volta al mattino e una volta al pomeriggio per 3 giorni consecutivi.
- Rimettere i ratti nella gabbia di casa dopo ogni trattamento e digiunare per 8 ore dopo l'ultimo trattamento.
4. Raccolta di sangue e tessuti dai ratti dopo l'esperimento
- Secondo i requisiti del comitato etico competente per gli esperimenti sugli animali, anestetizzare i ratti mediante iniezione intraperitoneale di pentobarbital sodico all'1% (40 mg/kg, iniezione intraperitoneale). Confermare l'anestesia adeguata con la risposta al pizzicamento delle dita dei piedi. Sopprimere i ratti con un salasso dell'aorta addominale dopo il prelievo di sangue.
- Alternare la disinfezione cutanea con soluzione disinfettante iodoforo e alcol al 75% prima dell'iniezione. Toccare un batuffolo di cotone imbevuto di iodio povidone al centro della pelle addominale e applicare con movimenti circolari verso l'esterno. Ripeti con un batuffolo di cotone imbevuto di etanolo. Ripetere la disinfezione 3 volte.
- Chiedi all'assistente di usare due emostatici per sollevare la pelle al centro dell'addome. Come operatore, usa un bisturi per tagliare la pelle addominale e i muscoli dal rafe alla sinfisi pubica.
- Dopo aver aperto la cavità addominale, separare l'intestino con batuffoli di cotone sterili per esporre l'aorta addominale nella parete addominale posteriore.
- Localizzare l'aorta addominale, prelevare 5 ml di sangue di ratto in provette di raccolta del sangue e ottenere il plasma in 1,5 microprovette centrifugando a 3000 x g per 10 minuti dopo aver tenuto in piedi il sangue per 1 ora. Conservare il plasma a -80 °C.
- Tagliare la pelle con le forbici chirurgiche lungo l'apertura addominale inferiore verso l'aspetto laterale dell'arto inferiore destro, esponendo i muscoli dell'arto inferiore, e dopo aver separato accuratamente la fascia con una pinza, tagliare il bisturi per rimuovere il muscolo gastrocnemio intatto.
- Lavare il muscolo gastrocnemio in soluzione fisiologica sterile per rimuovere i peli e il sangue aderenti.
- Mettere il muscolo gastrocnemio rimosso in una provetta da centrifuga da 15 ml contenente il 4% di paraformaldeide.
5. Rilevazione dei livelli plasmatici di CK e FABP 3 mediante ELISA
- Calcolare e determinare il numero di piastre preconfezionate necessarie per un esperimento. Rimuovere le piastre necessarie, inserirle nel telaio a 96 pozzetti, rimettere le micropiastre rimanenti nel sacchetto di alluminio per la sigillatura e conservarle a 4 °C.
- Equilibrare i kit e i campioni a temperatura ambiente (25-28 °C) per 120 minuti, in equilibrio completo a temperatura ambiente.
NOTA: L'equilibrazione del kit e del campione è fondamentale e deve essere bilanciata per un tempo sufficiente. - Impostare pozzetti standard, campioni e vuoti. Aggiungere 50 μL di standard CK o FABP3 a diverse concentrazioni (100, 50, 25, 12,5, 6,25, 0 ng/mL) ai pozzetti standard. Ripetere ogni standard una volta, occupando un totale di 12 pozzetti.
- Riempire i pozzetti del campione con 40 μL di diluente del campione (0,8 g NaCl, 0,02 g KH 2PO 4, 0,29 g Na 2 HPO 4 12H2O, 0,02g KCl, 0,01 g NaN3in 100 mL di acqua bidistillata, pH7,4), seguiti da 10 μL del campione da testare. Ripetere ogni campione una volta, occupando 48 pozzetti in totale.
- Fatta eccezione per i pozzetti vuoti situati due pozzetti dietro l'ultimo pozzetto del campione, aggiungere 100 μL di anticorpo CK o FABP3 (anticorpo marcato con enzimi) marcato con HRP a ciascun pozzetto standard e campione.
- Sigillare i pozzetti con pellicola sigillante e incubare a bagnomaria a 37 °C o termostato per 60 minuti.
- Scartare il liquido, asciugare tamponando su carta assorbente, riempire ogni pozzetto con detersivo, lasciare agire per 20 s, scuotere il liquido di lavaggio, asciugare tamponando su carta assorbente e ripetere il lavaggio del piatto 5 volte (o utilizzare una lavapiatti).
- Aggiungere 50 μL di soluzione cromogenica A (20 mg di tetrametilbenzidina 10 mL di etanolo in 100 mL di acqua bidistillata) e 50 μL di soluzione cromogenica B (0,1 M/L di acido citrico, 0,2 M/L di tampone fosfato monobasico di sodio, pH 5,0-5,4) in ciascun pozzetto. Conservare al riparo dalla luce per 15 minuti a 37 °C.
- Per pozzetti standard, pozzetti campione e pozzetti vuoti, aggiungere 50 μL di soluzione di terminazione a ciascun pozzetto e misurare il valore di densità ottica di ciascun pozzetto a 450 nm entro 15 minuti.
6. Analisi istologica del danno muscolare gastrocnemio indotto da notexina nei ratti
- Preparare sezioni di paraffina spesse 5 μm colorate con ematossilina ed eosina per l'esame microscopico ottico come descritto alpunto 25.
7. Elaborazione delle immagini e analisi dei dati
- Leggere e analizzare le immagini acquisite dal sistema di imaging con il software di analisi. Spostare il campo visivo dell'immagine selezionata al centro dello schermo con il mouse, fare clic su 40x, quindi fare clic su Scatta istantanea.
- Registrare i valori OD dell'ELISA in un foglio di calcolo e calcolare i livelli di CK e FABP3 nei ratti nei campioni utilizzando la curva standard.
- Utilizzare software di analisi statistica per le analisi statistiche. Esprimere le misurazioni come media ± deviazione standard (
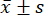 ), e analizzare i confronti tra i gruppi mediante ANOVA unidirezionale, con il test LSD quando la varianza era uniforme e il metodo Tamhane T2 quando la varianza non era uniforme. La differenza è stata considerata statisticamente significativa con un valore p inferiore a 0,05.
), e analizzare i confronti tra i gruppi mediante ANOVA unidirezionale, con il test LSD quando la varianza era uniforme e il metodo Tamhane T2 quando la varianza non era uniforme. La differenza è stata considerata statisticamente significativa con un valore p inferiore a 0,05.
Risultati
Al fine di osservare le proprietà morfologiche del muscolo scheletrico di ratto dopo la lesione, il muscolo gastrocnemio è stato colorato con ematossilina ed eosina e le immagini colorate sono state lette con un software di analisi come descritto nel protocollo per 8 ratti per gruppo. Nei ratti con lesione del muscolo gastrocnemio indotta da notexina (gruppo NTX), molte cellule muscolari erano rotte, atrofiche, necrotiche e disposte in modo irregolare. C'era anche un'elevata infiltrazione di neutrofili e linfociti into...
Discussione
Qui, abbiamo descritto un protocollo per il trattamento Tuina della lesione muscolare scheletrica nei ratti e poi abbiamo analizzato il grado di lesione muscolare scheletrica dopo il trattamento per verificare l'efficacia del metodo. In particolare, i modelli di danno muscolare scheletrico di ratto, inclusi, a titolo esemplificativo ma non esaustivo, l'induzione di farmaci (notexina, bupivacaina)16, contusione contusiva 26, schiacciamento27 e ischemia-riperfusione
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata supportata da sovvenzioni della National Natural Science Foundation of China (Grant Nos.82174521), progetto di innovazione per studenti laureati dell'Università di medicina cinese di Hunan (2022CX109)
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | JIANGXI FENGLIN | 20220521 | |
| 1.5 microtubes | Servicebio | EP-150X-J | |
| 15 mL centrifuge tube | Servicebio | EP-1501-J | |
| 30G needle | CONPUVON | 220318 | |
| 5 mL blood collection tube | Servicebio | QX0023 | |
| Acrylic handle | Guangdong Guangxingwang Plastic Materials Co., Ltd | 65643645 | |
| Adjustment splint | CREROMEM | 20220729 | |
| Cotton Swab | INOHV | 22080215 | |
| Enzyme-labeled Instrument | Rayto | RT-6100 | |
| Ethanol | INOHV | 211106 | |
| Fork holder | Yongkang Kangzhe Health Technology Co., Ltd | JL001 | |
| Hair removal cream | Veet, France | LOTC190922002 | |
| Hematoxylin dyeing solution set | Wuhan Google Biotech | G1005 | |
| Imaging system | Nikon, Japan | Nikon DS-U3 | |
| IODOPHOR disfecting solution | Hale&Hearty | 20221205 | |
| Light microscope | Nikon, Japan | Nikon Eclipse E100 | |
| Limit baffle | CREROMEM | 20220724 | |
| Notexin | Latoxan S.A.S. | L8104-100UG | |
| Pentobarbital sodium | Merck KGaA | P3761 | |
| Rat creatine kinase (CK) ELISA kit | LunChangShuoBiotech | YD-35237 | |
| Rat fatty acid-binding protein 3 (FABP3) ELISA kit | LunChangShuoBiotech | YD-35730 | |
| Rubber roller | Hebei Mgkui Chemical Technology Co.,Ltd | 202207 | |
| Screw | Weiyan Hardware | B05Z122 | |
| Sprague Dawley rats | Hunan Slake Kingda Laboratory Animal Co. | SYXK2019-0009 | |
| Spring | Bingzhang Hardware | TH001 | |
| Surgical blade | Covetrus | #23 | |
| Weigh controller | Iyoys | HY-XSQ |
Riferimenti
- Lempainen, L., et al. Management of anterior thigh injuries in soccer players: practical guide. BMC Sports Science, Medicine and Rehabilitation. 14 (1), 41 (2022).
- Bayer, M. L., Mackey, A., Magnusson, S. P., Krogsgaard, M. R., Kjær, M. Treatment of acute muscle injuries (in Danish). Ugeskrift for Laeger. 181 (8), V11180753 (2019).
- Serner, A., et al. Progression of Strength, Flexibility, and Palpation Pain During Rehabilitation of Athletes with Acute Adductor Injuries: A Prospective Cohort Study. The Journal of Orthopaedic and Sports Physical Therapy. 51 (3), 126-134 (2021).
- Gozubuyuk, O. B., Koksal, C., Tasdemir, E. N. Rehabilitation of a patient with bilateral rectus abdominis full thickness tear sustained in recreational strength training: a case report. Physiotherapy Theory and Practice. 38 (13), 3216-3225 (2022).
- Hotfiel, T., et al. Current Conservative Treatment and Management Strategies of Skeletal Muscle Injuries. Zeitschrift für Orthopädie und Unfallchirurgie. 154 (3), 245-253 (2016).
- de Sire, A., et al. Pharmacological Treatment for Acute Traumatic Musculoskeletal Pain in Athletes. Medicina. 57 (11), 1208 (2021).
- Connor, D. E., et al. Therapeutic potential of exosomes in rotator cuff tendon healing. Journal of Bone and Mineral Metabolism. 37 (5), 759-767 (2019).
- Martins, A. L. L., Giorno, L. P., Santos, A. R. Tissue Engineering Applied to Skeletal Muscle: Strategies and Perspectives. Bioengineering. 9 (12), 744 (2022).
- Horgan, D., et al. Clouds across the new dawn for clinical, diagnostic and biological data: accelerating the development, delivery and uptake of personalized medicine. Diagnosis. , (2023).
- Urits, I., et al. A Comprehensive Review of Alternative Therapies for the Management of Chronic Pain Patients: Acupuncture, Tai Chi, Osteopathic Manipulative Medicine, and Chiropractic Care. Advances in Therapy. 38 (1), 76-89 (2021).
- Lee, N. W., et al. Chuna (or Tuina) Manual Therapy for Musculoskeletal Disorders: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Evidence-based Complementary and Alternative Medicine: eCAM. 2017, 8218139 (2017).
- Xie, J., Deng, D. X., Chen, Y., Peng, L. Progress in the intervention of massage techniques on skeletal muscle injury. Hunan Journal of Traditional Chinese Medicine. 34 (04), 199-201 (2018).
- Yuan, Y., Zhang, H., Zhang, G. H., Xue, X. N. Research progress on microstructure changes and rehabilitation treatment of exercise-induced skeletal muscle injury. Massage and Rehabilitation Medicine. 14 (6), 29-33 (2023).
- Zhao, Y. The Establishment of Famous Tuina Master Ding Jifeng and Wei Fa - Commemorating the 100th Anniversary of Mr. Ding Jifeng's Birthday. Traditional Chinese Medicine Culture. 9 (6), 18-21 (2014).
- Hardy, D., et al. Comparative Study of Injury Models for Studying Muscle Regeneration in Mice. PloS one. 11 (1), e0147198 (2016).
- Plant, D. R., Colarossi, F. E., Lynch, G. S. Notexin causes greater myotoxic damage and slower functional repair in mouse skeletal muscles than bupivacaine. Muscle & Nerve. 34 (5), 577-585 (2006).
- Tierney, M. T., Sacco, A. Inducing and Evaluating Skeletal Muscle Injury by Notexin and Barium Chloride. Methods in Molecular Biology. 1460, 53-60 (2016).
- Torres-Ruiz, J., Alcalá-Carmona, B., Alejandre-Aguilar, R., Gómez-Martín, D. Inflammatory myopathies and beyond: The dual role of neutrophils in muscle damage and regeneration. Frontiers in Immunology. 14, 1113214 (2023).
- Tu, H., Li, Y. L. Inflammation balance in skeletal muscle damage and repair. Frontiers in Immunology. 14, 1133355 (2023).
- Castro, C., Gourley, M. Diagnosis and treatment of inflammatory myopathy: issues and management. Therapeutic Advances in Musculoskeletal Disease. 4 (2), 111-120 (2012).
- Dabby, R., et al. Asymptomatic or minimally symptomatic hyperCKemia: histopathologic correlates. The Israel Medical Association Journal: IMAJ. 8 (2), 110-113 (2006).
- Khodabukus, A., et al. Tissue-Engineered Human Myobundle System as a Platform for Evaluation of Skeletal Muscle Injury Biomarkers. Toxicological Sciences. 176 (1), 124-136 (2020).
- Zhou, X. W., Jin, W. D., Zhu, L., Liu, X. H., Zhou, B. H. Experimental observation on the influence of different frequency, intensity and action time of Ding rolling manipulation on hemodynamics. Shanghai Journal of Traditional Chinese Medicine. (06), 42-44 (1998).
- Pablos, A., et al. Protective Effects of Foam Rolling against Inflammation and Notexin Induced Muscle Damage in Rats. International Journal of Medical Sciences. 17 (1), 71-81 (2017).
- Wisner, L., Larsen, B., Maguire, A. Enhancing Tumor Content through Tumor Macrodissection. Journal of Visualized Experiments: JoVE. (180), e62961 (2022).
- Deng, P., et al. Contusion concomitant with ischemia injury aggravates skeletal muscle necrosis and hinders muscle functional recovery. Experimental Biology and Medicine. 247 (17), 1577-1590 (2022).
- Dobek, G. L., Fulkerson, N. D., Nicholas, J., Schneider, B. S. Mouse model of muscle crush injury of the legs. Comparative Medicine. 63 (3), 227-232 (2013).
- Armstrong, D. M., et al. Sildenafil citrate protects skeletal muscle of ischemia-reperfusion injury: immunohistochemical study in rat model. Acta Cirúrgica Brasileira. 28 (4), 282-287 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon