Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
ARNi Mediated inactivation génique et la transgénèse par microinjection dans le nématode Necromenic Pristionchus pacificus
Dans cet article
Résumé
Dans les organismes modèles, la transgénèse permet de manipuler les fonctions des gènes tandis ARNi peut knockdown transcrits d'ARNm spécifiques 1-2. Ce protocole vise à illustrer les techniques nécessaires pour introduire de l'ADN transmis de façon stable et transitoire ARN double brin dans le nématode necromenic Pristionchus pacificus Pour des études en biologie évolutive, de développement et de comportement.
Résumé
Bien qu'il soit plus abordable pour les organismes modèles émergents d'obtenir les génomes entièrement séquencés, encore en profondeur la fonction des gènes et des analyses d'expression par interférence ARN et de transgénèse stables restent limitées dans de nombreuses espèces en raison de l'anatomie particulière et moléculaire biologie cellulaire de l'organisme. Par exemple, en dehors de la couronne de Caenorhabditis groupe qui comprend trois Caenorhabditis elegans, de façon stable transmis lignées transgéniques chez les non-Caenorhabditis espèces n'ont pas été signalés dans ce phylum spécieuse (Nematoda), à l'exception de Strongyloides stercoralis 4 et 5 Pristionchus pacificus. Pour faciliter l'expansion du rôle de P. pacificus dans l'étude du développement, l'évolution et le comportement 6-7, nous décrivons ici les méthodes actuelles d'utiliser la micro-injection pour rendre les animaux transgéniques et inactivation de gènes par RNAi. Comme les gonades des P. pacificus est syncytial et capable d'incorporer de l'ADN et l'ARN dans les ovocytes sont envoyés par micro-injection directe. Contrairement à C. elegans Cependant, l'héritage transgène stable et expression somatique dans P. pacificus nécessite l'ajout d'ADN génomique digéré par les endonucléases auto complémentaire à l'extrémité des transgènes cibles et des marqueurs co-injection 5. L'ajout de l'ADN génomique porteuse est similaire à l'exigence de l'expression du transgène dans le Strongyloides stercoralis 4 et dans les cellules germinales de C. elegans. Toutefois, il n'est pas clair si l'exigence spécifique de l'ADN des animaux génomiques propres parce que P. pacificus soma est très efficace à réduire au silence non complexes multi-copie des gènes ou que les tableaux extrachromosomique dans P. pacificus nécessitent séquences génomiques pour l'assemblage kinétochore correcte lors de la mitose. La migration ventrale de l'(deux arméesdidelphic) gonades hermaphrodites complique encore plus la capacité d'injecter deux gonades dans les vers individuels 8. Nous démontrons également l'utilisation de micro-injection d'un mutant dominant knockdown (rouleau, tu92) en injectant l'ARN double brin (ARNdb) dans les gonades d'obtenir non roulants F 1 progéniture. Contrairement à C. elegans, mais comme la plupart des autres nématodes, P. pacificus PS312 n'est pas réceptif à l'ARNi systémique via l'alimentation et le trempage et donc ARNdb doivent être administrés par microinjection dans les gonades syncytial. Dans cette étude, nous espérons pour décrire le processus de microinjection nécessaires pour transformer un promoteur PPA-EGL-4:: Un journaliste de fusion GFP et démontable d'un rouleau dominante PRL-1 (tu92) mutant dans un protocole visuel informatif.
Protocole
1. La transgénèse: préparation de l'ADN
- Dominantes de co-injection de marqueur: pRL3 [PPA-PRL-1 (tu92)]
Le plasmide pRL3 est une dominante de co-injection de marqueur pour identifier visuellement des événements de transformation réussie. Ce plasmide codant pour un allèle dominant mutant (tu92) du gène de la PPA-PRL-1 étroitement lié à la SQT-1 du gène du collagène en C. elegans et transforme le mode de locomotion de type sauvage dans le sens horaire sinusoïdale mouvements de torsion le long du corps du ver axe 1,5. L'animal transformé est très similaire au marqueur de sélection dominant populaires rol-6 (su1006) utilisés en C. elegans pour les 20 dernières années. - Reporter cible transgène: PPA-EGL-4p:: gfp
Un gène d'intérêt peut être lié transcriptionnellement ou translation d'une séquence codante GFP 9. Dans cette étude, le PPA-EGL-4promoter:: GFP (EGL-4, cGMP protéine kinase dépendante) was utilisés pour déterminer si un fragment de 2 kb en amont du début de la traduction peut conférer expression de la GFP dans P. pacificus PS312. Ce vecteur GFP contient une région de codage avec la GFP modifiées
introns et la polyvalente PPA-RPL-23 3 'UTR Terminator 5 aimablement fournies par Xiaoyue Wang et Ralf J. Sommer (Institut Max-Planck, Tübingen, Allemagne, Union européenne). - L'ADN génomique: PS312
L'ajout de type sauvage P. l'ADN génomique pacificus PS312 est nécessaire pour obtenir l'héritage transgène stable, en particulier à partir transgéniques animaux F 1 F 2 à leur progéniture 5. Il n'est pas encore certain si l'ADN génomique des formes complexes supplémentaires tableaux chromosomiques avec les deux transgènes (le marqueur de co-injection PRL-3 et le PPA-EGL-4p:: rapporteur GFP) similaires à ceux observés dans les stables F 2 lignes transgéniques dans C. elegans 3. Toutefois, l'obligation d'avoir l'ADN génomique et de partager des transgènes Identicasurplombe l cohérent suggère fortement la formation de complexes extra-chromosomiques tableaux les cellules hôtes peuvent reconnaître pour la transmission de l'ADN appropriée (ADNg préparés en utilisant Sigma G1N10 kit). - Digestion de l'ADN
Les enzymes de restriction sont utilisées pour linéariser le PPA-EGL-4p:: gfp vecteur d'ADN et de produire des surplombs collante compatible avec le marqueur de la co-injection et le PS312 pRL3 ADNg. Mélanger en tapotant et non vortex. Incuber pendant une heure à 37 ° C.
| pRL3 | 4 ug |
| 10xbuffer | 10 ul |
| PstI (10 U / pl) | 4 pl |
| dH 2 O | ~ |
| Total: | 100 uL |
| PPA-EGL-4p:: gfp | 4 ug |
| Tampon 10x | 10 ul |
| Sali (10 U / pl) | 4 pl |
| dH 2 O | ~ |
| Total: | 100 ul |
| ADNg PS312 | 10 ug |
| Tampon 10x | 10 ul |
| Pst I et Sal I (10 U / pl) | 8 pl |
| dH 2 O | ~ |
| Total: | 100 ul |
Tableau 1. Mélange pour enzyme de restriction Digest.
- Précipitation d'ADN et la préparation
- Ajouter l'acétate de sodium 01:10 (3 M NaCOOCH 3 pH 5,2) et 2.5X le volume d'éthanol à 100% pour le produit à digérer; ajouter 20 ng / l de glycogène pour voir granulés faciles.
- Centrifuger à14000 rpm pendant 15 minutes à 4 ° C.
- Décanter le surnageant par basculement lentement le tube de centrifugeuse à l'envers et puis en tapant sur un mouchoir en papier, en s'assurant que la pastille est sécurisé dans le coin inférieur du tube et libre de l'éthanol.
- Ajouter 1 ml d'éthanol à 75%.
- Immédiatement tournent à 14000 rpm pendant 5 minutes à 4 ° C.
- Décanter le surnageant par inclinant lentement le tube à centrifuger à l'envers et puis en tapant sur un mouchoir en papier en vous assurant que le culot fixez au coin au fond du tube et libre de l'éthanol.
- Culot sec dans la centrifugeuse sous vide à 14 000 rpm pendant 5 minutes à 25-30 ° C, jusqu'à ce que sec et totalement exempt de l'éthanol.
- Ajouter 30 ul de TE ou stériles dH 2 O et laisser une nuit à 4 ° C avant de brièvement mélangeant avec un vortex.
- Le tableau 2 décrit comment créer le mélange d'injection de chaque ADN purifié pour l'injection.
- Conserver à -20 ° C. Après décongélation le mélange dansprojection, ralentit le tube à 14 000 rpm pendant 5 minutes pour débarrasser les particules de débris qui peuvent obstruer l'aiguille d'injection.
| Le matériel génétique | Concentration |
| PPA-EGL-4p:: GFP (Sali) | > 5 ng / pl (0.1-10ng/μl) |
| pRL3 (Pst) | > 1 ng / pl |
| ADNg PS312 (Pst + Sali) | > 60 ng / ul |
| dH 2 O | ~ |
| Total: | 30 pl |
Tableau 2. Mélange de PPA-PRL-1 par injection
2. Interférence ARN: In vitro, la synthèse à double brin d'ARN
- Utilisez PCR pour amplifier le gène d'intérêt. RHL091 5'-agtggatccGAAGGTCCATACGGGAGC-3 '(Site BamHI) et 5'-RHL092 tatctgcagGTGAGGAGTACCAGGAGAG-3 '(site PstI) ont été utilisées pour amplifier un fragment pb 464 génomique (position 3-466) à partir du vecteur pRL3 contenant du PPA-PRL-1 (tu92) allèle.
- Recueil du produit de PCR avec BamHI et PstI.
- Ligaturer le fragment à BamHI / PstI digérés pL4440 nourrir ARNi vecteur 2.
- Transformer le vecteur inséré dans des cellules compétentes et de les cultiver sur des plaques d'ampicilline milieu LB (50 pg / ml).
- Sélectionnez le vecteur succès inséré par PCR utilisant les amorces T7.
- Utilisez le T7 flanqué produit PCR contenant le gène PRL-1 pour faire l'ARN double brin ARNdb) utilisant le bloc-IT ARNi synthèse kit (Invitrogen).
- La concentration ARNdb est le meilleur si> 200 ng / ul, jusqu'à 1 pg / pl pour l'injection.
- Conserver à -20 ° C. Après décongélation le mélange pour injection, ralentit le tube à 14 000 rpm pendant 5 minutes pour éliminer les particules de débris qui pourraient obstruer les injectiol'aiguille n.
3. Microinjection: protocole pour l'injection des transgènes et / ou ARNdb
- Aiguilles d'injection
- Réglez l'aiguille Narishige extracteur (modèle #: PC-10) de température:
- Tournez le bouton en bas à «Heater No.2».
- Tournez le "Adj chauffage n ° 2." bouton jusqu'à ce panneau de lit de 55,0 à 60,0 ° C pendant pointe de l'aiguille effilée de longueurs variables.
- Tournez le bouton du bas du dos à la "Etape 1" (tire l'aiguille en une seule étape).
- Chargez l'aiguille dans la chambre et assurez-vous qu'il soit sécurisé.
- Appuyez sur le bouton "Démarrer" (bouton rouge) et permettre à l'aiguille d'être tiré avec tous les poids (ce qui devrait faire deux aiguilles identiques dans des directions opposées).
- Retirez l'aiguille de la chambre et le ranger dans une plaque de culture en plastique maintenu en place par Play-Doh pour empêcher la poussière de s'accumuler sur les aiguilles.
- Réglez l'aiguille Narishige extracteur (modèle #: PC-10) de température:
- Tapis de montage
- Dans un tube à centrifuger de 1,5 ml, faire une solutio Agar 2% Noblen en ajoutant 0,02 g d'agar Noble à 1 ml d'H 2 O. L'agar peut être conservé à 4 ° C pendant jusqu'à un an.
- Bien mélanger et faire fondre la gélose dans un bloc thermique mis à> 88 ° C
- Utiliser une micropipette 1 ml, placer une goutte de liquide Agar Noble 2% au milieu de la lame de verre (Fisher, 12-544-F).
- Aplatir en plaçant une autre lame de verre sur le dessus de la goutte.
- Répéter «Étape Drop" jusqu'à ce qu'il y est une couche de cinq lames de verre.
- Retirez chaque lame de verre en faisant glisser les lames de verre mutuellement.
- Dry aplatir pad gélose sur des lames de verre dans un four sous vide à 70 ° C pendant 4 heures à une nuit (ou à température ambiante pendant la nuit).
- Faire coussinets d'injection multiple et de stocker pour une utilisation future.
- Microinjection dans les gonades hermaphrodites
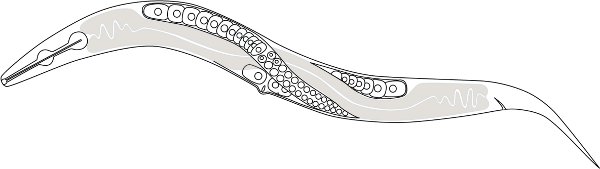
Figure 1. Un dessin schématique de la P. pacificus anatnomie. Les cellules nucléées sont claires cellules germinales femelles (ovocytes) et la partie grisée est l'intestin. Une seule gonade antérieure distale est montré, mais un préavis de deux gonades distale se croisent dorsalement vers la mi-corps.
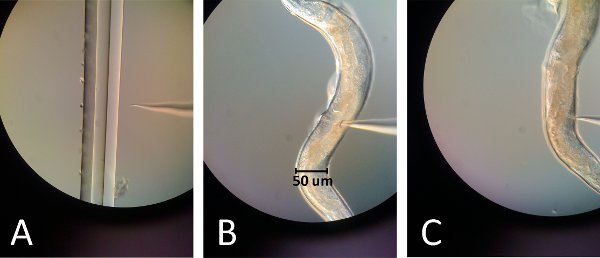
Figure 2. Images de microinjection. (A) La pointe de l'aiguille d'injection est en discussion avec la ligne droite de la pièce tiré capillaire. En touchant légèrement la pointe de l'aiguille pour que le bord, la pointe de l'aiguille se brise, tout en conservant une pointe acérée. (B) Les inserts aiguille dans le haut des gonades juste au-dessus de la courbure intestinale pour la première injection. (C) Les inserts aiguille dans le bas juste en dessous de la gonade la courbure intestinale pour la deuxième injection.
- Assurez-vous que le contraste et la mise en cisaillement DIC est idéal pour visualiser les gonades hermaphrodites.
- Charge de 1,0 à 2,0 ul de mélange par injection dans le tirécapillaires aiguille.
- Placez l'aiguille dans le manipulateur microinjection; jauges de pression du réservoir d'azote devrait être fixé à des conditions idéales (10-20 psi pour 0,5 à 1 sec.)
- Cassez le bout de l'aiguille en le touchant légèrement à bord d'un tube mince tiré capillaire placé sur une lame (figure 2A).
- Aiguille glisser disjoncteur: la partie la plus fine d'un capillaire tiré placé sur une lame de verre dans une goutte d'huile
- Une fois l'aiguille est cassée il peut être lieu à une position de ralenti lorsque vous choisissez votre ver au pad (P. pacificus ont une fenêtre de 5 minutes pour injection avant qu'elles sèchent et meurent-out).
- Utiliser une assiette pleine de vers adultes J4-jeunes, versez l'huile de paraffine suffisante (lourd) pour juste couvrir tous les vers dans OP50 tapis bactérien.
- Choisissez un ver et le placer sur le pavé d'injection.
- Placez la lame de verre avec le ver sur le microscope, la position du ver gonades en direction de l'aiguille et la vulve loin de la nécessitéLe (figure 2B, 2C).
- Abaissez l'aiguille à la position de la vue microscope.
- Position de la gonade en haut et l'aiguille dans le même plan focal (figure 2B).
- Poke délicatement le ver et la pompe d'injection dans le mélange; ooctyes séparant vers l'extrémité distale indiquent une injection réussie (Pour optimiser transgène ou la livraison ARNdb, vous devriez voir lors de l'injection d'une vague d'expansion dans la gonade qui se poursuit jusqu'à ce qu'elle soit proche de l'extrémité distale pourboire).
- Repositionner l'aiguille pour injecter de la baisse des gonades et injection de rappel, mais puisque cette gonade est sous l'intestin la propagation des ovocytes ne sera pas visible et est donc plus difficile à réaliser (figure 2C).
- Normale vers la recherche indique une injection réussie après l'injection, il n'y devrait pas y avoir endommagé les gonades (saillie hors de la vulve ou sauté à l'intérieur de la cavité du corps).
- Placez le dos aiguille dans la position de ralenti.
- Préparer pour sauver le ver.
- Ajouter unbaisse de (0,5 pi) de tampon M9 sur le coussin où le ver injecté est placé.
- En utilisant certains OP50 bactéries sur votre choix, appuyez sur la vis sans fin avec l'OP50, et il devrait s'en tenir. Nous n'utilisons pas pipeter à la bouche.
- Placez le ver sur la plaque ensemencée avec 50 points pl d'OP50, 2-4 vers peuvent être sauvés sur ces plaques.
- Post-injection de stockage et de dépistage pour la transgénèse
- Boutique injecté vers (P 0) à 20 ° C pendant environ 4 jours pour pondre des oeufs et de grandir F 1.
- Les vers l'écran le quatrième jour d'phénotype sélectionné (Pour l'écran de transgénèse, recherche d'animaux de roulement exprimant le PPA-PRL-1 marqueur dominant).
- Choisissez célibataire indépendant F 1 'animaux s avec le phénotype observé à de nouvelles semé la plaque et les conserver à 25 ° C; cette température favorise la formation de lignées stables de F 1' s.
- Simple F 2 F 1 à partir indépendante lignes. Individuelles F 2 ont les mêmes taux de transmission du transgène. Nous avons souvent d'obtenir> 15 F 2 lignes par transformée F 1 animal.
- Boutique générations suivantes à 25 ° C.
- Le taux de transmission de rouleaux demeure habituellement constant après la F 4 générations, il est donc nécessaire à ce moment de déterminer le niveau d'expression du transgène cible (PPA-EGL-4p:: GFP) pour chaque ligne. Expression de la GFP peut ne pas corréler avec le degré de pénétrance du phénotype rouleaux dominante.
- Post-injection de stockage et de dépistage des phénotypes ARNi
- Boutique injecté vers (P 0) à 20 ° C pendant environ 4 jours pour déposer et de grandir F 1.
- Ecran F 1 vers le quatrième jour de phénotype sélectionné (Pour l'écran pour phénotype knockdown ARNi, la recherche de phénotypes pénétrant qui peuvent être associés à la perte de l'activité du gène cible, dans notre cas, la perte du PPA-PRL-1 phénotype).
- Dans notre expérience, le phénotype knockdown non rouleau est perdu dans> 97% de la F 2.
4. Les résultats représentatifs:
1. Résultat de la transgénèse
| Session | Injecté P 0 | F 1 Rouleaux | % Transgénique F 2 | % De transmission moyen après 2 F |
| 1 | 60 | 2 | (Ligne 1) 0% (Ligne 2) 13% | NA 13% ± 10 |
| 2 | 40 | 1 * | (Ligne 3) 0% | NA |
| 3 | 40 | 0 | 0% | NA |
| 4 | 40 | 1 | (Ligne 4) 0% | NA |
| 5 | 20 | 0 | 0% | NA |
| 6 | 40 | 1 | (Ligne 5) 26% | 22% ± 10 |
* Un rouleau mâle qui n'a pas franchi; NA: Non applicable
Résultats Tableau 3 du PS312 injecté avec PPA-EGL-4p.:: GFP (Sal I digéré), pRL3 (rouleau) (Pst I digéré), et ADNg PS312 (PstI et Sali digéré).

La figure 3 (A) de type sauvage (B, C) Une écurie F 4 pRL3; PPA-EGL-4p.:: GFP lignée transgénique montrant la tête neurone GFP expression.
2. Résultat de l'interférence ARN

Figure 4. ARN injecté PRL-1 mutantsmontrent knockdown complète de "rouler" la locomotion (A). PRL-1 rouleau de gain-de-fonction mutant tu92. (B) «knock down» PRL-1 de type sauvage présentent une posture mutant normale et la locomotion. (C) injecté PRL-1 (bas) a également plus de corps que PRL-1 mutante (en haut). (D) Le corps d'injection plus PRL-1 (bas) est également plus long que le PS312 type sauvage (en haut). Le phénotype plus le corps a également été observée dans le rol-5 (SQT-1) knockdown ARNi de C. elegans N2 (données non présentées).
| rouleau | non-roll | |
| Un PRL-1 ARNdb (200 ng / pl) | 13 | 21 |
| B PRL-1 ARNdb (1000 ng / pl) | 9 | 16 |
| de contrôle | 20 | 2 |
Tableau 4. Résumé des PPA-PRL-1 injections ARNdb. (A) [ARNdb] = 200 ng / l; (B) [ARNdb] = 1000 ng / ul. P = 0,0019 et 0,041 par le test exact de Fisher, deux queues, pour 200 et 1000 injections ng / ul, respectivement.
Discussion
Populations de P. pacificus sont trouvés en association étroite avec diverses espèces de scarabées dans le monde et est un nématode modèle intermédiaire entre vivre libre et les nématodes parasitaires. La force du P. pacificus comme un organisme modèle émergent réside dans l'intégration de ses cartes génétiques et physiques qui favorisent la cartographie de positionnement des mutants isolés de impartiale écrans avant génétique (c'est à dire pas seulement pour les gè...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs sont très reconnaissants à RJ Sommer et X Wang pour l'aide aux micro-injection, ainsi que des commentaires perspicaces de la évaluateurs anonymes. Ce travail est soutenu par le NIH octroi SC2GM089602.
matériels
| Name | Company | Catalog Number | Comments |
| Produit: | Catalogue #: | Fournisseur: | |
|---|---|---|---|
| DMI3000 microscope à injection | DMI3000 | Leica | |
| Manipulateur microinjecteur (entraînement direct) | Conjointe Narashige BC-Ball 3 | Tritech recherche | |
| Extracteur d'aiguilles | Narashige PC-10 | Tritech recherche | |
| Microinjecteur ™ All-numérique multi-pression du système | Narashige MINj-D | Tritech recherche | |
| GeneElute ™ ADN génomique des mammifères Miniprep Kit | G1N70 | Sigma | |
| pJet Clonage Jet Kit | K1231 | Fermentas | |
| GeneJET plasmide Miniprep kit | K0502 | Fermentas | |
| DNA Clean & concentrateur ™ | D4005 | Zymo recherche | |
| BLOC-IT ™ ARNi TOPO ® kit de transcription | K3500-01-0 & K36501 | Invitrogen | |
| Difco ™ Agar Noble | DF0142-15-2 | Fisher Scientifi | |
| Couvercle en verre de microscope (1,5 - 0,19 mm d'épaisseur 0,16 à; Taille: 50 x 45mm) | 12 à 554-F | Fisher Scientific | |
| Capillaires en verre (filament) | 615000 | Systèmes AM | |
| Huile de paraffine (Lourd) | O122-1 | Fisher Scientific | |
| KH 2 PO 4 | P386-500 | Fisher Scientific | |
| Na 2 HPO 4 | AC20651-5000 | Fisher Scientific | |
| NaCl | BP3581 | Fisher Scientific | |
| MgSO 4 | M80-500 | Fisher Scientific |
Références
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Ahringer, J. Reverse Genetics. Wormbook. , (2006).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO J. 10, 3959-3970 (1991).
- Junio, A. J., Li, X., Massery, H. C., Nolan, T. J., Lamitina, S. T., Sundaram, M. V., Lok, J. B. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3' UTR. Exp. Parasitology. 118, 253-265 (2008).
- Schlager, B., Wang, X., Braach, G., Sommer, R. J. Molecular cloning of a dominant roller mutant and establishment of DNA-mediated transformation in the nematode Pristionchus pacificus. Genesis. 47, 300-304 (2009).
- Hong, R. L., Sommer, R. J. Pristionchus pacificus: a well-rounded nematode. Bioessays. 28, 651-659 (2006).
- Hong, R. L., Sommer, R. J. Chemoattraction in Pristionchus nematodes and implications for insect recognition. Curr. Biol. 16, 2359-2365 (2006).
- Rudel, D., Riebesell, M., Sommer, R. J. Gonadogenesis in Pristionchus pacificus and organ evolution: development, adult morphology and cell-cell interactions in the hermaphrodite gonad. Dev. Biol. 277, 200-221 (2005).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 11, 802-805 (1994).
- Chaudhuri, J., Parihar, M., Pires-daSilva, A. An Introduction to Worm Lab: from Culturing Worms to Mutagenesis. J. Vis. Exp. (47), e2293-e2293 (2011).
- Evans, T. C. Transformation and Microinjection. Wormbook. , (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon