Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
RNAi опосредованного Нокдаун гена и трансгенез по Микроинъекция в Necromenic нематода Pristionchus расШсиз
В этой статье
Резюме
В модельных организмов, трансгенез может манипулировать функций генов в то время как РНК-интерференции может нокдаун конкретных стенограммы мРНК 1-2. Этот протокол направлен на иллюстрации методов, необходимое для внедрения стабильно передается ДНК и переходные двухцепочечной РНК в necromenic нематоды Pristionchus расШсиз Для исследований в эволюционной, развития и поведенческих биологии.
Аннотация
Хотя это и более доступными для новых модельных организмов для получения полной последовательности генома, дальнейшего углубленного функции гена и выражения анализов, РНК-интерференция и стабильной трансгенез остается ограниченным во многих видов из-за особенности анатомии и молекулярной клеточной биологии организма. Например, за пределами Caenorhabditis корону группа, которая включает Caenorhabditis Элеганс 3, стабильно передается трансгенных линий, не связанных с Caenorhabditis видов не было зарегистрировано в этом благовидный типу (нематод), за исключением Strongyloides stercoralis 4 и Pristionchus расШсиз 5. Чтобы облегчить расширение роли П. расШсиз в изучении развития, эволюции и поведения 6-7, мы описываем здесь современные методы использовать микроинъекции для создания трансгенных животных и генной сбить путем РНК-интерференции. Как гонад P. расШсиз является syncitial и способных включения ДНК и РНК в ооцитах при доставке прямой микроинъекции. В отличие от С. Элеганс однако, стабильное наследование трансгенов и соматических выражение в П. расШсиз требует добавления собственной геномной ДНК переваривают эндонуклеазами дополнением к концам целевой трансгенов и инжекции маркеры 5. Кроме того носителя геномной ДНК похожа на требование для экспрессии трансгена в Strongyloides stercoralis 4 и в половых клетках C. Элеганс. Тем не менее, не ясно, если специальные требования для животных собственной геномной ДНК происходит потому, что П. расШсиз сома очень эффективно глушителей несложных мульти-копии генов или что внехромосомными массивы в P. расШсиз требуют геномных последовательностей для правильной сборки кинетохор во время митоза. Вентральной миграции двуруком (didelphic) гонад у гермафродитов еще более усложняет возможность вводить и половых желез в отдельных червей 8. Мы также демонстрируют использование микроинъекции в нокдаун доминирующим мутант (ролик, tu92) путем введения двухцепочечной РНК (дсРНК) в гонадах получить не-подвижного F 1 потомства. В отличие от С. Элеганс, но как и большинство других нематод, П. расШсиз PS312 не восприимчивы к системным RNAi через кормление и замачивания и, следовательно, дсРНК должны управлять микроинъекции в syncitial половых желез. В этом текущем исследовании, мы надеемся, чтобы описать процесс микроинъекции, необходимых для преобразования PPA-EGL-4 промоутера:: GFP репортер слияния и нокдаун доминирующим ролик ПРЛ-1 (tu92) мутант в визуально информативные протокола.
протокол
1. Трансгенез: ДНК подготовки
- Доминирующие совместно инъекций маркера: pRL3 [PPA-ПРЛ-1 (tu92)]
PRL3 плазмиды доминирующей совместно инъекции маркер для визуального выявления успешных событий трансформации. Эта плазмида кодирует доминирующие мутантный аллель (tu92) из PPA-ПРЛ-1 ген тесно связан с SQT-1 коллагена гена C. Элеганс и превращает дикого типа синусоидальной передвижения по часовой стрелке в скручивания движений вдоль тела червя оси 1,5. Преобразовано животных очень похожа на популярный доминирующим маркер выбора РОЛ-6 (su1006), используемые в С. Элеганс за последние 20 лет. - Целевая репортер трансгенов: PPA-EGL-4p:: GFP
Интересующего гена могут быть связаны или транскрипционно трансляционно для GFP кодирующей последовательности 9. В этом исследовании, PPA-EGL-4promoter:: GFP (EGL-4, цГМФ зависимой протеинкиназы) было использоватьг, чтобы определить, 2 кб фрагмент перед началом перевода может даровать GFP выражение в П. расШсиз PS312. Этот вектор содержит GFP GFP кодирующей области с измененными
интроны и многоцелевой PPA-RPL-23 3 'УТР терминатор 5 любезно предоставлены Xiaoyue Ванг и Ральф Дж. Соммер (Max-Planck Institute, Тюбинген, Германия, ЕС). - Геномная ДНК: PS312
Добавление дикого типа П. расШсиз PS312 геномной ДНК необходима для получения стабильного наследования трансгена, в частности, от трансгенных животных F 1 на их потомство F 2 5. Пока еще не уверен в том, геномной ДНК образует сложные дополнительные хромосомные массивов с двумя трансгенов (совместно инъекций маркера ПРЛ-3 и PPA-EGL-4p:: GFP репортер), аналогичные тем, которые наблюдаются в стабильных F 2 трансгенных линий в C. Элеганс 3. Тем не менее, требование о геномной ДНК и трансгенов поделиться идентичны cohesiве свесы наводит на мысль, образования сложных экстра-хромосомной массивы клеток хозяина может признать для правильной передачи ДНК (gDNA подготовлен с использованием Сигма G1N10 комплект). - ДНК пищеварения
Ограничение ферменты используются для линеаризации PPA-EGL-4p:: GFP векторной ДНК и производить липкой свесы совместимый с со-инъекции маркер pRL3 и PS312 gDNA. Смешать, нажав, не вортексе. Выдержите в течение одного часа при температуре 37 ° C.
| pRL3 | 4 мкг |
| 10xbuffer | 10 мкл |
| PstI (10 ед / мкл) | 4 мкл |
| дН 2 O | ~ |
| Всего: | 100 мкл |
| PPA-EGL-4p:: GFP | 4 мкг |
| 10-кратный буфер | 10 мкл |
| SalI (10 ед / мкл) | 4 мкл |
| дН 2 O | ~ |
| Всего: | 100 мкл |
| gDNA PS312 | 10 мкг |
| 10-кратный буфер | 10 мкл |
| Pst я и я Сал (10 ед / мкл) | 8 мкл |
| дН 2 O | ~ |
| Всего: | 100 мкл |
Таблица 1. Смесь для рестрикции Digest.
- ДНК осадков и подготовка
- Добавить 1:10 ацетата натрия (3 M NaCOOCH 3 рН 5,2) и в 2,5 раза объема 100% этанола, чтобы переварить продукт, добавить 20 нг / мкл гликогена, чтобы увидеть гранулы легче.
- Центрифуга при 14000 оборотов в минуту в течение 15 минут при 4 ° C.
- Декантируйте супернатант Типпинг медленно центрифужную пробирку с ног на голову и затем коснувшись ее на папиросной бумаги, убедившись, что шарик в безопасности в нижний угол трубку и свободного этанола.
- Добавьте 1 мл 75% этанола.
- Сразу спина при 14000 оборотов в минуту в течение 5 минут при температуре 4 ° C.
- Декантируйте супернатант медленно опрокидывания центрифужную пробирку с ног на голову, а затем нажав его на папиросной бумаги убедившись, что шарик его безопасным в нижний угол трубку и свободного этанола.
- Сухие гранулы в вакуумной центрифуге при 14000 оборотов в минуту в течение 5 минут на 25-30 ° С, до полного высыхания и полностью свободным от этанола.
- Добавить 30 мкл ТЕ или стерильной дН 2 O и оставить на ночь при 4 ° С до смешивания кратко вихря.
- Таблица 2 описывает, как создать инъекция смеси из каждой очищенной ДНК для инъекций.
- Хранить при -20 ° C. После оттаивания смеси для инъекций, спина вниз по трубе в 14 000 оборотов в минуту в течение 5 минут, чтобы избавить частиц космического мусора, которые могутзасорить инъекционной иглой.
| Генетический материал | Концентрация |
| PPA-EGL-4p:: GFP (SalI) | > 5 нг / мкл (0.1-10ng/μl) |
| pRL3 (PstI) | > 1 нг / мкл |
| gDNA PS312 (PstI + SalI) | > 60 нг / мкл |
| дН 2 O | ~ |
| Всего: | 30 мкл |
Таблица 2. PPA-ПРЛ-1 инъекция смеси
2. РНК-интерференция: В пробирке двойной синтез РНК
- Использование ПЦР для амплификации гена. RHL091 5'-agtggatccGAAGGTCCATACGGGAGC-3 '(BamHI сайт) и RHL092 5'-tatctgcagGTGAGGAGTACCAGGAGAG-3' (PstI сайта) были использованы для усиления 464 б.п. геномных фрагментовМента (положение 3-466) от pRL3 вектор, содержащий PPA-ПРЛ-1 (tu92) аллеля.
- Дайджест ПЦР продукт с BamHI и PstI.
- Лигировать фрагмент BamHI / PstI переваривается pL4440 RNAi кормления вектор 2.
- Преобразование вставлен вектор в компетентные клетки и выращивать их на Ампициллин LB пластины СМИ (50 мкг / мл).
- Выберите успешно вставлен вектор методом ПЦР с использованием T7 праймеров.
- Используйте T7 окружении ПЦР продукт, содержащий ПРЛ-1 гена, чтобы сделать двухцепочечной РНК дсРНК) с использованием БЛОК-IT RNAi синтеза комплект (Invitrogen).
- Концентрация дсРНК Лучше всего, если> 200 нг / мл, до 1 мкг / мкл для инъекций.
- Хранить при -20 ° C. После оттаивания смеси для инъекций, спин вниз по трубе в 14 000 оборотов в минуту в течение 5 минут, чтобы избавиться от частиц космического мусора, которые могут засорить инъекционной иглой.
3. Микроинъекция: Протокол для инъекций трансгенов и / или дсРНК
- Инъекция иглы
- Установить Narishige иглы съемник (модель #: PC-10) температура:
- Поверните нижнюю ручку "Нагреватель № 2".
- Включите "№ 2 Нагреватель Adj". ручку, пока панель читается 55.0-60.0 ° С в течение конические кончика иглы разной длины.
- Поверните нижнюю ручку обратно в "Шаг 1" (Тянет иголку в один шаг).
- Нагрузка иглы в камеру и убедитесь, что это безопасно.
- Нажмите кнопку "Пуск" (красная трубка) и позволяют иглы вырваться со всеми весами (это должно сделать две одинаковые иглы в противоположных направлениях).
- Удалите иглу из камеры и храните в пластиковой пластиной культуры закреплен на Play-Doh для предотвращения пыли на иглы.
- Установить Narishige иглы съемник (модель #: PC-10) температура:
- Монтажные колодки
- В 1,5 мл трубки центрифуги, делают 2% Благородный решение агар, добавив 0,02 г благородных Агар к 1 мл H 2 O. Агар можно хранить при температуре 4 ° С до года.
- Тщательно перемешать ирасплавить агар в тепло блок установлен в> 88 ° C.
- Использование 1 мл микропипетки, поместите каплю жидкости 2% Благородный Агар к середине стекло (Фишер, 12-544-F).
- Свести, поставив другую стекло в верхней части капли.
- Повторите "Капля Шаг", пока не будет слой пяти-стекло.
- Удалите каждую стекло, сдвинув стекол друг от друга.
- Сухой сгладить агар накладка на предметных стеклах в вакуумной печи при температуре 70 ° С в течение 4 часов в течение ночи (или при комнатной температуре в течение ночи).
- Сделайте несколько колодки инъекций и хранить для будущего использования.
- Микроинъекция в гермафродитами гонад
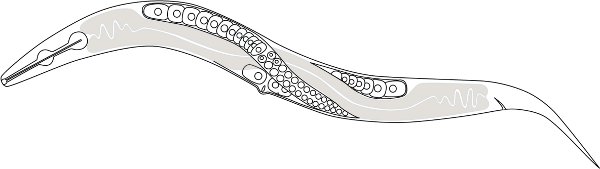
Рисунок 1. Схематическое изображение P. расШсиз анатомии. ясно ядерных клеток составляют женщины половых клеток (яйцеклеток) и серым цветом часть кишечника. Только один дистальных передней гонад показаноно обратите внимание на два дистальных гонад пересекаются друг с другом спинной около середины тела.
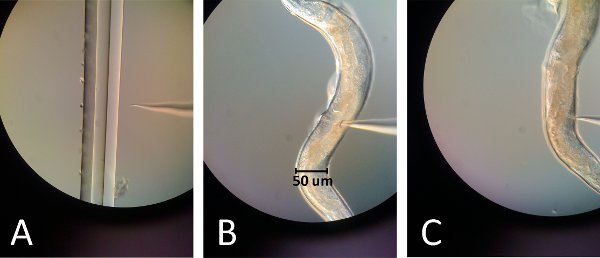
Рисунок 2. Изображения микроинъекции. () Конец инъекционной иглы находится в фокусе с крайней правой линии вытащил капиллярной части. По слегка касаясь кончиком иглы, что край, иглы должны ломаться с сохранением острие. (В) игла вставляется в верхнюю гонад чуть выше кишечнике кривизны для первой инъекции. (C) игла вставляется в нижнюю гонад чуть ниже кишки кривизны для второй инъекции.
- Убедитесь, что контраст и DIC настройки стрижки идеально подходит для просмотра гермафродит половых желез.
- Нагрузка 1,0-2,0 мкл инъекции смеси в капиллярной вытащил иглу.
- Место иголку в микроинъекции манипулятором; манометры азота бак должен быть установлен в идеальных условиях (10-20 фунтов на квадратный дюймза 0,5-1 сек).
- Перерыв иглы, коснувшись его слегка краю тонко потянул капилляр помещают на предметное стекло (рис. 2A).
- Иглы выключателя слайд: тонкие части вытащил капиллярной размещены на предметное стекло в каплю масла
- Как только игла нарушается оно может быть места в положение холостого хода в то время как вы выбрали вашу червя площадку (П. расШсиз есть 5 минут, окно для инъекций, прежде чем они сухие, и умирают).
- Использование пластин полный Д4-червей молодых взрослых, влить достаточно нефти парафина (тяжелые), чтобы только покрыть все черви в OP50 бактериального газона.
- Выберите червя и разместить его на инъекции площадку.
- Место стекло с червя на микроскоп, положение гонад червя в направлении иглы и вульвы от иглы (рис. 2В, 2С).
- Опустите иглу в позиционировать микроскопа зрения.
- Установите верхний гонад и иглы в той же фокальной плоскости (рис. 2В).
- Ткните червь мягко и насос в инъекции смеси; ooctyes разделения на дистальный конец указывают успешных инъекций (Для оптимизации трансгена или дсРНК доставки, вы должны увидеть при инъекции волна расширения в половых желез, которая продолжается, пока он находится недалеко от дистального совет).
- Перемещение иглы для введения в нижнюю гонад и повторить инъекции, однако так как это гонад находится под кишечнике распространение ооцитов не будет видно и, следовательно, более трудно достичь (рис. 2С).
- Нормально ищет червя указывает на успешное инъекции после инъекции, там не должно быть никаких повреждений половых желез (выступает из вульвы или выскочил внутри полости тела).
- Место иглу в положение холостого хода.
- Приготовьтесь к спасению червя.
- Добавить каплю (0,5 мкл) буфера M9 на площадку, где вводится червь помещается.
- Используя некоторые OP50 бактерий на ваш выбор, сенсорный червя с OP50, и он должен придерживаться. WE не используют рот пипеткой.
- Место червя на пластине засеяно 50 мкл пятна OP50, 2-4 черви могут быть спасены на таких пластин.
- После инъекции хранения и скрининг на трансгенез
- Магазин вводят черви (P 0) при 20 ° С в течение ~ 4 дня, чтобы отложить яйца и вырастить F 1.
- Экран червей на четвертый день для выбранных фенотип (На экран для трансгенез, поиск подвижного животных выразив PPA-ПРЛ-1 доминирующим маркер).
- Выберите одного независимого F 1 'с с животными наблюдали фенотипа к новым посеяны пластины и храните при температуре 25 ° C; эта температура способствует образованию устойчивых линий от F 1' s.
- Одноместный F 2 от независимых F 1 линий. Индивидуальные F 2 строки имеют схожие скорости передачи трансгена. Мы часто получаем> 15 F 2 строк на преобразован F 1 животное.
- Магазин последующих поколений при 25 ° C.
- Скорость передачи роликов обычно остается постоянной после F 4 поколения, при этом необходимо в это время, чтобы определить уровень экспрессии целевого трансгена (PPA-EGL-4p:: GFP) для каждой отдельной строке. GFP выражения не коррелируют со степенью пенетрантность доминирующим фенотип ролика.
- После инъекции хранения и скрининг на фенотипы RNAi
- Магазин вводят черви (P 0) при 20 ° С в течение ~ 4 дня, чтобы заложить и вырастить F 1.
- Экран F 1 червей на четвертый день для выбранных фенотип (для выявления РНК-интерференции нокдаун фенотип, поиск для капиллярного фенотипов, которые могут быть связаны с потерей целевой активности генов, в нашем случае потери PPA-ПРЛ-1 фенотип).
- По нашему опыту, не-ролик нокдаун фенотип теряется в> 97% от F 2.
4. Представитель результаты:
р "> 1. Результат трансгенеза| Сессия | Injected P 0 | F 1 Ролики | % Трансгенных F 2 | Средний% после передачи F 2 |
| 1 | 60 | 2 | (Линия 1) 0% (Линия 2) 13% | Не Доступно 13% ± 10 |
| 2 | 40 | 1 * | (Линия 3) 0% | Не Доступно |
| 3 | 40 | 0 | 0% | Не Доступно |
| 4 | 40 | 1 | (Линия 4) 0% | Не Доступно |
| 5 | 20 | 0 | 0% | Не Доступно |
| 6 | 40 | 1 | (Линия 5) 26% | 22% ± 10 |
. Таблица 3 Результаты вводят PS312 с PPA-EGL-4p:: GFP (Сал я перевариваются), pRL3 (ролик) (Pst я переваривается) и gDNA PS312 (PstI и SalI переваривается).

Рисунке 3 () дикого типа (В, С) стабильная F 4 pRL3; PPA-EGL-4р.:: GFP трансгенные линия, показывающая голову нейрона GFP выражения.
2. Результат РНК-интерференции

Рисунок 4. РНК вводили ПРЛ-1 мутантов показать полный нокдаун "скользящий" передвижения. () ПРЛ-1 ролик получить-функции мутанта tu92. (B) "сбил" ПРЛ-1 мутант выставку нормальной позе дикого типа и передвижения. (C) Injected ПРЛ-1 (нижняя) также имеет больше боды, чем ПРЛ-1 мутант (сверху). (D) больше тела вводят ПРЛ-1 (нижняя) также больше, чем дикого типа PS312 (сверху). Больше тела фенотип наблюдался также в РОЛ-5 (SQT-1) RNAi нокдаун C. Элеганс N2 (данные не представлены).
| рулон | не-ролл | |
| ПРЛ-1 дсРНК (200 нг / мкл) | 13 | 21 |
| В ПРЛ-1 дсРНК (1000 нг / мкл) | 9 | 16 |
| контроль | 20 | 2 |
Таблица 4. Резюме PPA-ПРЛ-1 дсРНК инъекций. () [ДсРНК] = 200 нг / мкл; (B) [дсРНК] = 1000 нг / мкл. Р = 0,0019 и 0,041 на точный критерий Фишера, двусторонний, на 200 и 1000 нг / мкл инъекции, соответственно.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
П. расШсиз населения находятся в тесной связи с различными скарабей видов по всему миру и представляет собой модель нематоды промежуточным между свободными и паразитических нематод. Сила П. расШсиз в качестве новой модели организма заключается в интеграции ее генетические и...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы очень благодарны RJ Соммер и X Ван за помощью микроинъекции, а также проницательные комментарии от анонимных рецензентов. Эта работа проводится при поддержке гранта NIH SC2GM089602.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Продукт: | Каталог #: | Поставщик: | |
|---|---|---|---|
| DMI3000 инъекций микроскопом | DMI3000 | Leica | |
| Microinjector манипулятор (прямой привод) | Narashige ВС-3 Шарнир | Tritech исследований | |
| Иглы Puller | Narashige PC-10 | Tritech исследований | |
| MicroInjector ™ Все-Digital Multi-давление в системе | Narashige MINJ-D | Tritech исследований | |
| GeneElute ™ млекопитающих Геномная ДНК Miniprep Kit | G1N70 | Сигма | |
| pJet Клонирование Jet комплект | K1231 | Fermentas | |
| GeneJET плазмиды Miniprep комплект | K0502 | Fermentas | |
| Чистая ДНК и концентратор ™ | D4005 | ZYMO исследований | |
| БЛОК-IT ™ RNAi ТОПО ® транскрипции комплект | K3500-01-K3650-01 | Invitrogen | |
| Difco ™ Агар Благородный | DF0142-15-2 | Фишер Scientifi | |
| Микроскоп покровного стекла (1,5 - 0,16 до 0.19mm толстый; Размер: 50 х 45 мм) | 12-554-F | Fisher Scientific | |
| Стекло капилляров (нить) | 615000 | AM системы | |
| Парафин нефти (жесткие) | O122-1 | Fisher Scientific | |
| KH 2 PO 4 | P386-500 | Fisher Scientific | |
| Na 2 HPO 4 | AC20651-5000 | Fisher Scientific | |
| NaCl | BP3581 | Fisher Scientific | |
| MgSO 4 | M80-500 | Fisher Scientific |
Ссылки
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Ahringer, J. Reverse Genetics. Wormbook. , (2006).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO J. 10, 3959-3970 (1991).
- Junio, A. J., Li, X., Massery, H. C., Nolan, T. J., Lamitina, S. T., Sundaram, M. V., Lok, J. B. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3' UTR. Exp. Parasitology. 118, 253-265 (2008).
- Schlager, B., Wang, X., Braach, G., Sommer, R. J. Molecular cloning of a dominant roller mutant and establishment of DNA-mediated transformation in the nematode Pristionchus pacificus. Genesis. 47, 300-304 (2009).
- Hong, R. L., Sommer, R. J. Pristionchus pacificus: a well-rounded nematode. Bioessays. 28, 651-659 (2006).
- Hong, R. L., Sommer, R. J. Chemoattraction in Pristionchus nematodes and implications for insect recognition. Curr. Biol. 16, 2359-2365 (2006).
- Rudel, D., Riebesell, M., Sommer, R. J. Gonadogenesis in Pristionchus pacificus and organ evolution: development, adult morphology and cell-cell interactions in the hermaphrodite gonad. Dev. Biol. 277, 200-221 (2005).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 11, 802-805 (1994).
- Chaudhuri, J., Parihar, M., Pires-daSilva, A. An Introduction to Worm Lab: from Culturing Worms to Mutagenesis. J. Vis. Exp. (47), e2293-e2293 (2011).
- Evans, T. C. Transformation and Microinjection. Wormbook. , (2006).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены