A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת פרמטר-Multi של הפתיחה הנקבובית מעבר החדירות בלב עכבר מבודד המיטוכונדריה
In This Article
Summary
פרוטוקול spectrofluorometric למדידת פתיחת מעבר המיטוכונדריה חדירות הנקבובית בלב עכבר מבודד המיטוכונדריה מוצג כאן. הבדיקה כרוכה במדידה בו הזמנית של Ca מיטוכונדריה 2 + טיפול, קרום נפח פוטנציאלי ומיטוכונדריה המיטוכונדריה. ההליך לקבלת לב איכותי ופונקציונלי המיטוכונדריה הוא גם תאר.
Abstract
נקבובי מעבר חדירות המיטוכונדריה (mtPTP) הוא ערוץ מסוים שאינם נוצר בקרום המיטוכונדריה הפנימי להובלה מומסת עם מסה מולקולרית קטנה מ -1.5 kDa. למרות הזהות המוחלטת המולקולרית של נקבובי היא עדיין תחת דיון, חלבונים כגון cyclophilin D, VDAC וANT לתרום להיווצרות mtPTP. למרות המעורבות של פתיחת mtPTP במוות של תאים מבוססת היטב 1, מצטבר ראיות מצביע על כך שmtPTP משרת תפקיד פיסיולוגי במהלך המיטוכונדריה Ca 2 + הומאוסטזיס 2, bioenergetics וחמזור איתות 3.
פתיחת mtPTP מופעלת על ידי מטריקס Ca 2 + אבל פעילותו יכולה להיות מווסתת על ידי מספר גורמים אחרים כגון סטרס חמצונים, דלדול נוקלאוטיד אדנין, ריכוזים גבוהים של פי, שלילת קוטביות הקרום המיטוכונדריה או תרה, וחומצות שומן ארוכת שרשרת 4. במבחנה, mtPTP פתיחה יכולה להיות achieved על ידי הגדלת ריכוז + Ca 2 בתוך מטריצת המיטוכונדריה באמצעות תוספת חיצונית של Ca 2 + (קיבולת אצירת סידן). כאשר Ca 2 + רמות בתוך המיטוכונדריה מגיע לסף מסוים, ומאפשר mtPTP פותח Ca 2 + שחרור, פיזורו של כוח מניע הפרוטונים, קריסת פוטנציאל קרום וגידול בהיקף מטריקס המיטוכונדריה (נפיחות) שסופו של דבר מוביל לקרע של קרום חיצוני של המיטוכונדריה ואובדן בלתי הפיך של תפקוד אברון.
כאן אנו מתארים assay fluorometric המאפשר אפיון מקיף של פתיחת mtPTP בלב עכבר מבודד המיטוכונדריה. הבדיקה כרוכה במדידה בו הזמנית של 3 פרמטרי המיטוכונדריה ששינו כאשר פתיחת mtPTP מתרחשת: המיטוכונדריה Ca 2 + הטיפול (ספיגה ושחרורו, כפי שהיא נמדדת על ידי Ca 2 + ריכוז במדיום assay) פוטנציאלית, מיטוכונדריה ממברנה, וmitochoנפח ndrial. את הצבעים המועסקים על Ca 2 + מדידה במדיום assay ופוטנציאל הקרום המיטוכונדריה הם Fura FF, impermeant קרום, מחוון ratiometric שעובר שינוי באורך גל העירור בנוכחות Ca 2 +, וJC-1, קטיוני, מחוון ratiometric המהווה מונומרים ירוקים או אדומים אגרגטים בפוטנציאל קרום נמוך וגבוה, בהתאמה. שינויים בהיקף המיטוכונדריה נמדדים על ידי הקלטת פיזור אור על ידי ההשעיה של המיטוכונדריה. מאז באיכות גבוהה, המיטוכונדריה פונקציונלית נדרשות לבדיקת פתיחת mtPTP, אנחנו גם מתארים את הצעדים הדרושים כדי להשיג לב שלם, בשילוב ומאוד פונקציונלי מבודד המיטוכונדריה.
Protocol
1. בידוד של המיטוכונדריה מלב מאוס
- כדי לבודד לב מיטוכונדריה, להרדים ולהקריב עכברים בהתאם לנהלים שאושרו על ידי הטיפול בבעלי החיים המוסדיים המקומי וועדת שימוש.
הערה: כל השלבים של פרוטוקול בידוד המיטוכונדריה חייב להתבצע על קרח. השתמש במאגרים קרים כקרח ומנות מראש מצוננות פטרי, צינורות וצינורות פלקון Eppendorf. הכרכים שניתנו בפרוטוקול הם למדגם המכיל 2 לבבות של עכברים.
- הסר לבבות, למקם אותם במאגר בידוד המיטוכונדריה קר (300 סוכרוז מ"מ, 10 mM Na-HEPES, 200 מיקרומטר EDTA, 7.4 pH) ולשטוף את הדם.
הערה: לקבלת תוצאות אופטימליות, ה-pH של מאגרי המיטוכונדריה צריכה להיות מותאמת עם KOH וחומצה אצטית.
- לבבות מניחים על צלחת פטרי קרה, להסיר שומן ואטרייה, ובררו היטב באמצעות להב עד לקבלing מוצר הומוגני.
- העברת לבבות טחונים לצינור פלקון 50 מ"ל, להוסיף 10 מ"ל של הצפת בידוד המיטוכונדריה עם 0.1 מ"ג / המ"ל טריפסין ומאפשר הדגימה לעיכול על קרח למשך 10 דקות.
הערה: טריפסין במהלך הליך הבידוד מגדיל את התשואה של המיטוכונדריה המבודדת וצריך להישמר קבוע בין הכנות המיטוכונדריה. אנו ממליצים בדיקת תפקודי המיטוכונדריה בהכנות המבודדות היא היעדר טריפסין על מנת להבטיח כי האנזים לא מפריע לתפקוד.
- הוסף 10 מ"ל של הצפת בידוד המיטוכונדריה עם חומצת שומן 0.1% BSA החופשי ומעכבי 5 מ"ג טריפסין (סויה) ומערבב על ידי היפוך כמה פעמי הצינור לנטרל טריפסין.
הערה: מאגר בידוד המיטוכונדריה יכול להיות מוכן מראש וניתן לאחסן ב -20 ° C. בדקו pH על הפשרה. טריפסין, מעכב טריפסין או BSA חייב להיותdded למאגר בידוד המיטוכונדריה ביום של הניסוי.
- שחזור הרקמות המעוכלות על ידי צנטריפוגה במהירות נמוכה עד בינונית למשך דקת 1 ב 4 ° C.
- רקמת resuspend במאגר 8 מיליליטר המיטוכונדריה בידוד בחומצת שומן 0.1% BSA החופשי והומוגני באמצעות homogenizer Dounce ממונע עם טפלון עלי (4-6 עובר ב1,200-14,00 סל"ד). שמור את המדגם על קרח בזמן שמאחד.
- העברת homogenate לתוך צינור פלקון 15 מ"ל וצנטריפוגה ב800xg עבור 10 דקות ב 4 ° C כדי גרעיני גלולה ופסולת רקמות.
- שחזר את supernatant המכיל את המיטוכונדריה לתוך צינורות וצנטריפוגות Eppendorf ב8000 XG במשך 15 דקות, בשעת 4 ° C.
- הסר בזהירות את השכבה הלבנה העליונה ולשטוף הכהים יותר הגלול שנותר בי המיטוכונדריה במאגר בידוד המיטוכונדריה 1 מ"ל.
- צנטריפוגה ב8000xg במשך 15 דקות ב 4 ° C. בטל supernatant ו resuspend גלולת המיטוכונדריה ב150 מיטוכונדריאלי Isola μlמאגר tion. שמור המיטוכונדריה על קרח למבחנים נוספים.
הערה: לקבלת תוצאות הטובות ביותר במהלך מבחנים תפקודיים, השתמש המיטוכונדריה בתוך 4 שעות של בדידות.
- לכמת חלבון המיטוכונדריה באמצעות assay ברדפורד.
2. בקרת איכות של מיטוכונדריה המבודדת
2.1. מדידה של יחס שליטת נשימה (RCR)
- לכייל את האלקטרודה במי חמצן Oxytherm אוויר רוויים להקים קו החמצן המרבי. כאשר רמה יציבה של חמצן מתקבלת להוסיף 100 μl של פתרון מוכן טרי 10 mM נתרן hydrosulfite להקים קו החמצן אפס. לבצע מדידות של 30 ° C.
- הוסף 2 מיליליטר מאגר המיטוכונדריה נשימה (125 mM KCl, 20 HEPES מ"מ, 3 המ"מ MgCl 2, 400 מיקרומטר EGTA, DTT מיקרומטר 300, 5 המ"מ KH 2 4 ת.ד., pH 7.2) עם rotenone 1 מיקרומטר לOxytherm הקאמרי, לאטום את החדר וrecor ההתחלהדינג.
- כאשר אות חמצן יציבה, להוסיף 250 מיקרוגרם המיטוכונדריה ונשימה הבזליים שיא דקות 1. הנשימה בנקודה זו צריכה להיות נמוכה מאוד כמיטוכונדריה זעה על מצעי אנדוגני (נשימת 1 מדינה).
- הוסף succinate 5 מ"מ ואות שיא דקות 1. צריכת חמצן צריכה לעלות במהלך 2 הנשמת המדינה.
- לגרום 3 נשימת מדינה על ידי הוספת 150 מיקרומטר ADP. בצריכת חמצן נקודה זו צריכה להגדיל עקב סינתזת ATP באמצעות זרחון חמצונים. אות שיא עד נשימה מואטת, המציין צריכה ומעבר למעמד 4 נשימה ADP. 4 הנשמת המדינה הקובע לדקות לפחות 1.
- הוסף CCCP מיקרומטר 1 ואות שיא דקות 1. נשימה כשהתיר צריכה להיות מקסימלי.
הערה: ההשפעה של CCCP על הנשימה של המיטוכונדריה היא תלויה במינון: ריכוזים גבוהים של CCCP יכולים לעכב צריכת חמצן ולכן צריך להיות בזהירות לאitrated.
- לחשב את יחס שליטת הנשימה (RCR) על ידי חלוקת שיעור צריכת חמצן במהלך 3 הנשמת מדינה בשיעור צריכת החמצן במהלך 4 הנשמת המדינה. RCR היעד צריך להיות ≥ 4.
2.2. הערכה של שלמות הקרום המיטוכונדריה (מבחן ג ציטוכרום)
- לשטוף ביסודיות את חדר Oxytherm עם אתנול 70% ומים וחזרו על שלבי 2.1.2 -2.1.4.
- הוסף ADP 1 mM ושיא צריכת חמצן לדקת 1.
- הוסף 10 מיקרומטר ג ציטוכרום. מאז ציטוכרום C הוא בלתי חדיר לקרומי המיטוכונדריה שלמים, עלייה בנשימה מצביעה קרומי המיטוכונדריה שבורה או פגומים.
3. מדידה של הפתיחה הנקבובית מעבר חדירות מיטוכונדריאלי
- התקנת spectrofluorometer למדידה רב הפרמטר של פתיחת mtPTP. באמצעות תכנית FelixGx, ליצור תצורת חומרה חדשה (sta היציב Quanta האדוןטה) הכולל את מקור האור, monochromator עירור, תא מדגם ושני גלאים שהוצבו ב90 מעלות ו270 ° ביחס לmonochromator העירור (איור 4). כדי להשיג רזולוצית זמן מקסימלי, שני monochromators הפליטה (90 °, 270 °) חייב להיות מבוטל ומסנני הפליטה ב 90 מעלות ו270 ° בתא המדגם מאופשרת בתפריט תצורת החומרה. צעד זה יסיר את השליטה המוטורית של אורכי גל הפליטה ולתקן כל monochromator באורך גל מסוים. אם monochromators הפליטה אינו מוגבל, כל גלאי יהיה המחזור בין שני אורכי גל ומדידות כפולות יירשם.
- יצירת פרוטוקול רכישה חדשה משתמש בסוג הצבע רב והכנס את הצבעים הבאים:
- Fura (הגבוה Ca + +): 340 ננומטר 525 ננומטר, עירור הפליטה (גלאי 1)
- Fura (Ca הנמוך + +): 380 ננומטר עירור, פליטה 525 ננומטר (גלאי 1)
- JC1 (מצטבר): עירור 543 ננומטר, 595 ננומטר הפליטה (גלאי 2)
- JC1 (מונומר): עירור 498 ננומטר, 525 ננומטר הפליטה (גלאי 1)
- נפיחות: עירור 525 ננומטר, 525 ננומטר הפליטה (גלאי 1)
- הגדר את חריצי עירור ופליטה עד 1 ננומטר והטמפרטורה עד 37 מעלות צלזיוס
- כדי לקבל את האות לratiometric Fura וJC-1, מייצר שתי עקבות נגזרות: Fura (הגבוה Ca + +) / Fura (נמוך Ca + +) וJC1 (צבירה) / JC1 (מונומר).
- לשנות באופן ידני גל הפליטה של גלאים 1 ו 2-525 ננומטר ו595 ננומטר, בהתאמה.
- מערבבי 1 מיליליטר הצפת Assay המיטוכונדריה (120 mM KCl, 10 mM NaCl, 1 mM KH 2 4 ת.ד., 20 מ"מ HEPES-טריס, 7.2 pH) עם rotenone 1 מיקרומטר, succinate 5 מ"מ וnM Fura FF 800 ב4-צדדי פנויים קובט methacrylate. הוסף מיקרוגרם המיטוכונדריה ומקום מדגם 250 בתא המדגם. ודא שstirrer המגנטי מופעל.
- להתחיל בהקלטה. לאחר דקות 1, להשהות את הרכישה, להוסיף 500 ננומטר JC-1 ולאחר מכן הפעל מחדשcquisition. אות יחס JC-1 צריכה להגדיל, המציין ספיגת צבע במיטוכונדריה הפעילה. המשך הקלטה עד אות JC-1 הגיעה לרמה מסוימת (בדרך כלל תוך 5 דקות).
- הוסף 20 מיקרומטר CaCl 2. עלייה מיידית באות יחס FF Fura צריכה להיות שנצפתה על ידי Ca + הנוכחות המוגברת 2 בחיץ assay, ואחריו ירידה הדרגתית בשל המיטוכונדריה Ca 2 + ספיגה. אות יחס JC-1 צריכה להפגין ירידה זמנית קצרה מעידה על שלילת קוטביות הקרום המיטוכונדריה קלה.
- חכה עד שמחזיר אות יחס FF Fura לרמה בסיסית לפני תוספת 2 דופק CaCl אחר (1-1.5 דקות). המשך פועם במרווחי זמן קבועים עד המיטוכונדריה אינה יכולה להצטבר Ca 2 + ומתחיל משחרר Ca 2 + למאגר assay. פתיחת mtPTP היא מדמיינת על ידי גידול מקביל באות יחס FF Fura בשל Ca 2 + שחרור, ירידה ביחס אות JC-1 בשל שורר קרוםקריסת ntial, וירידה בפיזור אור בשל נפיחות המיטוכונדריה (איור 5).
- בעקבות הפעלת mtPTP, לוודא את הספציפיות של Fura FF, JC-1 ואותות נפיחות בהתאמה עם mM EGTA 1, 1 מיקרומטר CCCP ו 5 מיקרוגרם / alamethicin מ"ל.
- כדי לאמת את הספציפיות של פתיחת mtPTP, חזור על שלבים 3.6-3.9 בנוכחות 1 מיקרומטר של ציקלוספורין המעכב D cyclophilin (cyclophilin D הוא רכיב של mtPTP). בנוכחות של ציקלוספורין, פתיחת mtPTP דורשת 2 פעימות באופן משמעותי יותר מCaCl דגימות ביקורת (איור 6).
4. נציג תוצאות
איור 2 מראה שליטת נשימה אופיינית ללב עכבר מבודד המיטוכונדריה. 3 הנשמת המדינה תושג על ידי תוספת של ADP למיטוכונדריה בsuccinate נושם, ומתאפיינת בצריכת חמצן גדל באופן משמעותי ביחס לsubstraטה לבד. דלדול הוסיף 4 נשימת ADP יוזם מדינה, במהלכה צריכת חמצן מאטה והוא דומה לשיעורים שהושגו לפני בנוסף ADP. RCR מתקבל על ידי חלוקת שיעור צריכת החמצן לנשימת 3 מדינה על ידי שמתוך 4 הנשמת המדינה. מבחן ג ציטוכרום משמש לבדיקת התקינות של הקרום החיצוני של המיטוכונדריה: כאשר ציטוכרום C נוסף למיטוכונדריה נושמת בsuccinate וADP, אין עלייה נוספת בנשימה הוא ציין, מצביע על קרומי המיטוכונדריה חיצוניים שלמים (איור 3).
תמונת נציג לפתיחת mtPTP בלב מיטוכונדריה מבודד מוצגת באיור 4. במקרה זה פתיחת mtPTP הייתה מופעלת על ידי התוספת של 4 2 פעימות CaCl (20 מיקרומטר כל אחת) במרווחי 1.5 דקות. פתיחת mtPTP היא לכאורה על ידי שחרורו הקרוב סימולטני של המיטוכונדריה Ca 2 + (עלייה באות יחס FF Fura), קריסת mitochondפוטנציאל ריאל קרום (ירידה באות יחס JC-1) ונפח גדל המיטוכונדריה (ירידה באות הנפיחות). כאשר ציקלוספורין הוא הוסיף, שנקשר למרכיב cyclophilin ד mtPTP, פתיחת mtPTP דורשת 7 פולסים של CaCl 2 במקום 4 (איור 5).
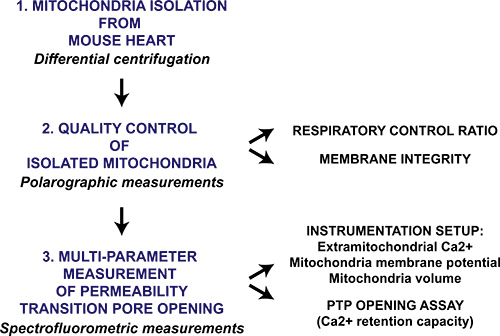
איור 1. תרשים זרימה של הפרוטוקול רב פרמטר המיטוכונדריה חדירות מעבר לפתיחה הנקבובית לב מיטוכונדריה מבודד. לב שנקטף מעכברים ומיטוכונדריה מבודדת באמצעות צנטריפוגה הפרש. אז הכנת המיטוכונדריה מוערכת על ידי מדידה איכותית polarographic של יחס נשימת שליטה ותקינות הקרום המיטוכונדריה בנוכחות ציטוכרום ג. פתיחת מיטוכונדריאלי חדירות מעבר נקבובי במיטוכונדריה המבודדת מופעלת על ידי CAC הרציף2 תוספות וl נמדדות עם spectrofluorometer ידי ניטור Ca 2 + שחרור מקריסת מיטוכונדריה, קרום פוטנציאל ונפיחות של מטריקס המיטוכונדריה.
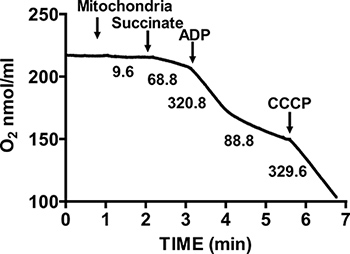
איור 2. מדידה יחס נשימת שליטה (RCR) של לב מיטוכונדריה מבודד. צריכת חמצן על ידי לב מיטוכונדריה מבודד נמדדה במהלך 3 הנשמת המדינה בנוכחות succinate וADP, ובמהלך 4 הנשמת מדינה לאחר צריכת ADP. התגובה של המיטוכונדריה המבודדת לuncouplers נמדדת על ידי התוספת של CCCP. מספרים בגרף הם שיעורי צריכת חמצן על ידי המיטוכונדריה המבודד בחלבון nmol / דקות / מ"ג.
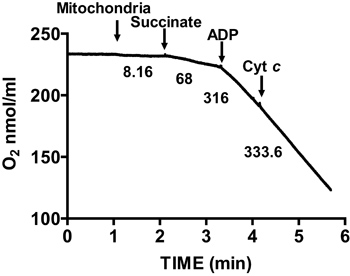
איור 3. מדוד ment של שלמות קרום לב מיטוכונדריה מבודד. שלמות הקרום מיטוכונדריאלי נקבעת על ידי מדידת צריכת חמצן במיטוכונדריה המבודדת בנוכחות succinate וADP ולאחר התוספת של ציטוכרום ג. מספרים בגרף הם שיעורי צריכת חמצן על ידי המיטוכונדריה המבודד בחלבון nmol / דקות / מ"ג.
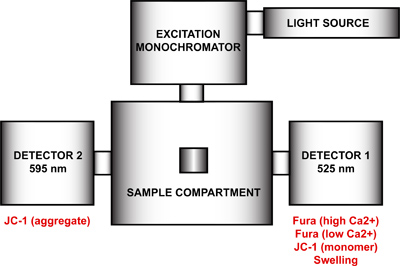
איור 4. תצורת חומרת spectrofluorometer למדידה רב הפרמטר של פתיחת mtPTP. תצורת החומרה של spectrofluorometer כוללת מקור אור, monochromator עירור, תא מדגם ושני גלאים בעלי אורכי גל פליטה קבועים ב525 ננומטר ו 595 ננומטר. גלאי 1 משמש לזיהוי האות של Fura FF גבוה והנמוך Ca 2 +, מונומר JC-1, ואות הנפיחות. גלאי 2 מודד את אות JC-1 המצרפי.
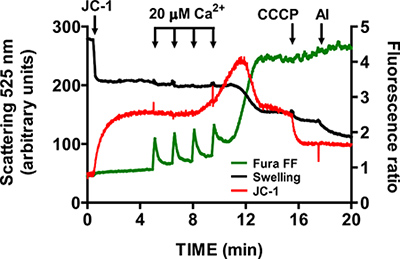
איור 5. מדידת פרמטר-Multi של פתיחת mtPTP בלב מיטוכונדריה מבודד. פתיחת mtPTP הייתה מופעל על ידי תוספות רציפות של 20 מיקרומטר CaCl 2 והתאפיינה Ca 2 + שחרור מקריסת מיטוכונדריה, מיטוכונדריה קרום פוטנציאל והגדיל את נפח מטריקס המיטוכונדריה (נפיחות). Extramitochondrial Ca 2 + ופוטנציאל קרום נמדד עם האינדיקטורים ratiometric Fura FF (ירוקות עקבות) וJC-1 (אדום זכר). נפיחות של המיטוכונדריה נמדדו על ידי הקלטת פיזור אור ב525 ננומטר (עקבות שחורות). הספציפיות של JC-1 ואותות נפיחות נבדקו עם CCCP 1 מיקרומטר ו5 מיקרוגרם / המ"ל alamethicin (רעלן של חיידקים).
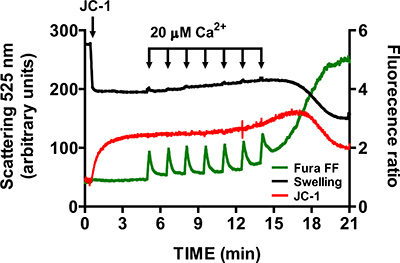
איור 6. Multiפרמטר מדידה של פתיחת mtPTP בלב מיטוכונדריה בנוכחות ציקלוספורין א ציקלוספורין מבודד (מיקרומטר 1) מגדיל את מספר 2 פעימות CaCl נדרשות לפתוח mtPTP בלב מיטוכונדריה מבודד.
Discussion
הפרוטוקול המובא כאן מתאר את הצעדים הניסיוניים הדרושים כדי להעריך פתיחה נקבובית מעבר חדירות בלב מיטוכונדריה מבודד (איור 1 ואיור 4): ההליך לבידוד לב העכבר מיטוכונדריה, פקדי נשימה המבטיחים יושרה והפונקציונלית שלהם, פרמטרים המיטוכונדרי במעקב במהלך פתיחת mtPTP ואת...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
עבודה זו נתמכה על ידי HL094536 (BJH).
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב | חברה | מספר קטלוגים | |
| טריפסין | סיגמה אולדריץ | T3030 | |
| טריפסין המעכב (סויה) | סיגמה אולדריץ | T9128 | |
| hydrosulfite נתרן | סיגמה אולדריץ | 71699 | |
| Rotenone | סיגמה אולדריץ | R8875 | |
| ציטוכרום C | סיגמה אולדריץ | C7752 | |
| Alamethicin | סיגמה אולדריץ | A4665 | |
| CCCP | סיגמה אולדריץ | C2759 | |
| ציקלוספורין | Calbiochem | 239835 | |
| Fura FF | Invitrogen | F14180 | |
| JC-1 | Invitrogen | T3168 | |
| מטחנת רקמה פוטר-Elvehjem עם טפלון העלי 15 מ"ל | תעשיות ויטון | ||
| stirrer העילי | תעשיות ויטון | 903475 | |
| Oxytherm (אלקטרודה חמצן הטמפרטורה המבוקרת) | Hansatech מכשירים | ||
| spectrofluorometer הפליטה QuantaMaster 80 כפול | פוטון טכנולוגית International, Inc |
References
- Kroemer, G., Galluzzi, L., Brenner, C. Mitochondrial Membrane Permeabilization in Cell Death. Physiol. Rev. 87, 99-163 (2007).
- Elrod, J., Wong, R., Mishra, S., Vagnozzi, R. J., Sakthievel, B., Goonasekera, S. A., Karch, J., Gabel, S., Farber, J., Force, T., Brown, J. H., Murphy, E., Molkentin, J. D. Cyclophilin D controls mitochondrial pore-dependent Ca2+ exchange, metabolic flexibility, and propensity for heart failure in mice. J. Clin. Invest. 120, 3680-3687 (2010).
- Hom, J. R., Quintanilla, R. A., Hoffman, D. L., de Mesy Bentley, K. L., Molkentin, J. D., Sheu, S. S., Porter, G. A. The permeability transition pore controls cardiac mitochondrial maturation and myocyte. 21, 469-478 (2011).
- Halestrap, A. P. What is the mitochondrial permeability transition pore. Journal of Molecular and Cellular Cardiology. 46, 821-831 (2009).
- Wei, A. C., Liu, T., Cortassa, S., Winslow, R. L., O'Rourke, B. Mitochondrial Ca2+ influx and efflux rates in guinea pig cardiac mitochondria: low and high affinity effects of cyclosporine A. Biochim. Biophys. Acta. 1813, 1373-1381 (2011).
- Saks, V. A., Kuznetsov, A. V., Kupriyanov, V. V., Miceli, M. V., Jacobus, W. E. Creatine kinase of rat heart mitochondria. The demonstration of functional coupling to oxidative phosphorylation in an inner membrane-matrix preparation. J. Biol. Chem. 260, 7757-7764 (1985).
- Boehm, E. A., Jones, B. E., Radda, G. K., Veech, R. L., Clarke, K. Increased uncoupling proteins and decreased efficiency in palmitate-perfused hyperthyroid rat heart. AJP - Heart. 280, 977-983 (2001).
- Fontaine, E., Eriksson, O., Ichas, F., Bernardi, P. Regulation of the Permeability Transition Pore in Skeletal Muscle Mitochondria. J. Biol. Chem. 273, 12662-12668 (1998).
- Berman, S. B., Watkins, S. C., Hastings, T. G. Quantitative biochemical and ultrastructural comparison of mitochondrial permeability transition in isolated brain and liver mitochondria: evidence for reduced sensitivity of brain mitochondria. Exp. Neurol. 164, 415-425 (2000).
- Panov, A., Dikalov, S., Shalbuyeva, N., Hemendinger, R., Greenamyre, J. T., Rosenfeld, J. Species- and tissue-specific relationships between mitochondrial permeability transition and generation of ROS in brain and liver mitochondria of rats and mice. Am. J. Physiol. Cell Physiol. 292, 708-718 (2007).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured filroblasts. Nature Protocols. 2, 287-295 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved