JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
미토콘드리아 절연 마우스 중심부에 투과율 전환 기공 영업의 다중 매개 변수 측정
요약
미토콘드리아 절연 마우스 중심부에 mitochondrial 투과 전환 기공 개구의 측정을위한 spectrofluorometric 프로토콜이 여기에 제공됩니다. 검정은 미토콘드리아 칼슘의 동시 측정을 포함 2 + 처리, mitochondrial 막 잠재력과 mitochondrial 볼륨입니다. 미토콘드리아 높은 품질과 기능 마음을 얻기위한 절차도 설명되어 있습니다.
초록
mitochondrial 투과 전환 기공 (mtPTP)는 1.5 kDa보다 작은 분자 질량과 용질을 운송 할 수있는 내부 mitochondrial 막에 형성되지 않은 특정 채널입니다. 기공의 결정적인 분자 ID가 토론에서 아직 시간이 남아 있기는하지만, 그러한 cyclophilin D, VDAC 및 ANT와 같은 단백질이 형성 mtPTP에 기여하고 있습니다. 세포 죽음의 mtPTP 개방의 참여 잘 하나를 설립하는 동안 증거를 축적하면 mtPTP는 mitochondrial 칼슘 2 + 항상성 2, bioenergetics 및 산화 환원 3 신호를하는 동안 physiologic 역할을 제공했음을 나타냅니다.
mtPTP 영업은 매트릭스 카 2로 실행됩니다 +하지만, 그 활동에는 산화 스트레스, 아데닌 뉴클레오티드 고갈, 파이의 높은 농도, mitochondrial 막 탈분극 또는 uncoupling, 4 장쇄 지방산과 같은 여러 가지 다른 요인에 의해 조절 될 수 있습니다. 체외, mtPTP에서 개방 ACH 할 수 있습니다칼슘 2 +의 외인성 추가 (칼슘 유지 용량)를 통해 mitochondrial 매트릭스 내부에 칼슘 2 + 농도를 증가시켜 재 현 할 수없는 뛰 어. 카 2 미토콘드리아 내부 + 수준의 특정 임계 값에 도달하면, mtPTP가 열리고 카 2 용이 + 릴리스 양자의 동기 힘의 손실, 막 잠재적 인 붕괴와 궁극적으로의 파열로 연결 mitochondrial 매트릭스 볼륨 (붓기)의 증가 외부 mitochondrial 막과 세포 기관 기능의 돌이킬 수없는 손실.
여기 미토콘드리아 절연 마우스 중심부에 mtPTP 개구의 포괄적 인 특성을 허용 fluorometric 분석을 설명합니다. mitochondrial 칼슘 2 + 취급합니다 (칼슘 2로 분석 매체에서 + 농도를 측정 이해와 릴리스), mitochondrial 막 잠재력, 그리고 mitocho : 검정은 mtPTP을 여는가 발생했을 때 변경 아르 세 mitochondrial 매개 변수의 동시 측정을 포함ndrial 볼륨입니다. 카 2 고용 염료는 검정 매체와 mitochondrial 막 잠재력에 + 측정 Fura FF, 막 impermeant, CA 2 +, 그리고 JC-1, 양이온의 존재에 여기 파장의 변화를 겪 ratiometric 표시입니다 각각 낮은 및 높은 막전위에서 녹색 단량체 또는 빨간색 응집체를 형성 ratiometric 표시. mitochondrial 볼륨의 변화는 mitochondrial 정지에 의해 빛이 분산을 기록에 의해 측정됩니다. 높은 품질, 기능 미토콘드리아는 mtPTP 여는 분석에 필요한 때문에, 우리는 그대로 높은 커플 링 기능 절연 심장 미토콘드리아 확보하는 데 필요한 단계를 설명합니다.
프로토콜
1. 마우스 심장에서 미토콘드리아의 절연
- 마음이 미토콘드리아 분리하려면, 마취 및 지역 기관 동물 케어 및 사용위원회의 승인을 절차에 따라 쥐를 희생.
참고 : 미토콘드리아 격리 프로토콜의 모든 단계가 얼음에서 수행해야합니다. 얼음 차가운 버퍼 및 사전 차가운 페트리 요리, 팔콘 튜브 및 Eppendorf 튜브를 사용하십시오. 프로토콜에 주어진 볼륨은 2 마우스 하트가 포함 된 샘플위한 것입니다.
- , 마음을 제거 차가운 미토콘드리아 절연 버퍼에 배치 (300 밀리미터 자당, 10 MM 그렇단-HEPES, 200 μM EDTA (에틸렌 다이아 민 테트라 초산), 산도 7.4)과 피를 씻어 내 버리지.
참고 : 최적의 결과를 얻으려면 mitochondrial 버퍼의 pH가 코와 아세트산의 산성으로 조정해야합니다.
- 감기에 페트리 접시에 장소의 마음은 지방과 심방을 제거하고 얻을 때까지 블레이드를 사용하여 잘게 잘게 썬 고기균일 한 제품을 들죠.
- 50 ML 팔콘 튜브에 다진 마음을 전송, 0.1 MG / ML 트립신과 미토콘드리아 절연 버퍼의 10 ML를 추가하고 샘플이 10 분 동안 얼음에 소화 할 수 있습니다.
참고 : 격리 절차를 수행하는 동안 트립신은 고립 된 미토콘드리아의 수율을 증가하고 mitochondrial 준비 사이에 일정한 보관해야합니다. 우리는 고립 준비에 mitochondrial 기능을 테스트하는 효소가 기능을 방해하지 않도록하는 트립신의 부재하시기 바랍니다.
- 0.1 % 지방산 무료 BSA와 5 MG 트립신 억제제 (콩)와 미토콘드리아 절연 버퍼의 10 ML을 추가하고 트립신을 중화하기 위해 반전 튜브를 여러 번에 섞는다.
참고 : 미토콘드리아 절연 버퍼는 사전에 준비 할 수 있으며, -20 ° C.에 저장할 수 있습니다 해동시 산도를 확인합니다. 트립신, 트립신 억제제 또는 BSA는해야합니다실험 당일 미토콘드리아 절연 버퍼에 dded.
- 4에 1 분 ° C.에 대한 낮은 - 투 - 중간 속도 원심 분리하여 소화 조직을 복구
- 테플론 유봉 (1,200-14,00 RPM에서 4-6 패스)와 동력 다운스 호 모지 나이저를 사용 0.1 % 지방산 무료 BSA와 균질화 8 ML 미토콘드리아 절연 버퍼에 Resuspend 조직. homogenizing 동안 얼음에 샘플을 보관.
- 4에 10 분 동안 800xg에서 15 ML 팔콘 튜브와 원심 분리기에 homogenate 전송 ° C 펠릿의 핵 및 조직 파편 있습니다.
- 4에, 15 분에 8,000 XG에서 Eppendorf 튜브와 원심 분리기에 미토콘드리아를 포함하는 표면에 뜨는 복구 ° C.
- 조심스럽게 상단 흰색 레이어를 제거하고 1 ML 미토콘드리아 절연 버퍼에있는 미토콘드리아를 포함하는 나머지 어두운 펠릿을 씻는다.
- 4에 15 분에 8000xg에서 원심 분리기 ° C. 150 μl Mitochondrial 솔라에 표면에 뜨는 및 resuspend 미토콘드리아 펠릿을 삭제 하시겠습니까기 버퍼. 자세한 assays에 얼음 미토콘드리아하세요.
참고 : 기능 assays 동안 최상의 결과를 얻으려면, 고립의 4 시간 이내에 미토콘드리아를 사용합니다.
- 브래드 포드 분석을 사용하여 mitochondrial 단백질을 정량화.
2. 절연 미토콘드리아의 품질 관리
2.1. 호흡 제어 비율의 측정 (RCR)
- 최대 산소 라인을 구축 공기 포화 물 Oxytherm 산소 전극을 보정합니다. 산소의 안정적인 수준은 제로 산소 라인을 구축 할 수있는 신선하게 조리 된 10 MM 나트륨 hydrosulfite 솔루션 100 μl를 추가 취득하는 경우. 30 ° C.에서 측정을 수행
- 챔버를 막고, Oxytherm 챔버 1 μM의 rotenone 2 개 ML 미토콘드리아 호흡 버퍼를 (125 MM KCl, 20 MM HEPES, 3 MM MgCl 2, 400 μM EGTA, 300 μM의 DTT, 5 MM KH 2 PO 4, 산도 7.2)를 추가 그리고 시작 recor땡.
- 산소 신호가 안정되면, 1 분에 250 미토콘드리아 μg 및 기록 기저 호흡을 추가 할 수 있습니다. 미토콘드리아는 내생 기판 (상태 1 호흡)에 respiring하기 때문에이 시점에서 호흡은 매우 낮은해야합니다.
- 5 MM 호박산 1 분에 대한 기록 신호를 추가 할 수 있습니다. 산소 소비량은 상태 2 호흡하는 동안 증가합니다.
- 150 μM의 ADP을 추가하여 주 3 호흡을 유도. 이 시점 산소 소비량에서 산화 인산화를 통해 ATP 합성에 의해 증가한다. 기록 신호 호흡은 ADP 소비, 4 호흡을 상태로 전환을 나타내는, 속도가 느려집니다 때까지. 최소한 1 분에 대한 기록 주 4 호흡.
- 1 μM의 CCCP와 1 분에 대한 기록 신호를 추가 할 수 있습니다. Uncoupled 호흡이 최대해야합니다.
참고 : mitochondrial 호흡에 CCCP의 효과는 복용량 따라 달라집니다 : CCCP의 높은 농도는 산소 소비량을 억제 할 수 있으므로주의 깊게 t해야합니다itrated.
- 주 4 호흡시 산소 소비 속도에 의해 주 3 호흡하는 동안 산소 소비 속도를 나누어 호흡 제어 비율 (RCR)를 계산합니다. 대상 RCR은 ≥ 4 여야합니다.
2.2. mitochondrial 멤브레인 무결성의 평가 (시토크롬 C 테스트)
- 철저하게 70 % 에탄올과 물 Oxytherm 챔버을 씻고 단계 2.1.2 -2.1.4를 반복합니다.
- 1 ㎜의 ADP와 1 분에 대한 기록 산소 소비를 추가합니다.
- 10 μM 시토크롬 C를 추가 할 수 있습니다. 시토크롬 C는 그대로 mitochondrial 멤브레인에 불 투과성이기 때문에, 호흡의 증가가 고장 또는 손상 mitochondrial 멤브레인을 나타냅니다.
3. Mitochondrial 투과율 전환 기공 영업 측정
- mtPTP 개구의 다중 매개 변수 측정을 위해 spectrofluorometer을 설정하십시오. FelixGx 프로그램 사용, 새로운 하드웨어 구성을 생성 (콴타 마스터 꾸준한 역테)은 광원, 여기 단색화, 샘플 구획과 여기 단색화 장치 (그림 4)에 대하여 90 ° 270 °에 위치이 감지기를 포함한다. 최대 시간 해상도를 달성하기 위해 두 방출 monochromators는 (90 ° 270 °) 사용 및 샘플 격실에서 90 ° 270 °에서 방출 필터는 하드웨어 구성 메뉴에서 사용하도록 설정해야합니다. 이 단계는 방출 파장의 모터 제어를 제거하고 특정 파장에서 각각의 단색화가 해결됩니다. 방출 monochromators이 비활성화되지 않은 경우, 각 감지기는 파장과 중복 측정을 모두 사이 사이클이 기록 될 것입니다 것입니다.
- 멀티 염료 유형을 사용하여 새로운 수집 프로토콜을 작성하고 다음과 같은 염료를 입력 :
- Fura (높은 칼슘 + +) : 여기 340 나노 미터, 방사 525 nm의 (검출기 1)
- Fura (낮은 칼슘 + +) : 여기 380 나노 미터, 방사 525 nm의 (검출기 1)
- JC1 (종합) : 여기 543 nm의, 방출 595 nm의 (검출기 2)
- JC1 (단량체) : 여기 498 나노 미터, 방사 525 nm의 (검출기 1)
- 부기 : 여기 525 나노 미터, 방사 525 nm의 (검출기 1)
- 37 ° C.에 1 나노 미터에 여기와 방출 슬릿과 온도를 설정
- Fura 및 JC-1에 대한 ratiometric 신호를 얻으려면 두 개의 파생 된 흔적을 생성합니다 : Fura (높은 칼슘 + +) / Fura (저 칼슘 + +)와 JC1 (종합) / JC1 (단량체).
- 수동으로 각각 탐지기 1 2-525 나노 미터와 595 nm의 방출 파장을 조정할 수 있습니다.
- 혼합 한 μM의 rotenone, 5 MM 호박산과 일회용 4면의 800 nm의 Fura FF 1 ML 미토콘드리아 분석 버퍼 (120 MM KCl, 10 MM NaCl, 1 ㎜ KH 2 PO 4, 20 MM HEPES - 트리스, 산도 7.2) 메타 크릴 레이트 큐벳. 샘플 칸에 250 μg 미토콘드리아와 장소 샘플을 추가합니다. 자기 교반기가 켜져 있는지 확인하십시오.
- 녹화를 시작합니다. 1 분 후에 인수를 일시 중지, 500 nm의 JC-1을 추가 한 다음를 다시 시작cquisition. JC-1 비율 신호가 활성화 미토콘드리아의 염료 이해를 나타내는 증가한다. JC-1 신호가 대지를 (보통 5 분 이내)에 도달 할 때까지 녹음을 계속합니다.
- 20 μM CaCl 2를 추가합니다. Fura FF 비율 신호의 순간 증가 mitochondrial 칼슘 2 + 통풍 관으로 인해 점차 감소에 이어 검정 버퍼의 증가 칼슘 2 + 존재에 의해 관찰해야합니다. JC-1 비율 신호는 약간의 mitochondrial 막 탈분극을 나타내는 간단한 과도 감소 전시한다.
- 전에 다른 CaCl 2 펄스 (1-1.5 분)의 추가로 기초 수준에 Fura FF 비율 신호가 반환 될 때까지 기다리십시오. 미토콘드리아는 칼슘이 축적 수 없을 때까지 고정 간격으로 pulsing 계속 + 및 + 검정 버퍼에 칼슘이를 공개 시작합니다. mtPTP 운영 인해 칼슘 2 Fura FF 비율 신호의 동시 증가 시각화입니다 + 릴리스 막 pote로 인해 JC-1 신호 비율의 감소ntial 붕괴, 그리고 mitochondrial 붓기로 인해 빛의 분산이 감소 (그림 5).
- mtPTP 활성화 후, 1 MM EGTA, 1 μM CCCP, 5 μg / ML의 alamethicin로 각각 Fura FF, JC-1과 붓기 신호의 특이성을 확인합니다.
- mtPTP 개구의 특이성을 확인하려면 단계 3.6 반복 - cyclophilin D 억제제 시클로 스포린 1 μm의 면전에서 3.9 A (cyclophilin D는 mtPTP의 구성 요소입니다.) 시클로 스포린의 존재에는 mtPTP의 개방은 컨트롤 샘플 (그림 6)보다 훨씬 CaCl 2 펄스를 필요로합니다.
4. 대표 결과
그림 2는 미토콘드리아 절연 마우스의 심장의 전형적인 호흡기 컨트롤을 보여줍니다. 주 3 호흡은 신산의 미토콘드리아 respiring에 ADP의 추가에 의해 달성되며, substra에 대해 크게 증가 산소 소비에 의해 특징입니다혼자 테. 의 고갈은 산소 소비가 느려지고 ADP의 추가 이전에 달성 속도 비교입니다 동안 ADP 시작 주 4 호흡을 추가했다. RCR은 주 4 호흡의로 주 3 호흡을위한 산소 소비 속도를 나누어 얻어진다. 시토크롬 C 시험은 검정 외부 mitochondrial 멤브레인의 무결성을하는 데 사용됩니다 시토크롬 C는 호박산과 ADP, 관찰 호흡에 더 이상의 증가에 미토콘드리아 respiring에 추가 될 때, 그대로 외부 mitochondrial 세포막을 (그림 3) 나타냅니다.
미토콘드리아 절연 중심부에 mtPTP 개방에 대한 대표 이미지가 그림 4에 표시됩니다. 이 경우 mtPTP 개방은 1.5 분 간격으로 4 CaCl 2 펄스 (20 μM 각)의 추가에 의해 실행되었다. mtPTP 운영은 mitochondrial 칼슘 2의 근처에 동시 릴리즈 + (Fura FF 비율 신호 증가), mitochond의 붕괴에 의해 명백리알 막전위 (JC-1 비율로 신호의 감소)과 증가 mitochondrial 볼륨 (붓기 신호의 감소). 가 추가되면 시클로 스포린, 이는 mtPTP의 cyclophilin D 구성 요소에 바인딩 mtPTP 운영은 CaCl 2 대신 4 7 펄스 (그림 5)가 필요합니다.
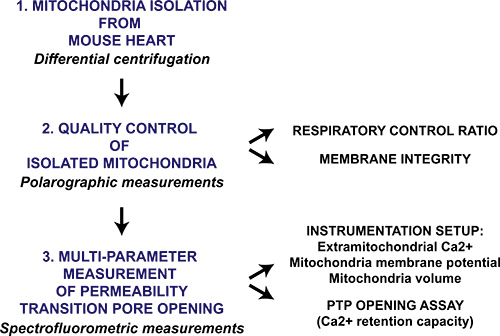
그림 1. 미토콘드리아 절연 심장에 대한 여러 매개 변수 mitochondrial 투과 전환 구멍을 여는 프로토콜의 흐름 차트입니다. 마음은 마우스에서 채취되며, 미토콘드리아는 차동 원심 분리를 통해 분리되어 있습니다. mitochondrial 준비는 이후 질적 시토크롬 C의 존재에 호흡 제어 비율과 mitochondrial 막 intactness의 polarographic 측정에 의해 평가된다. 절연 미토콘드리아에서 Mitochondrial 투과 전환 기공 개방 연속 CAC에 의해 실행된다리터 2 추가하며 미토콘드리아, 막 잠재적 인 붕괴에서 칼슘 2 + 릴리스를 모니터링하고 mitochondrial 매트릭스의 팽창에 의해 spectrofluorometer로 측정됩니다.
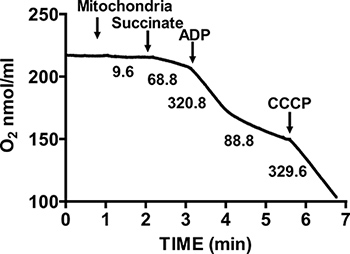
그림 2. 측정 미토콘드리아 절연 심장 호흡기 제어 비율 (RCR). 미토콘드리아 절연 심장의 산소 소비량은 호박산과 ADP의 존재에 주 3 호흡하는 동안 측정, 그리고 ADP 소비 후 주 4 호흡시.입니다 uncouplers에 고립 미토콘드리아의 응답은 CCCP의 추가에 의해 측정됩니다. 그래프의 숫자가 nmol / 분 / MG 단백질 격리 된 미토콘드리아에 의한 산소 소비 속도입니다.
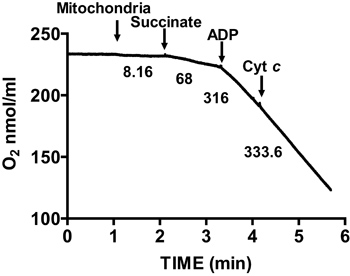
그림 3. 측정 미토콘드리아 절연 심장 막 무결성 ment. Mitochondrial 막 무결성이 호박산과 ADP의 존재와 시토크롬 C를 추가 한 후 격리 미토콘드리아에 산소 소비를 측정하여 결정됩니다. 그래프의 숫자가 nmol / 분 / MG 단백질 격리 된 미토콘드리아에 의한 산소 소비 속도입니다.
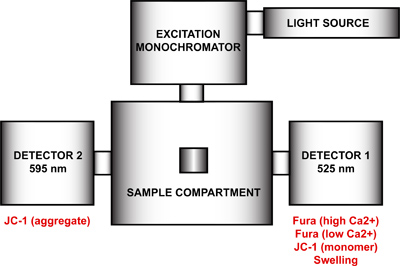
mtPTP 개구의 다중 매개 변수 측정을위한 그림 4. Spectrofluorometer 하드웨어 구성. spectrofluorometer의 하드웨어 구성은 광원, 여기 단색화, 샘플 구획과 525 nm의와 595 nm의에서 고정 방출 파장을 가진 두 검출기가 포함되어 있습니다. 감지기 1 Fura FF 높은과 낮은 칼슘 2 +, JC-1 모노머의 신호 감지 및 붓기 신호에 사용됩니다. 감지기 2 JC-1 통합 신호를 측정합니다.
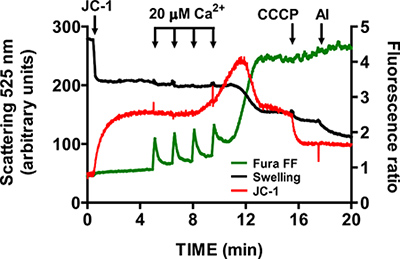
그림 5. 미토콘드리아 절연 중심부에 mtPTP 개구의 다중 매개 변수 측정. mtPTP 오픈 20 μM CaCl 2의 연속 추가에 의해 실행되었으며, 칼슘이 특징으로 한 + 미토콘드리아, mitochondrial 막 잠재적 인 붕괴의 자료와 mitochondrial 매트릭스 볼륨 (붓기)을 증가했다. Extramitochondrial 칼슘 2 +와 막 잠재력이 ratiometric 지표 Fura FF (녹색 성분)과 JC-1 (빨간색 추적)로 측정 하였다. 미토콘드리아의 팽창은 525 nm의 (검은 색 추적)에서 빛이 분산을 기록에 의해 측정되었다. JC-1의 특이성과 붓기 신호는 1 μM의 CCCP, 5 μg / ML alamethicin (미생물 독소)에서 테스트되었습니다.
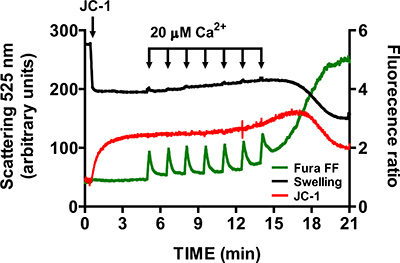
그림 6. 멀티시클로 스포린 A.의 시클로 스포린의 존재의 미토콘드리아 절연 중심부에 mtPTP 개구의 - 매개 변수 측정 (1 μM) 미토콘드리아 절연 중심부에 mtPTP를 여는 데 필요한 CaCl 2 펄스의 수를 증가시킵니다.
토론
여기에 제시된 프로토콜 미토콘드리아 격리 된 마음 (그림 1과 그림 4)에 투과 전환 기공 오픈을 평가하는 데 필요한 실험 단계를 설명 마우스 마음이 미토콘드리아 분리를위한 절차를, 그들의 무결성과 기능을 보장 호흡기 컨트롤은 mitochondrial 매개 변수는 동안 모니터 mtPTP 영업 및 측정을 위해 사용 된 염료, spectrofluorometric 장비의 설정까지, 그리고 mtPTP 개구의 특성. 이 프로토콜에서...
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
이 작품은 HL094536 (BJH)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| 트립신 | 시그마 - 알드리치 | T3030 | |
| 트립신 억제제 (콩) | 시그마 - 알드리치 | T9128 | |
| 나트륨 hydrosulfite | 시그마 - 알드리치 | 71,699 | |
| Rotenone | 시그마 - 알드리치 | R8875 | |
| 시토크롬 C | 시그마 - 알드리치 | C7752 | |
| Alamethicin | 시그마 - 알드리치 | A4665 | |
| CCCP | 시그마 - 알드리치 | C2759 | |
| 시클로 스포린 | Calbiochem | 239835 | |
| Fura FF | Invitrogen | F14180 | |
| JC-1 | Invitrogen | T3168 | |
| 조직 분쇄기 테플론 유봉 15 ML과 포터 - Elvehjem | 휘튼 산업 | ||
| 오버 헤드 교반기 | 휘튼 산업 | 903475 | |
| Oxytherm (온도 조절 산소 전극) | Hansatech 악기 | ||
| QuantaMaster 80 듀얼 방출 spectrofluorometer | 광자 기술 인터내셔널 |
참고문헌
- Kroemer, G., Galluzzi, L., Brenner, C. Mitochondrial Membrane Permeabilization in Cell Death. Physiol. Rev. 87, 99-163 (2007).
- Elrod, J., Wong, R., Mishra, S., Vagnozzi, R. J., Sakthievel, B., Goonasekera, S. A., Karch, J., Gabel, S., Farber, J., Force, T., Brown, J. H., Murphy, E., Molkentin, J. D. Cyclophilin D controls mitochondrial pore-dependent Ca2+ exchange, metabolic flexibility, and propensity for heart failure in mice. J. Clin. Invest. 120, 3680-3687 (2010).
- Hom, J. R., Quintanilla, R. A., Hoffman, D. L., de Mesy Bentley, K. L., Molkentin, J. D., Sheu, S. S., Porter, G. A. The permeability transition pore controls cardiac mitochondrial maturation and myocyte. 21, 469-478 (2011).
- Halestrap, A. P. What is the mitochondrial permeability transition pore. Journal of Molecular and Cellular Cardiology. 46, 821-831 (2009).
- Wei, A. C., Liu, T., Cortassa, S., Winslow, R. L., O'Rourke, B. Mitochondrial Ca2+ influx and efflux rates in guinea pig cardiac mitochondria: low and high affinity effects of cyclosporine A. Biochim. Biophys. Acta. 1813, 1373-1381 (2011).
- Saks, V. A., Kuznetsov, A. V., Kupriyanov, V. V., Miceli, M. V., Jacobus, W. E. Creatine kinase of rat heart mitochondria. The demonstration of functional coupling to oxidative phosphorylation in an inner membrane-matrix preparation. J. Biol. Chem. 260, 7757-7764 (1985).
- Boehm, E. A., Jones, B. E., Radda, G. K., Veech, R. L., Clarke, K. Increased uncoupling proteins and decreased efficiency in palmitate-perfused hyperthyroid rat heart. AJP - Heart. 280, 977-983 (2001).
- Fontaine, E., Eriksson, O., Ichas, F., Bernardi, P. Regulation of the Permeability Transition Pore in Skeletal Muscle Mitochondria. J. Biol. Chem. 273, 12662-12668 (1998).
- Berman, S. B., Watkins, S. C., Hastings, T. G. Quantitative biochemical and ultrastructural comparison of mitochondrial permeability transition in isolated brain and liver mitochondria: evidence for reduced sensitivity of brain mitochondria. Exp. Neurol. 164, 415-425 (2000).
- Panov, A., Dikalov, S., Shalbuyeva, N., Hemendinger, R., Greenamyre, J. T., Rosenfeld, J. Species- and tissue-specific relationships between mitochondrial permeability transition and generation of ROS in brain and liver mitochondria of rats and mice. Am. J. Physiol. Cell Physiol. 292, 708-718 (2007).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured filroblasts. Nature Protocols. 2, 287-295 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유