É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Parâmetro Multi-Medição da abertura dos poros transição de permeabilidade em mitocôndrias isoladas de coração Rato
Neste Artigo
Resumo
Um protocolo espectrofluorométrico para a medição da abertura do poro de permeabilidade mitocondrial transição de coração de rato isolado mitocôndrias é aqui apresentada. O teste envolve a medição simultânea de Ca mitocôndrias 2 + Manuseamento, volume potencial de membrana mitocondrial e mitocondrial. O procedimento para a obtenção de coração e de alta qualidade funcional a mitocôndria é também descrito.
Resumo
A poro de transição da permeabilidade mitocondrial (mtPTP) é um canal não específico em que se forma a membrana mitocondrial interna para transportar solutos com uma massa molecular inferior a 1,5 kDa. Embora a identidade molecular definitivo do poro está ainda sob debate, proteínas tais como a ciclofilina D, e VDAC ANT contribuir para mtPTP formação. Embora a participação de abertura mtPTP na morte celular está bem estabelecido 1, acumulação de provas indica que o mtPTP serve uma função fisiológica durante mitocondrial homeostase Ca 2 + 2, bioenergética e redox sinalização 3.
mtPTP abertura é desencadeada pela matriz de Ca 2 +, mas a sua actividade podem ser moduladas por vários outros factores, tais como o stress oxidativo, o esgotamento de nucleótidos de adenina, altas concentrações de Pi, a despolarização da membrana mitocondrial ou desacoplamento, e os ácidos gordos de cadeia longa 4. In vitro, mtPTP de abertura pode ser achieved por aumento da concentração de Ca + 2 no interior da matriz mitocondrial através da adição exógena de Ca 2 + (capacidade de retenção de cálcio). Quando os níveis de Ca 2 + no interior mitocôndrias atingir um determinado limite, o mtPTP abre e facilita a libertação de Ca2 +, a dissipação de força motriz de protões, colapso potencial de membrana e um aumento de volume da matriz mitocondrial (inchaço) que em última análise conduz à ruptura da membrana mitocondrial externa e perda irreversível da função organela.
Descrevemos aqui um ensaio fluorométrico, que permite para uma caracterização completa de mtPTP abertura de coração de rato isolado mitocôndrias. O teste envolve a medição simultânea de 3 parâmetros mitocondriais que são alteradas quando a abertura mtPTP ocorre: mitochondrial Ca 2 + manuseamento (absorção e libertação, conforme medido por Ca 2 + a concentração no meio de ensaio), o potencial de membrana mitocondrial, e mitochovolume de ndrial. Os corantes utilizados para o Ca 2 + medida no meio de ensaio e o potencial de membrana mitocondrial são Fura FF, um impermeante de membrana, o indicador de medida proporcional que sofre uma mudança no comprimento de onda de excitação na presença de +, e JC-1, uma catiónica Ca 2, indicador de medida proporcional que forma monómeros verdes ou agregados vermelhas no potencial de membrana de baixa e alta, respectivamente. As variações de volume mitocondrial são medidos através da gravação de dispersão da luz pela suspensão mitocondrial. Desde de alta qualidade, as mitocôndrias funcionais são necessárias para o ensaio de abertura mtPTP, também descrever os passos necessários para obter intacta, coração altamente acopladas e funcional mitocôndrias isoladas.
Protocolo
1. Isolamento de mitocôndrias de coração rato
- Para isolar mitocôndria cardíaca, anestesiar e sacrificar animais de acordo com os procedimentos aprovados pelo seu Animal Care Institucional e Comitê local de uso.
Nota: Todos os passos do protocolo de isolamento de mitocôndrias deve ser executada em gelo. Use tampões de gelo frios e pratos pré-refrigerados de Petri, Falcon tubos e tubos Eppendorf. Os volumes indicados no protocolo são para uma amostra contendo 2 corações de rato.
- Remover os corações, colocá-los em tampão de isolamento frio Mitocôndria (300 mM de sacarose, 10 mM de Na-HEPES, 200 mM EDTA, pH 7,4) e enxaguar sangue.
Nota: Para melhores resultados, o pH dos tampões mitocondrial deve ser ajustado com KOH e ácido acético.
- Corações lugar em uma placa de Petri frio, retire a gordura e átrios, e pique finamente com uma lâmina até obterrelativa a um produto homogéneo.
- Transferir corações picados para um 50 tubo Falcon ml, adicionar 10 ml de tampão de isolamento mitocôndrias com 0,1 mg / ml de tripsina e permitir que a amostra de digerir em gelo durante 10 min.
Nota: A tripsina durante o procedimento de isolamento aumenta o rendimento de mitocôndrias isoladas e deve ser mantido constante entre preparações mitocondriais. Recomendamos testar as funções mitocondriais em preparações isoladas é a ausência de tripsina para garantir que a enzima não interfira com a funcionalidade.
- Adicionar 10 ml de tampão de isolamento mitocôndrias com 0,1% de BSA livre de ácidos gordos e 5 mg de inibidor de tripsina (soja) e misturar por vezes invertendo o tubo várias para neutralizar a tripsina.
Nota: tampão de isolamento Mitocôndrias podem ser preparadas com antecedência e pode ser armazenado a -20 ° C. Verificar o pH após a descongelação. Tripsina, inibidor de tripsina ou BSA deve ser umdded para o tampão de isolamento mitocôndrias no dia da experiência.
- Recuperar o tecido digerido por baixo e médio da velocidade de centrifugação durante 1 min a 4 ° C.
- Ressuspender o tecido em tampão de isolamento 8 ml mitocôndrias com 0,1% de BSA livre de ácido gordo e homogeneizar utilizando um homogeneizador Dounce motorizado com um pilão de Teflon (4-6 passagens em 1,200-14,00 rpm). Manter a amostra em gelo enquanto se homogeneíza.
- Transferir homogeneizado num tubo Falcon de 15 ml e centrifugar a 800xg durante 10 min a 4 ° C para sedimentar os núcleos e os restos dos tecidos.
- Recuperar o sobrenadante que contém as mitocôndrias em tubos de Eppendorf e centrifugar a 8000 xg durante 15 min, a 4 ° C.
- Remova cuidadosamente a camada de top branco e lavar o restante mais escuro pellet contendo mitocôndrias em um tampão de isolamento ml mitocôndrias.
- Centrifugar a 8000xg durante 15 min a 4 ° C. Descartar o sobrenadante e ressuspender o pellet em 150 ul mitocôndrias mitocondrial IsolaTampão ção. Manter em gelo mitocôndrias para ensaios posteriores.
Nota: Para obter melhores resultados durante os ensaios funcionais, use mitocôndrias dentro de 4 horas de isolamento.
- Quantificar proteína mitocondrial utilizando o ensaio de Bradford.
2. Controle de Qualidade das mitocôndrias isoladas
2.1. Medição de índice de controle respiratório (RCR)
- Calibra-se o eléctrodo de oxigénio Oxytherm com água saturada de ar para estabelecer a linha máxima de oxigénio. Quando um nível estável de oxigénio é obtida adicionando 100 ul de uma solução a 10 mM preparada de fresco de hidrossulfito de sódio, para estabelecer a linha de oxigénio zero. Realizar medições a 30 ° C.
- Adicionar 2 ml de Tampão de respiração Mitocôndria (125 mM KCl, 20 mM de HEPES, 3 mM de MgCl2, 400 mM de EGTA, 300 mM DTT, 5 mM de KH 2 PO 4, pH 7,2) com 1 uM rotenona à câmara Oxytherm, vedar a câmara e recor inícioding.
- Quando o sinal de oxigênio é estável, adicionar 250 mg mitocôndrias e respiração basal recorde de 1 min. A respiração, neste ponto deve ser muito baixo, como as mitocôndrias são respirando sobre substratos endógenos (respiração estado 1).
- Adicionar 5 mM succinato e sinal recorde de 1 min. O consumo de oxigênio deve aumentar durante a respiração Estado 2.
- Induzir a respiração Estado 3, incluindo 150 ADP fiM. Neste ponto o consumo de oxigénio deve aumentar devido à síntese do ATP através da fosforilação oxidativa. Sinal de gravação até que a respiração fica mais lento, indicando ADP consumo e transição para o estado 4 da respiração. Gravar estado 4 da respiração durante pelo menos 1 min.
- Adicione 1 CCCP mM e sinal recorde de 1 min. Respiração desacoplada deve ser máxima.
Nota: O efeito da CCCP na respiração mitocondrial é dependente da dose: altas concentrações de CCCP pode inibir o consumo de oxigênio e, portanto, deve ser cuidadosamente titrated.
- Calcule a razão do controle respiratório (RCR), dividindo a taxa de consumo de oxigênio durante o Estado respiração 3 pela taxa de consumo de oxigênio durante a respiração Estado 4. A RCR alvo deve ser ≥ 4.
2.2. Avaliação da integridade da membrana mitocondrial (ensaio do citocromo c)
- Lave a câmara Oxytherm com etanol a 70% e água, e repetir as etapas 2.1.2 -2.1.4.
- Adicione 1 mM ADP e consumo recorde de oxigênio para 1 min.
- Adicionam-se 10 ^ M do citocromo c. Uma vez que o citocromo c é impermeável à intactas membranas mitocondriais, um aumento na respiração indica quebrados ou danificados membranas mitocondriais.
3. Medição da permeabilidade mitocondrial de abertura de poros de transição
- Configure o espectrofluorímetro para a medição de parâmetros múltiplos de abertura mtPTP. Usando o programa FelixGx, criar uma nova configuração de hardware (Quanta sta mestre constantete) que compreende a fonte de luz, um monocromador de excitação, o compartimento da amostra e dois detectores posicionados a 90 ° e 270 ° em relação ao monocromador de excitação (Figura 4). Para atingir resolução de tempo máximo, dois monocromadores de emissão (90 ° e 270 °) deve ser desativado e os filtros de emissão em 90 ° e 270 ° no compartimento de amostra habilitado no menu de configuração de hardware. Esta etapa irá remover o controle motor dos comprimentos de onda de emissão e corrigir cada monocromador em um determinado comprimento de onda. Se os monocromadores de emissão não são deficientes, cada detector ciclo entre os dois comprimentos de onda e medições duplicadas será gravado.
- Criar um protocolo de aquisição novo usando o tipo multi Dye e digite os seguintes corantes:
- Fura (alto Ca + +): 340 nm de excitação, 525 nm de emissão (detector 1)
- Fura (Ca + +) baixo: excitação 380 nm, 525 nm de emissão (detector 1)
- JC1 (agregado): excitação 543 nm, Emissão 595 nm (detector 2)
- JC1 (monómero): excitação 498 nm, emissão a 525 nm (detector 1)
- Inchaço: excitação 525 nm, emissão a 525 nm (detector 1)
- Definir as fendas de excitação e de emissão a 1 nm e a temperatura de 37 ° C.
- Para se obter o sinal de medida proporcional para Fura e JC-1, geram dois traços derivados: Fura (alto Ca + +) / Fura (baixo Ca + +) e JC1 (agregado) / JC1 (monómero).
- Ajustar manualmente o comprimento de onda de emissão de detectores 1 e 2 a 525 nm e 595 nm, respectivamente.
- Mistura-se 1 ml de Tampão de Ensaio As mitocôndrias (120 mM KCl, 10 mM NaCl, 1 mM de KH 2 PO 4, 20 mM de HEPES-Tris, pH 7,2) com 1 uM rotenona, 5 mM de succinato e 800 nM Fura FF num descartável de 4 faces cuvette metacrilato. Adicionar 250 mg de amostra mitocôndrias e colocar no compartimento de amostra. Certifique-se de que o agitador magnético está ligado.
- Iniciar a gravação. Após 1 min, pausar a aquisição, adicionar 500 nM JC-1 e, em seguida, reiniciar o umQUISIÇÃO. O sinal de JC-1 proporção deve aumentar, indicando absorção do corante pela mitocôndria ativa. Continuar a gravar até que o sinal de JC-1 ter atingido um patamar (em geral, dentro de 5 min).
- Adicionam-se 20 ^ M de CaCl2. Um aumento instantâneo na proporção FF Fura sinal devem ser observados pelo aumento da presença de Ca 2 + na solução tampão de ensaio, seguido de uma diminuição gradual devido a mitochondrial Ca 2 + absorção. O sinal de JC-1 deve apresentar uma taxa de diminuição transitória breve indicativo de despolarização da membrana mitocondrial leve.
- Espere até que Fura FF retornos de sinal relação ao nível basal, antes da adição de um outro pulso de CaCl 2 (1-1,5 min). Continue pulsando em intervalos fixos até que as mitocôndrias não pode acumular-se Ca 2 + e começar a libertar Ca2 + para o tampão de ensaio. abertura mtPTP é visualizado por um aumento concomitante no sinal de relação de Fura FF devido à libertação de Ca2 +, uma redução na relação sinal JC-1, devido ao pote membranantial colapso, e uma diminuição da dispersão de luz devido a inchaço mitocondrial (Figura 5).
- Após a activação mtPTP, verificar a especificidade de Fura FF, JC-1 e sinais de inchaço, respectivamente, com 1 mM de EGTA, 1 mM de CCCP e 5 ug / ml de alameticina.
- Para verificar a especificidade da abertura mtPTP, repetir os passos 3,6-3,9, na presença de 1 uM do inibidor da ciclofilina D ciclosporina A (ciclofilina D é um componente do mtPTP). Na presença de ciclosporina A, a abertura da mtPTP requer significativamente mais CaCl 2 pulsos do que as amostras de controlo (Figura 6).
4. Resultados representativos
A Figura 2 mostra um típico controle respiratório de coração de rato isolado mitocôndrias. Estado 3 da respiração é conseguido através da adição de ADP para respiradoras mitocôndrias em succinato, e é caracterizado por um consumo de oxigénio significativamente aumentada em relação ao substrate sozinho. Depleção de ADP adicionado Estado iniciados 4 respiração, durante o qual o consumo de oxigénio diminui e é comparável às taxas obtidas antes da adição de ADP. RCR é obtida dividindo-se a taxa de consumo de oxigénio para a respiração estado 3 da respiração por esse Estado 4. O citocromo c de teste é utilizado para ensaiar a integridade da membrana mitocondrial externa: quando o citocromo c é adicionado ao respiradoras mitocôndrias em succinato e ADP, qualquer aumento adicional na respiração é observada, indicando uma intactas exteriores das membranas mitocondriais (Figura 3).
Uma imagem representativa para a abertura mtPTP no coração mitocôndrias isoladas é mostrado na Figura 4. Neste caso, a abertura mtPTP foi desencadeada por adição de CaCl 2 4 pulsos (20 uM de cada) em intervalos de 1,5 min. abertura mtPTP é aparente pelo lançamento quase simultâneo de mitocondrial Ca 2 + (aumento da taxa de Fura sinal FF), colapso do mitochondpotencial de membrana rial (diminuição do sinal de JC-1 ratio) e aumento do volume mitocondrial (diminuição do sinal de inchaço). Quando a ciclosporina A é adicionado, o qual se liga ao componente de ciclofilina D mtPTP, abertura mtPTP requer 7 pulsos de CaCl 2 em vez de 4 (Figura 5).
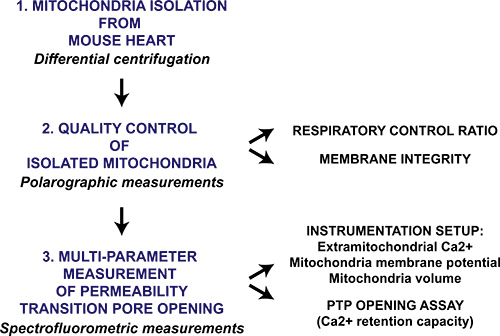
Figura 1. Fluxograma da permeabilidade mitocondrial de parâmetros múltiplos transição de protocolo de abertura de poros para o coração mitocôndrias isoladas. Coração é colhida a partir de ratinhos e mitocôndrias são isoladas através de centrifugação diferencial. A preparação mitocondrial é então avaliado qualitativamente por medição polarográfico do índice de controlo respiratório e intacto membrana mitocondrial na presença de citocromo c. Permeabilidade mitocondrial de abertura de poros de transição em mitocôndrias isoladas é desencadeada por CaC sequenciall 2 adições e é medida com um espectrofluorímetro monitorando Ca 2 + lançamento do colapso da membrana da mitocôndria, potencial e inchaço da matriz mitocondrial.
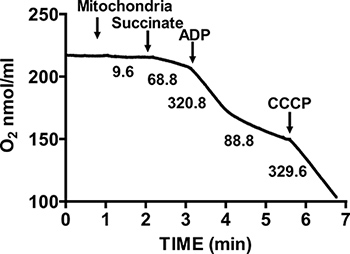
Figura 2. Medição de razão do controle respiratório (RCR) de coração mitocôndrias isoladas. O consumo de oxigénio pelas mitocôndrias de coração isolado é medida durante a respiração Estado 3 na presença de succinato e ADP, e durante a respiração Estado 4, após o consumo de ADP. A resposta das mitocôndrias isoladas de desacopladores é medido pela adição de CCCP. Números no gráfico são as taxas de consumo de oxigénio por mitocôndrias isoladas em nmol / min / mg de proteína.
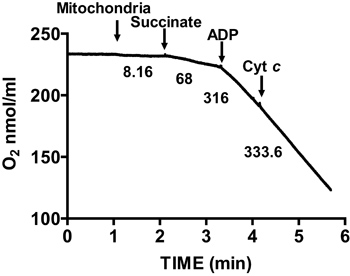
Figura 3. Medida mento da integridade da membrana do coração de mitocôndrias isoladas. A integridade da membrana mitocondrial é determinada por medição do consumo de oxigénio em mitocôndrias isoladas na presença de succinato e ADP e após a adição de citocromo c. Números no gráfico são as taxas de consumo de oxigénio por mitocôndrias isoladas em nmol / min / mg de proteína.
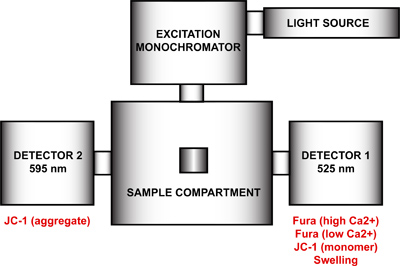
Figura 4. Espectrofluorómetro configuração de hardware para a medição de parâmetros múltiplos de abertura mtPTP. A configuração de hardware do espectrofluorómetro inclui uma fonte de luz, um monocromador de excitação, de um compartimento de amostra e dois detectores, com comprimentos de onda de emissão de 525 nm fixos e 595 nm. Detector 1 é usado para a detecção de sinais de Fura FF alto e baixo de Ca 2 +, o monómero de JC-1, e o sinal de inchamento. Detector 2 mede o sinal de JC-1 agregado.
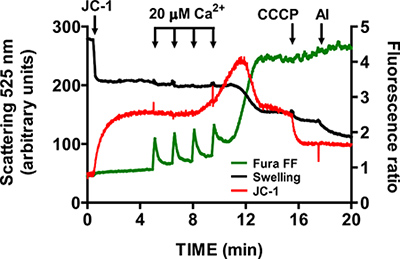
Figura 5. Múltiplos parâmetros de medição da abertura mtPTP no coração mitocôndrias isoladas. abertura mtPTP foi desencadeada por adições sequenciais de 20 uM de CaCl2 e foi caracterizado por Ca 2 + a partir de mitocôndrias libertação potencial colapso, membrana mitocondrial e aumento de volume da matriz mitocondrial (inchaço). Extramitochondrial Ca 2 + e o potencial de membrana foi medida com os indicadores de medida proporcional Fura FF (verde traço) e JC-1 (vermelho traço). Inchaço das mitocôndrias foi medido por espalhamento de luz a gravar a 525 nm (linha preta). Especificidade de JC-1 e sinais de inchaço foi testado com um CCCP uM e 5 ug / ml de alameticina (uma toxina microbiana).
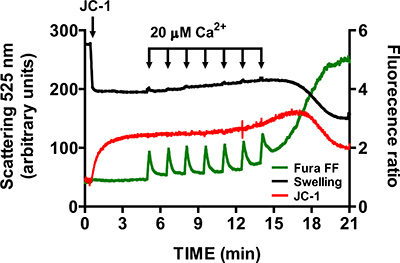
Figura 6. Multi-Parâmetro de medição da abertura mtPTP no coração mitocôndrias isoladas na presença de ciclosporina A. A ciclosporina (1 uM), aumenta o número de CaCl 2 impulsos necessários para abrir mtPTP no coração mitocôndrias isoladas.
Discussão
O protocolo aqui apresentado descreve os passos necessários experimentais para avaliar a permeabilidade da abertura do poro de transição no coração mitocôndrias isoladas (Figura 1 e Figura 4): o procedimento para o isolamento de coração de rato mitocôndrias, os controles respiratórias que assegurem a sua integridade e funcionalidade, os parâmetros monitorizados durante mitocondriais mtPTP abertura e os corantes utilizados para a sua medição, a criação da instrumentação ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado por HL094536 (BJH).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Tripsina | Sigma-Aldrich | T3030 | |
| Inibidor de tripsina (soja) | Sigma-Aldrich | T9128 | |
| Hidrossulfito de sódio | Sigma-Aldrich | 71699 | |
| Rotenona | Sigma-Aldrich | R8875 | |
| Citocromo c | Sigma-Aldrich | C7752 | |
| Alameticina | Sigma-Aldrich | A4665 | |
| CCCP | Sigma-Aldrich | C2759 | |
| A ciclosporina A | Calbiochem | 239835 | |
| Fura FF | Invitrogen | F14180 | |
| JC-1 | Invitrogen | T3168 | |
| Moinho de tecidos Potter-Elvehjem com um pilão de teflon de 15 ml | Wheaton Industries | ||
| Agitador suspenso | Wheaton Industries | 903475 | |
| Oxytherm (temperatura do eléctrodo de oxigénio controlado) | Hansatech Instruments | ||
| QuantaMaster 80 espectrofluorímetro emissão dupla | Photon Technology International, Inc. |
Referências
- Kroemer, G., Galluzzi, L., Brenner, C. Mitochondrial Membrane Permeabilization in Cell Death. Physiol. Rev. 87, 99-163 (2007).
- Elrod, J., Wong, R., Mishra, S., Vagnozzi, R. J., Sakthievel, B., Goonasekera, S. A., Karch, J., Gabel, S., Farber, J., Force, T., Brown, J. H., Murphy, E., Molkentin, J. D. Cyclophilin D controls mitochondrial pore-dependent Ca2+ exchange, metabolic flexibility, and propensity for heart failure in mice. J. Clin. Invest. 120, 3680-3687 (2010).
- Hom, J. R., Quintanilla, R. A., Hoffman, D. L., de Mesy Bentley, K. L., Molkentin, J. D., Sheu, S. S., Porter, G. A. The permeability transition pore controls cardiac mitochondrial maturation and myocyte. 21, 469-478 (2011).
- Halestrap, A. P. What is the mitochondrial permeability transition pore. Journal of Molecular and Cellular Cardiology. 46, 821-831 (2009).
- Wei, A. C., Liu, T., Cortassa, S., Winslow, R. L., O'Rourke, B. Mitochondrial Ca2+ influx and efflux rates in guinea pig cardiac mitochondria: low and high affinity effects of cyclosporine A. Biochim. Biophys. Acta. 1813, 1373-1381 (2011).
- Saks, V. A., Kuznetsov, A. V., Kupriyanov, V. V., Miceli, M. V., Jacobus, W. E. Creatine kinase of rat heart mitochondria. The demonstration of functional coupling to oxidative phosphorylation in an inner membrane-matrix preparation. J. Biol. Chem. 260, 7757-7764 (1985).
- Boehm, E. A., Jones, B. E., Radda, G. K., Veech, R. L., Clarke, K. Increased uncoupling proteins and decreased efficiency in palmitate-perfused hyperthyroid rat heart. AJP - Heart. 280, 977-983 (2001).
- Fontaine, E., Eriksson, O., Ichas, F., Bernardi, P. Regulation of the Permeability Transition Pore in Skeletal Muscle Mitochondria. J. Biol. Chem. 273, 12662-12668 (1998).
- Berman, S. B., Watkins, S. C., Hastings, T. G. Quantitative biochemical and ultrastructural comparison of mitochondrial permeability transition in isolated brain and liver mitochondria: evidence for reduced sensitivity of brain mitochondria. Exp. Neurol. 164, 415-425 (2000).
- Panov, A., Dikalov, S., Shalbuyeva, N., Hemendinger, R., Greenamyre, J. T., Rosenfeld, J. Species- and tissue-specific relationships between mitochondrial permeability transition and generation of ROS in brain and liver mitochondria of rats and mice. Am. J. Physiol. Cell Physiol. 292, 708-718 (2007).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured filroblasts. Nature Protocols. 2, 287-295 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados