Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Multi-Parameter-Messung der Durchlässigkeit Transition Pore Opening in isolierten Maus-Mitochondrien
In diesem Artikel
Zusammenfassung
Ein spektrofluorometrischen Protokoll für die Messung der mitochondrialen Permeabilitätsübergang Porenöffnung in isolierten Maus-Mitochondrien wird hier vorgestellt. Der Assay umfasst die gleichzeitige Messung von Mitochondrien Ca 2 + Handhabung, Mitochondrienmembranpotentials und mitochondriale Volumen. Das Verfahren zur Beantragung hochwertige und funktionale Herzmitochondrien wird ebenfalls beschrieben.
Zusammenfassung
Das mitochondriale Permeabilitätsübergang Pore (mtPTP) ein nicht spezifischen Kanal, der in der inneren mitochondrialen Membran bildet für gelöste Stoffe mit einem Molekulargewicht kleiner als 1,5 kDa transportieren. Obwohl die definitive molekulare Identität der Pore wird noch diskutiert, tragen Proteine wie Cyclophilin D, VDAC und ANT zur Bildung mtPTP. Während die Beteiligung von mtPTP Öffnung in Zelltod gut 1 festgelegten vermehrt Hinweise darauf gibt, dass die mtPTP eine physiologische Rolle dient während mitochondriale Ca 2 +-Homöostase 2, Bioenergetik und Redox Signaling 3.
mtPTP Öffnung durch Matrix Ca 2 + ausgelöst aber seine Aktivität kann durch verschiedene andere Faktoren, wie oxidative Stress, Adeninnucleotid Depletion, hohe Konzentrationen von Pi, Mitochondrienmembran Depolarisation oder Entkuppeln und langkettigen Fettsäuren 4 moduliert. In vitro mtPTP Öffnung kann ach seinieved durch Erhöhen Ca 2 +-Konzentration innerhalb der mitochondrialen Matrix durch exogene Zugabe von Ca 2 + (Calcium Retention Capacity). Wenn Ca 2 +-Spiegel in den Mitochondrien zu erreichen eine bestimmte Schwelle, wird das mtPTP und erleichtert Ca 2 +-Freisetzung, die Ableitung des Protons treibende Kraft, Membranpotential Kollaps und eine Erhöhung der mitochondrialen Matrix Volumen (Schwellung), die letztlich zum Bruch der äußeren Membran der Mitochondrien und irreversiblen Verlust der Organellen-Funktion.
Hier beschreiben wir eine fluorimetrischen Assay, die für eine umfassende Charakterisierung der mtPTP Öffnung in isolierten Maus-Mitochondrien ermöglicht. Der Assay umfasst die gleichzeitige Messung von 3 mitochondrialen Parameter verändert, wenn mtPTP Öffnung eintritt sind: mitochondrialen Ca 2 +-Handling (Aufnahme und Abgabe, wie durch Ca2 +-Konzentration im Testmedium gemessen), Mitochondrienmembranpotential und mitochondrial Volumen. Die Farbstoffe für Ca 2 +-Messung eingesetzt im Testmedium und Mitochondrienmembranpotential sind Fura FF, einer Membran impermeante, ratiometrisch Indikator, der eine Verschiebung in der Anregungswellenlänge in Gegenwart von Ca 2 + und JC-1, ein kationisches erfährt, ratiometrische Indikator, grün oder rot Monomeren Aggregate bildet bei niedrigen und hohen Membranpotential sind. Veränderungen im mitochondrialen Volumens erfolgt durch Aufnahme Lichtstreuung durch den mitochondrialen Suspension gemessen. Da qualitativ hochwertige, funktionelle Mitochondrien für die mtPTP Öffnung Assay erforderlich sind, beschreiben wir auch die notwendigen Schritte zu erhalten intakt, stark gekoppelte und funktionelle isolierten Herzen Mitochondrien.
Protokoll
Ein. Isolierung von Mitochondrien aus Maus Herz
- Zu isolieren Herzen Mitochondrien, zu betäuben und zu opfern Mäusen nach den Verfahren von Ihrem lokalen Institutional Animal Care und Use Committee genehmigt.
Hinweis: Alle Schritte der Mitochondrien isoliert Protokoll muss auf Eis durchgeführt werden. Verwenden eiskalten Puffer und vorgekühlten Petrischalen, Falcon-Röhrchen und Eppendorf-Röhrchen. Die Volumina im Protokoll angegeben ist, für eine Probe mit 2 Mäuseherzen.
- Entfernen Herzen, legen Sie sie in kaltem Mitochondrien Isolation Buffer (300 mM Saccharose, 10 mM Na-HEPES, 200 uM EDTA, pH 7,4) und abspülen Blut.
Hinweis: Für optimale Ergebnisse der pH-Wert der mitochondrialen Puffer sollten mit KOH und Essigsäure eingestellt werden.
- Ort Herzen auf einem kalten Petrischale entfernen Fett und Atrien und Hackfleisch fein mit einem Messer bis zu erhaltenING ein homogenes Produkt.
- Übertragen Hackfleisch Herzen einer 50 ml-Falcon-Röhrchen, 10 ml Mitochondrien Isolation Puffer mit 0,1 mg / ml Trypsin und damit die Probe auf Eis für 10 min zu verdauen.
Anmerkung: Trypsin während des Isolierungsverfahrens erhöht die Ausbeute an isolierten Mitochondrien und sollte konstant gehalten zwischen mitochondrialen Präparationen werden. Wir empfehlen Testen mitochondrialen Funktionen auf Zubereitungen isoliert ist die Abwesenheit von Trypsin, um sicherzustellen, dass das Enzym nicht mit Funktionen stören.
- 10 ml Mitochondrien Isolation Puffer mit 0,1% Fettsäure free BSA und 5 mg Trypsin-Inhibitor (Soja) und mischen durch Invertieren des Röhrchens mehrmals, um das Trypsin zu neutralisieren.
Hinweis: Mitochondrien Isolation Buffer kann im Voraus zubereitet werden und kann bei -20 ° C gelagert werden Überprüfen pH beim Auftauen. Trypsin, Trypsin-Inhibitor oder BSA muss seindded der Mitochondrien Isolation Puffer am Tag des Experiments.
- Wiederherstellen der verdaute Gewebe durch niedrige bis mittlere Geschwindigkeit Zentrifugation für 1 min bei 4 ° C.
- Resuspendieren Gewebe in 8 ml Mitochondrien Isolation Puffer mit 0,1% Fettsäure freies BSA und homogenisieren Verwendung eines motorisierten Dounce Homogenisator mit Teflon-Pistill (4-6 Durchläufen bei 1,200-14,00 rpm). Halten Sie die Probe auf Eis, während Homogenisieren.
- Übertragen Homogenat in ein 15 ml-Falcon-Röhrchen und Zentrifuge bei 800xg 10 min bei 4 ° C bis Pellet Kerne und Gewebereste.
- Wiederherstellen der Überstand mit dem Mitochondrien in Eppendorf-Röhrchen und Zentrifuge bei 8.000 xg für 15 min bei 4 ° C.
- Entfernen Sie vorsichtig die obere weiße Schicht und waschen Sie die verbleibenden dunkleren Pellet die Mitochondrien in 1 ml Mitochondrien Isolation Buffer.
- Zentrifugieren bei 8000 xg für 15 min bei 4 ° C. Überstand und resuspendieren Mitochondrien Pellet in 150 ul Mitochondriale Isolation Buffer. Keep on ice Mitochondrien für weitere Tests.
Hinweis: Die besten Ergebnisse bei der funktionellen Assays verwenden Mitochondrien innerhalb von 4 Stunden der Isolation.
- Quantifizierung mitochondriale Protein mit dem Bradford-Assay.
2. Qualitätskontrolle von isolierten Mitochondrien
2,1. Messung der Atemwege Regelverhältnis (RCR)
- Kalibrieren Sie den Oxytherm Sauerstoff-Elektrode mit Luft-gesättigtem Wasser, um die maximale Sauerstoff-Linie zu etablieren. Wenn ein stabiles Niveau von Sauerstoff erhalten werden 100 ul einer frisch zubereiteten 10 mM Natriumhydrosulfit Lösung, um die Null Sauerstoff Linie festzulegen. Führen Sie Messungen bei 30 ° C.
- 2 ml Mitochondrien Respiration Buffer (125 mM KCl, 20 mM HEPES, 3 mM MgCl 2, 400 uM EGTA, 300 uM DTT, 5 mM KH 2 PO 4, pH 7,2) mit 1 uM Rotenon der Oxytherm Kammer, versiegeln die Kammer und Start Recording.
- Wenn Sauerstoff Signal stabil ist, fügen Sie 250 ug Mitochondrien und aufzeichnen Basalatmung für 1 min. Die Atmung sollte an dieser Stelle sehr niedrig sein wie Mitochondrien auf endogene Substrate (State 1 Atmung) werden atmenden.
- Add 5 mM Succinat und Record-Signal für 1 min. Sauerstoffverbrauch sollte während State 2 Atmung erhöhen.
- Erbrechen State 3 Atmung durch Zugabe von 150 uM ADP. An diesem Punkt Sauerstoffverbrauch erhöhen sollte aufgrund der ATP-Synthese durch oxidative Phosphorylierung. Record-Signal, bis die Atmung verlangsamt, was auf ADP Verbrauch und Übergang zu 4 Atmung Zustand. Rekord State 4 Atmung für mindestens 1 min.
- Fügen Sie 1 uM CCCP und Record-Signal für 1 min. Entkoppelt Atmung sollte maximal sein.
Hinweis: Die Wirkung von CCCP auf die mitochondriale Atmung ist dosisabhängig: hohe Konzentrationen von CCCP können Sauerstoffverbrauch hemmen und sollten daher sorgfältig titrated.
- Berechnen Sie die Atemwege Regelverhältnis (RCR), indem Sauerstoffverbrauchsrate im Zustand 3 Atmung durch den Sauerstoff-Verbrauch während der State 4 Atmung. Ein Ziel RCR sollte ≥ 4 sein.
2,2. Beurteilung der mitochondrialen Membran Integrität (Cytochrom c-Test)
- Gründlich waschen Oxytherm Kammer mit 70% Ethanol und Wasser und wiederholen Sie die Schritte 2.1.2 -2.1.4.
- Fügen Sie 1 mM ADP und aufzeichnen Sauerstoffverbrauch für 1 min.
- Hinzufügen 10 uM Cytochrom c. Da Cytochrom c ist undurchlässig für intakte Membranen der Mitochondrien, zeigt eine Zunahme der Atmung gebrochen oder beschädigt mitochondrialen Membranen.
3. Messung der mitochondrialen Permeabilität Transition Pore Opening
- Richten Sie den Spektrofluorometer für die Multi-Parameter-Messung mtPTP Öffnung. Mit dem FelixGx Programm, erstellen Sie eine neue Hardware-Konfiguration (Quanta Master stetigen state), umfassend die Lichtquelle, Anregungsmonochromator, Probenkammer und zwei Detektoren bei 90 ° und 270 ° in Bezug auf die Anregung Monochromator (Abbildung 4) positioniert ist. Um eine maximale zeitliche Auflösung zu erreichen, müssen beide Emissionsmonochromatoren (90 ° und 270 °) deaktiviert und die Emissions-Filter bei 90 ° und 270 ° in den Probenraum in der Hardware-Konfiguration aktiviert haben. Dieser Schritt entfernt die Motorsteuerung der Emissionswellenlängen und beheben jeden Monochromator bei einer bestimmten Wellenlänge. Wenn die Emissionsmonochromatoren nicht deaktiviert sind, wird jeder Detektor Zyklus zwischen beiden Wellenlängen und doppelte Messungen werden aufgezeichnet.
- Erstellen Sie eine neue Übernahme-Protokoll mit der Multi Dye und geben Sie die folgenden Farbstoffe:
- Fura (hohe Ca + +): Anregung 340 nm, Emission 525 nm (Detektor 1)
- Fura (low Ca + +): Anregung 380 nm, Emission 525 nm (Detektor 1)
- JC1 (Aggregat): Anregung 543 nm, Emission 595 nm (Detektor 2)
- JC1 (Monomer): Anregung 498 nm, Emission 525 nm (Detektor 1)
- Schwellung: Anregung 525 nm, Emission 525 nm (Detektor 1)
- Einstellen der Anregung und Emission Schlitze bis 1 nm und die Temperatur auf 37 ° C.
- Um die ratiometrische Signal für Fura und JC-1 zu erhalten, erzeugen zwei abgeleiteten Spuren: Fura (hohe Ca + +) / Fura (low Ca + +) und JC1 (Aggregat) / JC1 (Monomer).
- Manuelle Einstellung der Emissionswellenlänge von Detektoren 1 und 2 bis 525 nm und 595 nm auf.
- Mix 1 ml Mitochondrien Assaypuffer (120 mM KCl, 10 mM NaCl, 1 mM KH 2 PO 4, 20 mM HEPES-Tris, pH 7,2) mit 1 uM Rotenon, 5 mM Succinat und 800 nM Fura FF in einem Einweg-4-seitige Methacrylat Küvette. Fügen Sie 250 ug Mitochondrien und Ort Probe im Probenraum. Stellen Sie sicher, dass der Magnetrührer eingeschaltet ist.
- Starten Sie die Aufnahme. Nach 1 min Pause den Erwerb, 500 nM JC-1 und starten Sie den acquisition. Der JC-1-Ratio Signal sollte zu erhöhen, was darauf hinweist Farbstoffaufnahme durch aktive Mitochondrien. Aufnahme fortsetzen, bis JC-1-Signal ein Plateau (in der Regel innerhalb von 5 min) erreicht hat.
- Hinzufügen 20 uM CaCl 2. Ein momentaner Anstieg der Fura FF Verhältnissignal sollte von der erhöhten Ca 2 + in der Gegenwart Assaypuffer, durch eine allmähliche Abnahme durch mitochondriale Ca 2 +-Aufnahme gefolgt beobachtet werden. Der JC-1-Ratio Signal sollte zeigen eine kurze vorübergehende Abnahme indikativ für leichte Mitochondrienmembran Depolarisation.
- Warten Sie, bis Fura FF Verhältnis Signal wieder auf Basisniveau vor der Zugabe der anderen CaCl 2 Puls (1-1.5 min). Weiter pulsierenden in festen Intervallen, bis Mitochondrien nicht ansammeln können Ca 2 + und beginnen Loslassen Ca 2 + in die Assay-Puffer. mtPTP Öffnung ist durch eine gleichzeitige Erhöhung der Fura FF Verhältnissignal durch Ca 2 +-Freisetzung visualisiert, eine Abnahme in der JC-1-Signal-Verhältnisses aufgrund Membran potential Kollaps und eine Abnahme der Lichtstreuung aufgrund mitochondriale Schwellung (Abbildung 5).
- Nach mtPTP Aktivierung, ob die Spezifität der Fura FF, JC-1 und Schwellungen, die jeweils mit 1 mM EGTA, 1 uM CCCP und 5 ug / ml Alamethicin.
- Um die Spezifität der mtPTP Öffnung zu überprüfen, wiederholen Sie die Schritte 3,6 bis 3,9 in Gegenwart von 1 uM des Cyclophilin D Inhibitor Cyclosporin A (Cyclophilin D ist eine Komponente des mtPTP). In Anwesenheit von Cyclosporin A, das Öffnen des mtPTP benötigt erheblich mehr CaCl2 Impulse als Kontrollproben (Abbildung 6).
4. Repräsentative Ergebnisse
Abbildung 2 zeigt eine typische respiratorische Kontrolle der isolierten Maus-Mitochondrien. Zustand 3 Beatmung wird durch Zugabe von ADP in Mitochondrien atmenden auf Succinat erreicht, und wird durch eine deutliche Erhöhung des Sauerstoffverbrauchs bezüglich des Substra dadurchte allein. Abreicherung zugegeben ADP initiiert State 4 Atmung, bei dem Sauerstoffverbrauch verlangsamt und ist vergleichbar mit Raten vor ADP Zugabe erreicht. RCR wird berechnet, indem der Sauerstoff-Verbrauch für staatliche 3 Atmung durch, dass der Staat 4 Beatmung erhalten. Die Cytochrom c-Test wird verwendet, um Test der Integrität der äußeren Membran der Mitochondrien: wenn Cytochrom c zu Mitochondrien atmenden auf Succinat und ADP, keine weitere Zunahme der Atmung beobachtet wird hinzugefügt, was auf eine intakte äußeren mitochondrialen Membranen (Abbildung 3).
Ein repräsentatives Bild für die mtPTP Öffnung in isolierten Herzen Mitochondrien ist in Abbildung 4 dargestellt. In diesem Fall mtPTP Öffnung wurde durch die Zugabe von 4 CaCl 2 Impulse (20 uM jedes) nach 1,5 min Intervallen ausgelöst. mtPTP Öffnung ist durch die gleichzeitige Freisetzung der Nähe der mitochondrialen Ca 2 + (Erhöhung Fura FF Verhältnissignal), Zusammenbruch mitochond scheinbarenrial Membranpotential (Abnahme der JC-1-Ratio-Signal) und erhöhte mitochondriale Volumen (Rückgang der Schwellung Signal). Wenn Cyclosporin A zugesetzt wird, welche an den D-Anteil des Cyclophilin bindet mtPTP erfordert mtPTP Öffnung 7 Impulsen von CaCl 2 anstelle von 4 (Abbildung 5).
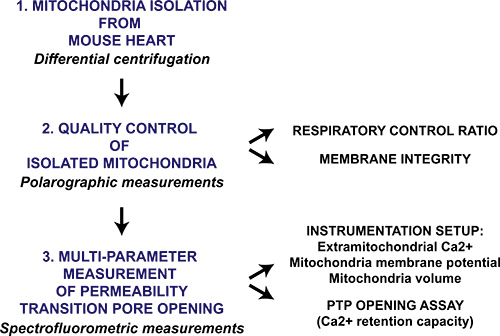
Abbildung 1. Ablaufdiagramm des Multi-Parameter-mitochondrialer Permeabilitätsübergang Porenöffnung Protokoll für isolierte Mitochondrien. Herz von Mäusen geerntet und Mitochondrien werden durch differentielle Zentrifugation isoliert. Die mitochondrialen Präparation wird dann qualitativ durch polarographische Messung des respiratorischen Verstärkungsfaktor und Mitochondrienmembran Intaktheit in Anwesenheit von Cytochrom c ausgewertet. Mitochondriale permeability transition pore Öffnung in isolierten Mitochondrien wird durch sequentielle CaC ausgelöstl 2 Additionen und ist mit einem Spektrofluorometer durch Überwachung Ca 2 +-Freisetzung aus Mitochondrien-Membran möglichen Zusammenbruch und Schwellung der mitochondrialen Matrix gemessen.
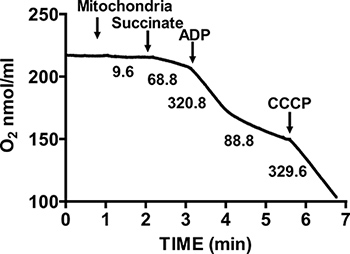
Abbildung 2. Messung Atemwege Regelverhältnis (RCR) von isolierten Herzen Mitochondrien. Sauerstoffverbrauch durch isolierte Mitochondrien während State 3 Atmung in Gegenwart von Succinat und ADP gemessen, und im Zustand 4 Atmung nach ADP Verbrauch. Die Reaktion des isolierten Mitochondrien Entkuppler wird durch die Zugabe von CCCP gemessen. Zahlen auf dem Graphen sind die Raten der Sauerstoffverbrauch durch isolierte Mitochondrien in nmol / min / mg Protein.
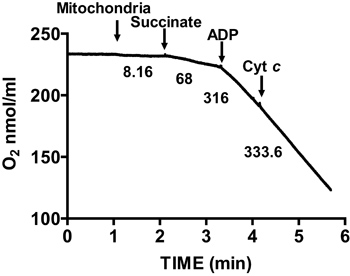
Abbildung 3. Measure ment der Membran Integrität der isolierten Herzen Mitochondrien. Mitochondrienmembran Integrität wird durch Messen des Sauerstoffverbrauchs in isolierter Mitochondrien in Gegenwart von Succinat und ADP und nach der Zugabe von Cytochrom c bestimmt. Zahlen auf dem Graphen sind die Raten der Sauerstoffverbrauch durch isolierte Mitochondrien in nmol / min / mg Protein.
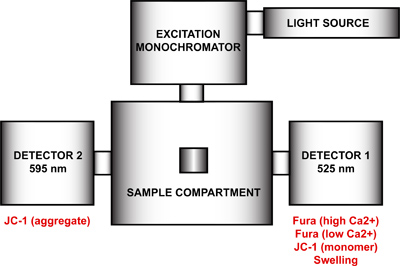
Abbildung 4. Spectrofluorometer Hardwarekonfiguration für die Multi-Parameter-Messung mtPTP Öffnung. Die Hardware-Konfiguration der Spektrofluorometer umfasst eine Lichtquelle, ein Erregungssignal-Monochromator, einen Probenraum und zwei Detektoren mit festen Emissionswellenlängen bei 525 nm und 595 nm liegt. Detektor 1 ist für die Signaldetektion von Fura FF hohen und niedrigen Ca 2 +, JC-1-Monomer und Aufblähen Signals verwendet wird. Detector 2 misst die JC-1 Summensignal.
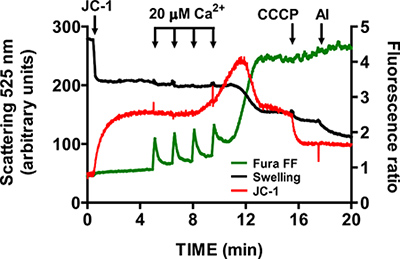
Abbildung 5. Multi-Parameter-Messung mtPTP Öffnung in isolierten Herzen Mitochondrien. mtPTP Eröffnung wurde durch sequentielle Zugabe von 20 uM CaCl 2 ausgelöst und wurde von Ca 2, dadurch +-Freisetzung aus Mitochondrien, Mitochondrienmembranpotentials Zusammenbruch und erhöhten mitochondrialen Matrix Volumen (Schwellung). Extramitochondrialen Ca 2 + und Membranpotential wurden mit den ratiometrisch Indikatoren Fura FF (grüne Kurve) und JC-1 (rote Kurve) gemessen. Schwellung der Mitochondrien wurde durch Aufnahme Lichtstreuung bei 525 nm (schwarze Kurve) gemessen. Spezifität von JC-1 und Schwellungen Signale wurde mit 1 uM CCCP und 5 ug / ml Alamethicin (a mikrobiellen Toxin) getestet.
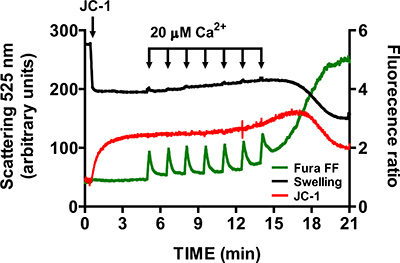
Abbildung 6. Multi-Parameter-Messung der mtPTP Öffnung in isolierten Mitochondrien in Gegenwart von Cyclosporin A. Cyclosporin A (1 uM) erhöht die Anzahl der CaCl 2 Impulse benötigt, um mtPTP in isolierten Mitochondrien öffnen.
Diskussion
Das Protokoll hier vorgestellten beschreibt die notwendigen experimentellen Schritte permeability transition pore Öffnung in isolierten Herzen Mitochondrien (Abbildung 1 und Abbildung 4) zu beurteilen: das Verfahren zur Isolierung von Maus-Mitochondrien, die Atemwege Steuerelemente, die ihre Integrität und Funktionalität zu gewährleisten, die mitochondriale Parameter während überwacht mtPTP Öffnung und die Farbstoffe für ihre Messung eingesetzt, die Einrichtung des spektrofluoro...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von HL094536 (BJH) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Trypsin | Sigma-Aldrich | T3030 | |
| Trypsin-Inhibitor (Sojabohne) | Sigma-Aldrich | T9128 | |
| Natriumhydrosulfit | Sigma-Aldrich | 71699 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Cytochrom c | Sigma-Aldrich | C7752 | |
| Alamethicin | Sigma-Aldrich | A4665 | |
| CCCP | Sigma-Aldrich | C2759 | |
| Cyclosporin A | Calbiochem | 239835 | |
| Fura FF | Invitrogen | F14180 | |
| JC-1 | Invitrogen | T3168 | |
| Tissue Grinder Potter-Elvehjem mit Teflon Pistill 15 ml | Wheaton Industries | ||
| Rührwerk | Wheaton Industries | 903475 | |
| Oxytherm (temperaturgesteuerten Sauerstoffelektrode) | Hansatech Instruments | ||
| QuantaMaster 80 duale Emission Spektrofluorometer | Photon Technology International, Inc. |
Referenzen
- Kroemer, G., Galluzzi, L., Brenner, C. Mitochondrial Membrane Permeabilization in Cell Death. Physiol. Rev. 87, 99-163 (2007).
- Elrod, J., Wong, R., Mishra, S., Vagnozzi, R. J., Sakthievel, B., Goonasekera, S. A., Karch, J., Gabel, S., Farber, J., Force, T., Brown, J. H., Murphy, E., Molkentin, J. D. Cyclophilin D controls mitochondrial pore-dependent Ca2+ exchange, metabolic flexibility, and propensity for heart failure in mice. J. Clin. Invest. 120, 3680-3687 (2010).
- Hom, J. R., Quintanilla, R. A., Hoffman, D. L., de Mesy Bentley, K. L., Molkentin, J. D., Sheu, S. S., Porter, G. A. The permeability transition pore controls cardiac mitochondrial maturation and myocyte. 21, 469-478 (2011).
- Halestrap, A. P. What is the mitochondrial permeability transition pore. Journal of Molecular and Cellular Cardiology. 46, 821-831 (2009).
- Wei, A. C., Liu, T., Cortassa, S., Winslow, R. L., O'Rourke, B. Mitochondrial Ca2+ influx and efflux rates in guinea pig cardiac mitochondria: low and high affinity effects of cyclosporine A. Biochim. Biophys. Acta. 1813, 1373-1381 (2011).
- Saks, V. A., Kuznetsov, A. V., Kupriyanov, V. V., Miceli, M. V., Jacobus, W. E. Creatine kinase of rat heart mitochondria. The demonstration of functional coupling to oxidative phosphorylation in an inner membrane-matrix preparation. J. Biol. Chem. 260, 7757-7764 (1985).
- Boehm, E. A., Jones, B. E., Radda, G. K., Veech, R. L., Clarke, K. Increased uncoupling proteins and decreased efficiency in palmitate-perfused hyperthyroid rat heart. AJP - Heart. 280, 977-983 (2001).
- Fontaine, E., Eriksson, O., Ichas, F., Bernardi, P. Regulation of the Permeability Transition Pore in Skeletal Muscle Mitochondria. J. Biol. Chem. 273, 12662-12668 (1998).
- Berman, S. B., Watkins, S. C., Hastings, T. G. Quantitative biochemical and ultrastructural comparison of mitochondrial permeability transition in isolated brain and liver mitochondria: evidence for reduced sensitivity of brain mitochondria. Exp. Neurol. 164, 415-425 (2000).
- Panov, A., Dikalov, S., Shalbuyeva, N., Hemendinger, R., Greenamyre, J. T., Rosenfeld, J. Species- and tissue-specific relationships between mitochondrial permeability transition and generation of ROS in brain and liver mitochondria of rats and mice. Am. J. Physiol. Cell Physiol. 292, 708-718 (2007).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured filroblasts. Nature Protocols. 2, 287-295 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten