È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Multi-parametro di misura della apertura dei pori di transizione di permeabilità nel Cuore mouse mitocondri isolati
In questo articolo
Riepilogo
Un protocollo spettrofluorimetrico per la misura della permeabilità mitocondriale apertura dei pori di transizione nel cuore topo mitocondri isolati è presentato qui. Il test prevede la misurazione simultanea dei mitocondri Ca 2 + Manipolazione, volume potenziale di membrana mitocondriale e mitocondriale. La procedura per ottenere il cuore di alta qualità e funzionale mitocondri è anche descritto.
Abstract
Il poro di transizione di permeabilità mitocondriale (mtPTP) è un canale non specifica che forma nella membrana mitocondriale interna per trasportare soluti con una massa molecolare inferiore a 1,5 kDa. Anche se l'identità definitiva molecolare del poro è ancora in discussione, proteine come cyclophilin D, VDAC e ANT contribuire alla mtPTP formazione. Mentre il coinvolgimento di apertura mtPTP nella morte cellulare è ben definito 1, accumulando prove indicano che la mtPTP serve un ruolo fisiologico durante mitocondriale omeostasi Ca 2 + 2, bioenergetica e redox di segnalazione 3.
apertura mtPTP è innescata da matrice Ca 2 +, ma la sua attività può essere modulata da diversi altri fattori come stress ossidativo, adenina nucleotide esaurimento, alte concentrazioni di Pi, depolarizzazione della membrana mitocondriale o sganciamento, e acidi grassi a catena lunga 4. In vitro, mtPTP apertura può essere achieved aumentando la concentrazione di Ca 2 + all'interno della matrice mitocondriale mediante aggiunte esogene di Ca 2 + (capacità di ritenzione di calcio). Quando i livelli di Ca 2 + nei mitocondri raggiunge una certa soglia, il mtPTP apre e facilita Ca 2 + rilascio, la dissipazione della forza motrice protonica, crollo potenziale di membrana ed un aumento di volume della matrice mitocondriale (gonfiore) che conduce infine alla rottura del membrana mitocondriale esterna e perdita irreversibile della funzione organello.
Qui si descrive un saggio fluorimetrico che permette una caratterizzazione completa di apertura mtPTP nel cuore topo mitocondri isolati. Il test prevede la misurazione simultanea dei tre parametri mitocondriali che vengono alterati quando apertura mtPTP verifica: mitocondriale Ca 2 + movimentazione (assorbimento e rilascio, misurata dalla concentrazione di Ca 2 + nel mezzo di saggio), il potenziale di membrana mitocondriale, e mitochoVolume ndrial. I coloranti impiegati per la misurazione Ca 2 + nel mezzo di saggio e il potenziale di membrana mitocondriale sono Fura FF, un impermeant membrana, indicatore raziometrico che subisce uno spostamento della lunghezza d'onda di eccitazione in presenza di Ca 2 +, e JC-1, un cationico, Indicatore raziometrico che costituisce monomeri verdi o rosse aggregati al potenziale di membrana a bassa e alta, rispettivamente. Variazioni di volume mitocondriale sono misurata registrando diffusione della luce dalla sospensione mitocondriale. Dal momento che di alta qualità, i mitocondri funzionale sono necessari per il test di apertura mtPTP, abbiamo anche descrivere i passi necessari per ottenere intatta, cuore altamente accoppiato e funzionale mitocondri isolati.
Protocollo
1. Isolamento dei mitocondri di cuore di topo
- Per isolare il cuore mitocondri, anestetizzare e sacrificio topi secondo le procedure approvate dal locale Cura degli animali e del Comitato Istituzionale uso.
Nota: Tutte le fasi del protocollo di isolamento mitocondri deve essere eseguita su ghiaccio. Usare tamponi di ghiaccio freddo e pre-refrigerati Petri, Falcon tubi e tubi Eppendorf. I volumi stabiliti nel protocollo sono per un campione contenente 2 cuori di topo.
- Rimuovere i cuori, metterli in acqua fredda Buffer Isolamento mitocondri (300 saccarosio mM, 10 mM Na-HEPES, 200 mM EDTA, pH 7,4) e risciacquare sangue.
Nota: Per ottenere risultati ottimali, il pH del buffer mitocondriali deve essere regolato con KOH e acido acetico.
- Cuori, posizionarli su un piatto freddo Petri, rimuovere il grasso e atri, e tritateli finemente con una lama fino ad ottenereche istituisce un prodotto omogeneo.
- Trasferire cuori tritati in una provetta da 50 ml Falcon, aggiungere 10 ml di tampone Isolamento mitocondri con 0,1 mg / ml di tripsina e consente al campione di digerire in ghiaccio per 10 min.
Nota: Tripsina durante la procedura di isolamento aumenta il rendimento di mitocondri isolati e deve essere mantenuta costante tra preparazioni mitocondriali. Si consiglia di testare le funzioni mitocondriali sui preparati isolato è l'assenza di tripsina per garantire che l'enzima non interferisce con la funzionalità.
- Aggiungere 10 ml di tampone di isolamento mitocondri con 0,1% di acidi grassi liberi BSA e 5 mg di inibitore della tripsina (soia) e mescolare per inversione della provetta diverse per neutralizzare la tripsina.
Nota: Buffer Isolation mitocondri possono essere preparati in anticipo e possono essere conservati a -20 ° C. Controllare il pH dopo lo scongelamento. Tripsina, inibitore della tripsina o BSA deve esseredded al Buffer Isolamento mitocondri il giorno dell'esperimento.
- Recuperare il tessuto digerito da un basso-medio della velocità di centrifugazione per 1 min a 4 ° C.
- Tessuto Risospendere in 8 ml tampone Isolamento mitocondri con 0,1% di acidi grassi liberi BSA e omogeneizzare con un omogeneizzatore Dounce motorizzato con un pestello in Teflon (4-6 passi di 1,200-14,00 rpm). Conservare il campione in ghiaccio durante la omogeneizzazione.
- Trasferire omogeneizzato in una provetta da 15 ml Falcon e centrifugare a 800xg per 10 min a 4 ° C per nuclei pellet e frammenti di tessuto.
- Recuperare il supernatante contenente i mitocondri in provette Eppendorf e centrifugare a 8000 xg per 15 min a 4 ° C.
- Rimuovere accuratamente lo strato superiore bianco e lavare il residuo scuro pellet contenente i mitocondri in 1 ml di tampone Isolamento mitocondri.
- Centrifugare a 8000xg per 15 min a 4 ° C. Gettare il surnatante e risospendere mitocondri pellet in 150 microlitri mitocondriale Isolazione del buffer. Tenere mitocondri in ghiaccio per ulteriori analisi.
Nota: Per ottenere i migliori risultati durante saggi funzionali, utilizzare i mitocondri all'interno di 4 ore di isolamento.
- Quantificare proteine mitocondriali usando il saggio Bradford.
2. Controllo di qualità dei mitocondri isolati
2,1. Misura del rapporto di controllo respiratorio (RCR)
- Calibrare l'elettrodo ossigeno Oxytherm di aria satura di acqua per stabilire il limite massimo di ossigeno. Quando un livello stabile di ossigeno è ottenuto aggiungere 100 microlitri di una soluzione preparata idrosolfito di sodio 10 mM di stabilire la linea di zero ossigeno. Eseguire misurazioni a 30 ° C.
- Aggiungere 2 ml Tampone Respiration mitocondri (125 mM KCl, 20 mM HEPES, 3 mM MgCl2, 400 mM EGTA, DTT 300 mM, 5 mM KH 2 PO 4, pH 7,2) con 1 rotenone pM alla camera Oxytherm, sigillare la camera e inizio regiding.
- Quando il segnale di ossigeno è stabile, aggiungere 250 ug mitocondri e registrare respirazione basale per 1 min. La respirazione a questo punto dovrebbe essere molto bassa in quanto i mitocondri sono respirano su substrati endogeni (Stato 1 respirazione).
- Aggiungere 5 succinato mM e segnale di registrazione per 1 min. Il consumo di ossigeno dovrebbe aumentare durante la respirazione Stato 2.
- Stato indurre 3 della respirazione aggiungendo ADP 150 uM. A questo punto il consumo di ossigeno dovrebbe aumentare grazie alla sintesi di ATP attraverso la fosforilazione ossidativa. Record segnale fino a respirazione rallenta, indicante il consumo ADP e la transizione allo stato 4 respirazione. Record Stato 4 respirazione per almeno 1 min.
- Aggiungere 1 CCCP pM e segnale di registrazione per 1 min. Respirazione disaccoppiata dovrebbe essere massimale.
Nota: L'effetto di CCCP sulla respirazione mitocondriale è dose-dipendente: alte concentrazioni di CCCP in grado di inibire il consumo di ossigeno e deve quindi essere attentamente titrated.
- Calcolare il rapporto di controllo respiratorio (RCR) dividendo tasso di consumo di ossigeno durante la respirazione Stato 3 per il tasso di consumo di ossigeno durante la respirazione Stato 4. RCR Un obiettivo deve essere ≥ 4.
2,2. Valutazione dell'integrità della membrana mitocondriale (citocromo c di prova)
- Lavare accuratamente la camera di Oxytherm con il 70% di etanolo e acqua e ripetere i passaggi 2.1.2 -2.1.4.
- Aggiungere 1 mM ADP e il consumo di ossigeno record per 1 min.
- Aggiungere 10 pM citocromo c. Poiché citocromo c è impermeabile intatte membrane mitocondriali, un aumento respirazione indica rotti o danneggiati membrane mitocondriali.
3. La misura della mitocondriale di apertura dei pori di transizione di permeabilità
- Impostare il spettrofluorimetro per il multi-parametro di misura di apertura mtPTP. Utilizzando il programma FelixGx, creare una nuova configurazione hardware (Quanta sta maestro costantete) comprendente la sorgente di luce, monocromatore di eccitazione, compartimento campione e due rivelatori posizionati a 90 ° e 270 ° rispetto al monocromatore di eccitazione (Figura 4). Per ottenere una risoluzione massima di tempo, sia monocromatori di emissione (90 ° e 270 °) deve essere disabilitata ed i filtri di emissione a 90 ° e 270 ° nel vano campione attivato nel menu di configurazione hardware. Questo passaggio rimuovere il controllo del motore delle lunghezze d'onda di emissione e correggere ogni monocromatore ad una particolare lunghezza d'onda. Se i monocromatori emissioni non sono disattivati, ogni rivelatore ciclo tra le due lunghezze d'onda e le misure duplicati verranno registrati.
- Creazione di un nuovo protocollo di acquisizione utilizzando il tipo Multi Dye e immettere i seguenti coloranti:
- Fura (alto Ca + +): eccitazione 340 nm, emissione 525 nm (rilevatore 1)
- Fura (basso Ca + +): eccitazione 380 nm, emissione 525 nm (rilevatore 1)
- JC1 (aggregato): eccitazione 543 nm, Emissione 595 nm (rivelatore 2)
- JC1 (monomero): eccitazione 498 nm, emissione 525 nm (rilevatore 1)
- Gonfiore: eccitazione 525 nm, emissione 525 nm (rilevatore 1)
- Impostare le fessure di eccitazione e di emissione a 1 nm e la temperatura a 37 ° C.
- Per ottenere il segnale raziometrico per Fura e JC-1, generare due tracce derivati: Fura (alto Ca + +) / Fura (basso Ca + +) e JC1 (aggregato) / JC1 (monomero).
- Consente di regolare manualmente la lunghezza d'onda di emissione di rivelatori 1 e 2 ai 525 nm e 595 nm, rispettivamente.
- Mescolare 1 ml Tampone del saggio mitocondri (120 mM KCl, 10 mM NaCl, 1 mM KH 2 PO 4, 20 mM HEPES-Tris, pH 7,2) con 1 rotenone pM, 5 mM di succinato e 800 nM Fura FF in un monouso quattro lati metacrilato cuvetta. Aggiungi campione da 250 mg mitocondri e posto nel vano campione. Assicurarsi che l'agitatore magnetico è acceso.
- Avviare la registrazione. Dopo 1 minuto, mettere in pausa l'acquisizione, aggiungere 500 nM JC-1 e quindi riavviare il uncquisition. Il segnale JC-1 ratio dovrebbe aumentare, indicando assorbimento colorante dai mitocondri attivo. La registrazione fino a JC-1 il segnale ha raggiunto un plateau (di solito entro 5 min).
- Aggiungere 20 mM CaCl 2. Un aumento istantaneo in rapporto segnale Fura FF dovrebbe essere osservato dalla aumentata Ca 2 + in presenza del tampone di saggio, seguita da una graduale diminuzione a causa mitocondriale Ca 2 + assorbimento. Il segnale JC-1 ratio dovrebbe esibire una diminuzione transitoria breve indicativa di una lieve depolarizzazione della membrana mitocondriale.
- Attendere fino al ritorno di rapporto segnale Fura FF al livello basale prima dell'aggiunta di un altro impulso di CaCl 2 (1-1,5 min). Continua a pulsare ad intervalli fissi fino a mitocondri non possono accumulare Ca 2 + e iniziare il rilascio di Ca 2 + nel tampone. apertura mtPTP è visualizzato da un concomitante aumento del rapporto segnale Fura FF causa Ca 2 + release, una diminuzione del JC-1 rapporto segnale dovuto pote membranacollasso ntial, e una diminuzione della diffusione della luce dovuta a rigonfiamento mitocondriale (Figura 5).
- Dopo l'attivazione mtPTP, verificare la specificità Fura FF, JC-1 e segnali gonfiore rispettivamente con 1 mM EGTA, 1 pM CCCP e 5 ug / ml alameticina.
- Per verificare la specificità di apertura mtPTP, ripetere i passaggi 3,6-3,9 in presenza di 1 pM della ciclosporina cyclophilin inibitore D A (cyclophilin D è un componente del mtPTP). In presenza di ciclosporina A, l'apertura del mtPTP richiede molto più CaCl 2 impulsi di campioni di controllo (Figura 6).
4. Risultati rappresentativi
Figura 2 mostra un tipico controllo respiratorio di cuore di topo mitocondri isolati. Stato 3 della respirazione si ottiene per aggiunta di ADP di mitocondri respirano il succinato, ed è caratterizzato da un consumo di ossigeno significativamente aumentata rispetto al substratite da solo. Deplezione di Stato aggiunto ADP iniziati 4 respirazione, durante il quale il consumo di ossigeno e rallenta è paragonabile a tassi raggiunti prima dell'aggiunta ADP. RCR si ottiene dividendo il tasso di consumo di ossigeno per respirazione 3 Stato da quello di Stato 4 respirazione. Il test citocromo c viene utilizzato per saggiare l'integrità della membrana esterna mitocondriale: quando citocromo c è aggiunto mitocondri respirano il succinato e ADP, non aumentare la respirazione si osserva, indicando un intatto membrana mitocondriale esterna (figura 3).
Una immagine rappresentativa per l'apertura mtPTP nel cuore mitocondri isolati è mostrato in Figura 4. In questo caso l'apertura mtPTP stata innescata con l'aggiunta di 4 CaCl 2 impulsi (20 pM ciascuno) ad intervalli di 1,5 min. apertura mtPTP risulta dal rilascio simultaneo di mitocondriale vicino Ca 2 + (aumento del segnale Fura rapporto FF), crollo del mitochondpotenziale di membrana rial (decremento JC-1 rapporto segnale) e un aumento del volume mitocondriale (diminuzione del segnale gonfiore). Quando ciclosporina A è aggiunto, che si lega alla componente cyclophilin D di mtPTP, apertura mtPTP richiede 7 impulsi di CaCl 2 invece di 4 (Figura 5).
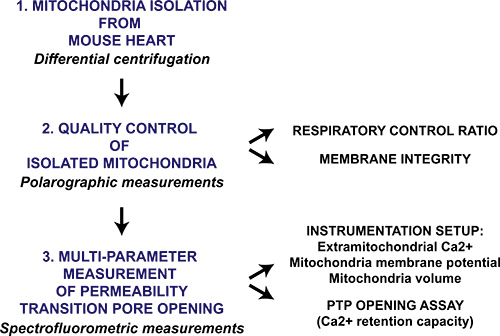
Figura 1. Diagramma di flusso del multi-parametro mitocondriale protocollo di transizione di apertura dei pori di permeabilità per il cuore mitocondri isolati. Cuore viene raccolto dai topi e mitocondri sono isolate tramite centrifugazione differenziale. La preparazione mitocondriale viene quindi valutata qualitativamente mediante misurazione polarografico del rapporto di controllo respiratorio e l'integrità della membrana mitocondriale in presenza di citocromo c. Mitocondriale permeabilità transizione di apertura dei pori in mitocondri isolati è innescato da sequenziale CaCl 2 aggiunte e viene misurata con un spettrofluorimetro monitorando Ca 2 + libero dai mitocondri, crollo potenziale di membrana e gonfiore della matrice mitocondriale.
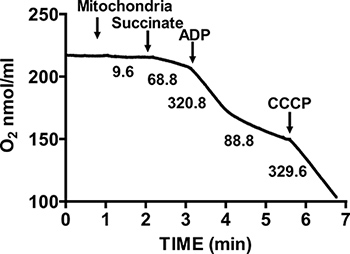
Figura 2. Misurazione controllo del rapporto respiratorio (RCR) del cuore isolato mitocondri. Consumo di ossigeno da cuore isolato mitocondri viene misurata durante State 3 della respirazione in presenza di succinato e ADP, e durante la respirazione Stato 4 dopo il consumo ADP. La risposta di mitocondri isolati per uncouplers viene misurata mediante l'aggiunta di CCCP. Numeri sul grafico sono i tassi di consumo di ossigeno da mitocondri isolati in nmol / min / mg di proteina.
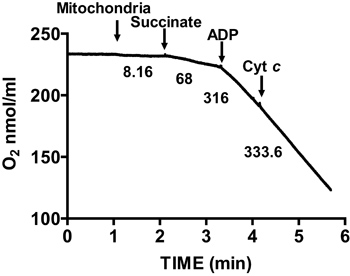
Figura 3. Misura mento dell'integrità della membrana del cuore isolato mitocondri. Membrana mitocondriale è determinata misurando il consumo di ossigeno nei mitocondri isolati in presenza di succinato e ADP e dopo l'aggiunta del citocromo c. Numeri sul grafico sono i tassi di consumo di ossigeno da mitocondri isolati in nmol / min / mg di proteina.
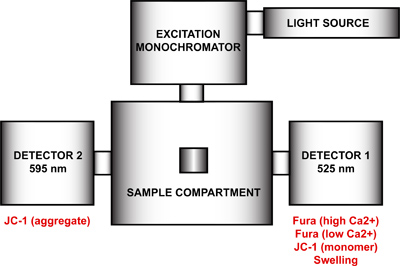
Figura 4. Configurazione hardware Spectrofluorometer per il multi-parametro di misura di apertura mtPTP. La configurazione hardware del spettrofluorimetro comprende una sorgente luminosa, un monocromatore di eccitazione, un compartimento campione e due rivelatori con lunghezze d'onda di emissione a 525 nm fissi e 595 nm. Rivelatore 1 è utilizzato per la rilevazione del segnale di Fura FF alta e bassa Ca 2 +, JC-1 monomero, e il segnale di rigonfiamento. Rivelatore 2 misura il segnale JC-1 aggregato.
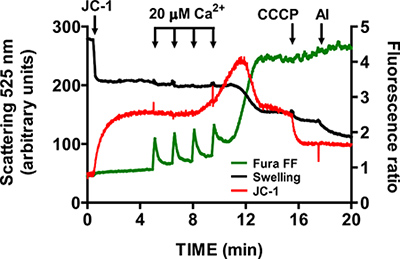
Figura 5. Multi-parametro di misura di apertura mtPTP nel cuore mitocondri isolati. apertura mtPTP è stato innescato da aggiunte sequenziali di 20 mM CaCl 2 ed è stato caratterizzato da Ca 2 + rilascio dai mitocondri, crollo potenziale di membrana mitocondriale e un aumento del volume matrice mitocondriale (gonfiore). Extramitocondriale Ca 2 + e potenziale di membrana sono stati misurati con gli indicatori raziometriche Fura FF (traccia verde) e JC-1 (traccia rossa). Gonfiore dei mitocondri è stata misurata mediante la registrazione di diffusione della luce a 525 nm (nero traccia). Specificità di JC-1 e segnali rigonfiamento è stato testato con 1 CCCP pM e 5 ug / ml alameticina (una tossina microbica).
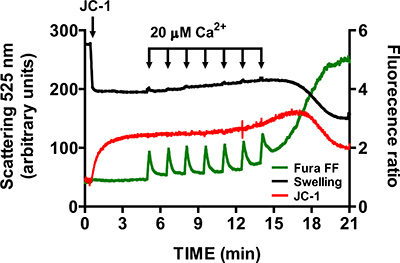
Figura 6. Multi-Parametro di misura di apertura mtPTP nel cuore mitocondri isolati in presenza di ciclosporina A. ciclosporina A (1 pM) aumenta il numero di CaCl 2 impulsi necessari per aprire mtPTP nel cuore mitocondri isolati.
Discussione
Il protocollo qui presentato descrive i passi necessari per valutare sperimentali transizione di apertura permeabilità pori nel cuore mitocondri isolati (Figura 1 e Figura 4): la procedura per isolare cuore topo mitocondri, i controlli respiratori che assicurano l'integrità e la funzionalità, i parametri monitorati durante mitocondriali mtPTP apertura ed i coloranti utilizzati per la loro misurazione, la costituzione della strumentazione spettrofluorimetrico, e la caratterizzazio...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto da HL094536 (BJH).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
| Tripsina | Sigma-Aldrich | T3030 | |
| Inibitore della tripsina (soia) | Sigma-Aldrich | T9128 | |
| Sodio hydrosulfite | Sigma-Aldrich | 71699 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Citocromo c | Sigma-Aldrich | C7752 | |
| Alameticina | Sigma-Aldrich | A4665 | |
| CCCP | Sigma-Aldrich | C2759 | |
| Ciclosporina A | Calbiochem | 239835 | |
| Fura FF | Invitrogen | F14180 | |
| JC-1 | Invitrogen | T3168 | |
| Tissue-grinder Potter Elvehjem con pestello in Teflon 15 ml | Wheaton Industries | ||
| Agitatore ad asta | Wheaton Industries | 903475 | |
| Oxytherm (elettrodo di ossigeno a temperatura controllata) | Hansatech Instruments | ||
| QuantaMaster 80 spettrofluorimetro doppia emissione | Photon Technology International, Inc. |
Riferimenti
- Kroemer, G., Galluzzi, L., Brenner, C. Mitochondrial Membrane Permeabilization in Cell Death. Physiol. Rev. 87, 99-163 (2007).
- Elrod, J., Wong, R., Mishra, S., Vagnozzi, R. J., Sakthievel, B., Goonasekera, S. A., Karch, J., Gabel, S., Farber, J., Force, T., Brown, J. H., Murphy, E., Molkentin, J. D. Cyclophilin D controls mitochondrial pore-dependent Ca2+ exchange, metabolic flexibility, and propensity for heart failure in mice. J. Clin. Invest. 120, 3680-3687 (2010).
- Hom, J. R., Quintanilla, R. A., Hoffman, D. L., de Mesy Bentley, K. L., Molkentin, J. D., Sheu, S. S., Porter, G. A. The permeability transition pore controls cardiac mitochondrial maturation and myocyte. 21, 469-478 (2011).
- Halestrap, A. P. What is the mitochondrial permeability transition pore. Journal of Molecular and Cellular Cardiology. 46, 821-831 (2009).
- Wei, A. C., Liu, T., Cortassa, S., Winslow, R. L., O'Rourke, B. Mitochondrial Ca2+ influx and efflux rates in guinea pig cardiac mitochondria: low and high affinity effects of cyclosporine A. Biochim. Biophys. Acta. 1813, 1373-1381 (2011).
- Saks, V. A., Kuznetsov, A. V., Kupriyanov, V. V., Miceli, M. V., Jacobus, W. E. Creatine kinase of rat heart mitochondria. The demonstration of functional coupling to oxidative phosphorylation in an inner membrane-matrix preparation. J. Biol. Chem. 260, 7757-7764 (1985).
- Boehm, E. A., Jones, B. E., Radda, G. K., Veech, R. L., Clarke, K. Increased uncoupling proteins and decreased efficiency in palmitate-perfused hyperthyroid rat heart. AJP - Heart. 280, 977-983 (2001).
- Fontaine, E., Eriksson, O., Ichas, F., Bernardi, P. Regulation of the Permeability Transition Pore in Skeletal Muscle Mitochondria. J. Biol. Chem. 273, 12662-12668 (1998).
- Berman, S. B., Watkins, S. C., Hastings, T. G. Quantitative biochemical and ultrastructural comparison of mitochondrial permeability transition in isolated brain and liver mitochondria: evidence for reduced sensitivity of brain mitochondria. Exp. Neurol. 164, 415-425 (2000).
- Panov, A., Dikalov, S., Shalbuyeva, N., Hemendinger, R., Greenamyre, J. T., Rosenfeld, J. Species- and tissue-specific relationships between mitochondrial permeability transition and generation of ROS in brain and liver mitochondria of rats and mice. Am. J. Physiol. Cell Physiol. 292, 708-718 (2007).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured filroblasts. Nature Protocols. 2, 287-295 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon