Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mitokondri İzole Fare Heart Geçirgenliği Geçiş Gözenek Açma Multi-parametre ölçümü
Bu Makalede
Özet
Mitokondri izole fare kalbinde mitokondriyal permeabilite geçiş gözenek açılması ölçümü için bir spektrofluorometrik protokolü sunulmuştur. Tahlil mitokondri Ca eşzamanlı ölçüm içerir 2 + Taşıma, mitokondriyal membran potansiyeli ve mitokondriyal hacmi. Mitokondri, yüksek kaliteli ve fonksiyonel kalp elde edilmesi için işlem de tarif edilmektedir.
Özet
Mitokondriyal permeabilite geçiş gözenek (mtPTP) 1.5 kDa daha küçük bir moleküler kütleye sahip çözünenlerin taşımak için iç mitokondrial membran oluşturan bir non spesifik kanalıdır. Gözenek kesin moleküler kimlik tartışmasının altında hala olmasına rağmen, bu tür Siklofilin D VDAC ve ANT gibi proteinlerin oluşumunu mtPTP katkıda bulunur. Hücre ölümü mtPTP açılış tutulumu iyi 1 yerleşmiş olmakla birlikte, biriken kanıtlar mtPTP mitokondrial Ca 2 + homeostaz 2, biyoenerji ve redoks 3 sinyal sırasında bir fizyolojik rol oynar belirtir.
mtPTP açılış matrisi Ca 2 ile tetiklenir + ama faaliyet gibi oksidatif stres, adenin nükleotid tükenmesi, Pi yüksek konsantrasyonlarda, mitokondriyal membran depolarizasyon veya ayrılmasının ve 4 uzun zincirli yağ asitleri gibi diğer bazı faktörler tarafından modüle edilebilir. vitro, mtPTP yılında açılması ACH olabilirCa 2 + eksojen eklemeler (kalsiyum tutma kapasitesi) ile mitokondrial matriks içine Ca 2 + konsantrasyonu arttırarak ieved. Ca 2 mitokondri içindeki + düzeyleri belirli bir eşiğin ulaştığınızda, mtPTP açar ve Ca 2 kolaylaştırır + sürümü, proton itici güç yitimi, membran potansiyeli çöküşü ve sonuçta rüptürü yol mitokondrial matriks hacmi (şişlik) bir artış dış mitokondriyal membran ve organel fonksiyon geri dönüşümsüz kaybı.
Burada mitokondri izole fare kalbinde mtPTP açılış kapsamlı karakterizasyonu sağlar florometrik tahlil açıklar. Mitokondrial Ca 2 + işleme (as Ca 2 tarafından tahlil orta + konsantrasyonu ölçülen alımı ve salınımı,), mitokondrial membran potansiyeli ve mitocho: assay mtPTP açılış oluşur değişmiş 3 mitokondriyal parametrelerin eş zamanlı ölçümü içerirndrial hacmi. Ca2 için kullanılan renklendiriciler deney ortamı ile mitokondriyal zar potansiyeli + ölçüm Fura FF, bir zar laktobionat, Ca 2 + ve JC-1, bir katyonik varlığında uyarma dalga boyunda bir değişim geçirir rasyometrik gösterge vardır sırasıyla, düşük ve yüksek membran potansiyelinde yeşil monomerlerin veya kırmızı agregaları rasyometrik göstergesi. Mitokondriyal hacmindeki değişiklikler mitokondriyal süspansiyon ışık saçılması kaydederek ölçülür. Yüksek kaliteli, fonksiyonel mitokondri mtPTP açılış tahlil için gerekli olduğundan, biz de sağlam, son derece birleştiğinde ve fonksiyonel izole kalp mitokondri elde etmek için gerekli adımları açıklar.
Protokol
1. Fare Kalpten Mitokondri İzolasyonu
- Kalp mitokondri izole etmek, uyutmak ve yerel Kurumsal Hayvan Bakım ve Kullanım Kurulu tarafından onaylanmış prosedürlere göre fareler kurban.
Not: mitokondri izolasyon protokolü tüm adımlar buz üzerinde yapılmalıdır. Buz soğuk tamponlar ve ön soğutulmuş Petri kapları, Falcon tüpleri ve Eppendorf tüpleri kullanın. Protokolü verilen hacimleri 2 fare kalpleri içeren bir örnek içindir.
- , Kalpler kaldırma soğuk Mitokondri İzolasyonu tampon içine yerleştirin (300 mM sukroz, 10 mM Na-HEPES, 200 mM EDTA, pH 7.4) ve kan durulayın.
Not: En iyi sonuçlar için, mitokondriyal tamponların pH KOH ve Asetik Asit ile ayarlanabilir olmalıdır.
- Soğuk bir Petri kabı koyun kalpleri, yağ ve atriyumlar çıkarın ve elde edene kadar bir bıçak kullanarak ince kıymahomojen bir ürün Ing.
- Bir 50 ml Falcon tüp ile kıyılmış kalpler transfer, 0.1 mg / ml tripsin ile Mitokondri izolasyon Tamponu 10 mL eklemek ve numune 10 dakika için buz üzerinde sindirimi için izin verir.
Not: izolasyon prosedürü sırasında Tripsin izole mitokondri verimi artırır ve mitokondriyal hazırlıkları arasında sabit tutulmalıdır. Biz izole hazırlıkları mitokondrial fonksiyonları test enzim işlevselliği etkilemez emin olmak için tripsin yokluğudur öneririz.
- % 0.1 yağ asidi serbest BSA ve 5 mg tripsin inhibitörü (soya) ile Mitokondri İzolasyon Buffer 10 ml ekleyin ve tripsin nötralize etmek için ters tüp birkaç kez karıştırın.
Not: Mitokondri izolasyon Tampon önceden hazırlanır ve -20 ° C'de saklanabilir Çözdürme sırasında pH kontrol edin. Tripsin, tripsin inhibitörü ya da BSA, bir olmalıdırDeney günü Mitokondri İzolasyon Buffer dded.
- 4 az 1 dakika ° C için düşük-orta hızlı santrifüjleme ile sindirilir doku Kurtar
- Teflon havaneli (1,200-14,00 devirde 4-6 geçer) ile motorlu Dounce homojenizatör kullanarak% 0.1 yağ asitsiz BSA ve homojenize ile 8 ml Mitokondri İzolasyonu Tamponunda süspanse doku. Homojenizasyon sırasında buz üzerinde örnek tutun.
- 4. 10 dakika için 800xg bir 15 ml Falcon tüp ve santrifüj içine Homojenat aktarın ° C pelet çekirdekler ve doku enkaz.
- 4, 15 dakika boyunca 8000 x g ile santrifüj Eppendorf tüpleri içine mitokondri içeren süpernatan kurtarma ° C.
- Dikkatli bir şekilde üst beyaz tabaka çıkarın ve 1 ml Mitokondri İzolasyon Tamponunda mitokondri içeren kalan koyu pelet yıkayın.
- 4 'de 15 dakika için 8000xg santrifüjleyin ° C. 150 ul Mitokondriyal Isola süpernatant ve tekrar süspansiyon pelet atın mitokondrition Tampon. Ileri testler için buz üzerinde mitokondri tutun.
Not: Fonksiyonel testler sırasında en iyi sonuçları elde etmek için, izolasyon 4 saat içinde mitokondri kullanın.
- Bradford assay kullanarak mitokondriyal protein sayısal.
2. İzole Mitokondri Kalite Kontrolü
2.1. Solunum kontrolü oranı ölçümü (RCR)
- Maksimum oksijen hattı kurmak için hava doymuş su ile Oxytherm oksijen elektrodu kalibre. Oksijen kararlı seviyesi sıfır oksijen hattı kurmak için bir taze hazırlanmış olan 10 mM sodyum hidrosülfit çözeltisi 100 ul ekle elde edildiği zaman. 30 ° C'de ölçümleri gerçekleştirin
- Oda mühürlenir, Oxytherm oda 1 uM rotenon 2 ml Mitokondri solunum tamponu (125 mM KCI, 20 mM HEPES, 3 mM MgCl2, 400 uM EGTA, 300 uM DTT, 5 mM KH 2 PO 4, pH 7.2) ekleyin ve start recording.
- Oksijen sinyali stabil olduğunda, 1 dakika süreyle 250 mitokondri mikrogram ve kayıt bazal solunum ekleyin. Mitokondri endojen substratların (Devlet 1 solunum) üzerine soluyarak olarak bu noktada solunum çok düşük olmalıdır.
- 5 mM süksinat ve 1 dakika süreyle kayıt sinyali ekleyin. Oksijen tüketimi Devlet 2 solunum sırasında artmalıdır.
- 150 mcM ADP ekleyerek Devlet 3 solunum øndükle. Bu noktada oksijen tüketimi ise oksidatif fosforilasyon yoluyla ATP sentezi nedeniyle artmalıdır. Rekor sinyal solunum ADP tüketimi ve 4 solunum Devlet geçiş gösteren, yavaşlatır kadar. En az 1 dakika süreyle kayıt durumu 4 solunum.
- 1 uM CCCP ve 1 dakika süreyle kayıt sinyali ekleyin. Kuplajsız solunum maksimal olmalıdır.
Not: mitokondriyal solunum üzerinde CCCP etkileri doza bağımlıdır: CCCP yüksek konsantrasyonlu oksijen tüketimi inhibe edebilir ve bu nedenle t özenle olmalıdıritrated.
- Devlet 4 solunum sırasında oksijen tüketimi oranıyla Devlet 3 solunum sırasında oksijen tüketim oranına bölünmesi ile solunum kontrolü oranı (RCR) hesaplayın. Bir hedef RCR ≥ 4 olmalıdır.
2.2. Mitokondrial membran bütünlüğünün Değerlendirilmesi (sitokrom c testi)
- İyice% 70 etanol ve su ile Oxytherm odasına yıkayın ve adımları 2.1.2 -2.1.4 tekrarlayın.
- 1 mM ADP ve 1 dakika süreyle kayıt oksijen tüketimi ekleyin.
- 10 uM sitokrom c ekleyin. Sitokrom c bozulmamış mitokondriyal membran geçirmez olduğundan, solunum artışı kırık veya hasarlı mitokondriyal membran gösterir.
3. Mitokondriyal Geçirgenlik Geçiş Gözenek Açılış Ölçümü
- MtPTP açıklığın çok parametre için ölçüm spectrofluorometer ayarlayın. FelixGx programını kullanarak, yeni bir donanım yapılandırması oluşturmak (Quanta ana sabit state) ışık kaynağı, uyarma monokromatör, numune kompartımanı ve uyarma monokromatör (Şekil 4) ile ilgili olarak 90 ° ve 270 ° 'de konumlandırılmış iki dedektör oluşan. Maksimal zaman çözünürlüğü elde etmek için, hem emisyon monokromatörler (90 ° ve 270 °) devre dışı bırakılır ve numune kompartımanı 90 ° ve 270 ° 'de emisyon filtresi donanım yapılandırması menüsü etkin olmalıdır. Bu adım emisyon dalga boylarında motor kontrol kaldırın ve belirli bir dalga boyunda her monokromatör çözecektir. Emisyon monokromatörler devre dışı değilse, her dedektör dalgaboyu ve yinelenen ölçümler arasında hem döngüsü kaydedilecektir olacaktır.
- Çoklu Boya türünü kullanarak yeni bir satın alma protokolü oluşturun ve aşağıdaki boyalar girin:
- Fura (yüksek Ca + +): eksitasyon 340 nm, emisyon 525 nm (dedektör 1)
- Fura (düşük Ca + +): eksitasyon 380 nm, emisyon 525 nm (dedektör 1)
- JC1 (agrega): eksitasyon 543 nm, Emisyon 595 nm (dedektör 2)
- JC1 (monomer): eksitasyon 498 nm, emisyon 525 nm (dedektör 1)
- Şişme: eksitasyon 525 nm, emisyon 525 nm (dedektör 1)
- 37 ° C ve 1 nm eksitasyon ve emisyon yarıklar ve sıcaklık ayarlama
- Fura ve JC-1 için rasyometrik sinyali elde etmek için, iki türetilmiş izleri oluşturur: Fura (yüksek Ca + +) / Fura (düşük Ca + +) ve JC1 (agrega) / JC1 (monomer).
- Elle sırasıyla, dedektör 1 ve 2 ile 525 nm ve 595 nm emisyon dalga boyu ayarlayın.
- Karıştırın 1 uM rotenon, 5 mM süksinat ve tek kullanımlık bir 4-yönlü, 800 nM Fura FF ile 1 ml mitokondri, tahlil tamponu (120 mM KCI, 10 mM NaCI, 1 mM KH 2 PO 4, 20 mM HEPES-Tris, pH 7.2) metakrilat küvet. Numune kompartımanı içinde 250 mikrogram mitokondri ve yerde örnek ekleyin. Manyetik karıştırıcı açık olduğundan emin olun.
- Kayda başlayın. 1 dakika sonra, elde etme duraklatabilir, 500 nM JC-1 eklenir ve daha sonra bir yenidencquisition. JC-1 oranı sinyali aktif mitokondrilerde dye uptake gösteren artmalıdır. JC-1 sinyali bir plato (genellikle 5 dakika içinde) ulaşana kadar kayıt devam edin.
- 20 uM CaCI2 ekleyin. Fura FF oran sinyali içinde bir ani artış, mitokondriyal Ca 2 + alımını dolayı bir kademeli azalma ardından, tayin tamponu içinde artan Ca +2 varlığında tarafından dikkate alınmalıdır. JC-1 oranı sinyali hafif mitokondrial membran depolarizasyon göstergesi kısa süreli azalmaya sergilemesi gerekir.
- Önce başka bir CaCl 2 pulse (1-1.5 dk) eklenmesi ile bazal seviyeye Fura FF oranı sinyali dönene kadar bekleyin. Mitokondri Ca 2 birikmez kadar sabit aralıklarla darbe Devam + ve + deney tamponu içine Ca 2 bırakmadan başlar. mtPTP açılması nedeniyle Ca 2 Fura FF oran sinyali eş zamanlı artış ile görüntülenmiştir + serbest bırakma, membran pote bağlı olarak JC-1 sinyal oranında azalmantial çöküşü ve mitokondriyal şişme nedeniyle ışık saçılması bir azalma (Şekil 5).
- MtPTP aktivasyonu takiben, 1 mM EGTA, 1 uM CCCP ve 5 ug / ml alamethicin ile sırasıyla Fura FF, JC-1 ve şişme sinyallerin özgüllüğünü teyit.
- MtPTP açma özgüllük doğrulamak için tekrar adımları 3.6 - Siklofilin D inhibitörü siklosporin 1 uM'si varlığında, 3.9 A (Siklofilin D mtPTP bir bileşenidir.) Siklosporin varlığında, mtPTP açılması kontrol numuneleri (Şekil 6) önemli ölçüde daha fazla CaCl2 darbe gerektirir.
4. Temsilcisi Sonuçlar
Şekil 2, mitokondri izole edilmiş fare kalbinde tipik solunum kontrol göstermektedir. State 3 solunum süksinat üzerinde mitokondri Solunum için ADP ilavesi ile elde edilir, ve substra göre önemli ölçüde artmıştır oksijen tüketimi ile karakterize ediliryalnız te. Tükenmesi oksijen tüketimi yavaşlatır ve ADP ilavesinden önce ulaşmış oranları karşılaştırılabilir sırasında ADP inisiyeler Devlet 4 solunum, ekledi. RCR State 4 solunum bu göre State 3 solunum için oksijen tüketim hızı bölünmesi ile elde edilir. Sitokrom c testi deneyi dış mitokondrial membran bütünlüğünün için kullanılır: sitokrom c süksinat ve ADP, gözlenen solunum ilave bir artış üzerine mitokondri Solunum eklendiğinde, sağlam bir dış mitokondriyal membranların (Şekil 3) gösterir.
Mitokondri içinde izole edilmiş kalp mtPTP açılması için temsili bir görüntü Şekil 4 'de gösterilmiştir. Bu durumda, açma mtPTP 1.5 dk aralıklarla 4 CaCl2 puls (20 uM her biri) ilavesi ile tetiklenmiştir. mtPTP açılış mitokondrial Ca 2 yakın eşzamanlı yayın + (Fura FF oranı sinyal artışı), mitochond çöküşü ile açıktırriyali membran potansiyeli (JC-1 oranı sinyal azalması) ve artmış mitokondriyal hacmi (şişlik sinyal azalması). Bir ilave edildiğinde siklosporin, ki mtPTP ve Siklofilin D bileşeni bağlanır, mtPTP açma CaCl2 yerine 4 7 darbeleri (Şekil 5) gerektirir.
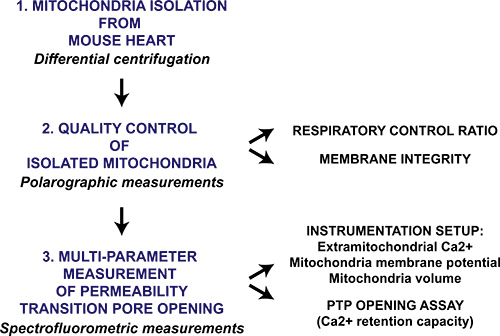
Şekil 1. Mitokondri izole kalp için çok parametre mitokondriyal permeabilite geçiş gözenek açılması protokolü akış şeması. Kalp farelerin hasat edilir ve mitokondri diferansiyel santrifüjleme yoluyla izole edilmiştir. Mitokondriyal hazırlama sonra niteliksel olarak sitokrom c varlığında solunum kontrol oranı ve mitokondrial zarın sağlamlık polarografik ölçümü ile değerlendirildi. Izole mitokondride mitokondriyal permeabilite geçiş gözenek açılması sıralı cac tarafından tetiklenenl 2 eklemeler ve mitokondri membran potansiyeli çöküşü Ca 2 + sürüm izleme ve mitokondrial matriks şişmesi ile spectrofluorometer ile ölçülür.
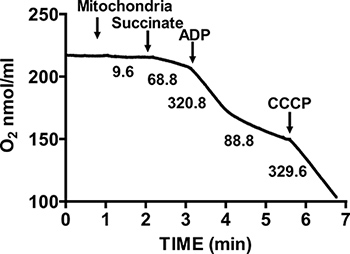
Şekil 2. Ölçümü mitokondri izole kalp, solunum kontrolü oranı (RCR). Mitokondri izole kalp oksijen tüketimi süksinat ve ADP varlığında Devlet 3 solunum sırasında ölçülen ve ADP tüketiminden sonra Devlet 4. solunum sırasında. Edilir Eşleşmeyenler ile izole mitokondri tepki CCCP ilavesi ile ölçülür. Grafikteki Numaraları nmol / dk / mg protein izole mitokondrilerde oksijen tüketimi oranları vardır.
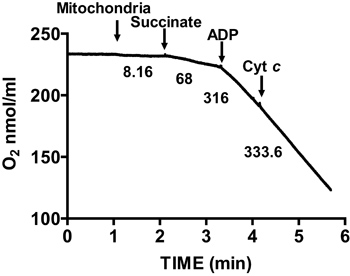
Şekil 3. Tedbir mitokondri izole kalp membran bütünlüğünün Ment. Mitokondrial membran bütünlüğü süksinat ve ADP varlığında ve sitokrom c ilave edildikten sonra izole mitokondri içinde oksijen tüketimi ölçmek suretiyle belirlenir. Grafikteki Numaraları nmol / dk / mg protein izole mitokondrilerde oksijen tüketimi oranları vardır.
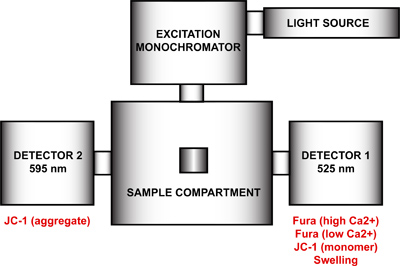
MtPTP açıklığın çok parametre ölçümleri için Şekil 4'te. Spectrofluorometer donanım konfigürasyonu. Spectrofluorometer ve donanım yapılandırması bir ışık kaynağı, bir uyarım monokromatör, bir numune kompartımanı ve 525 nm ve 595 nm dalga boyunda sabit emisyon dalga boylarında iki dedektörleri içerir. Detektör 1 Fura FF, yüksek ve düşük Ca2 +, JC-1 monomer sinyal algılama ve şişme sinyali için kullanılır. Dedektör 2 JC-1 toplam sinyal ölçer.
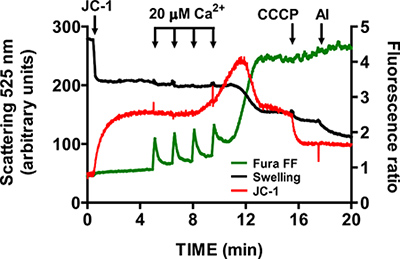
Şekil 5. Mitokondri izole kalp mtPTP açılış Multi-parametre ölçümü. mtPTP açılışı 20 mcM CaCl 2 sıralı eklemeler tetikledi ve Ca 2 ile karakterize edilmiştir + mitokondri, mitokondrial membran potansiyeli çöküşü salınımı ve mitokondrial matriks hacmi (şişlik) artmıştır. Extramitochondrial Ca 2 + ve membran potansiyeli rasyometrik göstergeleri Fura FF (yeşil iz) ve JC-1 (kırmızı iz) ile ölçüldü. Mitokondrinin şişmesi 525 nm (siyah iz) de ışık saçılması kayıt ile ölçüldü. JC-1 Özgünlük ve şişme sinyaller 1 uM CCCP ve 5 mg / ml alamethicin (mikrobiyal toksin) ile test edildi.
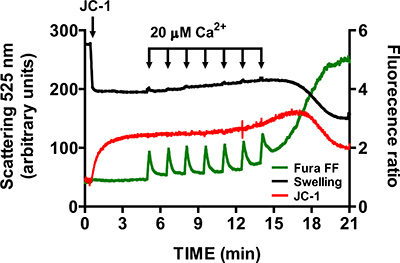
Şekil 6. ÇokluSiklosporin A. Siklosporin varlığında mitokondri izole kalp mtPTP açılış-parametre ölçümleri A (1 uM) mitokondri izole kalp mtPTP açmak için gerekli CaCl2 darbe sayısını artırır.
Tartışmalar
Burada sunulan protokol mitokondri izole kalp (Şekil 1 ve Şekil 4) permeabilite geçiş gözenek açılması değerlendirmek için gerekli deney adımları açıklar: fare kalp mitokondri izolasyon prosedürü, bütünlük ve işlevselliği sağlamak solunum kontrolleri, mitokondriyal parametreleri sırasında takip mtPTP açılış ve ölçüm için kullanılan boyalar, spektrofluorometrik enstrümantasyon, kurma ve mtPTP açılış karakterizasyonu. Bu protokol istihdam spectrofluor...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu eser HL094536 (BJH) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| Tripsin | Sigma-Aldrich | T3030 | |
| Tripsin inhibitörü (soya) | Sigma-Aldrich | T9128 | |
| Sodyum hidrosülfit | Sigma-Aldrich | 71699 | |
| Rotenon | Sigma-Aldrich | R8875 | |
| Sitokrom c | Sigma-Aldrich | C7752 | |
| Alamethicin | Sigma-Aldrich | A4665 | |
| CCCP | Sigma-Aldrich | C2759 | |
| Bir Siklosporin | Calbiochem | 239835 | |
| Fura FF | Invitrogen | F14180 | |
| JC-1 | Invitrogen | T3168 | |
| Doku değirmeni Teflon havaneli 15 ml Potter-Elvehjem | Wheaton Sektörler | ||
| Tepegöz karıştırıcı | Wheaton Sektörler | 903475 | |
| Oxytherm (sıcaklık kontrollü oksijen elektrodu) | Hansatech Aletleri | ||
| QuantaMaster 80 çift emisyon spectrofluorometer | Foton Technology International, Inc |
Referanslar
- Kroemer, G., Galluzzi, L., Brenner, C. Mitochondrial Membrane Permeabilization in Cell Death. Physiol. Rev. 87, 99-163 (2007).
- Elrod, J., Wong, R., Mishra, S., Vagnozzi, R. J., Sakthievel, B., Goonasekera, S. A., Karch, J., Gabel, S., Farber, J., Force, T., Brown, J. H., Murphy, E., Molkentin, J. D. Cyclophilin D controls mitochondrial pore-dependent Ca2+ exchange, metabolic flexibility, and propensity for heart failure in mice. J. Clin. Invest. 120, 3680-3687 (2010).
- Hom, J. R., Quintanilla, R. A., Hoffman, D. L., de Mesy Bentley, K. L., Molkentin, J. D., Sheu, S. S., Porter, G. A. The permeability transition pore controls cardiac mitochondrial maturation and myocyte. 21, 469-478 (2011).
- Halestrap, A. P. What is the mitochondrial permeability transition pore. Journal of Molecular and Cellular Cardiology. 46, 821-831 (2009).
- Wei, A. C., Liu, T., Cortassa, S., Winslow, R. L., O'Rourke, B. Mitochondrial Ca2+ influx and efflux rates in guinea pig cardiac mitochondria: low and high affinity effects of cyclosporine A. Biochim. Biophys. Acta. 1813, 1373-1381 (2011).
- Saks, V. A., Kuznetsov, A. V., Kupriyanov, V. V., Miceli, M. V., Jacobus, W. E. Creatine kinase of rat heart mitochondria. The demonstration of functional coupling to oxidative phosphorylation in an inner membrane-matrix preparation. J. Biol. Chem. 260, 7757-7764 (1985).
- Boehm, E. A., Jones, B. E., Radda, G. K., Veech, R. L., Clarke, K. Increased uncoupling proteins and decreased efficiency in palmitate-perfused hyperthyroid rat heart. AJP - Heart. 280, 977-983 (2001).
- Fontaine, E., Eriksson, O., Ichas, F., Bernardi, P. Regulation of the Permeability Transition Pore in Skeletal Muscle Mitochondria. J. Biol. Chem. 273, 12662-12668 (1998).
- Berman, S. B., Watkins, S. C., Hastings, T. G. Quantitative biochemical and ultrastructural comparison of mitochondrial permeability transition in isolated brain and liver mitochondria: evidence for reduced sensitivity of brain mitochondria. Exp. Neurol. 164, 415-425 (2000).
- Panov, A., Dikalov, S., Shalbuyeva, N., Hemendinger, R., Greenamyre, J. T., Rosenfeld, J. Species- and tissue-specific relationships between mitochondrial permeability transition and generation of ROS in brain and liver mitochondria of rats and mice. Am. J. Physiol. Cell Physiol. 292, 708-718 (2007).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured filroblasts. Nature Protocols. 2, 287-295 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır