Method Article
הדמיה בזמן אמת של תאי תאי צומת האנדותל במהלך נויטרופילים גלגול תחת פיזיולוגית זרימה
In This Article
Summary
כדוריות דם לבנות לחצות את monolayer אנדותל באמצעות paracellular או מסלול transcellular. פיתחנו assay פשוט כדי לעקוב אחר חלוקת junctional אנדוגני VE-cadherin וPECAM-1 במהלך נדידת transendothelial יקוציט תחת זרימה פיזיולוגית להפלות בין שני מסלולי הגלגול.
Abstract
במהלך דלקת, כדוריות דם לבנות לעזוב את מחזור הדם ולחצות את האנדותל להילחם פולש פתוגנים ברקמות בסיסיים. תהליך זה ידוע כהגירת transendothelial יקוציט. שני מסלולים לויקוציטים לחצות את monolayer אנדותל תוארו: מסלול paracellular, כלומר, באמצעות תאי תאי צמתים ומסלול transcellular, כלומר, דרך גוף התא האנדותל. עם זאת, זה כבר קשה מבחינה טכנית להפלות בין הטפילים ומסלול transcellular. פיתחנו assay במבחנה פשוט ללמוד חלוקת אנדוגני VE-cadherin וPECAM-1 במהלך נדידת transendothelial נויטרופילים תחת תנאי זרימה פיסיולוגיים. לפני זלוף נויטרופילים, טופלו תאי האנדותל קצר עם נוגדני fluorescently שכותרתו נגד VE-cadherin וPECAM-1. נוגדנים אלה לא מפריעים לתפקוד של שני החלבונים, כפי שנקבע על ידי תא substra החשמלימדידות חישת עכבת te וFRAP. שימוש assay זה, היינו מסוגל לבצע את חלוקת אנדוגני VE-cadherin וPECAM-1 במהלך נדידת transendothelial תחת תנאי זרימה ולהיפלות בין מסלולי טפילים וההגירה transcellular של לויקוציטים פני האנדותל.
Introduction
הגירת transendothelial יקוציט יעילה ופיקוח הדוק (TEM) היא בעל חשיבות מרכזית בתהליכים פיסיולוגיים כגון מעקב חיסוני ודלקת חריפה. עם זאת, בתנאים פיתו-פיסיולוגי מסוימים, TEM מבוקר והמוגזם הוא ציין וכתוצאה מהמחלות כרוניות דלקתיות (למשל, דלקת מפרקים שגרונית, טרשת עורקים, אסטמה). כמו כן, במהלך גרורות של תאי גידול, התהליך של הגירת transendothelial הוא סייע לתאים סרטניים לעזוב את זרימת הדם לגרורות 1-3. על מנת במיוחד כדי להפריע ליקוציט מוגזם או TEM תאים סרטניים, נדרשת הבנה מפורטת של הרגולציה של תהליך זה.
הוא האמין כי תהליך TEM מתרחש דרך שלבים שונים. מחקרי זרע, בביקורת לפני שני עשורים על ידי הקצב ושפרינגר, הובילו למודל הרב שלבי המתאר את התהליך של TEM 4,5. מודל זה עדיין נכון, למרות שחלקם המודעהצעדי ditional נכללו 6. אלון et al. תאר את הצורך בנוכחות של כמוקינים משותקים על פני השטח של האנדותל 7. לאחרונה, הם הראו כי האנדותל עצמו מייצר כמוקינים המוצגים במשטח פסגת אנדותל 8. יתר על כן, אותה הקבוצה הציגה את החשיבות של תנאי זרימה במהלך 7 TEM. לאחרונה, מספר פרסומים התמקדו בשתי כדוריות הדם לבנות מסלולים שונים יכולים לקחת בשלב diapedesis הסופי של TEM. הם יכולים לעבור את תאי תאי צמתים, כלומר, מסלול נדידת paracellular, או לעבור בגוף התא האנדותל, הידוע במסלול נדידת transcellular 9. קרמן ועמיתיו חקרו מסלולים אלה בפירוט והגיעו למסקנה כי לויקוציטים מעדיפים לבחור את מסלול נדידת paracellular (90%) על פני מסלול transcellular (10%) בעת חציית monolayer אנדותל וריד טבור 10.עם זאת, כאשר תאי אנדותל ממקורות אחרים שמשו, למשל, מוח או microvasculature, יותר לויקוציטים משמש מסלול transcellular (30%) 11. קבוצת Vestweber לאחרונה הראתה שכאשר תאי תאי צמתים לא הצליחו לנתק את זה מזה באמצעות דפיקה-במודל חיה, החלפת אנדוגני VE-cadherin לVE-cadherin-alpha-catenin כימרה, TEM יקוציט נחסם 12 באופן מלא . באופן מפתיע, החוקרים שמו לב שTEM נחסם בכמה, אבל לא כולם, רקמות. בסך הכל, ניסויים האלגנטיים אלה הצביעו על כך שכדוריות דם לבנות העדיפו את מסלול paracellular על ציר transcellular, למרות אותות הרגולציה שמפעילים החלטה זו עדיין אינם ידועים.
למרות שהרוב המכריע של לויקוציטים מעדיף מסלול נדידת paracellular, זה עדיין קשה להבחין בין שני המסלולים. בנוסף לכך, למרות מספר מחקרים המתמקדים בתפקידו של junct תאי תאי אנדותליונים, הדינמיקה של צמתים אלה, בפרט חלבוני junctional VE-cadherin וPECAM-1, במהלך המעבר ליקוציט עדיין בדיון. פיתחנו assay פשוט יחסית שבו ניתן לנטר מולקולות הצומת האלה בזמן אמת במהלך diapedesis יקוציט תחת תנאי זרימה פיסיולוגיים באמצעות נוגדני fluorescently שכותרתו. נוגדנים אלה לא להפריע או לחסום שלמות או ניידות junctional של החלבונים הממוקדים. assay זה מאפשר לנו לעקוב אחר הדינמיקה של חלבוני junctional במהלך התהליך של TEM paracellular. בנוסף, assay זה גם מאפשר להפלות בין מסלולי נדידת הטפילים וtranscellular.
Protocol
נויטרופילים היו מבודדים ממתנדבים בריאים שחתמו הסכמה מדעת. מחקר שבוצע בעמידה בהנחיות מוסדיות ולאומיות לרווחת אדם.
1 ציפוי ותחזוקה של תאי האנדותל וריד טבורי אדם
- תאי תרבות טבורי אדם וריד האנדותל (HUVECs) על פי הוראות יצרן. (בינוני האנדותל בסל בינוני (EBM-2) בתוספת האנדותל צמיחה בינונית (EGM-2) singlequots) לגדול HUVECs על פיברונקטין (FN) -coated מנות (10 מיקרוגרם / מ"ל, מומסים במי demineralized) באמצעות מדיה. השתמש בתרבית תאים בין 4-8 מעברים לניסויים.
- יום 1: זרימת תאים מעילים עם של פיברונקטין 100 μl (10 מיקרוגרם / מיליליטר PBS) לפחות שעת 2 ב 37 ° C ו 5% CO 2.
- יום 2: כאשר תאים מגיעים 80-90 מפגש%, trypsinize התאים לאחר שטיפה זהירה עם פוספט שנאגרו מלוח RT (PBS) pH 7.4, צנטריפוגות ב XG 800 וגלול ב800,000 תאים / מ"ל באמצעות תקשורת. צלחת 80,000 תאים בכל ערוץ של זרימת התאים מצופים FN ועדינות פיפטה ההשעיה התא למעלה ולמטה. תרבות O / N בחממה ב 37 ° C ו 5% CO 2.
- יום 3: רענן התקשורת בזרימה קאמרית השקופיות בעדינות על ידי הטיית השקופיות בזווית של ° 45. (ראה איור 1 א).
הערה: מומלץ להסיר רק את התקשורת במאגרים ולא בערוץ עצמו. הסרתה של התקשורת בערוצים עלולה לגרום לאובדן תא האנדותל ומוות כתוצאה מכוח גרירה של אמצעי התקשורת הנגרמת על ידי pipetting. - בדוק על ידי מיקרוסקופ לעומת שלב אם תאי האנדותל יצרו monolayer (כלומר, מחוברות 100%). אם התאים לא 100% ומחוברות, לשנות את התקשורת שתי פעמים ביום עד שהם מגיעים 100 מפגש%.
- ברגע שהתאים הגיעו confluency, לגרות את התאים עם תקשורת (ראה שלב1.1) המכילים מתווך דלקתי (TNF-α (מ"ל / 10 ng)). גירוי HUVECs O / N (כלומר, שעה 12) עם תוצאות TNF-α בפנוטיפ דלקתי של האנדותל, כלומר., עד תקנה של מולקולות הידבקות תא כגון ICAM-1 וVCAM-1 13.
.2 בידוד polymorphonuclear יקוציט על ידי מפלי Percoll
- הכן N-2-hydroxyethylpiperazine-2-ethanesulfonic-N'חומצת -buffer (HEPES) (להלן בשם: זרימת חיץ) לפני שבודד לויקוציטים polymorphonuclear (PMN). זרימת חיץ משמש כדי לשטוף PMNs מבודד וכחיץ בזרימה assay. כדי להכין זרימת חיץ: לדלל 7.72 גרם NaCl (132 מ"מ), 4.76 HEPES g (20 מ"מ), 0.45 גרם KCl (6 מ"מ), MgSO 0.25 גרם 4 (1 מ"מ) • 7H 2 O, K 2 HPO 4 • 3H 2 O (1.2 מ"מ) ב1 ליטר של מים demineralized ולהתאים pH 7.4 (המניה זה יכול להיות כל הזמן על 4 מעלות צלזיוס למשך מספר שבועות).
- הוספה הטרי 100 μl M 1 CaCl 2 & #160; (1 מ"מ), 2.5 מ"ל אלבומין אדם מריכוז מניית 200 g / L (0.5% V / V) ו0.1 גרם גלוקוז ל100 מ"ל (0.1% w / v) של זרימת חיץ. בשלב הבא, לסנן את זרימת החיץ באמצעות מסנן 0.45 מיקרומטר. הערה: זרימת מאגר זה צריך להיות מוכן טרי עבור כל ניסוי.
- לפני הבידוד של PMN, להכין 10% פתרון ציטראט trisodium (TNC) בPBS, pH 7.4.
- לאסוף 20 מ"ל של דם מלא בvacuettes heparine נתרן ממתנדב בריא. לדלל כל דם 1: 1 עם 10% PBS / TNC ב50 צינורות מ"ל ומיליליטר 20 פיפטה דילול דם בזהירות על 12.5 מ"ל של Percoll (23% (w / w) פתרון colloidal במים עם צפיפות של 1.130 g / ml) בצינור 50 מ"ל חדש. בזהירות להניח את הצינורות בצנטריפוגה וספין ל20 דקות ב XG 800 עם נמוכה האצה ובלי הפסקה שנקבעה על RT.
הערה: בעת הוספת הדם המדולל לPercoll, להטות את צינור Percoll המכיל בזווית של ° 45 ועדינות פיפטה הדם המדולל בשנינות הצינורh הגדרת ילד פיפטה האיטית ביותר. - הסר את כל הנוזלים ולאחר מכן למלא את הצינור עם תמוגה חיץ קר כקרח כדורית אדומה (3 [0.01 ז] ו18.5 EDTA מ"ג 4.15 גרם NH 4 Cl [0.155 M], 0.5 KHCO g (טריפלקס III) [0.1 מ"מ] 500 מ"ל של O H 2 קר כקרח) לlyse אריתרוציטים. השאר צינור על קרח, לעתים צינור היפוך, עד ההשעיה הופכת לאדומה כהה, ואחריו XG 500 צנטריפוגה במשך 5 דקות ב 4 ° C עם הפסקות אפשרו.
הערה: חלק גלולה מכיל PMNs (נויטרופילים, אאוזינופילים, בזופילים) יחד עם אריתרוציטים. - הסר supernatant ולשטוף גלולה פעמיים בתמוגה חיץ קר כקרח ב XG 500 למשך 5 דקות על 4 מעלות צלזיוס.
- Resuspend גלולה עם זרימת חיץ ב RT ולקבוע את ריכוז PMNs או באמצעות hemocytometer או נגד תא אוטומטי. להשעות את PMNs בזרימת חיץ ב1 x 10 6 תאים / מ"ל ולשמור על RT.
.3 תיוג של האנדותל צומתאל VE-cadherin וPECAM-1
- מוסיף את נוגדן 647 PECAM אלקסה פלואוריד (שיבוט WM59) בשעה 1: דילול 100 ונוגדן VE-cadherin-FITC סידן עצמאי (שיבוט 55-7H1) בשעה 01:50 דילול לHUVEC מדיום תרבות (ראה שלב 1.1), דגירה במשך 30 דקות לפני תחילת זרימת הניסוי לדמיין דינמיקת junctional של תאי האנדותל בגלגול נויטרופילים תחת תנאי זרימה פיסיולוגיים.
הערה: לפני הוספת הנוגדנים ישירות הכותרת לזרימת התאים, להבטיח שהנפח בכל ערוץ אינו עולה על 100 μl. זה עוזר לשמור על הוצאות הנוגדן נמוכים ככל האפשר.
.4 PMN TEM Assay תחת זרימה
- הנח את PMNs לתוך אמבט מים במשך 15 דקות על 37 מעלות צלזיוס לפני הזרקה אותם לזרימת המערכת.
- חבר את צינורות לזרימת מחסנית ריקה ולמלא עם (צעד לראות 4.3) חם (למשל, 37 ° C) זרימת חיץ כדי למנוע היווצרות של בועות אוויר בעת הגדרת המערכת זרימת דואר.
- חבר צד אחד של זרימת מחסנית ריקה למערכת זרימת משאבת המזרק באמצעות צינורות סיליקון המכילים מזרק 20 מ"ל, ולשים את הזרימה הקאמרית לבמת מיקרוסקופ.
- חבר הצד של זרימת מחסנית ריקה האחר לבקבוק המאגר מלא ב37 מעלות זרימת חיץ C (איור 1) ולהתחיל את משאבת המזרק כדי למלא את כל צינורות עם זרימת חיץ. המשאבה תמשוך את זרימת החיץ מהמאגר, דרך הזרימה קאמרית לתוך המזרק. הערה: צינורות זו מכיל גם יציאה באונליין Luer הזרקה, המאפשרת PMNs להיות מוזרק עם מחט לתוך ניסוי ריצה מבלי לעצור את הזרימה ויצירת בועות אוויר.
- החלף את זרימת התא הריק עם הזרם קאמרית המכיל HUVECs טופל-TNF-α, לחבר את צינורות זרימה המכיל חיץ ולמקם אותו לתוך הבמה מיקרוסקופ (איור 1 ג). לצבוט את הצינורות לפני הניתוק והחיבור מחדשמ 'לתאי המכילים את HUVECs, שלא צובט את עלול לגרום להיווצרות של בועות אוויר בתוך הצינור ו / או זרימת התאים.
- התאם את מהירות הזרימה לDYN 1/2 סנטימטר, בהתאם למהירות זרימה פיזיולוגית בvenules נימי הודעה (1-5 DYN / 2 סנטימטר).
- הרשומה ניגודיות דיפרנציאל הפרעה (DIC), FITC (488 ננומטר) ואלקסה פלואוריד (ננומטר 647) 647 בו זמנית באמצעות מיקרוסקופ סריקת לייזר confocal.
- הזרק PMNs (שלב 4.1) בזרימת המערכת לאט דרך אונליין בנמל הזרקת Luer (1D איור) באמצעות 1 מ"ל מזרקים.
- אחרי כמה דקות, לויקוציטים מופיע, לדבוק, ומתגלגל. להפסיק את הניסוי בכל רגע רצוי על ידי ניתוק צינורות מהזרימה קאמרית ומקבע pipetting (פורמלדהיד .3.7% ב PBS) לתוך הזרם קאמרית. לאפשר קיבוע ל10 דקות, ואחרי כביסה עם PBS. הנתונים נותחו באמצעות תוכנת הדמיה (ראה חומרים ושולחן ציוד).
הערה: בצע אותו הניסוי באמצעות מיקרוסקופ confocal סריקת לייזר מצויד בתא אקלים עם טמפרטורה קבועה על 37 מעלות צלזיוס, 5% CO 2, ו63X שמן אובייקטיבי.
תוצאות
בדקנו קודם אם הנוגדנים לא הפריעו לתפקוד המחסום של האנדותל. מדדנו את ההתנגדות של monolayers אנדותל באמצעות חישה חשמלית תא מצע עכבה (ECIS). לפרטים, ראה ואן Buul et al. 13 אין שינוי בהתנגדות נצפה כאשר הנוגדן אנטי-VE-cadherin fluorescently שכותרתו התווסף לתאים (איור 2 א). נוגדן אנטי VE-cadherin-שמוכר היטב לחסום VE-cadherin הפונקציה הפחיתה את ההתנגדות באופן דרמטי (איור 2 א). כמו כן, הנוגדנים המשמשים להדמיה אינו משנה את הדינמיקה של VE-cadherin, כפי שהוערך על ידי מדידת התאוששות ניאון לאחר צילום הלבנה (FRAP) של VE-cadherin-GFP (איור 2).
אחרי 1-2 דק ', נויטרופילים דבקו monolayer האנדותל הופעל כיכול להיות דמיינו בערוץ דסק"ש (איור 3 א). לאחר הזחילה ל5-30 seג, הרוב המכריע של נויטרופילים transmigrated דרך monolayer האנדותל באמצעות תאי תאי צמתים שתויגו עם הנוגדנים המכוונים נגד PECAM-1 וVE-cadherin. במהלך התהליך של diapedesis, חלוקת-VE cadherin וPECAM-1 המיושמת בזמן אמת (איור 3 ב). באתרים של diapedesis נויטרופילים, שובש באופן מקומי וPECAM-1 הראה מבנה דמוי טבעת יותר-cadherin VE. לאחר השלמת diapedesis, צמתים הקרובים וPECAM-1 עברו באתרים של diapedesis (איור 3 ג) בבירור-cadherin VE. שים לב שחלקים של הנוגדן אנטי PECAM-1 התגלו על פני השטח של נויטרופילים פעם נויטרופילים הגיעו לצד baso הצדדי של האנדותל. עם זאת, זה לא מנע נויטרופילים מחוצים את האנדותל. הדינמיקה שנצפתה של VE-cadherin בזמן אמת במהלך נדידת transendothelial נויטרופילים היו בהסכם עם העבודה על ידי שו ועמיתים שהראה, באמצעות מיקרוסקופ confocal ותאי האנדותל, שמתפזר לצדדים כאשר כדוריות דם לבנות חצו את צמתים תאי תאי אנדותל 14 cadherin-GFP-VE-cadherin-GFP-transfected VE. כמו כן עבודה על ידי סו ועמיתים לעבודה הדגישו התצפיות של PECAM-1 שלנו. הם הראו דיפוזיה ש, ליד לרוחב VE-cadherin על מעבר ליקוציט, PECAM-1 מחדש באופן מקומי לתוך טבעת סביב נויטרופילים transmigrating 15.

איור 1 בתא זרימת מבחנה. () חץ מציין את המאגר שממנו בינוני צריך להיות רעננים. צינורות (ב) סיליקון שמחבר את תא הזרימה עם יציאת הזרקת Luer אונליין הבמשמשת להזרקת PMNs מבלי לנתק את הצינור (ראש החץ). (C) קונטיקטשיקוף של זרימת מחסנית ריקה לבקבוק המאגר מלא ב37 מעלות זרימת חיץ C (ראש חץ). חיבור (D) של הזרימה קאמרית עם HUVECs TNF-α שטופל בצינור זרימה המכיל חיץ והניח בבמת מיקרוסקופ (ראש החץ).
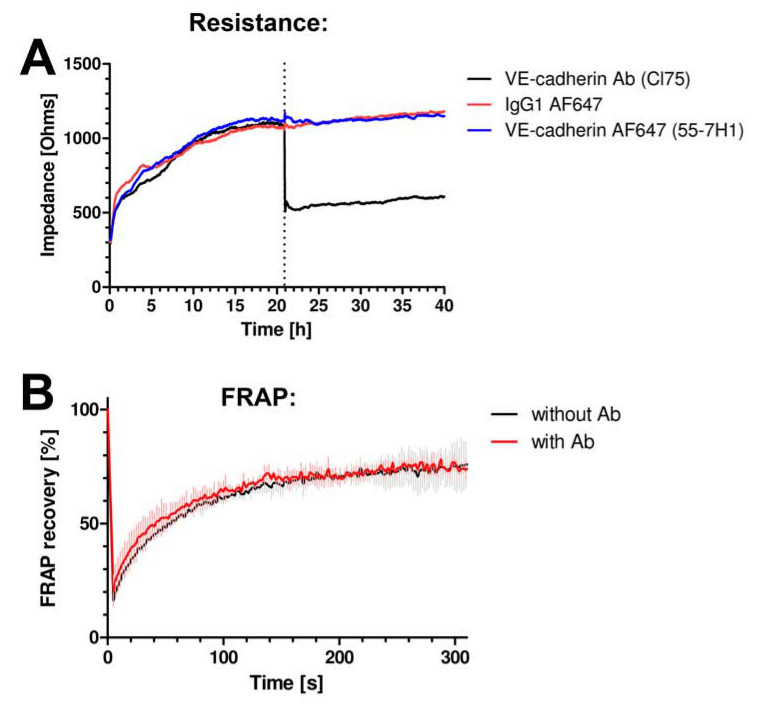
איור 2 נוגדנים לא להפריע לדינמיקה או פונקצית junctional-cadherin VE. () עכבת monolayer תא האנדותל נמדדה באמצעות ECIS. ציר Y מבטא עכבה באוהם וציר x מייצג את הזמן בשעות. שיבוט VE-cadherin נוגדן 55-7H1, שכותרתו עם Alexa647 (קו כחול) או אלוטיפ שליטת IgG-Alexa647 (קו אדום) אינו משנה עכבת monolayer תא אנדותל, ואילו VE-cadherin חסימת CL75 נוגדן (קו שחור) לא להקטין את העכבה . (B ) בא לידי הביטוי בHUVEC-cadherin-GFP VE וניתוח FRAP באמצעות מיקרוסקופ confocal עולה כי אין שינוי בהתאוששות הקרינה בנוכחותו או היעדריו של VE-cadherin 55-7H1 נוגדן.
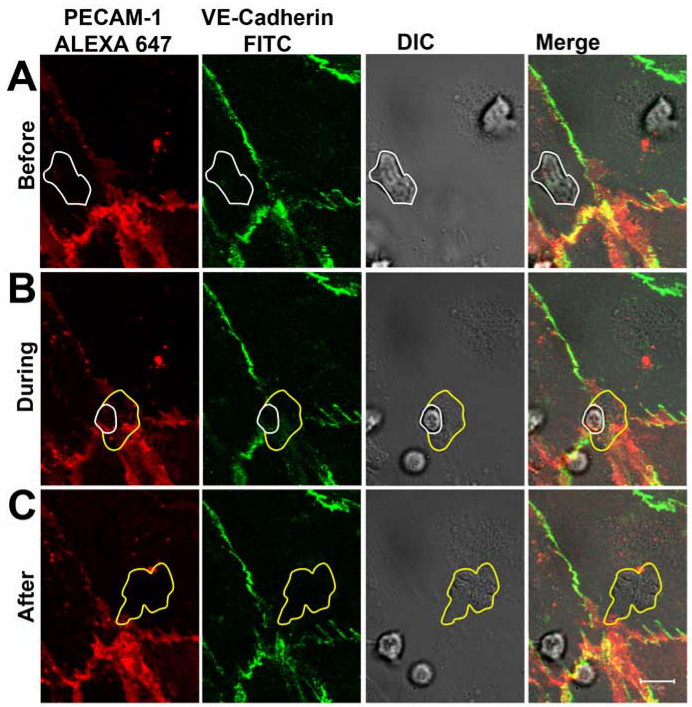
() נויטרופילים (מסומן בקו לבן) והקפדה על האנדותל וחוצה את צומת תאי תאים מבלי להשפיע על חלוקת איור 3 VE-cadherin וPECAM-1 הפצה בTEM נויטרופילים בזמן אמת. VE-cadherin וPECAM -1. (ב) נויטרופילים חוצים את monolayer האנדותל באמצעות תאי תאי צמתים. פיזור מקומי של וPECAM-1 ניתן להבחין כאשר נויטרופילים בולט באמצעות תאי תאי צמתים cadherin-VE. קו לבן ממחיש נוכחות נויטרופילים עדיין בחלק העליון של האנדותל. צהוב קו מראה tha קרום נויטרופיליםכבר לא הוא מתחת האנדותל. (ג) נויטרופילים חצו monolayer האנדותל באופן מלא. -VE cadherin וPECAM-1 עברו באתרים של diapedesis. קו צהוב ממחיש גבולות של נויטרופילים transmigrated. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
לפרוטוקול זה, זה הוא קריטי כדי למנוע ההיווצרות של בועות אוויר בזרימת התאים, שכן זה יגרום לאפופטוזיס התא וmonolayer שיבש. כדי להימנע מכך, ברצוננו להדגיש לשלם ריבית מסוימת לצעדים 4.2 ו4.5, שבו הצינורות מחוברים לזרימה קאמרית. עוד צעד קריטי בפרוטוקול הוא תחול של PMNs שנשמרים ב RT על ידי דוגריהם ל15-30 דקות ב37 מעלות צלזיוס לפני הזרקה אותם לזרימה קאמרית (שלב 4.1). כתוצאה מכך תחול של integrins יקוציט, המאפשרת להם להיצמד למולקולות דבקות כגון ICAM-1 או VCAM-1 בהאנדותל.
פרוטוקול זה אינו מוגבל ללמוד את הגלגול של נויטרופילים. ניתן להשתמש גם סוגי יקוציט אחרים כגון מונוציטים או לימפוציטים. שים לב השלב ש4.1, כלומר, תחול לויקוציטים עשוי להיות שונה בין סוגי יקוציט. כמו כן, ניתן להשתמש בסוגים אחרים של תאי האנדותל. לשם כך הוא נשאר קריטיכדי לעורר את תאי האנדותל עם גירויים דלקתיים מתאימים כגון TNF-α או IL-1β. אם נויטרופילים לא מגיבים בtransmigrating, ניתן לשקול טיפול לזמן קצר נויטרופילים (5 דק ') עם פפטיד N-formyl-L-methionyl-L-leucyl-L-פנילאלנין (fMLP) 16. זה יעודדו את הנויטרופילים, בintegrins בפרט, עוד יותר, מה שהופך אותם יותר נוטה לדבוק לאנדותל.
בדרך כלל 2 מהירות זרימת סנטימטר / DYN 1 משמשת. מהירות זרימה זו נמדדת בvenules פוסט נימים, אתרים שבם רוב הגירת transendothelial יקוציט מתרחשת 17. שימוש בזרימת התאים שתוארו, ניתן להגביר את מהירות עד לזרימת 10 DYN / 2 סנטימטר. עם זאת, זה לא מומלץ להגדיל את הגזירה נוספת. זה עלול לגרום לדליפה לא רצויה של הצינור והניתוק של התאים מהזרימה קאמרית.
התוצאות מתוארות באיור 3 עולות כי אלהנוגדנים יכולים לשמש כדי לחזות וללמוד את הדינמיקה של תאי תאי צמתים האנדותל במהלך diapedesis יקוציט. בפרט, בנוסף למבחני גלגול הקיימים פרוטוקול זה מאפשר להפלות paracellular מהגירת transcellular תחת תנאי זרימה פיסיולוגיים בזמן אמת. מאז הנוגדנים להכתים את תאי תאי צמתים, אחד יכול להבקיע מספר כדוריות הדם לבנות החוצים VE-cadherin / צמתים PECAM-1-חיוביים לעומת nonpositive VE-cadherin / PECAM-1 אתרים. דרך, הגירת transcellular זה יכול להיות מופלה מהגירת paracellular.
חשוב להדגיש כי נוגדנים אלה לא מפריעים לתפקוד של החלבונים שהם נקשרים ל: הנוגדן PECAM-1 שימש במחקר זה מופנה כנגד תחום תאי השני. תאי האנדותל שהיו מצופים בנוכחות הנוגדנים לא הראו פגמים בהפצת או להרכיב monolayer, דבר המצביעים על כך שהנוגדן לפחות לאלהפריע לאינטראקציות homotypic בין תאי האנדותל. בנוסף לכך, שני הנוגדנים אינם פוגעים ביכולתם של נויטרופילים לנדוד דרך monolayer אנדותל. בנוסף, מספר הנויטרופילים שמתגלגלים לאורך monolayer אנדותל בהעדר או הנוכחות של הנוגדנים לא שינה (מידע לא מוצג). חשוב לציין, מיקרוסקופיה סריקת לייזר confocal נותנת לנו את האפשרות להקליט את ערוצי ניאון שונים ודסק"ש בו זמנית.
לפיכך, assay זה מאפשר ללמוד את הדינמיקה של VE-cadherin וPECAM-1 באותו הזמן שבו נויטרופילים חוצים את צומת תאי תאי אנדותל ויעזרו להבין מדוע לויקוציטים לבחור מסלול אחד על פנים השני, כלומר, paracellular לעומת transcellular.
Disclosures
The authors have no competing financial interests.
Acknowledgements
The authors thank Dr. P.L. Hordijk for critically reading the manuscript. AED is supported by a Landsteiner Foundation for Blood Transfusion Research (LSBR) fellowship (grant #1028). JK is supported by the Dutch Heart Foundation (2005T3901). JDvB is a NHS Dekker fellow (grant #2005T039).
Materials
| Name | Company | Catalog Number | Comments | |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description | |
| μ-Slide VI | IBIDI | 80606 | Flow-chamber | |
| 0.45 μm filter | Whatman/GE Lifesciences | 10462100 | ||
| 1 mL syringe | BD Plastipak | 300013 | ||
| 20 mL syringe | BD Discardit II | 366296 | ||
| 21G needle | BD Microlance | 301155 | ||
| Albumin | Sanquin | 15522644 | ||
| Ammunium chloride (NH4Cl) | Merck | 1009245000 | ||
| Calcium chloride (CaCl2) | Sigma-Aldrich | 449709 | ||
| EBM-2 Basal medium + EGM-2 SingleQuot Kit Suppl. & Growth Factors | Lonza | CC-3156 + CC-4176 | media | |
| EDTA (Titriplex III) | Merck | 1370041000 | ||
| Falcon tubes | Corning Life Sciences | 352096 | ||
| Fibronectin | Sigma-Aldrich | F1141-2MG | FN | |
| Glucose | Sigma-Aldrich | G7528 | ||
| HEPES | Sigma-Aldrich | H3375 | ||
| In-line Luer Injection port | IBIDI | 10820 | ||
| Magnesium sulfate heptahydrate (MgSO4.7H2O) | Merck | 105886 | ||
| PECAM-1-ALEXA-647 | BD Pharmingen | 561654 | clone WM59 stock concentration 0.1mg/mL | |
| Percoll | GE Healthcare Life Sciences | 17-0891-09 | ||
| Phosphate Buffered Saline | Fresenius Kabi Nederland | M090001/01NL | PBS | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | ||
| Potassium hydrogen carbonate (KHCO3) | Merck | 1048540500 | ||
| Potassium phosphate dibasic trihydrate (K2HPO4) | Sigma-Aldrich | P5504 | ||
| Silicone Tygon 3350 tubing | VWR | 228-4331 | tubing | |
| Sodium chloride (NaCl) | Calbiochem (Millipore) | 567441 | ||
| Syringe pump | Harvard Apparatus | model number 55-5920 | ||
| TNFα | Peprotech | 300-01A | tumor necrosis factor | |
| trisodium citrate | Merck | 1.06447.5000 | TNC | |
| Vacuettes | Greiner, Germany | 980044 | ||
| VE-Cadherin-FITC | BD Pharmingen | 560411 | clone 55-7H1 | stock concentration 0.5mg/mL |
| Zeiss LSM510 META | Carl Zeiss MicroImaging, Jena, Germany | |||
| Zen Software 2008 | Carl Zeiss MicroImaging, Jena, Germany |
References
- Ross, R. Atherosclerosis--an inflammatory disease. N. Engl. J. Med. 340, 115-126 (1999).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Szekanecz, Z., Koch, A. E. Vascular involvement in rheumatic diseases: ' vascular rheumatology. Arthritis Res. Ther. 10, 224 (2008).
- Butcher, E. C. Leukocyte-endothelial cell recognition: three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Cinamon, G., Shinder, V., Shamri, R., Alon, R. Chemoattractant signals and beta 2 integrin occupancy at apical endothelial contacts combine with shear stress signals to promote transendothelial neutrophil migration. J. Immunol. 173, 7282-7291 (2004).
- Shulman, Z., Cohen, S. J., Roediger, B., et al. Transendothelial migration of lymphocytes mediated by intraendothelial vesicle stores rather than by extracellular chemokine depots. Nat. Immunol. 13, 67-76 (2012).
- Carman, C. V., Springer, T. A. Trans-cellular migration: cell-cell contacts get intimate. Curr. Opin. Cell Biol. 20, 533-540 (2008).
- Carman, C. V., Springer, T. A. A transmigratory cup in leukocyte diapedesis both through individual vascular endothelial cells and between them. J. Cell Biol. 167, 377-388 (2004).
- Millan, J., Hewlett, L., Glyn, M., et al. Lymphocyte transcellular migration occurs through recruitment of endothelial ICAM-1 to caveola- and F-actin-rich domains. Nat. Cell Biol. 8, 113-123 (2006).
- Schulte, D., Kuppers, V., Dartsch, N., et al. Stabilizing the VE-cadherin-catenin complex blocks leukocyte extravasation and vascular permeability. EMBO J. 30, 4157-4170 (2011).
- Buul, J. D., Mul, F. P., van der Schoot, C. E., Hordijk, P. L. ICAM-3 activation modulates cell-cell contacts of human bone marrow endothelial cells. J. Vasc. Res. 41, 28-37 (2004).
- Shaw, S. K., Bamba, P. S., Perkins, B. N., Luscinskas, F. W. Real-time imaging of vascular endothelial-cadherin during leukocyte transmigration across endothelium. J. Immunol. 167, 2323-2330 (2001).
- Su, W. H., Chen, H., Jen, C. J. Differential movements of VE-cadherin and PECAM-1 during transmigration of polymorphonuclear leukocytes through human umbilical vein endothelium. Blood. 100, 3597-3603 (2002).
- Paulsson, J. M., Jacobson, S. H., Lundahl, J. Neutrophil activation during transmigration in vivo and in vitro: A translational study using the skin chamber model. J. Immunol. Methods. 361, 82-88 (2010).
- Williams, M. R., Azcutia, V., Newton, G., Alcaide, P., Luscinskas, F. W. Emerging mechanisms of neutrophil recruitment across endothelium. Trends Immunol. 32, 461-469 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved