Method Article
Echtzeit-Bildgebung von Zell-Zell-Endothelial Junctions Während Neutrophile Transmigration unter physiologischen Fluss
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Leukozyten überqueren die endothelialen Monolayer mit Hilfe der parazellulären oder transzelluläre Route. Wir haben einen einfachen Test zu folgen die Verteilung endogener junctional VE-Cadherin und PECAM-1 während Leukozyten transendotheliale Migration unter physiologischen Fluss zwischen den beiden Seelenwege unterscheiden.
Zusammenfassung
Während der Entzündung, lassen Leukozyten den Kreislauf und über die Endothel zu kämpfen eindringende Krankheitserreger in das darunter liegende Gewebe. Dieser Prozess wird als Leukozyten transendotheliale Migration bekannt. Zwei Wege zur Leukozyten an das Endothel-Monoschicht durchqueren wurden beschrieben: die parazelluläre Route, dh durch die Zell-Zell-Übergänge und dem transzellulären Weg, dh durch die endotheliale Zellkörper. Jedoch ist es technisch schwierig, zwischen dem Parameter und transzelluläre Route unterscheiden. Wir entwickelten eine einfache in vitro-Test, um zu studieren die Verteilung der endogenen VE-Cadherin und PECAM-1 während der Neutrophilen transendotheliale Migration unter physiologischen Flussbedingungen. Vor der Perfusion Neutrophilen wurden Endothelzellen kurz mit fluoreszenzmarkierten Antikörpern gegen VE-Cadherin und PECAM-1 behandelt. Diese Antikörper nicht mit der Funktion beider Proteine stören, wie durch elektrische Zell Substra bestimmtte Impedanz-Mess und FRAP-Messungen. Unter Verwendung dieses Tests konnten wir folgen die Verteilung der endogenen VE-Cadherin und PECAM-1 während transendotheliale Migration unter Flussbedingungen und zu unterscheiden zwischen den para und transzellulären Migrationsrouten der Leukozyten durch das Endothel.
Einleitung
Effiziente und streng kontrollierten Leukozyten transendotheliale Migration (TEM) ist von zentraler Bedeutung bei physiologischen Prozessen wie der Immunüberwachung und akute Entzündungen. Jedoch unter bestimmten pathophysiologischen Bedingungen, unkontrollierte und übermäßige TEM beobachtet, was zu chronischen entzündlichen Erkrankungen (zB rheumatoide Arthritis, Arteriosklerose, Asthma). Auch während der Tumorzellmetastasierung, ist der Prozess der transendothelialen Migration Instrumental für Tumorzellen, um die Zirkulation zu metastasieren 1-3 zu verlassen. Um speziell mit übermäßiger Leukozyten oder Tumorzell TEM stören, ist ein detailliertes Verständnis der Regulation dieses Prozesses erforderlich.
Es wird angenommen, daß die TEM-Prozess durch verschiedene Schritte auftritt. Samen Studien, die von Butcher und Springer überprüft vor zwei Jahrzehnten, führte zu dem mehrstufigen Modell den Prozess der TEM 4,5 beschreibt. Dieses Modell gilt immer noch, auch wenn einige adliche Schritte wurden aufgenommen, 6. Alon et al. Die Notwendigkeit für das Vorhandensein immobilisierten Chemokinen auf der Oberfläche des Endothels 7. Kürzlich zeigten sie, dass das Endothel selbst erzeugt Chemokine, die an der endothelialen apikalen Oberfläche 8 dargestellt sind. Darüber hinaus setzen die gleiche Gruppe nach vorne die Bedeutung der Strömungsverhältnisse während der TEM-7. Kürzlich, können mehrere Publikationen zu den zwei verschiedenen Wegen Leukozyten konzentriert in der letzten Phase der TEM Diapedesis nehmen. Sie können entweder über die Zell-Zell-Verbindungen gehen, dh der parazellulären Migrationsroute, oder quer durch die endotheliale Zellkörper, wie der transzellulären Migration Route 9 bekannt. Carman und Kollegen untersuchten diese Wege im Detail und folgerte, dass Leukozyten bevorzugt wählen Sie die parazellulären Migrationsroute (90%) über den transzellulären Weg (10%) beim Überschreiten einer Nabelvenen-Endothelzellen Monolage 10.Wenn jedoch Endothelzellen aus anderen Ursprungs verwendet wurden, zB Gehirn oder Mikrogefäß, verwendet mehr Leukozyten den transzellulären Weg (30%) 11. Die Vestweber Gruppe kürzlich gezeigt, dass, wenn die Zell-Zell-Übergänge konnten voneinander durch Verwendung eines Knock-in-Tiermodell ersetzt endogenen dissoziieren VE-Cadherin für ein VE-Cadherin-Catenin alpha-Chimäre wurde Leukozyten TEM vollständig blockiert 12 . Überraschenderweise stellten die Autoren fest, dass TEM wurde in mehreren blockiert, aber nicht allen, Geweben. Insgesamt zeigen diese Experimente, dass Leukozyten elegant bevorzugt den parazellulären Weg über den transzellulären Weg, auch wenn die regulatorischen Signale, die diese Entscheidung auslösen, sind noch unbekannt.
Auch wenn die Mehrheit der Leukozyten bevorzugen den parazellulären Migrationsroute, ist es immer noch schwierig ist, zwischen beiden Wegen zu unterscheiden. Hinzu kommt, dass, obwohl mehrere Studien, die die Rolle der endothelialen Zell-Zell junctIonen, die Dynamik dieser Kreuzungen, insbesondere die Junction-Proteine VE-Cadherin und PECAM-1, während Leukozyten-Überfahrt ist noch immer umstritten. Wir entwickelten einen relativ einfachen Test, bei dem diese Verbindungsstelle Moleküle können in Echtzeit während der Leukozyten-Diapedese unter physiologischen Flussbedingungen unter Verwendung von fluoreszenzmarkierten Antikörpern überwacht werden. Diese Antikörper nicht stören oder blockieren junktionale Integrität oder Mobilität der Zielproteine. Dieser Test ermöglicht es uns, die Dynamik von Proteinen junctional während des Prozesses der parazellulären TEM folgen. Darüber hinaus ermöglicht dieser Test auch Unterscheidung zwischen den para und transzellulären Migrationsrouten.
Protokoll
Neutrophile wurden von gesunden Freiwilligen, die eine Einverständniserklärung unterzeichnet haben, isoliert. Die Forschung hat in Übereinstimmung mit den institutionellen und nationalen Leitlinien für die menschliche Wohlfahrt durchgeführt.
1. Auflage und Wartung von menschlichen Nabelschnurvenen-Endothelzellen
- Kultur menschlichen Nabelschnurvenen-Endothelzellen (HUVECs) nach den Anweisungen des Herstellers. Wachsen HUVECs auf Fibronektin (FN) beschichteten Medien mit Gerichten (10 pg / ml, in demineralisiertem Wasser gelöst) (Endothelial Basal Medium (EBM-2)-Medium mit Endothelial Growth Medium (EGM-2) SingleQuots ergänzt). Verwenden Zellkultur zwischen 4-8 Durchgänge für Experimente.
- Tag 1: Mantel Strömungskammern mit 100 ul Fibronectin (10 ug / ml in PBS) für mindestens 2 h bei 37 ° C und 5% CO 2.
- Tag 2: Wenn die Zellen 80-90% Konfluenz trypsinize die Zellen nach sorgfältigem Waschen mit RT Phosphat gepufferter Salzlösung (PBS) pH-Wert 7,4, Zentrifuge bei 800 xg und resuspendieren bei 800.000 Zellen / ml mit Medien. Platte 80000 Zellen in jedem einzelnen Kanal der FN-beschichtete Flusskammern und sanft pipettieren die Zellsuspension auf und ab. Kultur O / N in einem Inkubator bei 37 ° C und 5% CO 2.
- Tag 3: Aktualisieren Sie die Medien in der Durchflusskammer-Rutsche durch leichtes Kippen des Schiebe in einem 45 ° Winkel. (Siehe Abbildung 1a).
HINWEIS: Es wird empfohlen, die Medien nur in den Behältern und nicht in den Kanal selbst zu entfernen. Entfernen der Medien in den Kanälen kann in Endothelzellen Verlust und Tod aufgrund der Spannkraft der durch Pipettieren verursacht Medien führen. - Überprüfen durch Phasenkontrastmikroskopie, wenn die Endothelzellen haben eine Monoschicht (dh 100% konfluent) gebildet ist. Wenn die Zellen nicht 100% konfluent, ändern Sie die Medien zwei Mal pro Tag, bis sie 100% Konfluenz erreichen.
- Sobald die Zellen Konfluenz erreicht, stimulieren die Zellen mit den Medien (siehe Schritt1,1), enthaltend Entzündungsmediator (TNF-α (10 ng / ml)). Stimulierung HUVECs O / N (dh 12 Stunden) mit TNF-α zu einer entzündlichen Phänotyp des Endothels, dh. Hochregulierung von Zelladhäsionsmolekülen wie ICAM-1 und VCAM-1-13.
2. Polymorphkernige Leukozyten Isolierung mithilfe Percoll Gradienten
- Bereiten N-2-Hydroxyethyl-N'-2-ethansulfonsäure (HEPES) -Puffer (nachfolgend: flow-Puffer), bevor die Isolierung neutrophilen Granulozyten (PMN). Flow-Puffer verwendet wird, um isolierte PMN waschen und als Puffer in der Flow-Assay. Die Bereitstellung Flusspuffer: 7,72 g NaCl (132 mM), 4,76 g HEPES (20 mM), 0,45 g KCl (6 mM), 0,25 g MgSO 4 • 7H 2 O (1 mM), K 2 HPO 4 • 3H 2 O (1,2 mM) in 1 l entmineralisiertem Wasser gewaschen und auf pH 7,4 (das Lager kann bei 4 ° C mehrere Wochen lang aufbewahrt werden).
- Frisches 100 ul 1 M CaCl 2 & #160, (1 mM), 2,5 ml Humanalbumin aus einer 200 g / L Stammkonzentration (0,5% v / v) und 0,1 g Glucose in 100 ml (0,1% w / v) der Fließpuffer. Als nächstes filtert die Strömungs Puffer unter Verwendung eines 0,45 um-Filter. HINWEIS: Diese Flusspuffer muss frisch für jeden Versuch vorbereitet werden.
- Vor der Isolierung von PMN, bereiten 10% Trinatriumcitrat (TNC)-Lösung in PBS, pH 7,4.
- Sammle 20 ml Vollblut in Natrium-Heparin vacuettes von einem gesunden Freiwilligen. Verdünnte Gesamtblut 1: 1 mit 10% PBS / TNC in 50 ml-Röhrchen und Pipette 20 ml verdünntem Blut vorsichtig auf 12,5 ml Percoll (ein 23% (w / w) kolloidalen Lösung in Wasser mit einer Dichte von 1,130 g / ml) in einer neuen 50-ml-Tube. Die Rohre in der Zentrifuge vorsichtig und Spin für 20 min bei 800 xg mit geringer Beschleunigung und ohne Unterbrechung bei RT gesetzt.
HINWEIS: Bei der Zugabe der verdünnten Blut in den Percoll, kippen Sie das Percoll haltige Rohr in einem Winkel von 45 ° und sanft pipettieren Das verdünnte Blut in der Tube Witzh die langsamste Einstellung Pipette Junge. - Entfernen Sie alle flüssigen und anschließend das Rohr mit eiskaltem Erythrozytenlyse-Puffer (4,15 g NH 4 Cl [0.155 m] 0,5 g KHCO 3 [0.01 M] und 18,5 mg EDTA (Triplex-III) [0,1 mm] 500 ml füllen eiskaltem H 2 O), um Erythrozyten zu lysieren. Lassen Röhrchen auf Eis gelegentlich Umdrehen des Röhrchens, bis die Suspension wird dunkel rot, gefolgt von Zentrifugation 500 g für 5 min bei 4 ° C mit Unterbrechungen aktiviert.
HINWEIS: Die Pelletfraktion enthält die PMNs (Neutrophile, Eosinophile, Basophile), zusammen mit den Erythrozyten. - Überstand entfernen und zweimal waschen Pellet in eiskaltem Lyse-Puffer bei 500 g für 5 min bei 4 ° C.
- Das Pellet mit strömungs Puffer bei RT und bestimmen, PMN-Konzentration entweder mit einer Zählkammer oder automatisierte Zellzähler. Suspendieren die PMN in Fluss Puffer bei 1 x 10 6 Zellen / ml und halten bei RT.
3. Kennzeichnung von Endothelial Junctional VE-Cadherin und PECAM-1
- Hinzufügen des PECAM Alexa Fluor 647-Antikörper (Klon WM59) in einer 1: 100 Verdünnung und der calciumunabhängige VE-Cadherin-FITC-Antikörper (Klon 55-7H1) bei einer Verdünnung von 1:50 zu HUVEC-Kulturmedium (siehe Schritt 1.1), und Inkubation für 30 min vor dem Start des Fluss Experiment junctional Dynamik von Endothelzellen während der Neutrophilen-Transmigration unter physiologischen Flussbedingungen zu visualisieren.
Hinweis: Vor dem Hinzufügen der direkt markierten Antikörpern zu den Strömungskammern, sicherzustellen, dass das Volumen in jedem Kanal hat 100 ul betragen. Dies hilft, die Antikörper Kosten so niedrig wie möglich.
4. PMN TEM-Assay unter Fluss
- Platzieren Sie die PMNs in einem Wasserbad für 15 min bei 37 ° C vor der Injektion von ihnen in den Durchflusssystem.
- Schließen Sie den Schlauch an einem leeren Flusskammer und füllen mit warmem (zB 37 ° C) Durchflusspuffer (siehe Schritt 4.3), um die Bildung von Luftblasen zu verhindern, bei der Einrichtung the Flusssystem.
- Eine Seite eines leeren Flusskammer in der Spritzenpumpe Strömungssystem durch Verwendung von Silikonschlauch, die einen 20-ml-Spritze, und legte die Strömungskammer in den Mikroskoptisch.
- Die andere Seite eines leeren Flusskammer zu dem Reservoir Kolben mit 37 ° C Vorlauf-Puffer (Abbildung 1B) gefüllt und starten Sie die Spritzenpumpe, um alle Schläuche mit Durchfluss-Puffer zu füllen. Die Pumpe wird die Strömungs-Puffer aus dem Reservoir durch die Durchflusskammer in die Spritze zu ziehen. Hinweis: Dieser Schlauch enthält auch eine in-line Luer Injektionsöffnung, die PMNs mit einer Nadel in einen laufenden Versuch injiziert werden können, ohne den Durchfluss und die Entstehung von Luftblasen.
- Das leere Flusskammer mit dem Strom-Kammer, die TNF-α-behandelten HUVECs ersetzen, schließen Sie das Flusspuffer haltigen Schläuche und legen Sie sie in den Mikroskoptisch (Abbildung 1c). Kneifen Sie die Rohre vor Trennen und Wiederverbinden derm mit den Kammern, welche die HUVECs, als nicht Abquetschen kann bei der Bildung von Luftblasen im Schlauch und / oder Strömungskammern führen.
- Einstellen der Strömungsgeschwindigkeit auf 1 dyn / cm 2 in Übereinstimmung mit physiologischen Strömungsgeschwindigkeit in post Venolen (1-5 dyn / cm 2).
- Rekorddifferentialinterferenzkontrast (DIC), FITC (488 nm) und Alexa Fluor 647 (647 nm) gleichzeitig mit einem konfokalen Laser-Scanning-Mikroskop.
- Spritzen Sie die PMN über die In-Line-Luer Injektionsöffnung (1D) mit 1 ml-Spritzen (Schritt 4.1) langsam in den Flow-System.
- Nach ein paar Minuten, Leukozyten erscheinen, haften und transmigrate. Stoppen Sie das Experiment zu jedem beliebigen Zeitpunkt durch Abschalten der Schlauch von der Durchflusskammer und Pipettieren Fixierungsmittel (3,7% Formaldehyd in PBS) in die Durchflusskammer. Erlauben Fixierung für 10 min durch Waschen mit PBS. Daten werden mit Imaging-Software (siehe Materialien und Ausrüstung Tabelle) analysiert.
HINWEIS: Führen Sie die er-Experiment mit einem konfokalen Laser-Scanning-Mikroskop mit einer Klimakammer ausgestattet mit einer konstanten Temperatur bei 37 ° C, 5% CO 2 und eine 63X Öl-Ziel.
Ergebnisse
Zunächst überprüft, wenn die Antikörper nicht mit der Barrierefunktion des Endothels stören. Wir messen den Widerstand der endothelialen Monoschichten mit Hilfe elektrischen Zell-Substrat-Impedanz-Mess (ECIS). Details siehe Van Buul et al. Keine 13 Widerstandsänderung beobachtet wurde, wenn die Anti-VE-Cadherin-fluoreszenzmarkierten Antikörper wurde zu den Zellen (2A) aufgenommen. Ein Anti-VE-Cadherin-Antikörper, gut erkannt zu Block VE-Cadherin-Funktion reduziert den Widerstand drastisch (Abbildung 2A). Auch die für die Bildgebung verwendet werden, nicht die Dynamik zu ändern VE-Cadherin-Antikörper, wie durch Messung der Fluoreszenzerholung nach Photobleaching (FRAP) der bewerteten VE-Cadherin-GFP (2B).
Nach 1-2 min, Neutrophilen an aktivierten endothelialen Monoschicht anhaftet als könnte im DIC Kanal (3A) dargestellt werden. Nach kriechen 5-30 sec, die große Mehrheit der Neutrophilen transmigrierten durch die endothelialen Monoschicht durch die Zell-Zell-Verbindungen, die mit den gegen PECAM-1 gerichteten Antikörper markiert waren und VE-Cadherin. Während des Prozesses der Diapedese, die Verteilung der VE-Cadherin und PECAM-1 wurde in Echtzeit (3B) folgt. An den Standorten der Neutrophilen-Diapedese, VE-Cadherin wurde lokal gestört und PECAM-1 zeigte eine ringartige Struktur. Nach Beendigung der Diapedese, die Verbindungsstellen nahe und VE-Cadherin und PECAM-1 deutlich an den Stellen der Diapedese (3C) verlagert. Man beachte, dass Teile des Anti-PECAM-1-Antikörper wurden an der Oberfläche der Neutrophilen nachgewiesen, wenn die Neutrophilenzahl erreichte die basolaterale Seite des Endothels. Dies führte jedoch nicht verhindern, dass Neutrophile aus der Überquerung des Endothels. Die beobachtete Dynamik der VE-Cadherin in Echtzeit während der Neutrophilen transendotheliale Migration waren in Übereinstimmung mit der Arbeit von Shaw und Kollegen, diezeigte, mit Hilfe der konfokalen Mikroskopie und VE-Cadherin-GFP-transfizierten Endothelzellen, die VE-Cadherin-GFP seitlich diffus, wenn Leukozyten querte die endotheliale Zell-Zell-Verbindungsstellen 14. Arbeiten auch von Su und Mitarbeiter unterstrich unsere Beobachtungen von PECAM-1. Sie zeigten, dass neben lateralen VE-Cadherin Diffusion auf Leukozyten Passage wurde PECAM-1 lokal in einem Ring um die transmigrating neutrophilen 15 verteilt.

Abbildung 1. In-vitro-Flusskammer. (A) Der Pfeil zeigt das Reservoir, aus dem das Medium muss aktualisiert werden. (B) Silikonschlauch, der die Strömungskammer mit dem in-line Luer Einspritzöffnung zum Einspritzen von PMNs ohne Lösen der Rohrleitung (Pfeilspitze) verwendet verbindet. (C) ConnReflexion eines leeren Flusskammer zu dem Reservoir Kolben mit 37 ° C Vorlaufpuffer (Pfeilspitze) gefüllt. (D) Verbindung der Strömungskammer mit dem TNF-α-behandelten HUVECs zur Strömungs-Puffer enthaltenden Schlauch und in dem Mikroskoptisch (Pfeilkopf) angeordnet ist.
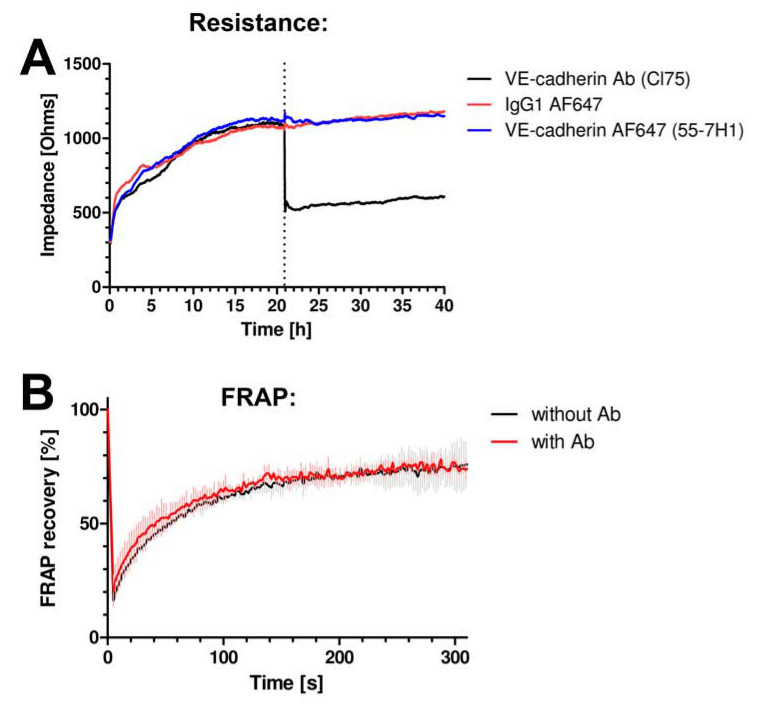
Abbildung 2. VE-Cadherin Antikörper nicht mit Junction-Dynamik oder die Funktion stören. (A) Endothelial Zellschicht Impedanz wird mit ECIS gemessen. Y-Achse drückt Impedanz in Ohm und x-Achse die Zeit in Stunden. VE-Cadherin-Antikörper Klon 55-7H1, mit Alexa647 (blaue Linie) markiert oder Isotyp IgG-Alexa647 Kontrolle (rote Linie) nicht endothelialen Zellschicht Impedanz nicht verändern, während die VE-Cadherin-blockierenden Antikörper CL75 (schwarze Linie) haben reduzieren die Impedanz . (B ) VE-Cadherin-GFP wurde in HUVEC exprimiert und FRAP-Analyse unter Verwendung der konfokalen Mikroskopie zeigte keine Änderung in der Wiederherstellung der Fluoreszenz in der Gegenwart oder Abwesenheit der VE-Cadherin-Antikörper 55-7H1.
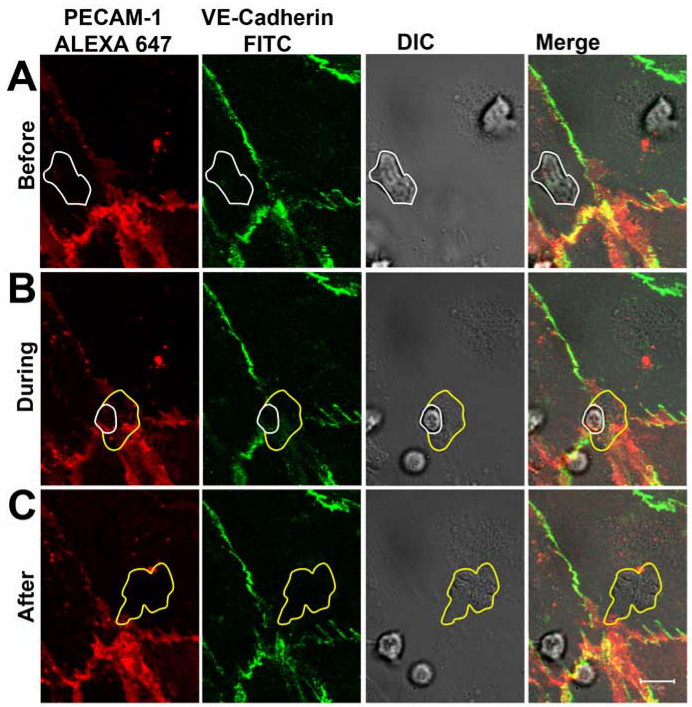
Figur 3 VE-Cadherin und PECAM-1-Verteilung während Neutrophilen TEM in Echtzeit. (A) Neutrophile (mit weißer Linie gekennzeichnet) auf dem Endothel anhaften und über den Zell-Zell-Übergang, ohne die Verteilung der VE-Cadherin und PECAM -1. (B) über den Neutrophilen-Endothel-Monoschicht durch die Zell-Zell-Verbindungen. Eine lokale Dispersion der VE-Cadherin und PECAM-1 kann beobachtet werden, wenn eine Neutrophilen durch Zell-Zell-Junctions vorsteht. Weiße Linie zeigt Neutrophilen Gegenwart noch an der Spitze des Endothels. Gelbe Linie zeigt Neutrophilen Membran that ist bereits unter Endothel. (C) Neutrophile vollständig überquerte die endothelialen Monolayer. VE-Cadherin und PECAM-1 werden an den Standorten der Diapedese verlegt. Gelbe Linie zeigt Grenzen der transmigrierten Neutrophilen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Aus diesem Protokoll ist es wichtig, die Bildung von Luftblasen in den Strömungskammern zu verhindern, da dies in Zell-Apoptose und eines gestörten Einzelschicht führen. Um dies zu vermeiden, möchten wir betonen, besonderes Interesse auf die Schritte 4.2 und 4.5, in denen die Rohre auf die Strömungskammer angeschlossen bezahlen. Ein weiterer wichtiger Schritt im Protokoll ist das Priming der PMNs, die bei Raumtemperatur durch Inkubation für 15-30 Minuten bei 37 ° C vor dem Einspritzen zu der Strömungskammer (Schritt 4.1) gehalten sind. Dies führt bei der Grundierung von Leukozyten-Integrine, so dass sie auf Adhäsionsmolekülen wie ICAM-1 oder VCAM-1 auf dem Endothel anhaften.
Dieses Protokoll ist nicht auf die Transmigration von Neutrophilen zu studieren. Auch andere Leukozyten Typen wie Monozyten oder Lymphozyten verwendet werden. Beachten Sie, dass Schritt 4,1, dh, Grundieren der Leukozyten zwischen Leukozyten-Typen unterscheiden. Es können auch andere Arten von Endothel-Zellen verwendet werden. Für diese kritische bleibtdie Endothelzellen mit geeigneten Entzündungsreize wie TNF-α oder IL-1β stimuliert. Wenn Neutrophile nicht in transmigrating reagiert, kann man überlegen Behandlung der Neutrophilen kurz (5 Minuten) mit N-Formyl-L-Methionyl-L-Leucyl-L-phenylalanin (fMLP) Peptid 16. Dadurch werden die Neutrophilen noch weiter zu fördern, insbesondere deren Integrine, was sie anfälliger für am Endothel haften.
Typischerweise 1 dyn / cm 2 Fließgeschwindigkeit verwendet wird. Diese Strömungsgeschwindigkeit wird in der Post-Venolen, Websites, auf denen die meisten Leukozyten transendotheliale Migration tritt 17 gemessen. Verwendung der beschriebenen Strömungskammern ist es möglich, Strömungsgeschwindigkeit bis zu 10 dyn / cm 2 zu erhöhen. Es wird jedoch nicht empfohlen, um die Scher weiter zu erhöhen. Es kann zu unerwünschten Leckage von dem Schlauch und Ablösung der Zellen von der Strömungskammer führen.
Die in 3 dargestellten Ergebnisse zeigen, dass dieseAntikörper können verwendet werden, zu visualisieren und zu untersuchen, die Dynamik der endothelialen Zell-Zell-Übergänge während der Leukozyten-Diapedese werden. Insbesondere, zusätzlich zu den bestehenden Trans Assays Dieses Protokoll erlaubt es, parazellulären von transzellulären Migration unter physiologischen Flussbedingungen in Echtzeit zu unterscheiden. Da die Antikörper färben die Zell-Zell-Verbindungen, kann man die Anzahl der Leukozyten, die VE-Cadherin / PECAM-1-positiven Kreuzungen überqueren gegen kraft VE-Cadherin / PECAM-1-Stellen punkten. Auf diese Weise transzellulären Migration von parazellulären Migration unterschieden werden.
Es ist wichtig zu unterstreichen, dass diese Antikörper nicht mit der Funktion der Proteine zu binden, stören sie: die PECAM-1-Antikörper, die in dieser Studie verwendet wird, gegen die zweite extrazelluläre Domäne gerichtet. Endothelzellen, die in Gegenwart des Antikörpers plattiert wurden keine Defekte in Verstreuen oder Bilden einer Monoschicht zeigen, was darauf hindeutet, dass der Antikörper zumindest nichtstören homotypische Wechselwirkungen zwischen Endothelzellen. Darüber hinaus, müssen beide Antikörper die Fähigkeit von Neutrophilen an Endothelzellen durch die Monoschicht zu migrieren beeinträchtigen. Zusätzlich wird die Anzahl von Neutrophilen, die durch die endotheliale Monoschicht in der Abwesenheit oder Anwesenheit der Antikörper transmigrieren nicht verändert (Daten nicht gezeigt). Wichtig ist, gibt uns der konfokalen Laser-Scanning-Mikroskopie die Möglichkeit, verschiedene Fluoreszenzkanäle und DIC gleichzeitig aufnehmen.
Somit ermöglicht dieser Test die Untersuchung der Dynamik von VE-Cadherin und PECAM-1 bei der gleichen Zeit, wenn eine neutrophile kreuzt die endothelialen Zell-Zell-Übergang und wird helfen, zu verstehen, warum Leukozyten wählen eine Strecke über die andere, dh gegenüber transpara.
Offenlegungen
The authors have no competing financial interests.
Danksagungen
The authors thank Dr. P.L. Hordijk for critically reading the manuscript. AED is supported by a Landsteiner Foundation for Blood Transfusion Research (LSBR) fellowship (grant #1028). JK is supported by the Dutch Heart Foundation (2005T3901). JDvB is a NHS Dekker fellow (grant #2005T039).
Materialien
| Name | Company | Catalog Number | Comments | |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description | |
| μ-Slide VI | IBIDI | 80606 | Flow-chamber | |
| 0.45 μm filter | Whatman/GE Lifesciences | 10462100 | ||
| 1 mL syringe | BD Plastipak | 300013 | ||
| 20 mL syringe | BD Discardit II | 366296 | ||
| 21G needle | BD Microlance | 301155 | ||
| Albumin | Sanquin | 15522644 | ||
| Ammunium chloride (NH4Cl) | Merck | 1009245000 | ||
| Calcium chloride (CaCl2) | Sigma-Aldrich | 449709 | ||
| EBM-2 Basal medium + EGM-2 SingleQuot Kit Suppl. & Growth Factors | Lonza | CC-3156 + CC-4176 | media | |
| EDTA (Titriplex III) | Merck | 1370041000 | ||
| Falcon tubes | Corning Life Sciences | 352096 | ||
| Fibronectin | Sigma-Aldrich | F1141-2MG | FN | |
| Glucose | Sigma-Aldrich | G7528 | ||
| HEPES | Sigma-Aldrich | H3375 | ||
| In-line Luer Injection port | IBIDI | 10820 | ||
| Magnesium sulfate heptahydrate (MgSO4.7H2O) | Merck | 105886 | ||
| PECAM-1-ALEXA-647 | BD Pharmingen | 561654 | clone WM59 stock concentration 0.1mg/mL | |
| Percoll | GE Healthcare Life Sciences | 17-0891-09 | ||
| Phosphate Buffered Saline | Fresenius Kabi Nederland | M090001/01NL | PBS | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | ||
| Potassium hydrogen carbonate (KHCO3) | Merck | 1048540500 | ||
| Potassium phosphate dibasic trihydrate (K2HPO4) | Sigma-Aldrich | P5504 | ||
| Silicone Tygon 3350 tubing | VWR | 228-4331 | tubing | |
| Sodium chloride (NaCl) | Calbiochem (Millipore) | 567441 | ||
| Syringe pump | Harvard Apparatus | model number 55-5920 | ||
| TNFα | Peprotech | 300-01A | tumor necrosis factor | |
| trisodium citrate | Merck | 1.06447.5000 | TNC | |
| Vacuettes | Greiner, Germany | 980044 | ||
| VE-Cadherin-FITC | BD Pharmingen | 560411 | clone 55-7H1 | stock concentration 0.5mg/mL |
| Zeiss LSM510 META | Carl Zeiss MicroImaging, Jena, Germany | |||
| Zen Software 2008 | Carl Zeiss MicroImaging, Jena, Germany |
Referenzen
- Ross, R. Atherosclerosis--an inflammatory disease. N. Engl. J. Med. 340, 115-126 (1999).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Szekanecz, Z., Koch, A. E. Vascular involvement in rheumatic diseases: ' vascular rheumatology. Arthritis Res. Ther. 10, 224 (2008).
- Butcher, E. C. Leukocyte-endothelial cell recognition: three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Cinamon, G., Shinder, V., Shamri, R., Alon, R. Chemoattractant signals and beta 2 integrin occupancy at apical endothelial contacts combine with shear stress signals to promote transendothelial neutrophil migration. J. Immunol. 173, 7282-7291 (2004).
- Shulman, Z., Cohen, S. J., Roediger, B., et al. Transendothelial migration of lymphocytes mediated by intraendothelial vesicle stores rather than by extracellular chemokine depots. Nat. Immunol. 13, 67-76 (2012).
- Carman, C. V., Springer, T. A. Trans-cellular migration: cell-cell contacts get intimate. Curr. Opin. Cell Biol. 20, 533-540 (2008).
- Carman, C. V., Springer, T. A. A transmigratory cup in leukocyte diapedesis both through individual vascular endothelial cells and between them. J. Cell Biol. 167, 377-388 (2004).
- Millan, J., Hewlett, L., Glyn, M., et al. Lymphocyte transcellular migration occurs through recruitment of endothelial ICAM-1 to caveola- and F-actin-rich domains. Nat. Cell Biol. 8, 113-123 (2006).
- Schulte, D., Kuppers, V., Dartsch, N., et al. Stabilizing the VE-cadherin-catenin complex blocks leukocyte extravasation and vascular permeability. EMBO J. 30, 4157-4170 (2011).
- Buul, J. D., Mul, F. P., van der Schoot, C. E., Hordijk, P. L. ICAM-3 activation modulates cell-cell contacts of human bone marrow endothelial cells. J. Vasc. Res. 41, 28-37 (2004).
- Shaw, S. K., Bamba, P. S., Perkins, B. N., Luscinskas, F. W. Real-time imaging of vascular endothelial-cadherin during leukocyte transmigration across endothelium. J. Immunol. 167, 2323-2330 (2001).
- Su, W. H., Chen, H., Jen, C. J. Differential movements of VE-cadherin and PECAM-1 during transmigration of polymorphonuclear leukocytes through human umbilical vein endothelium. Blood. 100, 3597-3603 (2002).
- Paulsson, J. M., Jacobson, S. H., Lundahl, J. Neutrophil activation during transmigration in vivo and in vitro: A translational study using the skin chamber model. J. Immunol. Methods. 361, 82-88 (2010).
- Williams, M. R., Azcutia, V., Newton, G., Alcaide, P., Luscinskas, F. W. Emerging mechanisms of neutrophil recruitment across endothelium. Trends Immunol. 32, 461-469 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten