Method Article
В режиме реального времени изображений эндотелиальных межклеточных соединений Во нейтрофилов Трансмиграция в физиологических Flow
В этой статье
Резюме
Лейкоциты пересечь эндотелия монослоя с помощью парацеллюлярная или трансцеллюлярного маршрут. Мы разработали простой анализ следовать распределение эндогенного Junctional VE-кадгерин и PECAM-1 во лейкоцитов трансэндотелиальной миграции в физиологических потока различать между двумя переселении маршрутов.
Аннотация
Во время воспаления, лейкоциты покинуть кровообращение и пересечь эндотелий бороться вторжения патогенов в подлежащие ткани. Этот процесс известен как лейкоцитов трансэндотелиальной миграции. Две трассы для лейкоцитов пересечь эндотелия монослоя были описаны: в парацеллюлярного маршрут, т.е. через межклеточных соединений и трансцеллюлярного маршруту, то есть, через эндотелия тела клетки. Тем не менее, это было технически трудно различить пара- и трансцеллюлярного маршрута. Мы разработали простой анализ в пробирке, чтобы изучить распределение эндогенных VE-кадгерин и PECAM-1 во время нейтрофилов трансэндотелиальной миграции в физиологических условиях потока. До нейтрофилов перфузии, эндотелиальные клетки были кратко обрабатывали флуоресцентно-меченых антител против VE-кадгерина и PECAM-1. Эти антитела не мешают функции обоих белков, как было определено с помощью электрического клеток-substraИзмерения те сопротивление зондирования и FRAP. С помощью этого анализа, мы были в состоянии следовать распределение эндогенных VE-кадгерин и PECAM-1 во время трансэндотелиальной миграции в условиях кровотока и различать параметрами и трансцеллюлярного путей миграции лейкоцитов через эндотелий.
Введение
Эффективное и жестко контролируется лейкоцитов трансэндотелиальный миграции (TEM) имеет ключевое значение в физиологических процессах, таких как иммунного надзора и острого воспаления. Тем не менее, при определенных патофизиологических условиях, неконтролируемое и чрезмерное ТЕМ наблюдаемую в результате хронических воспалительных заболеваний (например, ревматоидный артрит, атеросклероз, астма). Также в течение метастазов опухолевых клеток, процесс миграции трансэндотелиальной играет важную роль в опухолевые клетки, чтобы оставить циркуляцию к метастазированию 1-3. Для того, чтобы специально мешать чрезмерного лейкоцитов или опухолевых клеток ТЭМ, детальное понимание регуляции этого процесса требуется.
Считается, что этот процесс происходит через ТЭМ различных этапов. Семенные исследования, оцененные два десятилетия назад Мясник и Springer, привело к многоступенчатой модели, описывающей процесс ТЕА 4,5. Эта модель все еще сохраняется, хотя некоторые объявлениянительные шаги были включены 6. Алон и соавт. Описал потребность в присутствии иммобилизованных хемокинов на поверхности эндотелия 7. В последнее время они показали, что сам эндотелий вырабатывает хемокинов, которые представлены на эндотелиальной апикальной поверхности 8. Более того, та же группа выдвинула важность условий потока во время ТЭМ 7. В последнее время несколько публикаций были посвящены двум различным маршрутам лейкоцитов может принять на заключительном этапе диапедез ТЕА. Они могут либо пройти межклеточных соединений, то есть, в парацеллюлярная миграционный путь, или пересекают эндотелия тела клетки, известный как трансцеллюлярного маршрута миграции 9. Карман и его коллеги изучили эти пути в деталях и пришли к выводу, что лейкоциты преимущественно выбрать парацеллюлярная миграционный путь (90%) по сравнению с трансцеллюлярного маршруту (10%) при пересечении пупочной вены эндотелия монослой 10.Однако, когда были использованы эндотелиальные клетки из других источников, например, головного мозга или микрососудов, больше лейкоцитов использовали трансцеллюлярного маршрут (30%) 11. Группа Vestweber недавно показали, что, когда межклеточных соединений были не в состоянии отделить друг от друга с помощью домино в животной модели, замены эндогенного VE-кадгерин для VE-кадгерин-альфа-катенина химерой, лейкоцитов ТЕМ был полностью заблокирован 12 . Удивительно, но авторы заметили, что ПЭМ был заблокирован в нескольких, но не всех, ткани. В целом, эти элегантные эксперименты показали, что лейкоциты предпочли парацеллюлярного маршрут над трансцеллюлярного маршруту, хотя регуляторные сигналы, которые вызывают это решение до сих пор неизвестны.
Несмотря на то, что большинство лейкоцитов предпочитают парацеллюлярная маршрут перемещения, оно по-прежнему трудно различить обоих путей. Кроме того, несмотря на несколько исследований, посвященных роли эндотелиальной турным межклеточнойионы, динамика этих переходов, в частности соединительных белков VE-кадгерин и PECAM-1, во время лейкоцитов пересечения до сих пор обсуждается. Мы разработали сравнительно простой тест, в котором эти молекулы распределительные можно контролировать в режиме реального времени во время лейкоцитов диапедез в физиологических условиях потока с использованием флуоресцентно-меченых антител. Эти антитела не вмешиваться или блокировать Junctional целостность или подвижность целевых белков. Этот анализ позволяет проследить динамику соединительных белков в процессе парацеллюлярной ТЭМ. Кроме того, этот анализ также позволяет дискриминацию между параметрами и трансцеллюлярного миграционных путей.
протокол
Нейтрофилы выделяли из здоровых добровольцев, которые подписали информированное согласие. Исследования были выполнены в соответствии с институциональными и национальных руководящих принципов для благосостояния человека.
1 Покрытие и обслуживание человека эндотелиальных клеток пупочной вены
- Культура человека эндотелиальных клеток пупочной вены (HUVECs) в соответствии с инструкциями производителя. Grow HUVECs на фибронектина (FN) -покрытие блюда (10 мкг / мл, растворенные в деминерализованной воде) с использованием средств массовой информации (эндотелия базальной среды (ДМ-2), дополненной среде роста эндотелия (EGM-2) singlequots). Используйте клеточной культуры между 4-8 проходов для экспериментов.
- День 1: Смазать потока-камеры с 100 мкл фибронектина (10 мкг / мл в PBS) в течение не менее 2 ч при 37 ° С и 5% СО 2.
- День 2: Когда клетки достигают 80-90% слияния, Trypsinize клетки после тщательного промывания РТ фосфатным буферным солевым раствором (PBS) рН 7,4, центрифуги при 800 мкг в и ресуспендируют в 800 000 клеток / мл с использованием средств массовой информации. Пластина 80 000 клеток в каждой канал FN покрытием потока камерах и осторожно пипеткой клеточной суспензии вверх и вниз. Культура O / N в инкубаторе при 37 ° С и 5% СО 2.
- День 3: Обновить СМИ в поток-камеры горкой, осторожно наклоняя слайд под углом 45 °. (Рисунок 1А).
ПРИМЕЧАНИЕ: Рекомендуется только извлекайте носитель в водоемах, а не в самом канале. Снятие средств массовой информации в каналах может привести к потеря эндотелиальных клеток и смерти в результате увлечения силу СМИ, вызванной с помощью пипетки. - Проверка на фазово-контрастной микроскопии, если эндотелиальные клетки образовали монослой (то есть, 100% сливной). Если клетки не 100% сливной измените носитель два раза в день, пока они не достигнут 100% слияния.
- После того, как клетки достигли слияния, стимулируют клетки со средствами массовой информации (смотри шаг1,1), содержащий воспалительный медиатор (TNF-α (10 нг / мл)). Стимулирование HUVECs O / N (то есть, 12 ч) с результатами ФНО-α в воспалительных фенотипа эндотелия, т.е.., Повышающую регуляцию молекул клеточной адгезии, таких как ICAM-1 и VCAM-1 13.
2 настоящее заболевание Изоляция Использование Перколла градиентов
- Подготовьте N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты (HEPES) -буфера (здесь и далее называемый: поток-буфера) до выделения полиморфно-ядерных лейкоцитов (PMN). Поток-буфер используется для мытья изолированных PMNs и в качестве буфера в анализе потока. Для подготовки потока-буфера: разбавить 7,72 г NaCl (132 мм), 4,76 г HEPES (20 мм), 0,45 г KCl (6 мм), 0,25 г MgSO 4 • 7H 2 O (1 мм), K 2 HPO 4 • 3Н 2 О (1,2 мМ) в 1 л деминерализованной воды и доведения рН до 7,4 (этот запас можно хранить при температуре 4 ° С в течение нескольких недель).
- Добавить свежие 100 мкл 1 М CaCl 2 & #160; (1 мМ), 2,5 мл человеческого альбумина с концентрацией 200 г / л складе (0,5% об / об) и 0,1 г глюкозы в 100 мл (0,1% вес / объем) из потока буфера. Далее, фильтровать блок-буфера с использованием 0,45 мкм фильтр. ПРИМЕЧАНИЕ: Этот поток-буфер должен быть подготовлен новый для каждого эксперимента.
- До выделения ПМН, подготовить 10% тринатрийцитрат (TNC) решение в PBS, рН 7,4.
- Соберите 20 мл цельной крови в гепарина натрия vacuettes от здорового добровольца. Развести цельной крови 1: 1 с 10% PBS / TNC в 50 мл пробирки и пипетки 20 мл тщательно разбавляют кровь на 12,5 мл Percoll (с 23% (вес / вес) коллоидного раствора в воде с плотностью 1,130 г / мл) в новую пробирку на 50 мл. Осторожно помещают в пробирки центрифуги и спина в течение 20 мин при 800 х г с низким ускорением и без перерыва, установленного при комнатной температуре.
Примечание: При добавлении разбавленной крови в перколлом, наклонить Перколла-содержащий трубку углом 45 ° и осторожно пипеткой в разбавленной крови в трубке именноч самый медленный настройка пипетки мальчик. - Удалить все жидкости, а затем заполнить трубку с ледяной эритроцитов лизиса-буфере (4,15 г NH 4 Cl [0,155 М], 0,5 г КНСО 3 [0,01 М] и 18,5 мг EDTA (триплекс III) [0,1 мм] в 500 мл ледяной H 2 O) лизировать эритроциты. Оставьте пробирку на льду, иногда переворачивая пробирку, пока суспензия не станет темно-красный, с последующим центрифугированием 500 х г в течение 5 мин при 4 ° С с перерывами с поддержкой.
ПРИМЕЧАНИЕ: Осадок фракция содержит ПЯЛ (нейтрофилы, эозинофилы, базофилы) вместе с эритроцитами. - Удалить супернатант и мыть гранул дважды в ледяной лизиса-буфера при 500 мкг в течение 5 мин при 4 ° С.
- Ресуспендируют гранул с потока-буфера при комнатной температуре и определения концентрации PMNS используя либо гемоцитометра или автоматизированного счетчика клеток. Приостановить PMNs в потока-буфера в 1 х 10 6 клеток / мл и держать при комнатной температуре.
3 Маркировка эндотелиальных Junctionаль VE-кадгерин и PECAM-1
- Добавьте РЕСАМ Alexa Fluor 647-антителом (клон WM59) в разведении 1: 100 и кальций-независимой VE-кадгерин-FITC антителом (клон 55-7H1) в 1:50 разбавление в HUVEC в культуральной среде (этап 1.1), и инкубируют в течение 30 мин до начала эксперимента потока для визуализации соединительных динамику эндотелиальных клеток нейтрофилов при переселении в физиологических условиях потока.
ПРИМЕЧАНИЕ: Прежде чем добавлять непосредственно-меченых антител к потоку-камер, убедитесь, что объем в каждом канале не превышает 100 мкл. Это помогает держать расходы антитело как можно более низкой.
4 ПМН ТЭМ пробирного Под Flow
- Поместите PMNs в водяной бане в течение 15 мин при 37 ° С до их инжекции в поток системе.
- Подключите трубку к пустой потока-камеры, а затем теплой (например, 37 ° C) поток-буфер (см шаг 4.3), чтобы предотвратить образование воздушных пузырей при настройке гоСистема электронной подачи.
- Подключите одну сторону пустой потока-камеры к системе потока насос шприца с помощью силиконовых трубок, содержащий 20 мл шприц, и поставить блок-камеру на столике микроскопа.
- Подключите другую сторону пустой потока-камеры в резервуар колбу, заполненную 37 ° C потока-буфера (фиг.1В) и начать шприцевой насос, чтобы заполнить все трубы с потоком-буфера. Насос будет тянуть блок-буфер из резервуара через расходную-камеры в шприц. ПРИМЕЧАНИЕ: Этот трубопровод также содержит Luer порта впрыска в режиме онлайн, что позволяет PMNs, который будет введен с иглой в работающей эксперимента без остановки потока и создания воздушных пузырьков.
- Замените пустой блок-камеру с потока-камеру, содержащую ФНО-α обращению HUVECs, подключить поток-буфера, содержащего трубку и поместите его в столик микроскопа (Рисунок 1C). Повышение от пробирки до отключение и подключением в камерах, содержащих HUVECs, а не зажимая с может привести к образованию пузырьков воздуха внутри трубы и / или потока камерах.
- Регулировка скорости потока 1 дин / см 2, в соответствии со скоростью потока физиологического в почтовых капиллярных венулы (1-5 дин / см 2).
- Запись Дифференциальный интерференционного контраста (DIC), FITC (488 нм) и Alexa Fluor 647 (647 нм) одновременно с использованием конфокальной лазерной сканирующей микроскопии.
- Введите PMNS (шаг 4.1) медленно в измерительном-системы через в линии Luer инъекционным портом (Рисунок 1D) с использованием 1 мл шприцы.
- Через несколько минут, появляются лейкоциты, придерживаются, и переселяться. Прекращение эксперимента в любой желаемый момент, отсоединив трубки с потоком-камеры и пипетирования фиксатора (3,7% формальдегида в PBS) в поток-камеры. Разрешить фиксацию в течение 10 мин, с последующим промыванием PBS. Данные анализировались с помощью обработки изображений (см материалы и таблицы оборудования).
ПРИМЕЧАНИЕ: Выполните он эксперимент с использованием конфокальной лазерной сканирующей микроскопии, оснащенный климатической камере с постоянной температурой в 37 ° С, 5% СО 2, и 63x масло-цель.
Результаты
Мы впервые опробован если антитела не мешают барьерной функции эндотелия. Мы измерили сопротивление эндотелиальных монослоев с помощью электрического клетки с субстратом импеданса зондирования (ЕСНГ). Более подробную информацию см Ван Buul и соавт. 13 не изменение сопротивления не наблюдалось, когда анти-VE-кадгерин флуоресцентно-меченного антитела к клеткам добавляли (Фиг.2А). Анти-VE-кадгерин антитела, которые хорошо узнаваемым блокировать VE-кадгерин функция снижается сопротивление резко (рисунок 2А). Кроме того, антитела, используемые для визуализации не изменит динамику VE-кадгерин, как оценивали путем измерения флуоресцентного восстановление после фото-отбеливания (FRAP) от VE-кадгерин-GFP (фиг.2В).
После 1-2 мин, нейтрофилы придерживался активированного эндотелия монослоя как может быть визуализированы в канале ДВС (Рисунок 3А). После ползать на 5-30 таковойС, большинство из нейтрофилов переселено через монослой эндотелиальных через межклеточных соединений, которые были помечены с антителами, направленными против PECAM-1 и VE-кадгерина. В процессе диапедез, распределение VE-кадгерин был следовать, и РЕСАМ-1 в реальном времени (фиг.3В). В местах нейтрофилов диапедез, VE-кадгерин был нарушен, и локально РЕСАМ-1 показал более кольцевую структуру. После завершения диапедез, переходы, близкие и VE-кадгерина и PECAM-1 четко переехал в местах диапедез (Рисунок 3C). Обратите внимание, что части анти-PECAM-1 антитела были обнаружены на поверхности нейтрофилов раз нейтрофилов достигли Baso-боковой поверхности эндотелия. Тем не менее, это не помешало нейтрофилы от пересечения эндотелий. Наблюдаемая динамика VE-кадгерина в реальном времени во время нейтрофилов трансэндотелиальной миграции были согласны с работами Шоу и коллег, которыепоказали, с помощью конфокальной микроскопии и VE-кадгерина-GFP-трансфецировали эндотелиальные клетки, что VE-кадгерин-GFP рассеянный вбок, когда лейкоциты пересек эндотелиальные межклеточных соединений 14. Также работают, Су и его коллеги подчеркнули наши наблюдения PECAM-1. Они показали, что, рядом с боковой VE-кадгерина диффузии при прохождении лейкоцитов, РЕСАМ-1 локально перераспределены в кольцо вокруг переходим нейтрофилов 15.

Рисунок 1 В пробирке проточной камеры. () Стрелка указывает резервуар, из которого среда нуждается в обновлении. (B) Силиконовые трубки, которая соединяет проточную камеру с в линии порта Luer впрыска, используемого для инъекционных PMNs без отсоединения труб (стрелки). (C) Соедотражения пустого потока-камеры в резервуар колбу, заполненную 37 ° C потока-буфера (стрелки). (D) соединения из потока-камеры с ФНО-α, обработанных HUVECs в поток-буфера, содержащего трубки и поместить в столике микроскопа (стрелки).
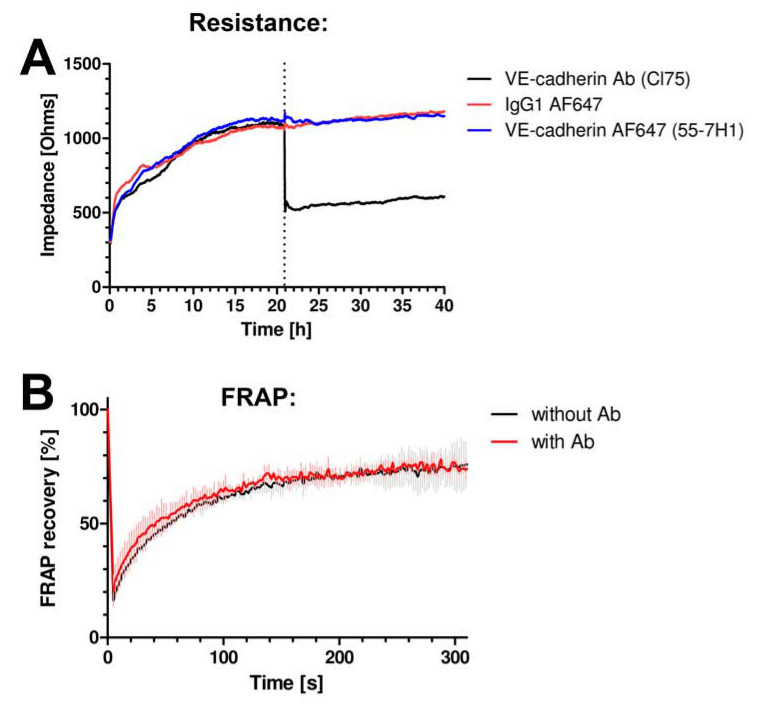
Рисунок 2 VE-кадгерин антитела не мешают соединительных динамики или функции. (А) эндотелиальных клеток монослоя импеданс измеряется с помощью ЕСНГ. Y-ось выражает сопротивление, Ом и х-ось представляет время в часах. VE-кадгерин антитела клона 55-7H1, помечены Alexa647 (синяя линия) или изотипа контроль IgG-Alexa647 (красная линия) не изменяют эндотелиальных клеток монослоя сопротивление, в то время как VE-кадгерин блокирования антител CL75 (черная линия) сделал уменьшить сопротивление . (В ) VE-кадгерин-GFP была выражена в HUVEC и анализ FRAP с помощью конфокальной микроскопии не было обнаружено никаких изменений в восстановление флуоресценции в присутствии или в отсутствие VE-кадгерина 55-7H1 антитела.
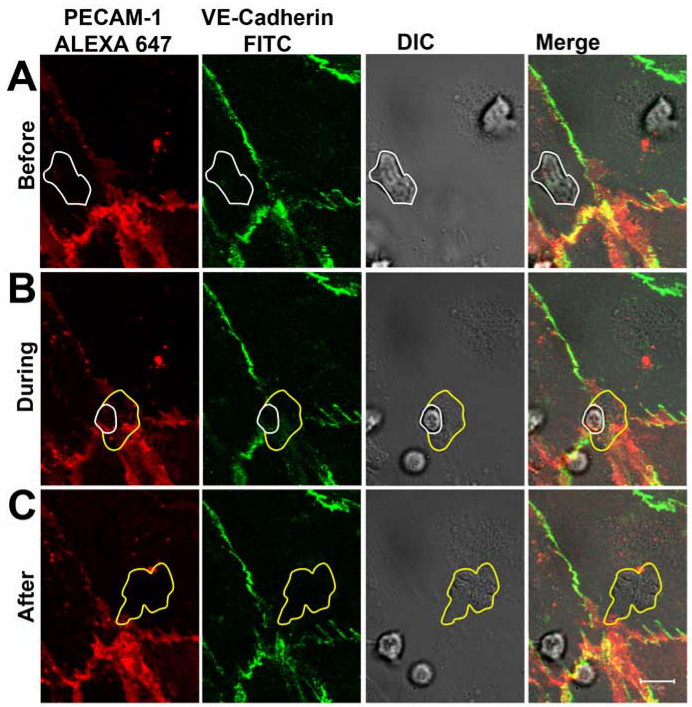
Рисунок 3 VE-кадгерин и РЕСАМ-1 распределения во нейтрофилов ПЭМ в режиме реального времени. (А) нейтрофилов (отмечены белой линией) придерживаясь на эндотелий и пересечения клетка-клетка соединение, не влияя на распределение VE-кадгерина и РЕСАМ -1. (B) нейтрофилов пересечения эндотелия монослой через межклеточных соединений. Местный дисперсия VE-кадгерин и PECAM-1 можно наблюдать при нейтрофилов выступает через межклеточных соединений. Белая линия показывает присутствие нейтрофилов по-прежнему на вершине эндотелия. Желтая линия показывает мембран нейтрофилов тхат уже под эндотелия. (C) нейтрофилов полностью пересек эндотелия монослой. VE-кадгерин и PECAM-1 были переселены в местах диапедез. Желтая линия показывает границы переселились нейтрофилов. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Для этого протокола, она имеет решающее значение для предотвращения образования воздушных пузырьков в потоке-камер, так как это приведет к клеточной апоптоза и нарушенного монослоя. Чтобы избежать этого, мы хотели бы подчеркнуть, обратить особое интерес к шагов 4,2 и 4,5, где трубы, подключенных к оттоку камеры. Другим важным шагом в протоколе является грунтовка из PMNs, которые хранятся при комнатной температуре путем инкубации их в течение 15-30 мин при 37 ° С до инъекционных их с блок-камеры (шаг 4.1). Это приводит к грунтовки лейкоцитов интегринов, что позволяет им придерживаться молекул адгезии, таких как ICAM-1 или VCAM-1 в эндотелии.
Этот протокол не ограничивается, чтобы изучить трансмиграцию нейтрофилов. Также могут быть использованы другие типы лейкоцитов, таких как моноциты или лимфоцитов. Отметим, что шаг 4,1, то есть, грунтования лейкоциты могут отличаться между типами лейкоцитов. Кроме того, другие типы эндотелиальных клеток могут быть использованы. Для этого остается критическимстимулировать эндотелиальные клетки с соответствующими воспалительных стимулов, таких как TNF-α или IL-1β. Если нейтрофилы не реагируют на переходим, можно считать обработку кратко нейтрофилов (5 мин) с N-формил-L-метионил-L-лейцил-L-фенилаланин (FMLP) пептида 16. Это будет стимулировать нейтрофилы, в частности их интегринов, еще дальше, делая их более склонными придерживаться эндотелия.
Обычно используется 1 дин / см скорость потока 2. Эта скорость потока измеряется в посткапиллярных венул, сайтов, где большая часть миграции лейкоцитов трансэндотелиальный происходит 17. Используя описанные потока-камер, можно увеличить скорость потока до 10 дин / см 2. Тем не менее, это не рекомендуется, чтобы увеличить сдвига дальше. Это может привести к нежелательной утечки трубопровода и отрыва клеток из потока-камеры.
Результаты, описанные на рисунке 3, показывают, что этиантитела могут быть использованы для визуализации и изучения динамики переходов межклеточных эндотелиальных во лейкоцитов диапедез. В частности, в дополнение к существующим Трансмиграция анализов Этот протокол позволяет различать парацеллюлярная от трансцеллюлярного миграции в физиологических условиях потока в реальном времени. Поскольку антитела окрашивают межклеточных соединений, можно забить количество лейкоцитов, что пересечь VE-кадгерина / PECAM-1-положительных переходов по сравнению с неположительны VE-кадгерина / PECAM-1-сайтов. Таким образом, трансцеллюлярного миграция может быть подвергнут дискриминации от парацеллюлярной миграции.
Важно подчеркнуть, что эти антитела не мешают функции белков они связываются с: PECAM-1 антитело, используемое в данном исследовании, направленных против второй внеклеточного домена. Эндотелиальные клетки, которые высевали в присутствии антител не было обнаружено никаких дефектов в распространении или образуя монослой, предполагая, что антитело по крайней мере, не сделалмешать однотипных взаимодействий между эндотелиальными клетками. В дополнение к этому, оба антитела не ухудшают способность нейтрофилов мигрировать через монослой эндотелиальных. Кроме того, количество нейтрофилов, что переселяться через монослой эндотелиальных в отсутствие или в присутствии антител не изменяется (данные не показаны). Важно отметить, что конфокальной лазерной сканирующей микроскопии дает нам возможность записать различные флуоресцентные каналы и DIC одновременно.
Таким образом, этот анализ позволяет изучать динамику VE-кадгерина и PECAM-1, в то же время, когда нейтрофилов пересекает эндотелия переход межклеточной и поможет понять, почему лейкоциты выбрать один маршрут над другой, т.е. парацеллюлярная против трансцеллюлярного.
Раскрытие информации
The authors have no competing financial interests.
Благодарности
The authors thank Dr. P.L. Hordijk for critically reading the manuscript. AED is supported by a Landsteiner Foundation for Blood Transfusion Research (LSBR) fellowship (grant #1028). JK is supported by the Dutch Heart Foundation (2005T3901). JDvB is a NHS Dekker fellow (grant #2005T039).
Материалы
| Name | Company | Catalog Number | Comments | |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description | |
| μ-Slide VI | IBIDI | 80606 | Flow-chamber | |
| 0.45 μm filter | Whatman/GE Lifesciences | 10462100 | ||
| 1 mL syringe | BD Plastipak | 300013 | ||
| 20 mL syringe | BD Discardit II | 366296 | ||
| 21G needle | BD Microlance | 301155 | ||
| Albumin | Sanquin | 15522644 | ||
| Ammunium chloride (NH4Cl) | Merck | 1009245000 | ||
| Calcium chloride (CaCl2) | Sigma-Aldrich | 449709 | ||
| EBM-2 Basal medium + EGM-2 SingleQuot Kit Suppl. & Growth Factors | Lonza | CC-3156 + CC-4176 | media | |
| EDTA (Titriplex III) | Merck | 1370041000 | ||
| Falcon tubes | Corning Life Sciences | 352096 | ||
| Fibronectin | Sigma-Aldrich | F1141-2MG | FN | |
| Glucose | Sigma-Aldrich | G7528 | ||
| HEPES | Sigma-Aldrich | H3375 | ||
| In-line Luer Injection port | IBIDI | 10820 | ||
| Magnesium sulfate heptahydrate (MgSO4.7H2O) | Merck | 105886 | ||
| PECAM-1-ALEXA-647 | BD Pharmingen | 561654 | clone WM59 stock concentration 0.1mg/mL | |
| Percoll | GE Healthcare Life Sciences | 17-0891-09 | ||
| Phosphate Buffered Saline | Fresenius Kabi Nederland | M090001/01NL | PBS | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | ||
| Potassium hydrogen carbonate (KHCO3) | Merck | 1048540500 | ||
| Potassium phosphate dibasic trihydrate (K2HPO4) | Sigma-Aldrich | P5504 | ||
| Silicone Tygon 3350 tubing | VWR | 228-4331 | tubing | |
| Sodium chloride (NaCl) | Calbiochem (Millipore) | 567441 | ||
| Syringe pump | Harvard Apparatus | model number 55-5920 | ||
| TNFα | Peprotech | 300-01A | tumor necrosis factor | |
| trisodium citrate | Merck | 1.06447.5000 | TNC | |
| Vacuettes | Greiner, Germany | 980044 | ||
| VE-Cadherin-FITC | BD Pharmingen | 560411 | clone 55-7H1 | stock concentration 0.5mg/mL |
| Zeiss LSM510 META | Carl Zeiss MicroImaging, Jena, Germany | |||
| Zen Software 2008 | Carl Zeiss MicroImaging, Jena, Germany |
Ссылки
- Ross, R. Atherosclerosis--an inflammatory disease. N. Engl. J. Med. 340, 115-126 (1999).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Szekanecz, Z., Koch, A. E. Vascular involvement in rheumatic diseases: ' vascular rheumatology. Arthritis Res. Ther. 10, 224 (2008).
- Butcher, E. C. Leukocyte-endothelial cell recognition: three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Cinamon, G., Shinder, V., Shamri, R., Alon, R. Chemoattractant signals and beta 2 integrin occupancy at apical endothelial contacts combine with shear stress signals to promote transendothelial neutrophil migration. J. Immunol. 173, 7282-7291 (2004).
- Shulman, Z., Cohen, S. J., Roediger, B., et al. Transendothelial migration of lymphocytes mediated by intraendothelial vesicle stores rather than by extracellular chemokine depots. Nat. Immunol. 13, 67-76 (2012).
- Carman, C. V., Springer, T. A. Trans-cellular migration: cell-cell contacts get intimate. Curr. Opin. Cell Biol. 20, 533-540 (2008).
- Carman, C. V., Springer, T. A. A transmigratory cup in leukocyte diapedesis both through individual vascular endothelial cells and between them. J. Cell Biol. 167, 377-388 (2004).
- Millan, J., Hewlett, L., Glyn, M., et al. Lymphocyte transcellular migration occurs through recruitment of endothelial ICAM-1 to caveola- and F-actin-rich domains. Nat. Cell Biol. 8, 113-123 (2006).
- Schulte, D., Kuppers, V., Dartsch, N., et al. Stabilizing the VE-cadherin-catenin complex blocks leukocyte extravasation and vascular permeability. EMBO J. 30, 4157-4170 (2011).
- Buul, J. D., Mul, F. P., van der Schoot, C. E., Hordijk, P. L. ICAM-3 activation modulates cell-cell contacts of human bone marrow endothelial cells. J. Vasc. Res. 41, 28-37 (2004).
- Shaw, S. K., Bamba, P. S., Perkins, B. N., Luscinskas, F. W. Real-time imaging of vascular endothelial-cadherin during leukocyte transmigration across endothelium. J. Immunol. 167, 2323-2330 (2001).
- Su, W. H., Chen, H., Jen, C. J. Differential movements of VE-cadherin and PECAM-1 during transmigration of polymorphonuclear leukocytes through human umbilical vein endothelium. Blood. 100, 3597-3603 (2002).
- Paulsson, J. M., Jacobson, S. H., Lundahl, J. Neutrophil activation during transmigration in vivo and in vitro: A translational study using the skin chamber model. J. Immunol. Methods. 361, 82-88 (2010).
- Williams, M. R., Azcutia, V., Newton, G., Alcaide, P., Luscinskas, F. W. Emerging mechanisms of neutrophil recruitment across endothelium. Trends Immunol. 32, 461-469 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены