Method Article
Imagens em tempo real de endoteliais junções célula-célula durante Neutrophil Transmigração Sob Fisiológica Fluxo
Neste Artigo
Resumo
Os leucócitos atravessam a monocamada endotelial utilizando o paracelular ou o percurso intracelular. Foi desenvolvido um ensaio simples para seguir a distribuição de juncional endógeno VE-caderina e PECAM-1 durante a migração transendotelial de leucócitos sob fluxo fisiológico para discriminar entre as duas vias de transmigração.
Resumo
Durante a inflamação, leucócitos deixam a circulação e atravessar o endotélio para combater patógenos invasores nos tecidos subjacentes. Este processo é conhecido como a migração de leucócitos transendotelial. Duas vias de leucócitos para atravessar a monocamada endotelial foram descritos: a via paracelular, ou seja, através da junção célula-célula e da via intracelular, isto é, através do corpo da célula endotelial. No entanto, tem sido tecnicamente difícil discriminar entre o pará- e via transcelular. Foi desenvolvido um ensaio in vitro simples para estudar a distribuição dos endógeno VE-caderina e PECAM-1 durante a migração transendotelial de neutrófilos sob condições de fluxo fisiológico. Antes da perfusão de neutrófilos, células endoteliais foram tratados brevemente com anticorpos marcados com fluorescência contra VE-caderina e PECAM-1. Estes anticorpos não interferem com a função de ambas proteínas, tal como foi determinado pela célula-substra eléctricoste de detecção da impedância e FRAP medições. Utilizando este ensaio, foi possível seguir a distribuição da endógena VE-caderina e PECAM-1 durante a migração transendotelial sob condições de fluxo e discriminar entre os parágrafos e migração transcelular rotas dos leucócitos através do endotélio.
Introdução
Eficiente e rigidamente controlado migração de leucócitos transendotelial (TEM) é de importância fundamental em processos fisiológicos como a vigilância imunológica e inflamação aguda. No entanto, sob certas condições fisiopatológicas, TEM descontrolada e excessiva resultante é observado em doenças inflamatórias crónicas (por exemplo, artrite reumatóide, aterosclerose, asma). Também durante a metástase de células tumorais, o processo de migração transendotelial é instrumental para células tumorais para deixar a circulação de metástase 1-3. A fim de interferir especificamente com leucócitos excessiva ou MET de células de tumor, é necessário um conhecimento detalhado da regulação deste processo.
Acredita-se que o processo ocorre através de MET diferentes etapas. Estudos seminais, avaliação, há duas décadas por Butcher e Springer, levou ao modelo de várias etapas que descreve o processo de TEM 4,5. Este modelo ainda é válido, embora alguns anúncioetapas nal foram incluídas 6. Alon et ai. Descrito a necessidade da presença de quimiocinas imobilizadas na superfície do endotélio 7. Recentemente, eles mostraram que o próprio endotélio gera quimiocinas que são apresentados na superfície apical endotelial 8. Além disso, o mesmo grupo apresentou a importância das condições de fluxo durante TEM 7. Recentemente, várias publicações voltadas para as duas rotas diferentes leucócitos pode tomar na fase final da diapedese TEM. Eles podem ir através da junção célula-célula, isto é, o percurso de migração paracelular, ou atravessam o corpo da célula endotelial, conhecido como o percurso de migração transcelular 9. Carman e seus colegas estudaram estes percursos em detalhe e concluiu que os leucócitos, preferencialmente, escolher a rota de migração paracellular (90%) ao longo da via transcelular (10%) ao atravessar uma monocamada endotelial da veia umbilical 10.No entanto, quando foram utilizadas células endoteliais de outras origens, por exemplo, cérebro ou microvasculatura, mais leucócitos utilizada a via transcelular (30%) 11. O grupo Vestweber mostraram recentemente que quando as junções célula-célula foram incapazes de se dissociam umas das outras por meio de um bate-em modelo animal, a substituição endógena VE-caderina para uma VE-caderina-alfa-catenina quimera, leucócitos MET foi totalmente bloqueada 12 . Surpreendentemente, os autores verificaram que TEM foi bloqueado em vários, mas não todos, os tecidos. Em geral, estas experiências indicaram que os leucócitos elegantes preferidas via paracelular através da via transcelular, embora os sinais reguladores que desencadeiam esta decisão ainda são desconhecidos.
Embora a maioria dos leucócitos preferência o percurso de migração paracelular, ainda é difícil discriminar entre as duas vias. Além de que, apesar de vários estudos focalizando o papel do Junct célula-célula endotelialíons, a dinâmica desses cruzamentos, em especial, as proteínas juncionais VE-caderina e PECAM-1, durante a travessia de leucócitos ainda está em debate. Foi desenvolvido um ensaio relativamente simples, no qual estas moléculas de junção pode ser monitorado em tempo real durante a diapedese de leucócitos em condições de fluxo fisiológicas, utilizando anticorpos marcados fluorescentemente. Estes anticorpos não interferir ou bloquear integridade juncional ou mobilidade das proteínas-alvo. Este ensaio nos permite acompanhar a dinâmica das proteínas juncionais durante o processo de paracellular TEM. Além disso, este ensaio também permite discriminar entre os parágrafos e transcelulares rotas de migração.
Protocolo
Os neutrófilos foram isolados de voluntários saudáveis que tenham assinado o termo de consentimento. A pesquisa foi realizada em conformidade com as diretrizes institucionais e nacionais para o bem-estar humano.
1. chapeamento e Manutenção de veia umbilical humana células endoteliais
- Células Cultura Cordão Veia endoteliais (HUVEC) de acordo com as instruções do fabricante. As HUVECs crescem em fibronectina (FN) -Revestido pratos (10 ug / ml, dissolvidos em água desmineralizada) utilizando meios (Meio Basal Endotelial (EBM-2) meio suplementado com Meio de Crescimento Endotelial (EGM-2) singlequots). Use cultura celular entre 4-8 passagens para os experimentos.
- Dia 1: O revestimento de fluxo de câmaras com 100 mL de fibronectina (10 ug / ml em PBS), durante pelo menos 2 horas a 37 ° C e 5% de CO 2.
- Dia 2: Quando as células atingem 80-90% de confluência, as células trypsinize após lavagem cuidadosa com solução salina tamponada com fosfato temperatura ambiente (PBS) pH 7,4, centrifugar a 800 xg e ressuspender em 800 mil células / ml, utilizando meios de comunicação. Placa de 80.000 células em cada canal do fluxo de câmaras FN-revestidos e Pipeta suavemente a suspensão de células para cima e para baixo. Cultura O / N em uma incubadora a 37 ° C e 5% de CO 2.
- Dia 3: Atualizar a mídia no slide fluxo câmara inclinando ligeiramente as lâminas em um ângulo de 45 °. (Ver Figura 1A).
NOTA: Recomenda-se apenas remova a mídia nos reservatórios e não no próprio canal. Remoção dos meios de comunicação nos canais pode resultar em perda de células endoteliais e morte devido à força arrastando da média causada por pipetagem. - Verificar por microscopia de contraste de fase, se as células endoteliais formam uma monocamada (isto é, 100% confluente). Se as células não são 100% confluentes, alterar a mídia duas vezes por dia até atingirem 100% de confluência.
- Uma vez que as células atingiram a confluência, estimular as células com meios de comunicação (ver passo1,1) contendo mediador inflamatório (TNF-α (10 ng / ml)). Estimular HUVECs S / N (isto é, 12 horas) com os resultados de TNF-α num fenótipo inflamatória do endotélio, por exemplo., A sobre-regulação de moléculas de adesão celular, tais como ICAM-1 e VCAM-1 13.
2 de leucócitos polimorfonucleares isolamento utilizando gradientes de Percoll
- Preparar N-2-hidroxietilpiperazina-N'-2-etanossulfónico (HEPES) -buffer (daqui em diante chamado de: fluxo de tampão), antes do isolamento de leucócitos polimorfonucleares (PMN). Flow-tampão é usado para lavar os PMNs isolados e como tampão no ensaio de fluxo. Para preparar o fluxo de tampão: diluir 7,72 g de NaCl (132 mM), 4,76 g de HEPES (20 mM), 0,45 g de KCl (6 mM), 0,25 g de MgSO 4 7H 2 O • (1 mM), K 2 HPO 4 • 3H 2 O (1,2 mM) em 1 L de água desmineralizada e ajusta-se até pH 7,4 (esta unidade pode ser mantida a 4 ° C, durante várias semanas).
- Adicionar 100 ul fresco 1 M CaCl2 & #160, (1 mM), 2,5 ml de albumina humana a partir de uma concentração de 200 g / l de estoque (0,5% v / v) e 0,1 g de glicose a 100 ml (0,1% w / v) de tampão de fluxo. Em seguida, filtra-se o tampão de fluxo utilizando um filtro de 0,45 um. NOTA: Este buffer fluxo precisa ser preparada para cada experimento.
- Antes do isolamento do PMN, preparar uma solução a 10% de citrato trissódico (TNC) em PBS, pH 7,4.
- Recolher 20 ml de sangue total em vacuettes heparina sódica de um voluntário saudável. Dilui-se o sangue total de 1: 1 com 10% de PBS / TNC em tubos de 50 ml e 20 ml de sangue diluído de pipeta cuidadosamente em 12,5 ml de Percoll (a 23% (w / w) de solução coloidal em água com uma densidade de 1,130 g / ml) em um novo tubo de 50 ml. Cuidadosamente coloque os tubos em centrífuga e girar durante 20 minutos a 800 xg, com aceleração e baixa sem pausa ajustado à temperatura ambiente.
NOTA: Ao adicionar o sangue diluído ao Percoll, incline o tubo Percoll contendo em um ângulo de 45 ° e pipeta suavemente o sangue diluído na sagacidade tuboh a configuração mais lenta pipeta menino. - Remover todo o líquido e subsequentemente encher o tubo com a lise de eritrócitos-tampão gelado (4,15 g NH 4 Cl [0,155 M], 0,5 g de KHCO3 [0,01 M] e 18,5 mg de EDTA (triplex III) [0,1 mM] a 500 ml de gelado de H 2 O) para lisar os eritrócitos. Deixar o tubo em gelo, ocasionalmente, invertendo o tubo, até a suspensão torna-se vermelho escuro, seguido por centrifugação a 500 xg durante 5 min a 4 ° C com intervalos activado.
NOTA: A fracção de sedimento contem os PMNs (neutrófilos, eosinófilos, basófilos) em conjunto com os eritrócitos. - Remover o sobrenadante e lave o peletizado duas vezes em lise-tampão gelado a 500 xg durante 5 min a 4 ° C.
- Ressuspender o sedimento com tampão de fluxo à TA e determinar a concentração de PMN utilizando um hemocitómetro ou contador de células automatizado. Suspender as PMNs em fluxo tampão a 1 x 10 6 células / ml e manter à temperatura ambiente.
3. Rotulagem de junção endotelialai VE-caderina e PECAM-1
- Adicionar o PECAM Alexa Fluor 647 anticorpo (clone WM59) a uma diluição 1: 100 e o anticorpo de VE-caderina-FITC independente de cálcio (clone 55-7H1) a uma diluição de 1:50 para meio de cultura de HUVEC (ver passo 1.1), e incubar durante 30 min antes de se iniciar a experiência de fluxo de visualizar dinâmica de junção de células endoteliais durante a transmigração de neutrófilos sob condições de fluxo fisiológico.
NOTA: Antes de adicionar os anticorpos diretamente rotulados ao fluxo câmaras, que o volume de cada canal não exceda 100 l. Isto ajuda a manter as despesas de anticorpo tão baixo quanto possível.
4. PMN TEM Ensaio Sob Fluxo
- Coloque as PMNs em banho-maria durante 15 min a 37 ° C antes de injectar-los para o sistema de fluxo.
- Conecte o tubo de um fluxo-câmara vazia e encha com água morna (por exemplo, 37 ° C) Fluxo-buffer (veja o passo 4.3) para evitar a formação de bolhas de ar quando a criação de thsistema de e fluxo.
- Conectar um lado de uma câmara vazia de fluxo para o sistema de fluxo da bomba de seringa, o uso de tubos de silicone contendo uma seringa de 20 ml, e colocar a câmara de fluxo para a fase de microscópio.
- Ligue o outro lado de um fluxo-câmara vazia para o frasco reservatório enchido com 37 ° C, o fluxo de tampão (Figura 1B) e ligar a bomba de seringa, de modo a encher todo o tubo de escoamento tampão. A bomba vai puxar o fluxo tampão do reservatório, através da câmara de fluxo para dentro da seringa. NOTA: Este tubo também contém uma porta de injecção na linha de Luer, o que permite que os PMN a ser injectada com uma agulha na experiência de marcha, sem interromper o fluxo e criando as bolhas de ar.
- Substituir o fluxo da câmara de vazio com a câmara de fluxo contendo tratados com TNF-α HUVECs, ligar o tubo de fluxo contendo tampão e colocá-lo na fase de microscópio (Figura 1C). Beliscar fora dos tubos antes de desligar e voltar a ligar om para as câmaras que contêm a HUVEC, como não beliscar fora pode resultar na formação de bolhas de ar no interior do tubo e / ou de fluxo de câmaras.
- Ajustar a velocidade do fluxo de 1 dyn / cm 2, de acordo com a velocidade de fluxo fisiológico em vénulas pós-capilares (1-5 dyn / cm 2).
- Grave contraste de interferência diferencial (DIC), FITC (488 nm) e Alexa Fluor 647 (647 nm) simultaneamente, utilizando um microscópio de varredura a laser confocal.
- Injectar as PMNs (passo 4.1) lentamente no sistema de fluxo, através do em-linha Luer porta de injecção (Figura 1D) utilizando seringas de 1 ml.
- Depois de alguns minutos, os leucócitos aparecem, aderir, e transmigrate. Parar a experiência em qualquer momento desejado, desligando o tubo a partir da câmara de escoamento e a pipetagem fixador (formaldeído a 3,7% em PBS), na câmara de fluxo. Permitir fixação durante 10 minutos, seguido de lavagem com PBS. Os dados são analisados por meio de software de imagem (ver materiais e equipamentos de mesa).
NOTA: Execute o que experimento utilizando um microscópio de varredura a laser confocal equipado com uma câmara climática com temperatura constante a 37 ° C, 5% de CO2, e um óleo de 63X-objetivo.
Resultados
Primeiro, testamos se os anticorpos não interferiu com a função de barreira do endotélio. Medimos a resistência de monocamadas endoteliais usando célula-substrato impedância detecção elétrica (ECIS). Para mais detalhes, ver Van Buul et al. 13 Nenhuma mudança na resistência foi observada quando o anticorpo anti-VE-caderina fluorescentemente marcada foi adicionada às células (Figura 2A). Um anticorpo anti-VE-caderina, que é bem conhecida para bloquear a VE-caderina função reduzida a resistência dramaticamente (Figura 2A). Além disso, os anticorpos utilizados para imagiologia de não alterar a dinâmica de VE-caderina, como foi avaliado através da medição de fluorescência a recuperação após foto-branqueamento (FRAP) de VE-caderina-GFP (Figura 2B).
Após 1-2 minutos, os neutrófilos aderida à monocamada endotelial activado como poderia ser visualizado no canal de DIC (Figura 3A). Depois de rastejar para 5-30 sec, a grande maioria dos neutrófilos transmigrou através da monocamada endotelial através da junção célula-célula que foram marcadas com os anticorpos dirigidos contra PECAM-1 e VE-caderina. Durante o processo de diapedese, a distribuição da VE-caderina e PECAM-1 foi seguida em tempo real (Figura 3B). Nos locais de neutrófilos diapedese, VE-caderina foi interrompida localmente e PECAM-1 mostrou uma estrutura mais em forma de anel. Depois de se completar a diapedese, as junções estreitas e VE-caderina e PECAM-1 claramente realocados nos locais de diapedese (Figura 3C). Note-se que as partes do anticorpo anti-PECAM-1 foram detectados na superfície de neutrófilos quando os neutrófilos atingiram o lado baso-lateral do endotélio. No entanto, isso não impediu que os neutrófilos de atravessar o endotélio. As dinâmicas observadas de VE-caderina em tempo real durante a migração de neutrófilos transendotelial estavam de acordo com o trabalho de Shaw e colegas quemostrou, através de microscopia confocal e VE-caderina-GFP-transfectadas células endoteliais, que VE-caderina-GFP difundida lateralmente quando leucócitos cruzou as junções célula-célula endotelial 14. Trabalhar também por Su e colaboradores ressaltaram as nossas observações de PECAM-1. Eles mostraram que, ao lado de lateral do VE-caderina difusão sobre passagem de leucócitos, PECAM-1 foi redistribuído localmente em um anel em torno dos neutrófilos transmigrando 15.

Figura 1 Na câmara de fluxo in vitro. (A) A seta indica o reservatório a partir do qual o meio necessita de ser actualizada. (B) tubo de silicone que liga a câmara de fluxo com o in-line porta de injeção Luer usado para injetar PMNs sem desconectar o tubo (seta). (C) Connexão de um fluxo-câmara vazia para o frasco reservatório enchido com 37 ° C, o fluxo de tampão (ponta de seta). (D) de ligação da câmara de fluxo com as HUVEC tratadas com TNF-α para o tubo de fluxo contendo tampão e colocada na platina do microscópio (ponta de seta).
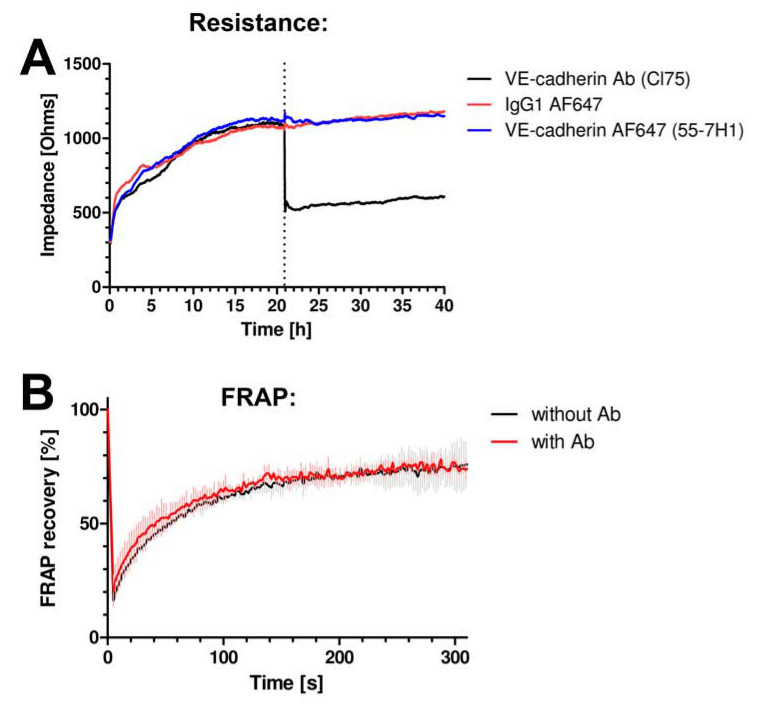
Figura 2 VE-caderina anticorpos não interferem na dinâmica ou função juncional. (A) monocamada de células endoteliais impedância é medida usando ECIS. Eixo Y expressa impedância em Ohms e o eixo x representa o tempo em horas. VE-caderina de murganho, clone 55-7H1, marcado com ALEXA647 (linha azul) ou IgG de controlo isotipo-ALEXA647 (linha vermelha) não alteram impedância monocamada de células endoteliais, enquanto que a VE-caderina de bloqueio CL75 anticorpo (linha preta) fez reduzir a impedância . (B ) VE-caderina-GFP foi expressa em HUVEC e análise FRAP usando microscopia confocal revelou nenhuma mudança na recuperação de fluorescência na presença ou ausência da VE-caderina 55-7H1 anticorpo.
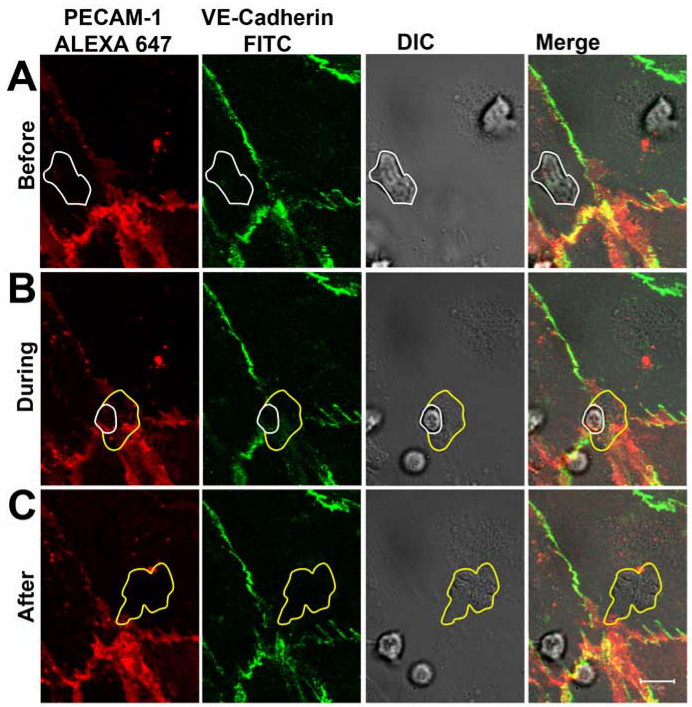
Figura 3. VE-caderina e PECAM-1 de distribuição durante TEM neutrófilos em tempo real. (A) Neutrófilos (marcada com linha branca) aderindo sobre o endotélio e atravessando a junção célula-célula, sem afectar a distribuição de VE-caderina e PECAM -1. (B) de Neutrófilos de atravessar a monocamada endotelial através da junção célula-célula. Uma dispersão de locais de VE-caderina e PECAM-1 podem ser observadas quando um neutrófilo sobressai através da junção célula-célula. A linha branca ilustra a presença de neutrófilos ainda na parte superior do endotélio. Linha amarela mostra tha membrana de neutrófilost já está debaixo de endotélio. (C) de neutrófilos foi totalmente cruzou a monocamada endotelial. VE-caderina e PECAM-1 são realocados em locais de diapedese. Linha amarela ilustra fronteiras do neutrófilo transmigrou. Clique aqui para ver uma versão maior desta figura.
Discussão
Por este protocolo, é crítica para impedir a formação de bolhas de ar nas câmaras de fluxo, uma vez que isto irá resultar na apoptose de células e uma monocamada interrompido. Para evitar isso, queremos salientar que pagar particular interesse para os passos 4.2 e 4.5, onde os tubos estão ligados à câmara de fluxo. Um outro passo crucial no protocolo é a iniciação das PMNs que são mantidos à temperatura ambiente através da sua incubação durante 15-30 minutos a 37 ° C antes de injectar-los para a câmara de fluxo (passo 4.1). Isto resulta na iniciação das integrinas de leucócitos, permitindo-lhes aderir às moléculas de adesão tais como ICAM-1 ou VCAM-1 no endotélio.
Este protocolo não está restrito para estudar a transmigração de neutrófilos. Também podem ser utilizados outros tipos de leucócitos tais como monócitos ou linfócitos. Note-se que o passo 4.1, isto é, os leucócitos priming pode ser diferente entre os tipos de leucócitos. Além disso, outros tipos de células endoteliais pode ser utilizado. Por isso, continua a ser críticopara estimular as células endoteliais a estímulos inflamatórios adequados, tais como TNF-α ou IL-1β. Se os neutrófilos não respondem em transmigração, pode-se pensar em tratar o brevemente neutrófilos (5 min) com N-formil-L-metionil-L-leucil-L-fenilalanina (fMLP), péptido 16. Isso vai estimular os neutrófilos, em particular as suas integrinas, ainda mais, tornando-os mais propensos a aderir ao endotélio.
Normalmente 1 dyn / cm 2 velocidade de fluxo é utilizado. Esta velocidade de fluxo é medido em vênulas pós-capilares, locais onde a maior migração de leucócitos transendotelial ocorre 17. Usando as câmaras de fluxo descritas, é possível aumentar a velocidade de fluxo de até 10 dines / cm 2. No entanto, não é recomendado para aumentar o cisalhamento adicional. Isso pode provocar uma fuga indesejada do tubo e descolamento das células a partir da câmara de fluxo.
Os resultados descritos na Figura 3 indicam que estesOs anticorpos podem ser utilizados para visualizar e estudar a dinâmica das junções endoteliais célula-célula durante a diapedese de leucócitos. Em particular, para além dos ensaios de transmigração existentes este protocolo permite discriminar paracelular de migração transcelular em condições de fluxo fisiológicas em tempo real. Uma vez que os anticorpos manchar as junções célula-célula, pode-se marcar o número de leucócitos que atravessar VE-caderina / entroncamentos PECAM-1 positivos contra não positivo VE-caderina / PECAM-1 locais. Desta forma, a migração intracelular pode ser discriminada da migração paracellular.
É importante salientar que estes anticorpos não interferem com a função das proteínas que se ligam ao anticorpo a: PECAM-1 utilizados neste estudo é dirigido contra o segundo domínio extracelular. As células endoteliais foram plaqueadas na presença de anticorpo não apresentaram quaisquer defeitos de propagação ou formação de uma monocamada, sugerindo que o anticorpo, pelo menos não o fezinterfere com as interacções homotípicas entre as células endoteliais. para além disso, ambos os anticorpos não prejudica a capacidade dos neutrófilos para migrar através da monocamada endotelial. Além disso, o número de neutrófilos que transmigrar através da monocamada endotelial na ausência ou na presença de anticorpos não é alterada (dados não apresentados). É importante salientar, a microscopia confocal a laser nos dá a possibilidade de gravar diversos canais fluorescentes e DIC simultaneamente.
Assim, este ensaio permite estudar a dinâmica da VE-caderina e PECAM-1, ao mesmo tempo, quando um dos neutrófilos atravessa a junção célula-célula endotelial e irá ajudar a entender por leucócitos escolher um percurso sobre o outro, isto é, contra paracelular transcelular.
Divulgações
The authors have no competing financial interests.
Agradecimentos
The authors thank Dr. P.L. Hordijk for critically reading the manuscript. AED is supported by a Landsteiner Foundation for Blood Transfusion Research (LSBR) fellowship (grant #1028). JK is supported by the Dutch Heart Foundation (2005T3901). JDvB is a NHS Dekker fellow (grant #2005T039).
Materiais
| Name | Company | Catalog Number | Comments | |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description | |
| μ-Slide VI | IBIDI | 80606 | Flow-chamber | |
| 0.45 μm filter | Whatman/GE Lifesciences | 10462100 | ||
| 1 mL syringe | BD Plastipak | 300013 | ||
| 20 mL syringe | BD Discardit II | 366296 | ||
| 21G needle | BD Microlance | 301155 | ||
| Albumin | Sanquin | 15522644 | ||
| Ammunium chloride (NH4Cl) | Merck | 1009245000 | ||
| Calcium chloride (CaCl2) | Sigma-Aldrich | 449709 | ||
| EBM-2 Basal medium + EGM-2 SingleQuot Kit Suppl. & Growth Factors | Lonza | CC-3156 + CC-4176 | media | |
| EDTA (Titriplex III) | Merck | 1370041000 | ||
| Falcon tubes | Corning Life Sciences | 352096 | ||
| Fibronectin | Sigma-Aldrich | F1141-2MG | FN | |
| Glucose | Sigma-Aldrich | G7528 | ||
| HEPES | Sigma-Aldrich | H3375 | ||
| In-line Luer Injection port | IBIDI | 10820 | ||
| Magnesium sulfate heptahydrate (MgSO4.7H2O) | Merck | 105886 | ||
| PECAM-1-ALEXA-647 | BD Pharmingen | 561654 | clone WM59 stock concentration 0.1mg/mL | |
| Percoll | GE Healthcare Life Sciences | 17-0891-09 | ||
| Phosphate Buffered Saline | Fresenius Kabi Nederland | M090001/01NL | PBS | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | ||
| Potassium hydrogen carbonate (KHCO3) | Merck | 1048540500 | ||
| Potassium phosphate dibasic trihydrate (K2HPO4) | Sigma-Aldrich | P5504 | ||
| Silicone Tygon 3350 tubing | VWR | 228-4331 | tubing | |
| Sodium chloride (NaCl) | Calbiochem (Millipore) | 567441 | ||
| Syringe pump | Harvard Apparatus | model number 55-5920 | ||
| TNFα | Peprotech | 300-01A | tumor necrosis factor | |
| trisodium citrate | Merck | 1.06447.5000 | TNC | |
| Vacuettes | Greiner, Germany | 980044 | ||
| VE-Cadherin-FITC | BD Pharmingen | 560411 | clone 55-7H1 | stock concentration 0.5mg/mL |
| Zeiss LSM510 META | Carl Zeiss MicroImaging, Jena, Germany | |||
| Zen Software 2008 | Carl Zeiss MicroImaging, Jena, Germany |
Referências
- Ross, R. Atherosclerosis--an inflammatory disease. N. Engl. J. Med. 340, 115-126 (1999).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Szekanecz, Z., Koch, A. E. Vascular involvement in rheumatic diseases: ' vascular rheumatology. Arthritis Res. Ther. 10, 224 (2008).
- Butcher, E. C. Leukocyte-endothelial cell recognition: three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Cinamon, G., Shinder, V., Shamri, R., Alon, R. Chemoattractant signals and beta 2 integrin occupancy at apical endothelial contacts combine with shear stress signals to promote transendothelial neutrophil migration. J. Immunol. 173, 7282-7291 (2004).
- Shulman, Z., Cohen, S. J., Roediger, B., et al. Transendothelial migration of lymphocytes mediated by intraendothelial vesicle stores rather than by extracellular chemokine depots. Nat. Immunol. 13, 67-76 (2012).
- Carman, C. V., Springer, T. A. Trans-cellular migration: cell-cell contacts get intimate. Curr. Opin. Cell Biol. 20, 533-540 (2008).
- Carman, C. V., Springer, T. A. A transmigratory cup in leukocyte diapedesis both through individual vascular endothelial cells and between them. J. Cell Biol. 167, 377-388 (2004).
- Millan, J., Hewlett, L., Glyn, M., et al. Lymphocyte transcellular migration occurs through recruitment of endothelial ICAM-1 to caveola- and F-actin-rich domains. Nat. Cell Biol. 8, 113-123 (2006).
- Schulte, D., Kuppers, V., Dartsch, N., et al. Stabilizing the VE-cadherin-catenin complex blocks leukocyte extravasation and vascular permeability. EMBO J. 30, 4157-4170 (2011).
- Buul, J. D., Mul, F. P., van der Schoot, C. E., Hordijk, P. L. ICAM-3 activation modulates cell-cell contacts of human bone marrow endothelial cells. J. Vasc. Res. 41, 28-37 (2004).
- Shaw, S. K., Bamba, P. S., Perkins, B. N., Luscinskas, F. W. Real-time imaging of vascular endothelial-cadherin during leukocyte transmigration across endothelium. J. Immunol. 167, 2323-2330 (2001).
- Su, W. H., Chen, H., Jen, C. J. Differential movements of VE-cadherin and PECAM-1 during transmigration of polymorphonuclear leukocytes through human umbilical vein endothelium. Blood. 100, 3597-3603 (2002).
- Paulsson, J. M., Jacobson, S. H., Lundahl, J. Neutrophil activation during transmigration in vivo and in vitro: A translational study using the skin chamber model. J. Immunol. Methods. 361, 82-88 (2010).
- Williams, M. R., Azcutia, V., Newton, G., Alcaide, P., Luscinskas, F. W. Emerging mechanisms of neutrophil recruitment across endothelium. Trends Immunol. 32, 461-469 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados