Method Article
好中球遊出の下で生理的流れの間に内皮細胞 - 細胞接合のリアルタイムイメージング
要約
白血球は、傍細胞または経細胞経路を用いて内皮単層を横切る。私たちは、内因性の接合部の分布がVE-カドヘリンおよびPECAM-1を白血球経内皮移行中に生理的な流れの下2移住ルートを区別するために従うように、単純なアッセイを開発した。
要約
炎症時には、白血球が循環を離れ、下にある組織に侵入する病原体と戦うために内皮を横切る。このプロセスは、白血球の経内皮遊走として知られている。内皮単層を横切る白血球のための2つのルートが記載されている: すなわち 、細胞-細胞間結合および経細胞経路を介して傍細胞経路、 すなわち、内皮細胞体を介し。しかし、パラ - 及び経細胞経路を区別することは技術的に困難であった。私たちは、生理的な流れの条件の下で好中球経内皮移動中およびPECAM-1-カドヘリン、VE内因性の分布を調べるための簡単なin vitroアッセイを開発しました。好中球灌流の前に、内皮細胞は、短時間VE-カドヘリンおよびPECAM-1に対する蛍光標識抗体で処理した。電気細胞substraによって決定したように、これらの抗体は、両方のタンパク質の機能を妨害しなかったTEインピーダンス検出およびFRAP測定。このアッセイを用いて、流動条件下で経内皮移動中およびPECAM-1 VEカドヘリンと内皮を通過する白血球のパラ - 及び経細胞遊走のルートを区別し、内因性の分布に従うことができました。
概要
効率的かつ厳密に制御された白血球経内皮遊走(TEM)は、免疫監視および急性炎症などの生理学的プロセスに極めて重要である。しかし、特定の病態生理学的条件の下で、制御されない過度のTEMは、慢性炎症性疾患( 例えば、関節リウマチ、アテローム性動脈硬化症、喘息)、その結果が観察される。また、腫瘍細胞の転移の間に、経内皮移動の過程は、腫瘍細胞が1-3転移する循環を残すための器械である。具体的には、過剰な白血球または腫瘍細胞TEMを妨害するために、このプロセスの調節の詳細な理解が必要とされる。
これは、TEMプロセスは、異なる工程を経て生じると考えられる。ブッチャーとスプリンガーによって20年前にレビュー精液の研究では、TEM 4,5の処理を説明する多段階モデルにつながった。このモデルは、まだいくつかの広告が、当てはまるditionalの手順は、6が含まれています。アロンらは、内皮7の表面上に固定化されたケモカインの存在の必要性を説明した。最近では、それらは内皮自体が内皮頂端面8に提示されたケモカインを生成することを示した。また、同じグループは、TEM 7時の流れの状態の重要性を提唱。最近、2つの異なるルート白血球に焦点を当てたいくつかの出版物は、TEMの最終漏出段階で取ることができます。彼らは、すなわち 、細胞-細胞間結合を通じて傍細胞移動ルートを行くか、経細胞移動ルート9として知られている内皮細胞体を介して交差することができます。カーマンらは詳細にこれらの経路を研究し、臍帯静脈内皮単層10を横断するときに白血球が優先的に経細胞経路(10%)以上の傍細胞移動ルート(90%)を選択することを結論した。しかし、他の起源からの内皮細胞を用いた場合、 例えば、脳または微小血管系、より白血球は経細胞経路(30%)の11を使用した。 Vestweberグループは、最近、内因性の交換、細胞-細胞間結合は、ノックイン動物モデルを使用して、互いから解離することができなかったときことを示したVE-カドヘリン、VE-カドヘリン、α-カテニンキメラのために、白血球のTEMは、完全に12を遮断した。驚くべきことに、著者は、TEMは、いくつかのすべてではなく、組織において、ブロックされたことに気づいた。全体的に、これらのエレガントな実験は、この決定をトリガー調節シグナルは依然として不明であるが、白血球は、経細胞経路での傍細胞経路を優先することを示した。
白血球の大部分が傍細胞移動ルートを好むにもかかわらず、それは両方の経路を区別することは困難である。それに加えて、いくつかの研究にもかかわらず、内皮細胞 - 細胞JUNCTの役割に焦点を当てイオンは、これらの接合部の力学は、特に接合部のタンパク質は、VE-カドヘリンおよびPECAM-1、白血球の交差が論争中である時に。私たちは、これら接合分子は蛍光標識された抗体を用いて、生理的流れの条件下で、白血球の血管外遊出中にリアルタイムで監視することができる比較的簡単なアッセイを開発した。これらの抗体は、妨害または標的とするタンパク質の接合部の完全性や移動性を阻害しなかった。このアッセイは、私たちは、傍細胞TEMの過程接合部タンパク質の動態を追跡することができます。さらに、このアッセイはまた、パラ及び経細胞移動ルートとの間の識別を可能にする。
プロトコル
好中球は、インフォームドコンセントに署名した人の健康なボランティアから単離した。研究が人類の福祉のための制度や国のガイドラインを遵守して行われている。
ヒト臍帯静脈内皮細胞の1めっきとメンテナンス
- 製造業者の指示に従って培養ヒト臍帯静脈内皮細胞(HUVECを)。フィブロネクチン上のHUVECを育てる(FN)がメディアを使用して(脱イオン水に溶解した10μg/ mlの)料理がコーティングされ(内皮増殖培地(EGM-2)singlequotsを加えた内皮基本培地(EBM-2)培地)。実験のために4-8の通路の間に細胞培養を使用してください。
- 1日目:37℃で少なくとも2時間、5%CO 2のためにフィブロネクチンを100μl(PBS中10μg/ ml)を有するコート、フローチャンバー。
- 2日目:細胞を、80〜90%コンフルエンスに達し、RTリン酸緩衝生理食塩水(で慎重に洗浄した後、細胞をトリプシン処理PBS)pH7.4のメディアを使用して、800,000細胞/ mlで800×gで遠心分離し、再懸濁。プレートFNでコーティングされたフローチャンバーのすべての単一のチャネル80,000細胞、ゆっくり上下細胞懸濁液をピペット。 37℃のインキュベーター中、5%CO 2で培養O / N。
- 3日目:優しく45°の角度でスライドを傾けてフローチャンバースライドでメディアを更新します。 ( 図1Aを参照)。
メモ:のみ貯水池ではなく、チャネル自体のメディアを削除することを推奨します。チャンネル内のメディアの除去が原因ペッティングによって引き起こされるメディアのドラッグ力に内皮細胞の損失と死に至ることがある。 - 内皮細胞単層( すなわち、100%コンフルエント)を形成した場合、位相差顕微鏡により確認してください。細胞が100%コンフルエントでない場合、彼らは100%のコンフルエンスに達するまで、メディアを2回日を変更する。
- 細胞がコンフルエントに達したら、培地で細胞を刺激する(ステップを参照1.1)炎症性メディエーター(TNF-α(10 ngの個/ ml)を含有する)。 、内皮の炎症性表現型をTNF-αの結果とHUVECをO / N( すなわち、12時間)刺激すなわち 、アップレギュレーションなどのICAM-1およびVCAM-1の13のような細胞接着分子。
パーコール勾配を使用した2。多形核白血球の単離
- 多形核白血球(PMN)を単離する前に:(フローバッファー以下と呼ばれる)、N-2-ヒドロキシエチルピペラジン-N'-2-エタンスルホン酸(HEPES)を調製-buffer。フローバッファを単離したPMN及びフローアッセイにおけるバッファとしての洗浄に使用される。フローバッファを準備するには:7.72グラムのNaCl(132 mM)を、4.76グラムのHEPES(20 mM)を、0.45グラムのKCl(6 mM)を、0.25グラムの硫酸マグネシウム•7H 2 O(1 mM)を、K 2 HPO 4•3Hを希釈脱イオン水1L中2 O(1.2ミリモル)と(この在庫が数週間、4℃で保持することができる)pH7.4に調整します。
- 新鮮な100μlの1Mの塩化カルシウム&#を追加します。160;が200g / Lのストック濃度から(1 mM)を2.5 mlのヒトアルブミン(0.5%v / v)およびフロー緩衝液100ml(w / vの0.1%)、0.1グラムのグルコース。次に、0.45μmのフィルターを用いて、フローのバッファをフィルタリングします。注:このフローバッファは、すべての実験のために新たに調製する必要があります。
- PMNの単離の前に、10%のクエン酸三ナトリウム(TNC)PBS、pH7.4中の溶液を調製。
- 健康なボランティアからのナトリウムヘパリンのvacuettes全血を20mlを収集します。パーコールの12.5ミリリットル(1.130グラム/ mlの密度で、水中の23%(w / w)のコロイド溶液)の上に慎重に、血液を希釈して50mlチューブとピペット20mlの10%PBS / TNCで1:全血の1に希釈新しい50mlチューブ中。慎重に遠心機でチューブを配置し、低加速し、RTで設定されていないブレークで800×gで20分間スピン。
注:パーコールに希釈した血液を追加する場合は、45度の角度でパーコール含有チューブを傾け、静かにチューブのウィットに希釈血液をピペットH最も遅いピペット男の子の設定。 - すべての液体を除去し、続いて500ミリリットルに氷冷した赤血球溶解バッファー(4.15グラムのNH 4 Clを[0.155 M]、0.5gのKHCO 3 [0.01 M]及び18.5ミリグラムEDTA(三重III)[0.1 mm]としたチューブを埋める赤血球を溶解するための氷冷H 2 O)である。サスペンションが有効になって休憩して、4℃で5分間の遠心分離500×gで、続いて暗赤色に変わるまで、時折転倒、氷上でチューブのままにしておきます。
注:ペレット画分を一緒に赤血球とのPMN(好中球、好酸球、好塩基球)が含まれています。 - 上清を除去し、4℃で5分間500×gで氷冷溶解 - 緩衝液中で2回ペレットを洗浄。
- RTで流れバッファーでペレットを再懸濁し、血球計または自動細胞カウンターのいずれかを使用してPMNの濃度を決定する。 1×10 6細胞/ mlで、フローバッファ内のPMNをサスペンドし、室温で保管してください。
内皮ジャンクションの3ラベリングアルは、VE-カドヘリンおよびPECAM-1
- 1でPECAMアレクサフルオロ647抗体(クローンWM59)を追加します。1:50希釈HUVECに、培地で100倍希釈し、カルシウム非依存VE-カドヘリン-FITC抗体(クローン55-7H1)、(ステップ1.1参照)前生理的流れの条件下で好中球遊走の間に内皮細胞の接合動態を可視化するために、フロー実験を開始する30分間インキュベートする。
注:フローチャンバーに直接標識抗体を追加する前に、各チャネルのボリュームは100μLを超えていないことを確認してください。これは、可能な限り低い抗体費を維持するのに役立ちます。
4 PMN TEMアッセイで流動
- 前のフローシステムにそれらを注入する37℃で15分間水浴中にPMNを配置してください。
- 目を設定する際の気泡の形成を防止する(ステップ4.3参照)、空のフローチャンバーにチューブを接続し、暖かいでいっぱいに( 例えば、37℃)、フローバッファ電子フローシステム。
- 20ミリリットルの注射器を含むシリコーンチューブを使用して、シリンジポンプフローシステムに空のフローチャンバーの一方の側を接続し、顕微鏡のステージへの流れチャンバを置く。
- 37°Cフロー緩衝液( 図1B)で満たされたリザーバフラスコに空のフローチャンバの反対側を接続し、フローバッファーですべてのチューブを充填するために、シリンジポンプを起動する。ポンプは、注射器に流動室を通ってリザーバから流れバッファを引っ張ってくる。注:このチューブはまた、PMNの流れを停止させ、気泡を作成せずに実行している実験に針を注入することを可能にする、インラインルアー注入ポートが含まれています。
- フローチャンバーを含むTNF-αで処理したHUVECを持つ空のフローチャンバーを交換し、フローバッファーを含むチューブを接続し、顕微鏡ステージ( 図1C)に置きます。切断して再接続する前に、チューブを切っピンチピンチオフしないように、HUVECを含有するチャンバーmは、チューブおよび/またはフローチャンバ内の気泡の形成をもたらすことができる。
- ポスト毛細管細静脈において生理的流れ速度に応じて、1ダイン/ cm 2の流速を調整する(1-5ダイン/ cm 2)であった。
- レコード微分干渉コントラスト(DIC)、FITC(488nmの)およびアレクサフルオロ647(647 nm)を同時に共焦点レーザー走査顕微鏡を用いて。
- 1ミリリットルの注射器を使用して、インラインルアー注入口( 図1D) を介して 、フローシステム内にゆっくりのPMN(ステップ4.1)を注入する。
- 数分後、白血球が付着現れ、転生。フローチャンバー内にフローチャンバー及びピペッティング固定液(PBS中3.7%ホルムアルデヒド)からチューブを外して、任意の瞬間に実験を停止します。 10分間の固定を可能にし、PBSで洗浄した。データは、(材料および機器の表を参照)画像ソフトウェアを用いて分析される。
NOTE:37°C、5%CO 2の恒温及び63X油を目的とした人工気象室を備えた共焦点レーザー走査顕微鏡を用いて彼の実験を実行する。
結果
抗体は、内皮のバリア機能を妨害しなかった場合には、まず試験した。私たちは、電気細胞 - 基質インピーダンスセンシング(ECIS)を使用して、内皮単層の抵抗を測定した。詳細については、ヴァンBuul らを参照してください。抗VE-カドヘリン蛍光標識抗体は細胞( 図2A)に添加した場合の抵抗13全く変化が見られなかった。 VE-カドヘリン機能をブロックすることが十分に認識されている抗VE-カドヘリン抗体は、抵抗を劇的( 図2A)を減少させた。また、のダイナミクスを変化させないイメージングのために使用される抗体は、VE-カドヘリンの光退色(FRAP)後の蛍光回復を測定することによって評価したように( 図2B)カドヘリン-GFPをVE。
1-2分後、好中球はDICチャンネル( 図3A)で可視化することができるように活性化内皮単層に付着した。 5-30 SEのクロール後、C、好中球の大半はPECAM-1に対する抗体で標識し、VE-カドヘリンをした細胞間結合を介して内皮単層を通って遊出。漏出の過程の分布は、VE-カドヘリンおよびPECAM-1は、リアルタイム( 図3B)に従った。好中球の血管外遊出の部位に、VE-カドヘリンが局所的に破壊し、PECAM-1以上のリング状の構造を示した。漏出が完了した後、閉じて、接合部は、VE-カドヘリンおよびPECAM-1は明らかに漏出部位( 図3C)に移転しました。好中球は、内皮のBASO-側面に到達したら、抗PECAM-1抗体の部分が好中球の表面上で検出されたことに注意してください。しかし、これは内皮を横切るから好中球を防ぐことはできませんでした。の観察されたダイナミクスは、好中球経内皮移動中にリアルタイムでカドヘリンをVEショウらが仕事と一致した共焦点顕微鏡を用いて、示し、VE-カドヘリン-GFP-トランスフェクトVE-カドヘリン-GFPは、白血球が内皮細胞間結合14を横切った際に横方向拡散内皮細胞を、。また蘇によって動作し、共同研究者は、PECAM-1の私たちの観察を強調した。彼らは次の横方向への白血球の通過時に拡散カドヘリンVEは、ことを示した、PECAM-1はローカルに転生好中球15の周りにリングに再配布されました。

体外フローチャンバーで 、図1(A)の矢印は、媒体を更新する必要がある、そこからリザーバを示している。 (B)チューブ(矢印)を切断することなくPMNのを注入するために用いたインラインルアー注入ポートとフローチャンバーを接続するシリコンチューブ。 (C)コーン37°Cフローバッファー(矢頭)で満たされたリザーバフラスコに空のフローチャンバーのと接続。 (D)フローバッファーを含むチューブに、TNF-αで処理したHUVECを有するフロー· チャンバーの接続および顕微鏡ステージ(矢頭)に入れた。
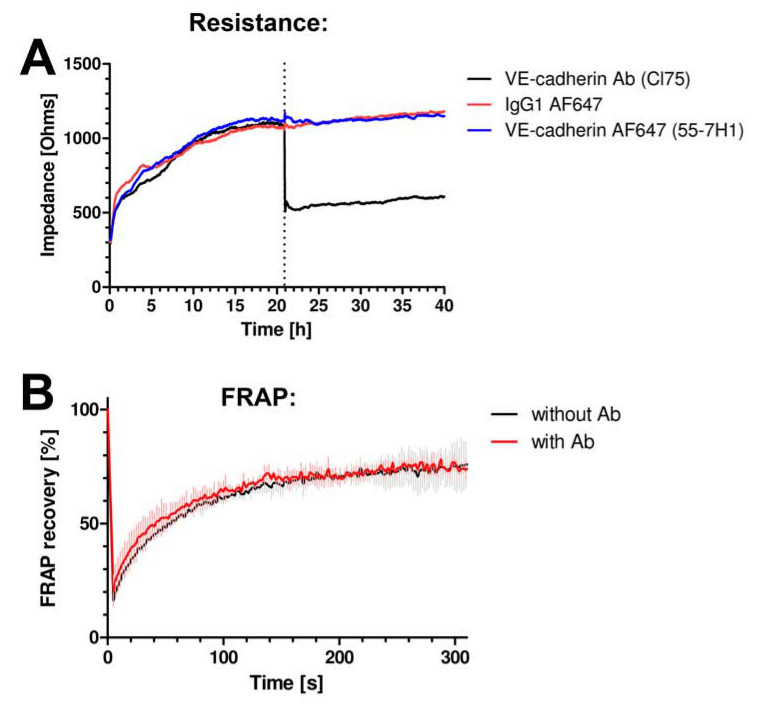
図2は、VE-カドヘリン接合ダイナミクスまたは機能を妨害しない抗体。(A)内皮細胞単層のインピーダンスは、ECISを用いて測定される。 Y軸は、オームにインピーダンスを表し、x軸は、時間単位の時間を表す。インクルード抗体CL75(黒線)をブロックカドヘリン、VEのに対し、Alexa647の(青線)またはアイソタイプのIgG-Alexa647の制御で標識された抗体クローン55-7H1、(赤線)は、内皮細胞単層インピーダンスを変化させないカドヘリンは、VEのインピーダンスを減少させた。 (B )、共焦点顕微鏡を用いてHUVECおよびFRAP分析において発現させたカドヘリン-GFPはVE ngのは、VE-カドヘリン55-7H1抗体の存在下または非存在下で蛍光回復の変化を示さなかった。
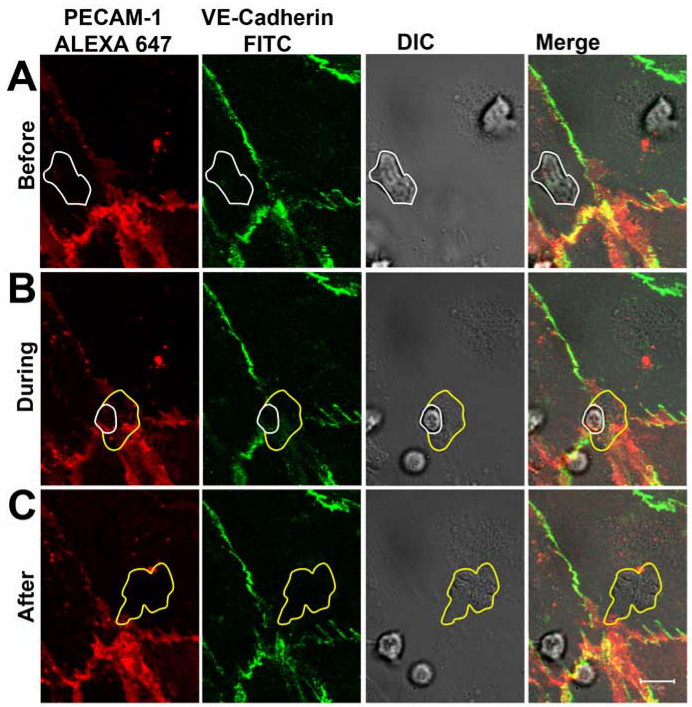
図3は、VE-カドヘリンおよびPECAM-1の分布をリアルタイムで好中球のTEM中に(A)好中球が内皮に付着したとの分布に影響を与えることなく、細胞間の接合部を横切る(白線でマーク)VE-カドヘリンおよびPECAM -1。 (B)好中球は、細胞-細胞間結合を介して内皮単層を横切る。好中球は、細胞 - 細胞接合部を通って突出するとき、VE-カドヘリンおよびPECAM-1の局所分散を観察することができる。白線は内皮の上にまだ好中球の存在感を示している。黄色の線は、好中球膜THAを示していますtは内皮の下に既にある。 (C)好中球が完全に内皮単層を超えました。 VE-カドヘリンおよびPECAM-1は、漏出部位に再配置されます。黄色のラインが遊出し、好中球の境界を示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
このプロトコルについては、これは、細胞アポトーシスおよび破壊単層をもたらすので、フローチャンバー内の気泡の形成を防止することが重要である。これを避けるために、私たちは、チューブをフローチャンバーに接続されている手順4.2および4.5、特に関心を払うように強調したい。プロトコルにおけるもう一つの重要なステップは、前のフローチャンバー(ステップ4.1)にそれらを注入する、37℃で15〜30分間、それらをインキュベートすることにより、室温に保たれているPMNのプライミングである。これは、彼らがそのような内皮でのICAM-1またはVCAM-1などの接着分子に付着させ、白血球インテグリンのプライミングになる。
このプロトコルは、好中球の遊走を研究するために限定されるものではない。また、単球またはリンパ球のような他の白血球の型を使用することができる。そのステップ4.1に注意して、 すなわち、白血球をプライミングすると、白血球の型の間で異なる場合があります。また、内皮細胞の他のタイプを使用することができる。このためには、臨界のままで例えば、TNF-αまたはIL-1βのような適切な炎症性刺激による内皮細胞を刺激する。好中球遊出に応答しない場合、人はN-ホルミル-L-メチオニル-L-ロイシル-L-フェニルアラニン(fMLPの)ペプチド16での好中球の短時間(5分)の治療を検討してもよい。これは内皮に付着し、それらをより受けやすいこと、さらに、それらのインテグリン、特に、好中球を刺激する。
典型的には、1ダイン/ cm 2の流速が用いられる。この流速は、後毛細血管細静脈、大部分の白血球経内皮遊走17を発生する部位で測定される。説明したフローチャンバーを使用して、10ダイン/ cm 2の流速を高めることができる。しかし、さらに剪断力を高めるためにはお勧めしません。これは、フローチャンバーからの細胞のチューブと剥離の不要な漏れの原因となります。
図3に記載した結果は、これらのことを示している抗体を視覚化し、白血球血管外遊出の際に、内皮細胞間結合の動力学を研究するために使用することができる。具体的には、既存のトランスマイグレーションアッセイに加えて、このプロトコルは、リアルタイムでの生理的な流れの条件の下で経移行から傍細胞を識別することができます。抗体は細胞間結合を染色するので、人は/ PECAM-1のサイトカドヘリンVE非正対VE-カドヘリン/ PECAM-1陽性接合を横切る白血球数を獲得することができます。このように、細胞間移行が傍細胞遊走識別することができる。
これは、これらの抗体は、それらが結合するタンパク質の機能を妨害しないことを強調することが重要である:本研究で使用PECAM-1抗体は、第二の細胞外ドメインに対して向けられる。抗体は、少なくともなかったことを示唆して拡散または単分子層を形成する際の欠陥を示さなかった抗体の存在下で播種した内皮細胞は、内皮細胞間同型相互作用を妨害。それに加えて、両方の抗体は、内皮単層を通って移動する好中球の能力を損なわない。さらに、抗体の非存在下または存在下で内皮単層を横切って遊出する好中球の数は変化しない(データは示さず)。重要なことは、共焦点レーザー走査顕微鏡は私たちに、同時に異なる蛍光チャネルおよびDICを記録する可能性を与えます。
好中球は、内皮細胞間の接合部を横断し、白血球が経細胞に対する他の、 すなわち、傍細胞上の1つの経路を選択する理由を理解するのに役立ちますときこのように、このアッセイは、同時に、VE-カドヘリンおよびPECAM-1のダイナミクスを研究することができます。
開示事項
The authors have no competing financial interests.
謝辞
The authors thank Dr. P.L. Hordijk for critically reading the manuscript. AED is supported by a Landsteiner Foundation for Blood Transfusion Research (LSBR) fellowship (grant #1028). JK is supported by the Dutch Heart Foundation (2005T3901). JDvB is a NHS Dekker fellow (grant #2005T039).
資料
| Name | Company | Catalog Number | Comments | |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description | |
| μ-Slide VI | IBIDI | 80606 | Flow-chamber | |
| 0.45 μm filter | Whatman/GE Lifesciences | 10462100 | ||
| 1 mL syringe | BD Plastipak | 300013 | ||
| 20 mL syringe | BD Discardit II | 366296 | ||
| 21G needle | BD Microlance | 301155 | ||
| Albumin | Sanquin | 15522644 | ||
| Ammunium chloride (NH4Cl) | Merck | 1009245000 | ||
| Calcium chloride (CaCl2) | Sigma-Aldrich | 449709 | ||
| EBM-2 Basal medium + EGM-2 SingleQuot Kit Suppl. & Growth Factors | Lonza | CC-3156 + CC-4176 | media | |
| EDTA (Titriplex III) | Merck | 1370041000 | ||
| Falcon tubes | Corning Life Sciences | 352096 | ||
| Fibronectin | Sigma-Aldrich | F1141-2MG | FN | |
| Glucose | Sigma-Aldrich | G7528 | ||
| HEPES | Sigma-Aldrich | H3375 | ||
| In-line Luer Injection port | IBIDI | 10820 | ||
| Magnesium sulfate heptahydrate (MgSO4.7H2O) | Merck | 105886 | ||
| PECAM-1-ALEXA-647 | BD Pharmingen | 561654 | clone WM59 stock concentration 0.1mg/mL | |
| Percoll | GE Healthcare Life Sciences | 17-0891-09 | ||
| Phosphate Buffered Saline | Fresenius Kabi Nederland | M090001/01NL | PBS | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | ||
| Potassium hydrogen carbonate (KHCO3) | Merck | 1048540500 | ||
| Potassium phosphate dibasic trihydrate (K2HPO4) | Sigma-Aldrich | P5504 | ||
| Silicone Tygon 3350 tubing | VWR | 228-4331 | tubing | |
| Sodium chloride (NaCl) | Calbiochem (Millipore) | 567441 | ||
| Syringe pump | Harvard Apparatus | model number 55-5920 | ||
| TNFα | Peprotech | 300-01A | tumor necrosis factor | |
| trisodium citrate | Merck | 1.06447.5000 | TNC | |
| Vacuettes | Greiner, Germany | 980044 | ||
| VE-Cadherin-FITC | BD Pharmingen | 560411 | clone 55-7H1 | stock concentration 0.5mg/mL |
| Zeiss LSM510 META | Carl Zeiss MicroImaging, Jena, Germany | |||
| Zen Software 2008 | Carl Zeiss MicroImaging, Jena, Germany |
参考文献
- Ross, R. Atherosclerosis--an inflammatory disease. N. Engl. J. Med. 340, 115-126 (1999).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Szekanecz, Z., Koch, A. E. Vascular involvement in rheumatic diseases: ' vascular rheumatology. Arthritis Res. Ther. 10, 224 (2008).
- Butcher, E. C. Leukocyte-endothelial cell recognition: three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Cinamon, G., Shinder, V., Shamri, R., Alon, R. Chemoattractant signals and beta 2 integrin occupancy at apical endothelial contacts combine with shear stress signals to promote transendothelial neutrophil migration. J. Immunol. 173, 7282-7291 (2004).
- Shulman, Z., Cohen, S. J., Roediger, B., et al. Transendothelial migration of lymphocytes mediated by intraendothelial vesicle stores rather than by extracellular chemokine depots. Nat. Immunol. 13, 67-76 (2012).
- Carman, C. V., Springer, T. A. Trans-cellular migration: cell-cell contacts get intimate. Curr. Opin. Cell Biol. 20, 533-540 (2008).
- Carman, C. V., Springer, T. A. A transmigratory cup in leukocyte diapedesis both through individual vascular endothelial cells and between them. J. Cell Biol. 167, 377-388 (2004).
- Millan, J., Hewlett, L., Glyn, M., et al. Lymphocyte transcellular migration occurs through recruitment of endothelial ICAM-1 to caveola- and F-actin-rich domains. Nat. Cell Biol. 8, 113-123 (2006).
- Schulte, D., Kuppers, V., Dartsch, N., et al. Stabilizing the VE-cadherin-catenin complex blocks leukocyte extravasation and vascular permeability. EMBO J. 30, 4157-4170 (2011).
- Buul, J. D., Mul, F. P., van der Schoot, C. E., Hordijk, P. L. ICAM-3 activation modulates cell-cell contacts of human bone marrow endothelial cells. J. Vasc. Res. 41, 28-37 (2004).
- Shaw, S. K., Bamba, P. S., Perkins, B. N., Luscinskas, F. W. Real-time imaging of vascular endothelial-cadherin during leukocyte transmigration across endothelium. J. Immunol. 167, 2323-2330 (2001).
- Su, W. H., Chen, H., Jen, C. J. Differential movements of VE-cadherin and PECAM-1 during transmigration of polymorphonuclear leukocytes through human umbilical vein endothelium. Blood. 100, 3597-3603 (2002).
- Paulsson, J. M., Jacobson, S. H., Lundahl, J. Neutrophil activation during transmigration in vivo and in vitro: A translational study using the skin chamber model. J. Immunol. Methods. 361, 82-88 (2010).
- Williams, M. R., Azcutia, V., Newton, G., Alcaide, P., Luscinskas, F. W. Emerging mechanisms of neutrophil recruitment across endothelium. Trends Immunol. 32, 461-469 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved